- 30. Ärzte-Fortbildungskurs in Klinischer Onkologie


Neue Onkologika: Ethische Abwägungen rund um Kosten, Nutzen und Verfügbarkeit
Mit der Fallvignette einer heute 70 Jährigen, ED MM 2015, März 2019: Therapierefraktär nach 5 Linien, refraktär auf BTZ, LEN, POM, CFZ, DARA, schwerer progredienter Hyperviskosität , Anämie, AZ-Verschlechterung, total Protein 138g/l, IgA 86g/l schnell ansteigend und Zuweisung an das KSSG für Phase 1 Studientherapie (BCMA, initialisiert), exemplifizierte Prof. Dr. med. Christoph Driessen eine Situation, wie sie in der Praxis vorkommt. In den Monaten Juni-Juli erhielt die Patientin BTZ-Nelfinavir, Protein sinkend auf 120g/l, klinische Stabilisierung, Kostengutsprache und Wiedererwägung Nelfinavir abgelehnt, Übernahme Nelfinavir aus Klinikbudget. August: Studienprogramm kurzfristig beendet von Sponsor. Therapiebeginn Dara-POM-Dex, KoGu 6.8. Protein 115g/l, IgA 70g/l, Therapiefortsetzung. Info-Wiedereröffnung Phase 1 Studie im Winter- Wiedererwägungsgesuch, Therapiefortsetzung Protein 118g/l, IgA 66g/l, klinische Stabilisierung. KoGu vom 5.8. positiv nach Verhandlung mit Firmen, KoGu Dara-POM-Dex bis 26.9l 2019(!). 3.10. Protein 94g/l, IgA 63g/l, klinisch (dast) beschwerdefrei. Pat. geht 1 Woche in Urlaub nach Italien. 3.11. IgA 37g/l, PR, klinisch gutes Befinden, normaler Alltag. 9.10., 5.11. Nachfrage/Berichte KK wegen BTZ, Ablehnung Kosten BTZ. 2.12. 2019 gutes Befinden, Protein normal, IgA 36g/l (leichte Symptome in therapiefreier Woche). 20.1.2020 KMP/PET Staging: 90% MM Befall im KM, ubiquitär FDG-positive Skelettmanifestationen, Einschluss in BCMA-Immuntherapie Studie.
Es stellen sich die folgenden Fragen/Probleme:
- Zugang zu hochspezialisierten Onkologika «off label» oft nur nach vorgängiger Kostengutsprache
- Situation «neue Onkologika» und «off label»
- Wie sieht die Entscheidungspraxis aus?
- Was ist «medizinisch richtig»?
- Wie «angemessen/fair» sind die Preise?
- Was ist «moralisch richtig»
- Welchen Kriterien folgt ärztliches Handeln
Der Referent verwies auf die Entwicklung der Preise für Onkologika zur Myelomtherapie. Während diese sich im Jahre 1950 (Melphalan) bis 1960 (Steroide) zwischen 600 und 2000$ bewegten, war die Hochdosistherapie mit autologem Stammzellsupport bereits in der Grössenordnung von 50‘000$. Mit Bortezomid (100 000$), Lenalidomid (80 000$), Pomalidomid (120 000$), Daratumumab (140 000$) im m Jahr 2015 erfolgte ein weiterer Anstieg. Die Jahre 2020 (CAR) und 2021 (BITE) werden mit 200 000$ bis 500 000$ veranschlagt.
Die neuen Onkologika sind nicht nur teurer, sie zeigen auch einen Nutzen, wie der Referent anhand des Gesamtüberlebens von non-transplant Myelompatienten in der Ostschweiz in den Jahren 2000-2005 vs. 2006-2010 zeigte.
Zunahme der Onkologika
Während in den Jahren 1941-1950 die Gesamtzahl der zyto-toxischen Medikamente 1 und die jährliche Zunahme 0.1, und die Anzahl zielgerichteter Medikamente 0 betrug, waren es
zwischen 2011-2014 3 zytotoxische Medikamente mit einer
jährlichen Zunahme von 0.75 und 30 zielgerichtete Medikamente mit einer jährlichen Zunahme von 8.25. Gleichzeitig mit der Zunahme der Krebsmedikamente steigen die Kosten für diese Medikamente immer weiter in die Höhe. Bei den Entscheidungen zur Kostengutsprache wird eine grosse Heterogenität festgestellt.
Welche Neuen Onkologika für welchen Patienten?
Meine Verordnungen werde ich treffen zu Nutz und Frommen der Kranken, nach bestem Vermögen und Urteil, ich werde sie bewahren vor Schaden und willkürlichem Unrecht, so besagt es der Eid des Hippokrates.
Der Referent stellt folgende Hypothese auf: Wir überschätzen oft den Zusatznutzen von neuen Onkologika, die «evidenzbasiert» eingeführt werden. Medizinische Evidenz kommt aus RCTs. Diese vergleichen grosse Kohorten, die in wenigen wesentlichen Merkmalen übereinstimmen. RCTs informieren uns über
- einen Unterschied beim geprüften Endpunkt
- für den Durchschnitt der Patienten in den Kohorten
Dies bedeutet nicht, dass alle Patienten im überlegenen Arm besser abschneiden. RCTs sagen uns nicht direkt, welches die beste Behandlung für unseren nächsten Patienten ist. Wir sollten abschätzen, wie wahrscheinlich es ist, dass dieser nächste Patient profitiert.
Der Referent stellt fest, dass nur medikamentöse Therapiestudien durchgeführt werden, die den Sponsor wirtschaftlichen Nutzen erwarten lassen. «Defensive» Studien gibt es kaum. Die Evidenz der modernen medikamentösen Tumortherapie hat einen Bias zugunsten des langen und grosszügigen Einsatzes moderner, teurer Onkologika. Neue Onkologika sind recht sicher, oft wirksam, aber ihre «Indikationsstellung» unterliegt einem relevanten Bias und ist wahrscheinlich nicht fair, so der Referent.
Ein «System» der Verfügbarkeit an den Grenzen der Fairness:
Medizinischer Fortschritt und der Bias von Evidenz, Standards, Zulassung, Erstattung. Was ist medizinisch notwendig? Was ist gesellschaftlich-ethisch angemessen?
- Wirtschaft und Gesellschaft: Preis, Wert und Verfügbarkeit
- Verteilungsgerechtigkeit und Ethik
Die 4 Determinanten des Preises (WHO2018, Industrieperspektive)
a) Kosten R&D
b) b Kosten Produktion und Kommerzialisierung
c) «Wert» einer Medizin
d) Ausreichender Gewinn auf R&D
Kosten Forschung und Entwicklung
WHO 2018:99FDA Zulassungen 1989-2017. Return 14.5 US$ per US$ R&D Kosten – adjustiert für gescheiterte Projekte und Opportunitätskosten.
Der Weltmarkt für Onkologika betrug 2018 130 Mrd. US$ Der %-Gewinn (EBIT) pro Umsatz der Branche weltweit beträgt für Bergbau, Rohölproduktion 19.8%, Pharmazie 19.1%, für Konsumgüter Nahrungsmittel 11.9%, Telekommunikation 7.5%, Raumfahrt und Verteidigung 6.2% um nur einige zu nennen.
Die Rechtfertigung hoher Preise für Onkologika ist zumindest fraglich. Es herrscht ein Bias im System medizinischer Evidenz. Der Nutzen ist in (vielen?) Einzelfällen hoch. Die Ressourcen der Gesellschaft sind begrenzt. Wie kann der Onkologe hier «gut» entscheiden und handeln?
Ethik:
Frage nach dem guten Handeln im gesellschaftlichen Kontext.
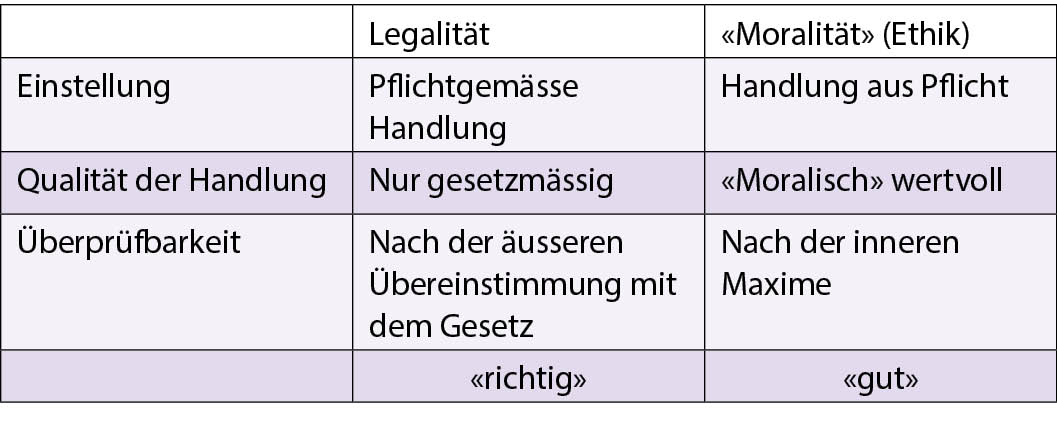
Deontologie («Pflicht»): Pflichtethik, Moral, das «Erforderliche», das «Gesollte». Teleologie («Ziel»): Utilitarismus, konsequentialistische Theorie. Moralität und Legalität (Emanuel Kant), (modif. nach G. Majo, Mittelpunkt Mensch: Ethik in der Medizin, 2012)
Medizinethik: «Pflichtenethik», «Primum non nocere», Autonomie, Prinzip der Menschenwürde. Das «Vier-Prinzipien Modell der Medizinethik» (BeauchampTL, Childress F. Principles of Biomedical Ethics (1877), 7th Ed, OUP 2012.
Personalisierte Medizin und das Gerechtigkeitsproblem:
- Informationszunahme stellt Gerechtigkeit in Frage
- Differenz untergräbt Versicherungsidee, erschwert Solidarität
- Was bedeutet Gerechtigkeit, wenn die Fähigkeit zur Unterscheidung drastisch zunimmt?
Gerechtigkeit teilt sich auf in Gesetzesgehorsam und Gleich-behandlung auf.
Gerechtigkeitstyp: kommutative Gerechtigkeit vs. distributive Gerechtigkeit, erstere ist formal arithmetisch, letztere verhältnismässig/geometrisch. Gleichbehandlung durch Wegsehen gegenüber Ungleichbehandlung durch Hinsehen. Anwendung ohne Ansehen der Person gegenüber «Gleiches gleich, Ungleiches ungleich» verteilen.
Gerechtigkeit und Pflichtenethik vs. Gewinne, Verluste, Kosten, DRGs etc.
1. Wir sind primär den Patienten verpflichtet
2. Wir erbringen unsere Leistung medizinisch vernünftig, mit Augenmass, Kenntnis und Erfahrung, in einer vernünftigen und effizienten operationsform, auf dem aktuellen Stand der medizinischen Möglichkeiten
Aufgabe eines Vergütungssystems ist es, in diesem Rahmen einen wirtschaftlichen Betrieb zu ermöglichen. Tut es dies nicht, muss eine politische Diskussion geführt werden.
Unsere Verpflichtung unseren Patienten gegenüber ist höherwertig als die gegenüber dem Vergütungssystem. Sie wird deshalb nicht dem Vergütungssystem angepasst.
Therapiewahl und Kosten in der Praxis:
- für Patienten die medizinisch beste verfügbare Therapie finden
- wenn diese Therapie vom «System» erstattet wird, ist der «Preis» unerheblich (Systemproblem)
- Der Arzt muss gewährleisten, dass er/sie in der Entscheidung (finanziell) unabhängig ist («Marge» Medikamentenabgabe, «Sponsoring» ad personam).
Wenn die Therapie nicht vom System erstattet wird:
ambulant:
- A) medizinisch akzeptable Argumentation und geringer individueller Zusatznutzen gegenüber Alternative (ESMO-MCBS) (nach meiner Einschätzung für diesen Patienten) alternative Therapie
- B) fachlich inakzeptable Argumentation oder hoher individueller Zusatznutzen (s.o.): Therapie durchführen, Zeitpunkt nach
Klinik 1-3 Wiedererwägungsgesuche. - stationär:
- A) individueller Zusatznutzen nur kurzfristig: Verschieben in ambulanten Bereich, Kostengutsprachegesuch
- B) individueller Zusatznutzen kurzfristig hoch: Therapie gemäss medizinischer Entscheidung, unabhängig von Kosten/Erstattung
- Primat «keine Ausrichtung Therapie am Erstattungssystem»
Wege aus der Krise:
- Evidenz: «real world evidence», «n=1 Trials», «defensive Studien» (Sponsor: Versicherer, Gesundheitssystem)
- Medikamentenentwicklung: «drug repurposing»
- Kostengutsprache: Modelle zentriert auf Nutzen und verantwortungsvolle ärztliche Entscheidung
Drug Repurposing in der Onkologie:
- Wir haben ca. 5000 Medikamente, die «sicher» sind, die meisten davon sind ausserdem «generisch»
- Die meisten haben biologisch relevante molekulare Wirkungen
- Wir kennen die onkologisch relevanten molekularen Wirkungen dieser Medikamente meist nicht, weil a) die Medikamente mit anderem Fokus untersucht wurden, b) die molekularen onkologischen Mechanismen nicht bekannt waren
- Systematische Nutzung molekularer Wirkungen bekannter, zugelassener Medikamente für «targeted therapy», schnell, sicher, verfügbar, preisgünstig Zentrum für die Wiederverwendung von Medikamenten: eine Medikamentenbibliothek und Informationsquelle der nächsten Generation.
Das TCGA (The Cancer Genome Atlas)-Projekt
Die Daten aus diesem Pilotprojekt werden den Forschern und Klinikern einen Einblick in einen umfassenden Atlas mit molekularen Informationen über die genomischen Veränderungen bei allen Krebsarten vermitteln. Die von TCGA generierten genomischen Informationen könnten Fortschritte in der Krebsforschung stimulieren und Möglichkeiten für die Entdeckung und Entwicklung neuer Ziele für Krebstherapeutika ermöglichen. Sie könnten auch neue Möglichkeiten zur Unterstützung von Klinikern bei der Entwicklung personalisierter Behandlungspläne für jeden Patienten liefern und es klinischen Studien ermöglichen, sich auf die Patienten zu konzentrieren, die am ehesten auf bestimmte Behandlungen ansprechen. Das TCGA Projekt hat gezeigt, dass 244 Gene statistisch signifikant als «Cancer Driver» mutiert sind, 47% der Gene/Pathways haben ein korrespondierendes Medikament /Compound in der Medikamentenwiederverwendungsbibliothek.
Der Referent schloss mit einem Vorschlag eines neuen Paradigmas für Forschung, Entwicklung, Zulassung und Vergütung.
Molekularbiologie für die onkologische Praxis
Krebs – es ist alles in den Genen! … aber es wird durch seine kodierten Proteine induziert. Durch epigenetische Änderungen, durch das Mikroumgebungssystem des Wirts, durch das Immunsystem und durch die Blutgefässe. Nur etwa 1% der DNA besteht aus Proteinkodierenden Genen (ca. 21000 Protein-kodierende Gene) und 99% ist Schrott, stellte Prof. Dr. med. Adrian Ochsenbein, Bern, fest.
Molekulare Mechanismen, die zu Krebs führen
Der Referent erwähnte zunächst die Mehrstufenkarzinogenese und als Beispiel das Kolonkarzinom, mit der APC Genmutation, die zur Hyperproliferation und dem frühen Adenom, der K-ras Mutation, die mit dem intermediären Adenom einhergeht, der DCC-Genmutation und dem späten Adenom, der p53 Mutation, die zum Karzinom führt und weiteren Mutationen, die die Metastase auslösen. Weitere genetische Alterationen, die zu Krebs führen, sind das Vorhandensein von Oncogenen und die Absenz von Tumorsuppressorgenen. Sie führen zu Proliferation und Apoptose. Die Onkogene wirken als Wachstumsfaktoren, Wachstumsfaktorrezeptoren, Signalüberträger, Proteinkinasen Transkriptionsfaktoren und Apoptoseregulatoren. Die Protoonkogene stellen die normale Form des Gens, welches in eine positive Regulation des Zellzyklus involviert ist, dar.
Die Tumorsuppressorgene kontrollieren den Zellzyklus Checkpoint, den Proteinturnover, den DNA- Schaden und die Hypoxie. Das normale Gen verhütet Krebs, eine erste Mutation führt zu einem anfälligen Träger, die zweite Mutation zu Krebs. Die Expression des P53 Gens geht mit Inhibition der Angiogenese, Wachstumsanhalten, DNA-Reparatur und Apoptose einher.
Die genetischen Veränderungen, die zu Krebs führen, umfassen durch Oncogene Mutationsaktivierungen, Genamplifikation, Gentranslokation, durch Tumorsuppressorgene Mutationsinaktivierung, Genedetektion, Gen «Silencing». Die Genalterationen bestehen aus Punktmutationen, Chromosomenaberrationen, ausgewogene und nicht ausgewogene strukturelle Abweichungen, numerische Abweichungen: Trisomie, Monosmie. Als Beispiele für genetische Abweichungen zeigte der Referent Änderungen im Satz «THE RED CATZ SAT: Eine Punktmutation wäre «THE ROD CAT SAT», eine Inversion «THE DER CAT SAT», eine Deletion «TED ERC ATS AT, eine Insertion «THH EDE RCA TSA T» und eine Translokation «THE SAT RED CAT».
Die Mutationsfrequenz ist bei den verschiedenen Krebsarten unterschiedlich. Relativ wenig Mutationen werden beim Ewing Sarkom, Schilddrüsenkarzinom und beim Rhabdokarzinom festgestellt, während sie bei. Kolonkarzinom, Lungenkarzinom und Melanom u.a. häufig sind (Laurence MS, Nature 2013).
Driver und Passenger Mutationen: Die Driver Mutation (Verstärker-Mutation) ist eine Mutation im Signaltransduktionsweg, die die Proliferation der Tumorzelle fördert. Mutationen, die keinen kausalen Zusammenhang zu Wachstum und Proliferation zeigen, werden als Passenger-Mutationen bezeichnet.
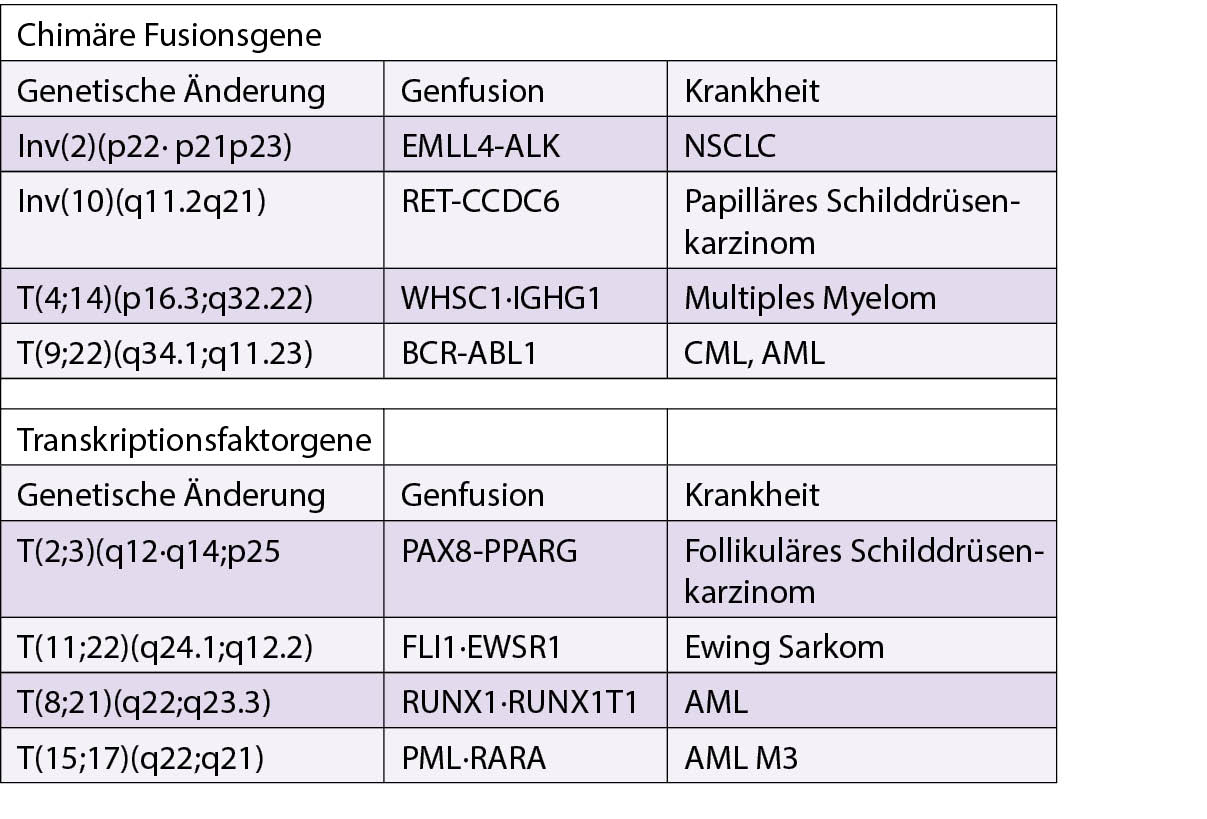
Ausgewogene chromosomale Rearrangements umfassen chimäre Fusionsgene und deregulierte Expression von strukturell normalen Genen. Zu den chimären Fusionsgenen gehören die genetischen Änderungen in den Tyrosinkinasegenen und den Transkriptions-faktorgenen.
Unausgewogene chromosomale Rearrangements:
Genom Gewinn: Komplette Trisomie, partielle Trisomie, intrachromosomale Amplifikation. extrachromosomale Amplifikation.
Genom Verlust: Monosmie, large-scale Deletion, submikroskopische Deletion. Oncomire bei Krebs: Ein Oncomir ist eine mit Krebs assoziierte microRNA. Einige Oncomire sind Onkogene, andere sind Tumorsuppressoren.
Epigenetische Änderungen: Unter Epigenetik versteht man Vererbung ohne Änderungen der DNA-Sequenz. Es handelt sich um Methylgruppen, Acetylgruppen oder Phosphatgruppen Die DNA-Methylierung kann DNA markieren und Gene aktivieren oder reprimieren.
Detektion von molekularen Abnormalitäten
Diese umfasst DNA Codes: Genetik/Genomik/Epigenomik:
Studium von DNA-Variabilitäten, die mit einer Krankheitsprädisposition bei malignen Merkmalen assoziiert ist.
RNA Expression: Transkriptomik: Quantitative Untersuchung von RNA (mRNA oder nicht-kodierende RNA) , die durch Zellen oder Gewebe als Antwort auf einen Stimulus exprimiert wird.
Protein Expression: Proteomik: Quantitative Untersuchung von Proteinen, die in Körperflüssigkeiten, einer Zelle oder Gewebe produziert werden als Antwort auf einen Stimulus.
Des Weiteren stellt der Referent die FISH Methode (Fluorescence in situ hybridization) vor. Es handelt sich dabei um eine Methode zum Nachweis von RNA und DNA-Molekülen in situ, d.h. in Geweben, Zellen oder auf Chromosomen mit fluoreszenzmarkierter RNA- oder DNA-Sonden.
Die vergleichende Genom Hybridisierung ist eine Labormethode zur Messung von Gewinn oder Verlust von chromosomalen Regio-nen in Tumorzellen. Man nimmt an, dass Gewinne und Verluste der DNA in Tumorzellen nicht völlig zufällig, sondern teilweise mit einer gewissen Kausalität zusammenhängen. Modelle, die die Tumorprogression mit dem Auftreten von DNA-Gewinn oder -Verlust in Beziehung setzen, könnten bei der Suche nach Krebs-genen und bei der Krebsdiagnose nützlich sein.
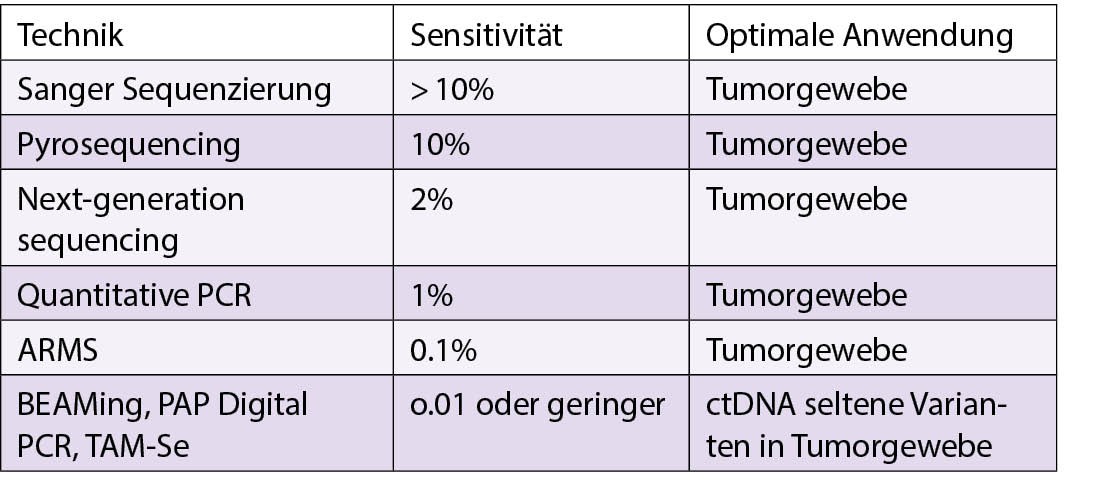
Der Referent erwähnte ferner die Polymerase Chain Reaction und die Real-time quantitative RT-PCR, sowie die digital PCR, Next generation PCR high-throughput quantification sowie die Next Generation Sequencing (NGS) Technologie. Er verglich die Methodologien zur Erfassung und Analyse von ctDNA.
Biomarker
Prognostische Biomarker: Information über Outcome/natürlicher Krankheitsverlauf, unabhängig von der Therapie.
Prädiktive Biomarker: Information über das Ansprechen auf eine gegebene Therapie. Diagnostik (Detektion/Monitoring der Krankheit) TRK Fusion, ein prädiktiver Biomarker.
Mutationen verschiedener Gene können Krebs im gleichen Organ auslösen, andrerseits können Veränderungen eines bestimmten Gens zu Tumoren an verschiedenen Orten im Körper führen. Ein Vertreter eines solchen molekulargenetischen Markers ist TRK, der bei verschiedenen Krebsarten als mutmasslicher Auslöser nachgewiesen wurde. Larotrectinib hat sich bei TRK Fusions-positiven Krebsarten sowohl bei Erwachsenen als auch Kindern als wirksam erwiesen. MGMT Promotor Methylierung ist ein weiterer prädiktiver Biomarker. Ein diagnostischer Biomarker ist das Konzept des «minimal residual disease», wie der Referent erklärte. Den Schluss des Referats machte
die Precision Medicine (Proteomics, Metabolomics, Genomics, Transcriptomics und Big Data), um nur einige Begriffe zu nennen.
Prof. Dr. Dr. h.c. Walter F. Riesen