- La stéatopathie non alcoolique
La stéatopathie non alcoolique (en anglais : non-alcoholic fatty liver disease – NAFLD) est l’ une des causes les plus fréquentes d’ atteinte hépatique chronique affectant 17-46 % de la population générale. Lorsqu’ elle est associée à une inflammation (stéatohépatite non alcoolique, NASH) elle peut conduire au développement d’ une fibrose hépatique puis à une cirrhose et est actuellement l’ une des principales causes de maladie chronique du foie. La NAFLD est considérée comme la manifestation hépatique du syndrome métabolique et est aussi bien retrouvée dans les régions à revenu faible qu’ intermédiaire en raison d’ une épidémie dramatique d’ obésité et de diabète de type 2 (DT2) dans le monde. La cirrhose liée à la NAFLD deviendra la principale indication à la transplantation hépatique au cours des 10 à 20 prochaines années devant la cirrhose liée à l’ infection par le virus de l’ hépatite C et la cirrhose d’ origine éthylique. Les domaines actuels de recherche s’ intéressent aux programmes de dépistage dans les populations à haut risque et au développement de nouvelles pharmacothérapies afin de prévenir la progression de la maladie vers la cirrhose.
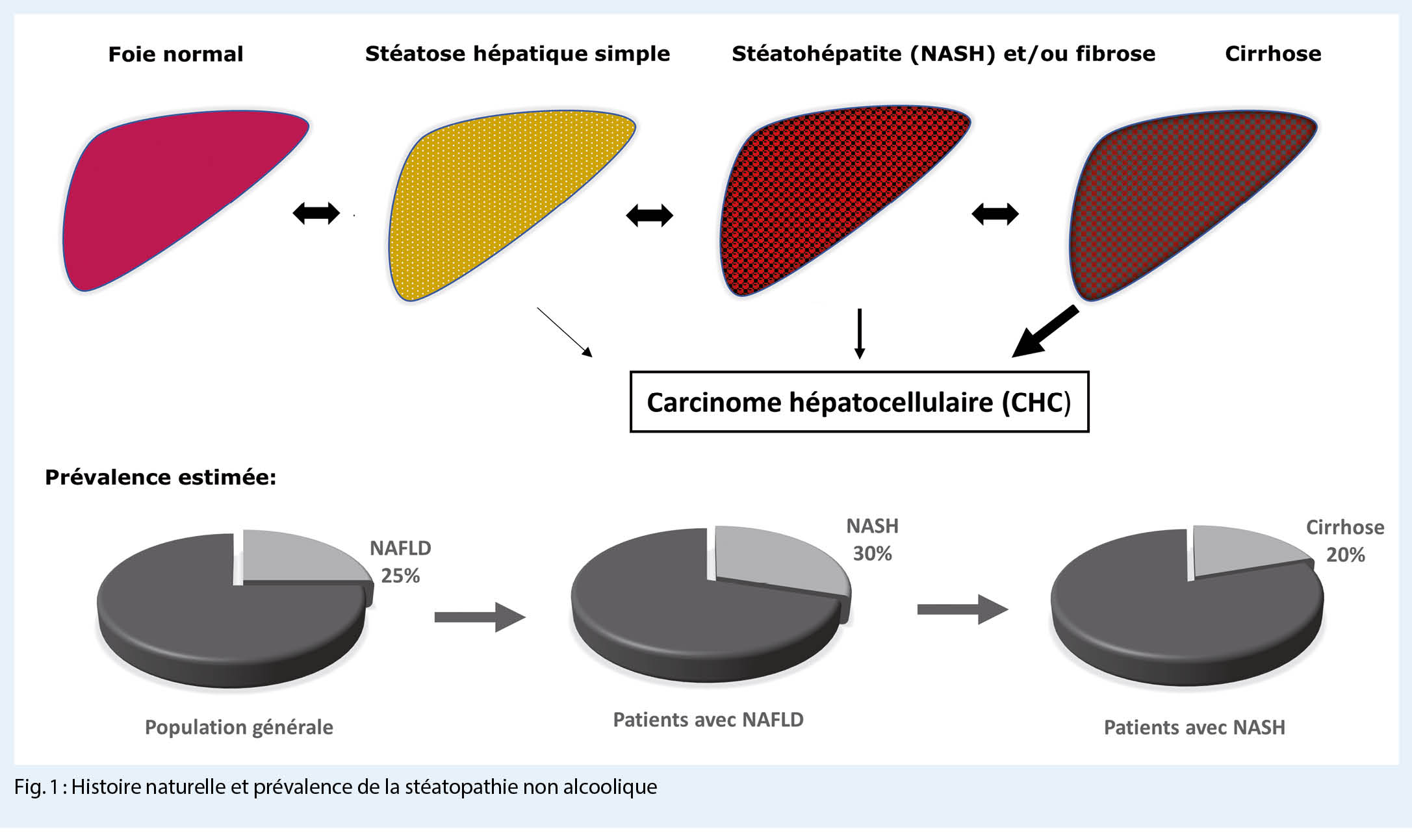
La NAFLD se caractérise par l’ accumulation de lipides dans le foie dans plus de 5 % des hépatocytes. Elle englobe un spectre de maladies hépatiques comprenant la stéatose simple (non-alcoholic fatty liver – NAFL), la stéatohépatite non alcoolique (NASH), qui se caractérise par une inflammation des hépatocytes, en présence d’ une stéatose hépatique compliquée de fibrose ou de cirrhose. En effet, les acides gras libres peuvent conduire à des lésions cellulaires parenchymateuses et déclencher une inflammation entraînant la destruction des hépatocytes et le développement d’ une fibrose. La fibrose hépatique est un mécanisme complexe caractérisé par la formation et le dépôt de tissu conjonctif fibreux menant au remodelage progressif du parenchyme hépatique et à une augmentation de la morbidité et mortalité. Le diagnostic de NAFLD exige l’ exclusion des autres causes secondaires de maladie hépatique telles que la consommation excessive d’ alcool (définie comme une consommation quotidienne d’ alcool de plus de 30 g pour les hommes et de plus de 20 g pour les femmes) et les infections virales par les virus de l’ hépatite B et C (fig. 1) (1, 2).
Au niveau épidémiologique, l’ impact de la NAFLD est considérable comme le montre une récente méta-analyse qui a retrouvé une prévalence mondiale de NAFLD de 25 %. Les taux les plus élevés ont été signalés en Amérique du Sud et au Moyen-Orient. Ces données ont également estimé une prévalence de NASH de 1,5% à 6,5% dans la population générale (3).
Syndrome métabolique et NAFLD
Plusieurs études ont démontré que la NAFLD est fortement liée à la résistance à l’ insuline et au syndrome métabolique, défini comme l’ association de trois des cinq caractéristiques suivantes associées à la résistance à l’ insuline : l’ intolérance au glucose ou le DT2, l’ hypertriglycéridémie, un taux de lipoprotéine de haute densité (HDL)-cholestérol bas, une augmentation de la circonférence abdominale et l’ hypertension artérielle (1). La résistance à l’ insuline, qui est au centre de cette maladie, conduit à une lipolyse et à la libération d’ acides gras libres qui s’ accumulent sous forme de graisse ectopique, principalement comme lipides intracellulaires et peuvent provoquer un stress oxydatif et une inflammation hépatocytaire (4).
Histoire et progression de la maladie
En général, la NAFLD est une maladie lentement progressive sur plusieurs années. La NASH est une maladie plus sévère et le développement de la fibrose est plus rapide que dans la NAFL simple sans inflammation hépatique (5). Il a été démontré que la fibrose hépatique avancée est le facteur le plus prédictif de mortalité dans la NAFLD, ce qui suggère que les patients atteints de stéatose devraient bénéficier d’ un dépistage de la fibrose à l’ aide de biomarqueurs ou d’ une élastographie hépatique (2).
La NAFLD est également un facteur de risque de développer un carcinome hépatocellulaire (CHC) (6). La prévalence du CHC lié à la NALFD augmente et l’ incidence varie de 0,25 % à 7,6 % à 5 ans chez les patients atteints de fibrose avancée ou d’une cirrhose (7). Le CHC survient généralement dans le contexte d’ une cirrhose, mais environ 20-50 % des cas peuvent se développer sur un foie non cirrhotique. Par ailleurs la NALFD, avec ou sans NASH, prédispose au CHC (8). Les recommandations Européennes et Américaines recommandent une surveillance du CHC par une échographie hépatique (possiblement associée au dosage de l’ alpha-foetoprotéine sanguine) tous les 6 mois chez les sujets avec une fibrose avancée ou une cirrhose (9). Il est intéressant de noter que les décès dus aux maladies cardiovasculaires sont plus fréquents que les décès liés à la morbidité hépatique dans la NAFLD (10). Les résultats de méta-analyses récentes indiquent que les personnes atteintes de la NAFLD sont exposées à un risque d’infarctus aigu du myocarde ou d’ accident vasculaire cérébral. Toutefois l’ association indépendante de la NAFLD avec le risque cardiovasculaire est controversée. Dans ce contexte, Alexander et al. ont récemment recueilli des données sur une cohorte de 120 000 patients atteints de NAFLD et ont montré que l’ association entre le risque de développer un événement cardiovasculaire et la NAFLD est plus faible que ce qui avait été estimé précédemment, avec un rapport de risque de 1, 2 (11). Ces données suggèrent que la NAFLD n’ est pas un facteur de risque indépendant d’ évènements cardiovasculaires, mais pourrait dépendre des cofacteurs métaboliques et des autres facteurs de risque cardiovasculaire.
Recommandations et traitements actuels
La stéatose hépatique doit être documentée chaque fois que l’ on suspecte une NAFLD. En pratique, les patients souffrant d’ obésité et de DT2 devraient faire l’ objet d’ un dépistage non invasif de la NAFLD. La stéatose doit être documentée par échographie comme procédure de diagnostic de première ligne. Des biomarqueurs sériques de dépistage comme le fatty liver index (FLI) ou le Steatotest ont été développés et peuvent également être utilisés pour la détection de la stéatose hépatique, mais la biopsie hépatique demeure le gold standard pour le diagnostic de la NASH (2).
L’ identification et la surveillance de la fibrose sont essentielles pour le suivi car il s’ agit du facteur pronostic le plus important dans la NAFLD (12). La combinaison de procédures non invasives utilisant des biomarqueurs ainsi que l’ élastographie hépatique peuvent être utilisées efficacement pour détecter une fibrose légère à modérée (13). Lorsqu’ une fibrose avancée ou une cirrhose est suspectée une biopsie du foie doit être effectuée pour confirmer le diagnostic (14).
Il existe une forte association entre le mode de vie et la NAFLD (15). Les thérapies les plus efficaces ciblent les interventions sur le mode de vie. La perte de poids est associée à une amélioration de la stéatose et de la résistance à l’ insuline chez les patients atteints de DT2 et est associée à une amélioration des enzymes hépatiques et des lésions histologiques chez les patients obèses et en surpoids. Les changements de régime alimentaire, le mode de vie en faveur d’ une alimentation saine et l’ activité physique habituelle constituent le traitement de première ligne pour la plupart des patients atteints de NAFLD (2, 23).
A l’ heure actuelle aucun traitement pharmacologique n’ est approuvé pour la prise en charge de la NAFLD. Bien qu’ aucune recommandation ferme n’ ait été faite, certaines pharmacothérapies se sont révélées bénéfiques pour des patients bien sélectionnés. En général, la pharmacothérapie est réservée aux patients atteints de NASH et de fibrose avancée (2). Les sensibilisateurs à l’ insuline ont été testés et la metformine n’ a pas montré d’ amélioration au niveau des lésions histologiques chez les patients atteints de NAFLD par rapport au placebo après 6 mois de traitement (16). Des études avec la pioglitazone chez des patients non diabétiques ont montré des réductions très significatives de la stéatose, de l’ inflammation et du ballonnement hépatocellulaire, ainsi que des améliorations de la résistance à l’ insuline et des niveaux d’ enzymes hépatiques (17, 18). L’ essai PIVENS a également montré que le traitement de vitamine E chez les patients non diabétiques, par rapport au placebo, était associé à une amélioration des lésions histologiques en lien avec la NASH (17). Lorsque les changements du mode de vie et la pharmacothérapie ne parviennent pas à réduire et à prévenir la progression de la fibrose, il est possible de recourir à la chirurgie bariatrique comme option pour perdre du poids (2). Celle-ci a démontré une réduction des lésions hépatiques associées à la NAFLD et des lésions histologiques de la NASH (19, 20). Les futures pharmacothérapies ciblent directement les mécanismes moléculaires de la fibrogénèse. Les molécules actuellement testées comprennent l’ agonisme du récepteur X des farnésoïdes (FXR) (acide obéticholique, agonistes FXR non stéroïdiens), l’ inhibition de l’ acétyl-CoA carboxylase, l’ agonisme du récepteur de l’ activateur de proliférateurs de peroxysomes (elafibranor, lanifibranor, saroglitazar) et l’ activation du facteur de croissance des fibroblastes FGF-21 ou FGF-19. D’ autres alternatives médicamenteuses ciblent la mort cellulaire ou l’ inflammation, tels que les inhibiteurs de la caspase (emricasan), les inhibiteurs de la galectine 3 et la réduction du recrutement des macrophages inflammatoires en bloquant les récepteurs de chimiokines CCR2/CCR5 (cénicriviroc). Une étude de phase 3 démontrant des résultats encourageants avec l’ acide obéticholique chez les sujets avec NASH a été récemment publiée et nous espérons que des thérapies efficaces pourraient être disponibles dans les 5 prochaines années (21, 22).
Copyright Aerzteverlag medinfo AG
Service de médecine interne
Hôpital Riviera-Chablais
Route du Vieux-Séquoia 20
1847 Rennaz
laurent.teasca@hopitalrivierachablais.ch
Service de gastroentérologie et d’ hépatologie
Hôpital Universitaire de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
nicolas.goossens@hcuge.ch
Nous ne déclarons aucun conflit d’ intérêts en relation avec cet article.
- Le NAFLD est une cause fréquente d’ atteinte hépatique et peut entraîner une fibrose hépatique et une cirrhose. Cette maladie est fortement liée au syndrome métabolique.
- Le bilan initial doit débuter par une échographie du foie.
- En cas de suspicion de fibrose hépatique celle-ci doit être recherchée par des procédures non invasives ou par une biopsie.
- Le traitement actuel consiste à prendre en charge le syndrome métabolique par des mesures hygiéno-diététiques. Une réduction de 10 % du poids et une activité physique trois fois par semaine effectuée de façon régulière peut améliorer de façon mesurable la fibrose.
- La pharmacothérapie est actuellement réservée à des patients bien sélectionnés. Il y a de grands espoirs que de futures thérapies médicamenteuses ciblant le développement de la fibrose soient disponibles dans les années à venir.
1. Ratziu V, Bellentani S, Cortez-Pinto H, Day C, Marchesini G. A position statement on NAFLD/NASH based on the EASL 2009 special conference. J Hepatol. 2010;53(2):372-384. doi:10.1016/j.jhep.2010.04.008
2. European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-1402. doi:10.1016/j.jhep.2015.11.004
3. Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease – Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64(1):73-84. doi:10.1002/hep.28431
4. Gaggini M, Morelli M, Buzzigoli E, DeFronzo RA, Bugianesi E, Gastaldelli A. Non-Alcoholic Fatty Liver Disease (NAFLD) and Its Connection with Insulin Resistance, Dyslipidemia, Atherosclerosis and Coronary Heart Disease. Nutrients. 2013;5(5):1544-1560. doi:10.3390/nu5051544
5. Singh S, Allen AM, Wang Z, Prokop LJ, Murad MH, Loomba R. Fibrosis Progression in Nonalcoholic Fatty Liver versus Nonalcoholic Steatohepatitis: A Systematic Review and Meta-analysis of Paired-Biopsy Studies. Clin Gastroenterol Hepatol. 2015;13(4):643-654.e9. doi:10.1016/j.cgh.2014.04.014
6. Byrne CD, Targher G. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease: is universal screening appropriate? Diabetologia. 2016;59(6):1141-1144. doi:10.1007/s00125-016-3910-y
7. Dyson J, Jaques B, Chattopadyhay D, et al. Hepatocellular cancer: the impact of obesity, type 2 diabetes and a multidisciplinary team. J Hepatol. 2014;60(1):110-117. doi:10.1016/j.jhep.2013.08.011
8. Desai A, Sandhu S, Lai J-P, Sandhu DS. Hepatocellular carcinoma in non-cirrhotic liver: A comprehensive review. World J Hepatol. 2019;11(1):1-18. doi:10.4254/wjh.v11.i1.1
9. European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu, European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018;69(1):182-236. doi:10.1016/j.jhep.2018.03.019
10. Targher G, Day CP, Bonora E. Risk of Cardiovascular Disease in Patients with Nonalcoholic Fatty Liver Disease. http://dx.doi.org/10.1056/NEJMra0912063. doi:10.1056/NEJMra0912063
11. Alexander M, Loomis AK, van der Lei J, et al. Non-alcoholic fatty liver disease and risk of incident acute myocardial infarction and stroke: findings from matched cohort study of 18 million European adults. BMJ. 2019;367:l5367. doi:10.1136/bmj.l5367
12. Ekstedt M, Hagström H, Nasr P, et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology. 2015;61(5):1547-1554. doi:10.1002/hep.27368
13. Petta S, Vanni E, Bugianesi E, et al. The combination of liver stiffness measurement and NAFLD fibrosis score improves the noninvasive diagnostic accuracy for severe liver fibrosis in patients with nonalcoholic fatty liver disease. Liver Int. 2015;35(5):1566-1573. doi:10.1111/liv.12584
14. European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015;63(1):237-264. doi:10.1016/j.jhep.2015.04.006
15. Zelber-Sagi S, Ratziu V, Oren R. Nutrition and physical activity in NAFLD: An overview of the epidemiological evidence. World J Gastroenterol. 2011;17(29):3377-3389. doi:10.3748/wjg.v17.i29.3377
16. Haukeland JW, Konopski Z, Eggesbø HB, et al. Metformin in patients with non-alcoholic fatty liver disease: a randomized, controlled trial. Scand J Gastroenterol. 2009;44(7):853-860. doi:10.1080/00365520902845268
17. Sanyal AJ, Chalasani N, Kowdley KV, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010;362(18):1675-1685. doi:10.1056/NEJMoa0907929
18. Aithal GP, Thomas JA, Kaye PV, et al. Randomized, placebo-controlled trial of pioglitazone in nondiabetic subjects with nonalcoholic steatohepatitis. Gastroenterology. 2008;135(4):1176-1184. doi:10.1053/j.gastro.2008.06.047
19. Caiazzo R, Lassailly G, Leteurtre E, et al. Roux-en-Y gastric bypass versus adjustable gastric banding to reduce nonalcoholic fatty liver disease: a 5-year controlled longitudinal study. Ann Surg. 2014;260(5):893-898; discussion 898-899. doi:10.1097/SLA.0000000000000945
20. Lassailly G, Caiazzo R, Buob D, et al. Bariatric Surgery Reduces Features of Nonalcoholic Steatohepatitis in Morbidly Obese Patients. Gastroenterology. 2015;149(2):379-388; quiz e15-16. doi:10.1053/j.gastro.2015.04.014
21. Tacke F, Weiskirchen R. An update on the recent advances in antifibrotic therapy. Expert Review of Gastroenterology & Hepatology. 2018;12(11):1143-1152.
doi:10.1080/17474124.2018.1530110
22. Younossi ZM, Ratziu V, Loomba R, et al. Obeticholic acid for the treatment of non-alcoholic steatohepatitis: interim analysis from a multicentre, randomised, placebo-controlled phase 3 trial. Lancet. 2019;394(10215):2184-2196. doi:10.1016/S0140-6736(19)33041-7
23. Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, et al. Weight loss through lifestyle modification significantly reduces features of nonalcoholic steatohepatitis. Gastroenterology. 2015;149:367e378
la gazette médicale
- Vol. 9
- Ausgabe 6
- November 2020