- Kongressausgabe der info@onkologie
Der ESMO Congress 2021 «The place where oncology experts come together, as a community» wie Prof. Solange Peters, CHUV Lausanne, die ESMO Präsidentin betonte, fand vom 16. – 21. September virtuell in Villejuif, Paris, statt.
 Hier finden Sie das PDF der Kongresszeitung
Hier finden Sie das PDF der Kongresszeitung
EDITORIAL ESMO 2021: Virtuell und aktuell
ESMO in the Alps – Live-Sitzung im Circle am Flughafen Kloten
Der ESMO Congress 2021 «The place where oncology experts come together, as a community» wie Prof. Solange Peters, CHUV Lausanne, die ESMO Präsidentin betonte, fand vom 16. – 21. September virtuell in Villejuif, Paris, statt. ESMO 2021 war einmal mehr die globale Bühne für den Austausch und die Debatte über exzellente translationale Krebsforschung, für die Präsentation erster praxisverändernder Daten und für den multidisziplinären Austausch zur Förderung von Therapien gegen Krebs.
Wie im letzten Jahr wurden Auszüge aus dem ESMO Congress am ESMO in the Alps Meeting, welches von der SAKK initiiert und organisiert wurde, vorgestellt.
Das ESMO in the Alps Meeting 2021 war sowohl eine Live-Sitzung im Circle am Flughafen Kloten vom 22. bis 24. September als auch ein live übertragenes Webinar, für welches das wissenschaftliche Komitee die wichtigsten Studien in 5 Hauptbereichen Urogenitaltumore, Tumore des Gastrointestinaltrakts, gynäkologische Tumoren und Brustkrebs, Lungenkrebs und Varia aus den Präsentationen am ESMO Kongress ausgewählt hat. Zum ersten Mal waren auch die Mentees der SAKK Young Oncology Academy im wissenschaftlichen Komitee vertreten. Der folgende Bericht soll eine Übersicht über das Meeting geben.
ESMO in the Alps, Zürich
Session Gynäkologische Krebserkrankungen und Brustkrebs
EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9.
Die Resultate der Phase 3 Studie mit Cemiplimab versus Chemotherapie nach Wahl des Untersuchers (IC) bei rekurrentem/metastatischem (R/M) Zervixkarzinom wurden von Prof. Krishnansu Tewari, Orange, California, präsentiert. Diese Studie umfasste die grösste Population, die bis dato in dieser Population durchgeführt wurde. Cemiplimab ist dabei die erste Immuntherapie, die einen statistisch und klinisch bedeutsamen Überlebensvorteil bei Gebärmutterhalskrebs nach Progression der Erkrankung nach einer platinhaltigen Erstlinien–Chemotherapie zeigte:
– Medianes OS 11,1 vs. 8,8 Monate mit IC-Chemotherapie, HR 0,73, (0,58-0,91; p = 0,00308)
Überlebensvorteile und ORR in der Gesamt- und AC-Population beobachtet.
Basierend auf den verfügbaren Tumorproben wurde ein numerischer OS-Vorteil für Cemiplimab im Vergleich zur IC-Chemotherapie bei Patienten mit PD-L1 <1% festgestellt, obwohl der Vorteil bei Patienten mit PD-L1≥ 1% grösser war.
Ein deutliches Ansprechen auf Cemiplimab wurde sowohl bei Patienten mit einer PD-L1-Expression ≥1% (18,3% (10,6-28,4) und < 1% (11,4 (3,8-24,6 n = 5/44) beobachtet.
Die mittlere Gesamtveränderung von GHS/QoL gegenüber dem Ausgangswert begünstigte Cemiplimab in der Gesamtpopulation (einseitig nominal P = 0,001).
Es wurden keine neuen Sicherheitssignale identifiziert.
Keynote 826
Die Zugabe von Prembrolizumab zur Chemotherapie + Bevacizumab führt bei Frauen mit persistierendem, rezidivierendem oder metastasiertem Gebärmutterhalskrebs zu statistisch signifikanten, klinisch bedeutsamen Verbesserungen von OS und PFS.
-Es wurde ein signifikanter Nutzen in allen protokollspezifischen primären Analysepopulationen (PD-L1, CPS < 1, All-Corner und CPS ≥10) beobachtet.
Der Nutzen war generell in allen protokollspezifischen Untergruppen gleich, einschliesslich der Untergruppen mit und ohne Bevacizumab.
Die ORR war höher und die DOR war länger, wenn Pembrolizumab hinzugefügt wurde.
Das Sicherheitsprofil für Pembrolizumab + Chemotherapie + Bevacizumab war überschaubar.
Pembrolizumab plus Chemotherapie mit oder ohne Bevacizumab könnte ein neuer Therapiestandard für Frauen mit persistierendem, rezidivierendem oder metastasiertem Gebärmutterhalskrebs sein, dies die Schussfolgerungen von Prof. Nicoletta Colombo, Milano.
TNBC
BrightTNess
Ereignisfreies Überleben, Gesamtüberleben und Sicherheit von Veliparib plus Carboplatin oder Carboplatin allein als Ergänzung zur neoadjuvanten Chemotherapie bei dreifach negativem Brustkrebs nach > 4 Jahren Nachbeobachtungszeit: BrighTNess, eine randomisierte Phase-3-Studie. Sie wurde von Prof. Sibylle Loibl, Zentrum für Hämatologie und Onkologie Bethanien, Frankfurt, der Erstautorin der Publikation, vorgestellt.
Die Zugabe von Carboplatin zu Paclitaxel, gefolgt von Doxorubin und Cyclophosphamid, verbesserte die pCR signifikant und führte zu einem verbesserten EFS nach einem medianen Follow-up von 4,5 Jahren.
Die Zugabe von Veliparib hatte keinen Einfluss auf pCR, EFS oder OS.
Patienten mit pCR hatten ein signifikant besseres EFS; dies war bei Patienten mit und ohne gBRCA-Mutationen ähnlich.
Höhere Raten hämatologischer Nebenwirkungen durch die zusätzliche Gabe von Carboplatin mit oder ohne Veliparib (vorläufig berichtet) beeinträchtigten weder die Durchführung der Behandlung noch die Auswirkungen dieser Behandlung auf die primären (pCR) oder sekundären (EFS/OS) Endpunkte der Studie.
Diese Ergebnisse unterstützen die Einbeziehung von Carboplatin in die neoadjuvante Chemotherapie bei TNBC im Stadium II-III, unabhängig vom gBRCA-Status.
Keynote 522
Keynote-522 ist die erste prospektive, randomisierte, placebokontrollierte Phase-3-Studie mit Pembrolizumab bei TNBC im Frühstadium in der neoadjuvanten und adjuvanten Behandlung stellte Prof. Peter Schmid, Barts Cancer Institute, Queen Mary University of London, UK.fest.
Keynote-522 hat seine beiden primären Endpunkte erreicht.
– Die neoadjuvante Behandlung mit Pembrolizumab + Chemotherapie führte zu einem statistisch signifikanten und klinisch bedeutsamen Anstieg der pCR (ypT0/Tis ypN0) (P = 0,00055).
Neoadjuvante Premprolizumab + Chemotherapie, gefolgt von adjuvanter Pembrolizumab-Behandlung zeigte eine statistisch signifikante und klinisch bedeutsame Verbesserung des EFS (P = 0,00031).
Zu diesem frühen Zeitpunkt zeigte sich in der Pembrolizumab-Gruppe ein positiver Trend beim OS, die Nachbeobachtung läuft noch.
Die Sicherheit entsprach den bekannten Profilen der einzelnen Therapien, es gab keine neuen Sicherheitsbedenken.
Die meisten immunvermittelten SARs traten in der neoadjuvanten Phase auf, waren geringfügig und durch Unterbrechung der Behandlung, Verabreichung von Steroiden und/oder Hormonersatz beherrschbar.
Auf der Grundlage der Ergebnisse der Keynote 522 hat die US-amerikanische FDA Pembrolizumab in Kombination mit Chemotherapie als neoadjuvante Behandlung zugelassen und dann als Einzelwirkstoff als adjuvante Behandlung nach der Operation für die Behandlung von Patienten mit Hochrisiko-TNBC im Frühstadium fortgesetzt.
Keynote -355
Endgültige Ergebnisse einer randomisierten, doppelblinden Phase-3-Studie zur Erstlinienbehandlung von metastasiertem dreifach negativem Brustkrebs mit Pembrolizumab + Chemotherapie im Vergleich zu Placebo + Chemotherapie
Pembrolizumab + Chemotherapie führte zu statistisch signifikanten und klinisch bedeutsamen Verbesserungen bei PFS und OS im Vergleich zur alleinigen Chemotherapie für die Erstlinienbehandlung von PD-L1-positivem (CPS<10) metastasiertem TNBC und erfüllte die beiden primären Endpunkte.
Konsistente Ergebnisse wurden in allen Patientenuntergruppen beobachtet.
Die Ergebnisse für die wichtigsten sekundären Endpunkte ORR, DCR und DOR sprachen für Pembrolizumab + Chemotherapie, stellte Frau Prof. Hope Rugo, San Francisco, die die Studie präsentierte, fest.
Die Sicherheit entsprach den bekannten Profilen der einzelnen Therapien, ohne dass neue Sicherheitsbedenken aufgetreten wären.
Die Ergebnisse unterstützen Pembrolizumab in Kombination mit Chemotherapie als neues Standardbehandlungsschema für Patienten mit lokal rezidivierendem, inoperablem oder metastasiertem TNBC, deren Tumoren PD-L1 exprimieren (CPS >10).
MONALEESA-2.
Die Ergebnisse der MONALEESA-2- Phase III Studie bei postmenopausalen Patientinnen mit fortgeschrittenem HR + /HER2-Brustkrebs, die mit Endocrin + Ribociclib behandelt werden wurden von Prof. Gabriel Hortobagyi, Houston, präsentiert.
Die Erstlinienbehandlung mit Ribociclib + Letrozol zeigte bei postmenopausalen Patientinnen mit fortgeschrittenem HR + /HER2-Brustkrebs einen statistisch signifikanten und klinisch bedeutsamen OS-Vorteil im Vergleich zu Placebo + Letrozol.
Das mediane OS wurde um mehr als 12 Monate verlängert (63,9 mit Ribociclib plus Letrozol gegenüber 51,4 Monaten mit Placebo plus Letrozol). HR war 0,76 80,63-0,93; p = 0,004). Die Sechs-Jahres-Überlebensrate betrug 44,2% bzw. 32,0% für Ribociclib und Placebo. Bei Ribocliclib wurden nach einer Nachbeobachtungszeit von mehr als 6,5 Jahren keine neuen Sicherheitssignale festgestellt.
Ribociclib in Kombination mit einer endokrinen Therapie ist die einzige Erstlinientherapie, die einen OS-Vorteil bietet und sollte daher als bevorzugte Behandlungsoption für HR+/HER2-fortgeschrittenes Mammakarzinom in Betracht gezogen werden Die MONALEESA-Studien mit Ribociclib zeigen einen kosistenten Gesamtüberlebensvorteil unabhängig vom endokrinen Therapiepartner, der Therapielinie oder dem Menopausenstatus.
DESTINY-Breast03Trastuzumab
Trastuzumab Deruxtecan (T-DXd) vs. Trastuzumab Emtansine (T-DM1) bei Patientinnen mit HERR2 + metastatischem Brustkrebs. Die Resultate der Phase 3 Studie
DESTIY-Breast03 wurden von Dr. Javier Cortes, vorgestellt.
Trastuzumab Deruxtecan zeigte in dieser ersten randomisierten Phase 3 Studie bei Brustkrebs eine hochgradig bedeutsame und statistisch signifikante Verbesserung des PFS im Vergleich zu T-DM1 bei Patienten mit HER2-positivem metastatischem Brustkrebs: PFS HR 0,26 (p_7,8 x 10-22) DXd zeigte einen konsistenten Nutzen über wichtige Untergruppen und Wirksamkeitsendpunkte hinweg mit einer bestätigten ORR für T-DXd von 79,7% gegenüber 34,2% für T-DM1 (CR 16,1% vs. 8,7%) und einen ermutigenden OS-Trend zum Zeitpunkt der ersten Zwischenanalyse. Die 12-Monats-OS-Rate für T-DXd betrug 94,1% gegenüber 85,9% für T-DM1. Das Sicherheitsprofil zwischen den beiden Gruppen war vergleichbar. Die Raten aller Arzneimittel bedingten unerwünschten Nebenwirkungen des Grades ≥3 waren in beiden Armen vergleichbar. Bei keiner der beiden Gruppen traten ILD/Pneumonitis-Ereignisse des Grades 4 oder 5 auf. Diese Daten sprechen dafür, dass T-DXd die Standardtherapie für 2L HER2-positivem metastatischem Brustkrebs BC werden sollte.
Session Gastrointestinale Tumoren
Pankreas-Karzinom
Das Pankreaskarzinom hat eine aggressive Tumorbiologie und frühe Micrometastasen. Autopsiestudien zeigen bei 2 cm 70% Micrometastasen, bei 4cm 100% Micrometastasen. Es ist seit Beginn eine systemische Krankheit. Die Rezidivraten nach Resektion in der gesamten Population mit Pankreaskarzinom beträgt mehr als 90%. Die Patienten befinden sich nach einer pp-Whipple-Operation häufig in einem schlechten Allgemein/Ernährungszustand. Die Therapie ist eine neoadjuvante systemische Therapie – ähnlich wie bei Ösophagus-, GEJ-, Magen- und Rektumkrebs, so Prof. Ueli Güller, Thun, in seiner Einleitung. Chirurgen sagen «Chirurgie ist der Standard of Care». Prof. Güller hält dagegen es gibt 2 Standards of Care: A) basierend auf randomisierten, kontrollierten Studien, B) wir haben es immer so gemacht. Es ist wichtig zu wissen, was Prof. Murray Brennan, Sloan Kettering Institute, gesagt hat «Biologie schlägt Skalpell – jederzeit». Dies ist bestimmt wahr für Pankreaskrebs.
Perioperativ oder nur adjuvant nab-Paclitaxel plus Gemcitabine bei resezierbarem Pankreaskrebs. Die Neonax Studie
Die Rationale war, dass sogar resezierbarer Pankreaskrebs immer noch eine schlechte Prognose hat, so Prof. Thomas Seufferlein, Ulm. Können wir das Outcome durch Modifikation der systemischen Therapie verbessern, entweder durch Zugabe chemotherapeutischer Wirkstoffe (nab-Paclitaxel) oder durch perioperative Behandlung wie beim Oesophagus-/Magen- oder Rektumkarzinom?
NEONAX untersuchte dies Frage in einem randomisierten Setting. Es ist eine interventionelle, prospektive, randomisierte kontrollierte, Open-Label, zweiseitige Phase II Studie gegen eine fixierte Überlebenswahrscheinlichkeit. «mITT»: Behandlung im Arm A startete mit neoadjuvanter Behandlung und R0/R1 Resektion, Arm B R0/R1 Resektion und Start der adjuvanten Therapie Nab-Paclitaxel, Gemcitabine. Primärer Endpunkt war Verbesserung der DFS Rate 18 Monate nach Randomisierung in beiden Armen von 38% (historische ONKO.001) bis 55% in der mITT Population.
Sekundäre Endpunkte OFS, OS und R0 Resektionsrate in der ITT Gruppe in beiden Armen. ORR und Tumorregression in Arm A, QoL.
Neonax erreichte eine 55% DFS Rate nach 18 Monaten in der ITT Population in beiden Armen nicht (Arm A 32.2%, Arm B 41.4%). Die neoadjuvante Therapie mit 2 Zyklen Gemcitabine plus nab-Paclitaxel ergab ein gutes Tumoransprechen (ORR 28.9%). Die Tumorprogressionsrate war niedriger als erwartet (6.7%). Die R0 Resektionsrate war hoch (87.8%; Upfrontoperation 67.4%). 90% der Patienten schlossen die präoperative Chemotherapie ab. Adjuvant Arm B: nur 42% der Patienten begannen und 27% schlossen die adjuvante Chemotherapie ab. mDFS betrug 11.4 Monate im perioperativen und 5.9 Monate im adjuvanten Arm in der ITT Analyse.
Eine grössere Gruppe von Patienten kann profitieren, wenn die Chemotherapie vor der Chirurgie verabreicht wird.
Die neoadjuvante Chemotherapie sollte als Standard für neue klinische Studien gelten.
Prodige 24/CCTG PAG
3 Jahre mehr Follow-up von der ursprünglichen Publikation. Die Prodige 24/CCTG PAG Studie untersuchte die Sicherheit und Wirksamkeit von mFOLFIRINOX vs. Gemcitabine allein bei Patienten mit reseziertem Pankreaskarzinom. Krankheitsfreies Überleben diente als primärer Endpunkt. 490 Patienten waren notwendig um 342 Ereignisse für die finale Analyse zu erhalten. Das Data and Safety Monitoring Committe empfahl die frühe Analyse und Publikation der Ergebnisse.
Die finale Analyse wurde mit 314 Ereignissen (91.8%) und einem medianen Follow-Up von 33.6 Monaten durchgeführt und die ersten Resultate wurden publiziert. Die aufdatierten 5-Jahres OS Daten und die prognostischen Faktoren für OS in der ITT Population wurden von Prof. Thierry Conroy, Nancy, präsentiert.
Die publizierten Daten der primären Analyse wurden vollständig bestätigt: die adjuvante Chemotherapie mit mFOLFIRINOX mit > 5 Jahren Follow-Up ist Gemcitabine überlegen mit signifikant besseren Outcomes, krankheitsfreies Überleben, Metastase-freies Überleben, spezifisches Überleben und Gesamtüberleben. Die Vollendung aller Zyklen scheint ein wichtiger prognostischer Faktor zu sein. Die reifen Daten dieser Studie bestätigen, dass mFOLFIRINOX das wirksamste Regime im adjuvanten Setting für fitte Patienten ist.
In der Diskussion ergab sich, dass für ältere Patienten mFOLFORINOX weniger in Frage kommt. Prof. Güller stellte die Frage, was mit einem Patienten, der einen CA19.9-Wert von 15 000 aufweist, zu tun ist? Dieser Mann hat sicher Metastasen. Prof. Güller und PD Del Sosso würden ihn aufklären und behandeln.
Magenkarzinom
Dr. Panagiotis Ntellas präsentierte eine kurze Übersicht über das Magenkarzinom. 90% sind Adenokarzinome. Nach der Lauren Klassifizierung differenziert/undifferenziert oder intestinal/gut differenziert.
Es existieren 4 Subtypen
A) Epstein Barr Virus bezogene Tumoren
B) Instabile Microsatellitentumore
C) Genomisch stabile Tumoren
D) Chromosomal instabile Tumoren
Diese Einteilung hat auch therapeutische Konsequenzen, stellte der Referent fest. Er erwähnte die Studien mit Immuntherapeutika beim Magenkarzinom ATTRACTION 2-3, ATTRACTION-4 und KEYNOTE 062.
Checkmate 649 Studie
Checkmate 649 wurde bereits 2020 vorgestellt. Die aufdatierten Resultate wurden von Dr. Yelena Janjigian, New York, präsentiert. Es handelt sich um die Behandlung des fortgeschrittenen Magenkarzinoms (GC), des Krebses des gastroösophagealen Übergangs (GEJC) und des Ösophagus-Adenokarzinoms (EAC) mit Nivolumab plus Chemotherapie oder Ipilimumab vs. Chemotherapie als Erstlinientherapie.
NIVO + Chemo zeigte bei zuvor unbehandelten Patienten mit fortgeschrittenem GC/GEJC/EAC nach weiteren 12 Monaten eine weitere Verbesserung von OS, PFS und objektivem Ansprechen im Vergleich zur Chemo und einen klinisch bedeutsamen langfristigen OS- und PFS-Vorteil mit anhaltender Trennung der KM-Kurven, höheres ORR und dauerhafteres Ansprechen, Vertiefung des Ansprechens mit zusätzlichem vollständigem Ansprechen bei längerem Follow-up. NIVO + IPI verbesserte das OS im Vergleich zur Chemotherapie bei Patienten mit PD-L1 CPS ≥ 5 dagegen nicht signifikant.
Es wurden keine neuen Sicherheitssignale bei NIVO + Chemo oder NIVO + IPI festgestellt
Längere Nachbeobachtungsdaten für NIVO + Chemo unterstützen den Einsatz als neue Standard-Erstlinienbehandlung bei Patienten mit fortgeschrittenem GC/GEJC/EAC
Diese Studie stellt eine praxisändernde Studie dar.
Rektumkarzinom
CONVERT
Neoadjuvante Chemotherapie mit Oxaliplatin und Capecitabine versus Bestrahlung mit Capecitabine bei lokal fortgeschrittenem Rektumkarzinom mit unbeteiligter mesorektaler Faszie. Die intialen Resultate einer multicenter, randomisierten, Open-label Phase III Studie wurden von Dr. Pei-Rong Ding, Guangzhou, vorgestellt.
Neoadjuvante Chemotherapie (nCT) mit Capecitabine/Oxaliplatin (CapeOx) allein erzielte eine ähnliche pCR-, cCR- und eine gute Downstaging-Rate (ypStadium 0-1) im Vergleich zu neoadjuvanter Chmeoradiotherapie. nCT mit CapeOx allein reduzierte die peri-operative Fernmetastasen- und präventive Ileostomierate.
Die Sicherheit war in beiden Armen ähnlich: nCRT geht mit einer geringeren Compliance in der adjuvanten Phase einher.
CapeOx könnte eine mögliche Alternative zur CRT bei lokal fortgeschrittenem Rektumkarzinom mit unbeteiligtem mesorektaler Faszie darstellen. Eine langfristige Nachbeobachtung ist erforderlich, um die Ergebnisse zu bestätigen.
FOLFOXIRI plus Bevacizumab pluas Atezolizumab versus FOLFOXIRI plus Bevacizumab als Erstlinientherapie bei unresezierbarem metastatischem Kolorektalkarzinom-Patienten.
Die Resultate der Phase III randomisierten Atezotribe Studie von CONO wurden von Dr. Chiara Cremolini, Pisana, präsentiert. Folfiri/Bevacizumab ist eine wertvolle Erstlinienoption für mCRC-Patienten, die in den wichtigsten klinischen Leitlinien weltweit empfohlen wird.
Eine Metaanalyse der Daten einzelner Patienten aus fünf randomisierten Studien zu FOLFOXIRI/Bevacizumab im Vergleich zu Tripletts (FOLFOX oder FOLFIRI/Bevacizumab) lieferte eine solide Bestätigung für einen signifikanten und klinisch bedeutsamen Überlebensvorteil von Triplet/Bevacizumab als Ersttherapie bei inoperablem mCRC.
Während Immun-Checkpoint-Inhibitoren bemerkenswerte Ergebnisse bei MSI-high/dMMR mCRC lieferten, werden derzeit Strategien geprüft, um die Immuntherapie auch bei MSS/pMMR mCRC wirksam zu machen. Für die Kombination von Immuncheckinhibitoren mit Bevacizumab gibt es eine biologische Rationale. In instabilen Mikrosatelliten wirken Immuncheckinhibitoren nicht. Bevacizumab potenziert die Funktionen dendritischer Zellen, erhöht die Infiltration von T-Zellen in den Tumor und vermindert die Aktivität immunsuppressiver Zellen.
Der primäre Endpunkt der Studie wurde erreicht: die Zugabe von Atezolizumab zu upfront FOLFOXIRI/Bevacizumab als initiale Therapie des mCRC verlängerte das PFS in molekular unselektierten mCRC Patienten (HR:0.69). Es wurden kein Unterschied in der RECIST-Ansprechrate und keine Sicherheitsprobleme beobachtet. Die OS-Daten waren zum Zeitpunkt des Cut-offs noch nicht ausgereift (28% der Ereignisse). Das Ausmass des PFS-Vorteils ist je nach MMR-Status heterogen (p für Interaktion 0,010).
In der dMMR-Untergruppe wurden beeindruckende Ergebnisse mit FOLFOXIRI/Bevacizumab/Atezolizumab berichtet (medianes PFS bei einem mittleren Follow-Up von 2o,6 Monaten wurde nicht erreicht). In der pMMR-Subgruppe bot der Zusatz von Atezolizumab immer noch einen statistisch signifikanten Vorteil gemäss dem ursprünglichen Studiendesign (HR 0,78, p = 0,071).
Biomarker werden derzeit als Prädiktoren für den Nutzen des Zusatzes von Atezolizumab in der pMMR-Untergruppe untersucht, darunter TMB; TILs, DetermaIO®; Immunoscore® und Immunoscore® CR IC; fäkales Mikrobiom.
Krystal-1
Adagrasib als Monotherapie oder kombiniert mit Cetuximab bei Patienten mit kolorektalkarebs, die eine KRASG12c Mutation haben.
Adagrasib ist ein differenzierter, selektiver Inhibitor von KRAS G12C. KRAS G12C -Mutationen kommen in ungefähr 3%-4% von Kolorektalkarzinomen vor und agieren als onkologische Treiber. Sie sind negative Prädiktoren der Effizienz von Cetuximab, so Prof. Jared Weiss, Chapel Hill, der die Studie präsentierte. Das KRAS-Protein wechselt zwischen GTP-on und GDP-off-Zuständen und hat eine Protein-Resynthese-Halbwertszeit von 24 Stunden. Adagrasib, ein kovalenter Inhibitor von KRAS G12C, bindet KRAS G12C irreversibel und selektiv in seinem inaktiven, GDP-gebundenen Zustand und wurde auf die gewünschten Eigenschaften hin optimiert, darunter lange Halbwertszeit von 24 Stunden, dosisabhängige PK und Gehirnpenetration.
Die Aufrechterhaltung einer kontinuierlichen Adagrasib-Exposition oberhalb eines Schwellenwerts ermöglicht die Hemmung der KRAS-abhängigen Signalübertragung während des gesamten Dosierungsintervalls und maximiert die Antitumoraktivität. Die Kombination von Adagrasib mit Cetuximab, einem EGFR-Inhibitor, kann die Hemmung der KRAS-abhängigen Signalübertragung verstärken oder eine adaptive Rückkopplung überwinden, um die Ergebnisse zu verbessern.
Die Adagrasib-Monotherapie zeigte eine vielversprechende klinische Aktivität (Ansprechrate 22%) und eine weitgehende Krankheitskontrolle (DCR 87%) bei stark vorbehandelten Patienten mit CRC, die eine KRAS G12C-Mutation aufweisen.
Adagrasib + Cetuximab zeigte eine ermutigende klinische Aktivität (Ansprechrate 43%, DCR 100%) bei stark vorbehandelten Patienten mit CRC mit KRAS G12C-Mutation.
Adagrasib ist gut verträglich und hat ein überschaubares Sicherheitsprofil, sowohl als Monotherapie als auch in Kombination mit Cetuximab.
Adagrasib + Cetuximab wird im Zweitlinien-Setting in KRYSTAL-10 untersucht, einer Phase-3-Studie bei Patienten mit KRAS G12C -mutiertem mCRC.
Für Prof. Güller ist diese Studie eines der Highlights dieser Session über Gastrointestinaltumoren.
Session Urogenitaltumoren
Prostatakarzinom
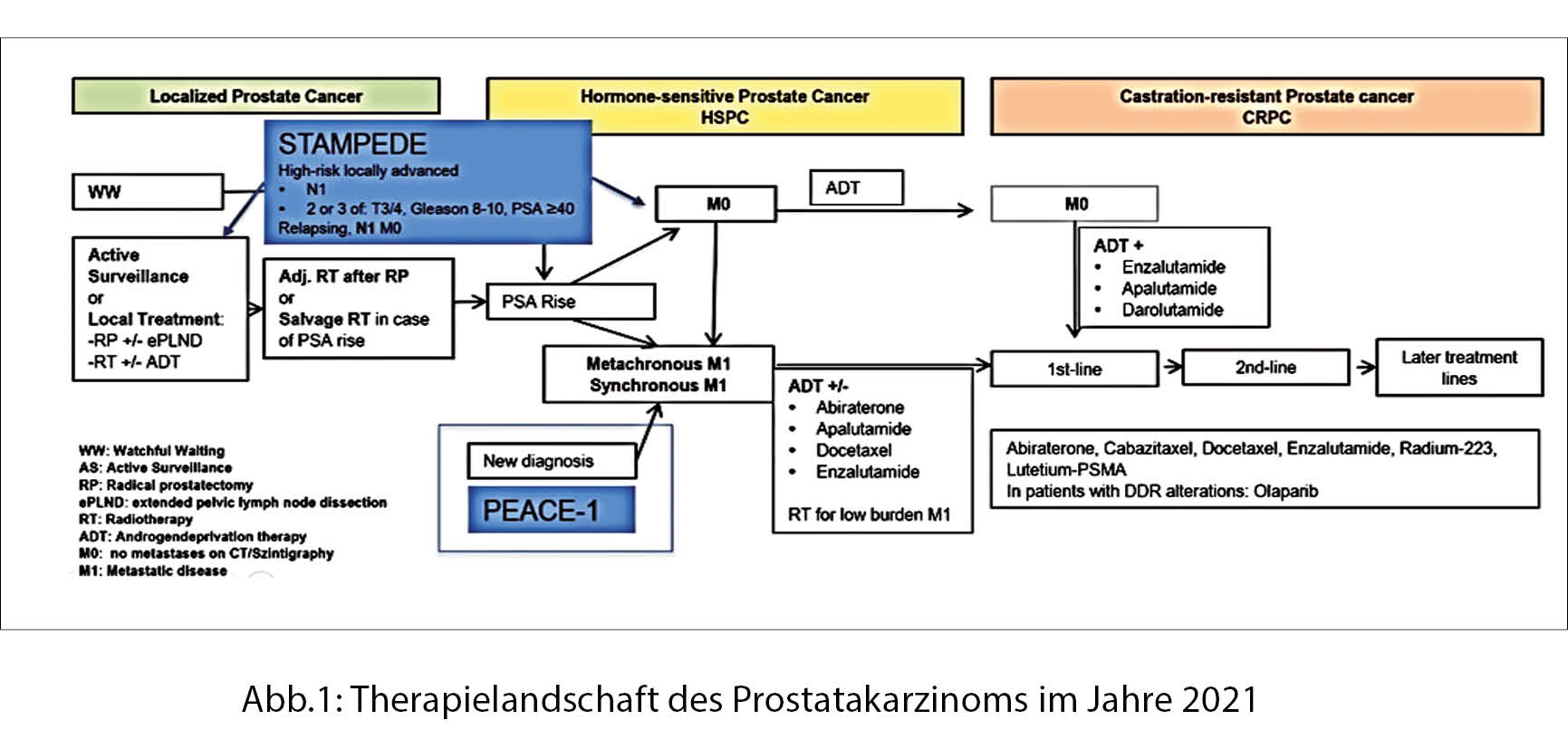
In einer Einführung präsentierte PD Dr. Aurelius Omlin die Therapielandschaft des Prostatakarzinoms im Jahre 2021 (Abb.1). Die beiden ausgewählten Vorträge werden sich mit der STAMPEDE-Studie und der PEACE-1-Studie befassen.
Abiratereonacetat plus Prednisolon (AAP) mit oder ohne Enzalutamid (ENZ) zur Androgendeprivationstherapie gegeben (ADT) verglichen mit ADT allein bei Männern mit nichtmetastatischem Hochrisiko-Prostatakarzinom. Eine kombinierte Analyse von zwei Vergleichen mit dem Stampede Protokoll.
Die Studie wurde von Prof. Gerhardt Attard, London, präsentiert.
Zwei Jahre einer auf Abirateronacetat plus Prednison -basierten Therapie verbessert die Metastasen-freie Überlebenszeit und das Gesamtüberleben von Hochrisiko-M0-Prostatakarzinomen, die mit einer ADT beginnen signifikant, und sollte als neuer Pflegestandard betrachtet werden.
Die Zugabe von Enzalutamid erhöht die Toxizität, hat aber keine erkennbaren Auswirkungen auf die Wirksamkeit.
PEACE-1
Peace-1 ist eine Phase 3 Studie mit einem 2×2 Faktordesign bei Männern mit de novo metastatischem, kastrations-sensitivem Prostatakarzinom (mCSPC). Das Gesamtüberleben mit Abirateronacetat plus Prednison wurde rapportiert.
Der Referent, Prof. Karim Fizazi, Paris, fasste die Daten wie folgt zusammen: Die Zugabe von AAP zu ADT plus Docetaxel verbesserte das mediane PFS bei Männern mit mCSPC signifikant um 2.5 Jahre. Auch das OS wurde verbessert, wobei das Sterberisiko um 25% gesenkt wurde, selbst wenn 81% der Männer in der Kontrollgruppe anschliessend mindestens einen Androgen-Signal-Inhibitor der nächsten Generation erhielten. Der Vorteil entspricht einem medianen Lebenszeitgewinn von mehr als 1.5 Jahren für Männer mit hochvolumiger metastasierter Erkrankung. Prof. Fizazi ist überzeugt, dass diese Daten die Praxis verändern werden und dass ADT plus Docetaxel plus AAP (mindestens) bei Männern mit de novo hochvolumigem mCSPC zur Anwendung kommen sollte.
STAR
Eine randomisierte mehrstufige Phase II/III Studie zum Vergleich einer Standard Erstlinientherapie (Sunitinib oder Pazopanib) mit vorübergehender Einstellung der Behandlung und der Möglichkeit, sie fortzusetzen, bei lokal fortgeschrittenem und/oder metastasiertem Nierenkrebs. Die von Prof. Janet Brown, Leeds, präsentierten Daten, die zeigten, dass eine medikamentenfreie Intervallstrategie im Hinblick auf Gesamtüberleben und qualitätsbereinigte Lebensjahre akzeptabel und potenziell kosteneffektiv ist, auch wenn die Unterschiede zwischen Überleben und Lebensqualität nicht signifikant verschieden waren. Die Referentin schloss mit dem Statement, dass obschon die Immuntherapie jetzt für viele Patienten die Erstlinientherapie darstellt, bleiben die TKI die geeignetste für einige Patienten in der Erstlinie und für viele andere in der Zweitlinie.
PRISM
Nivolumab in Kombination mit Ipilimumab in der Erstlinienbehandlung von Patienten mit fortgeschrittenem Nierenzellkarzinom – eine randomisierte Phase-II-Studie – wurde von Dr. Neven Vasudev, Leeds, präsentiert. Die Schlussfolgerungen von Dr. Vasudev waren:
Die Verabreichung von Ipilimumab in Kombination mit Nivolumab im 12-Wochenrhythmus statt im 3-Wochenrhythmus war mit einer klinisch signifikanten Verringerung der Raten behandlungsbedingter unerwünschter Ereignisse vom Grad 3 / 4 verbunden (33% gegenüber 53%). Die Ergebnisse für das mediane PFS, die ORR, die Dauer des Ansprechens und das 12-Monate-OS waren zwischen den Behandlungsarmen vergleichbar. Diese positive Phase-2-Studie unterstützt die weitere Erforschung verschiedener Nivolumab/Ipilimumab-Schemata, so der Referent.
In der Diskussion erinnerte PD Dr. Aurelius Omlin betreffend Stampede Studie, dass 2 Jahre Abiraterone/Prednison + ADT + / - RT (85%) einen absoluten Nutzen in 6 Jahre bringen.
-> MFS 82% vs. 69% (absolut 13%, NNT = 8)
-> =S 86% vs. 77% (absolut 9%, NNT = 11)
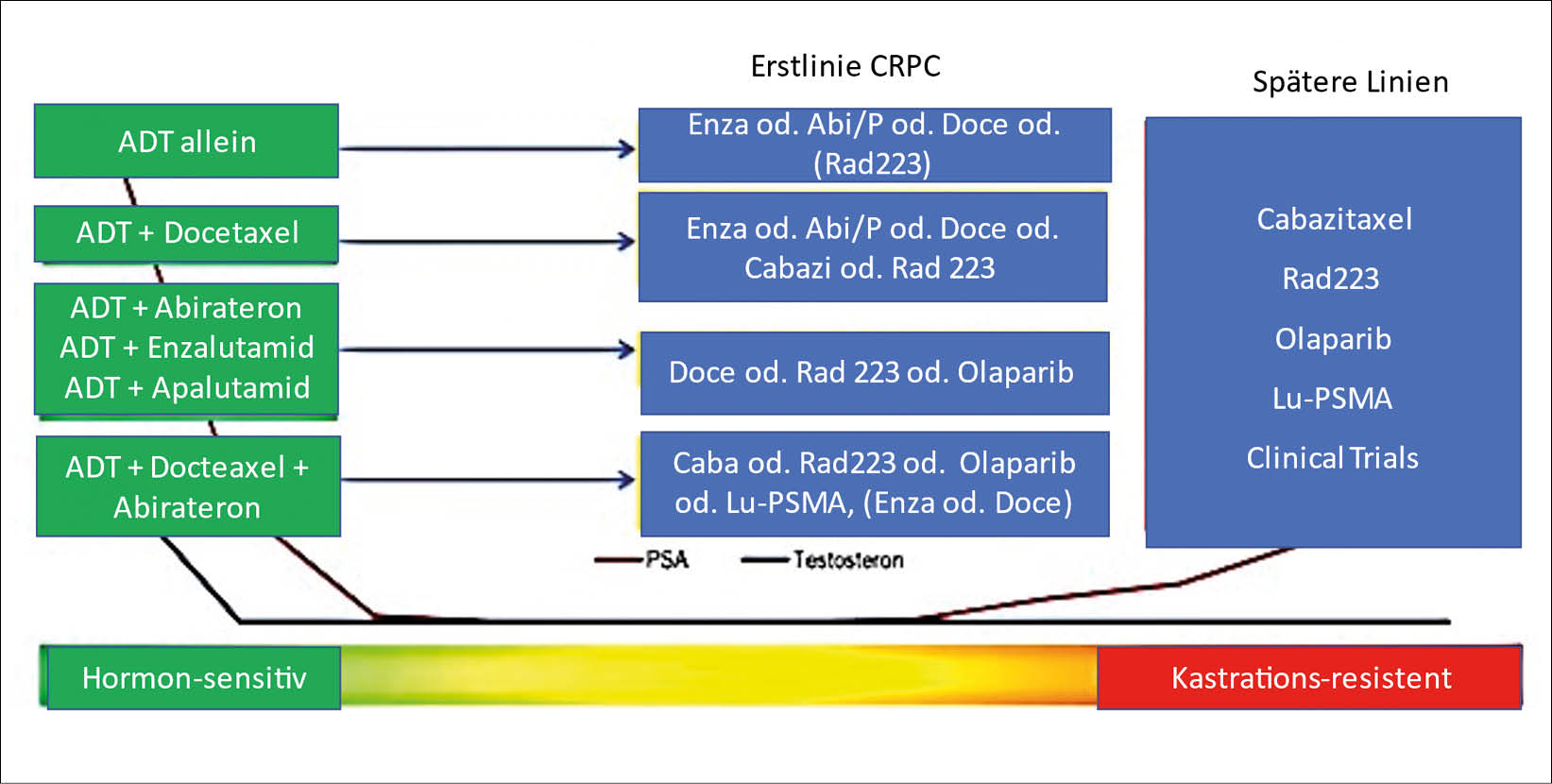
Er präsentierte die Behandlungsoptionen beim metastasierenden hormonsensitiven Prostatakarzinom und die Sequenzoptionen.
Nierenzellkarzinom
Die adjuvante Therapie beim lokalisierten Hochrisiko Nierenzellkarzinom setzt sich wie folgt zusammen, so Frau Prof. Lorch:
Nephrektomie als derzeitiger Standard. Rückfallquote bis zu 50%. Risikofaktoren sind Tumorgrösse, Lymphknoten-Beteiligung, Stadium.
Die adjuvante Zytokintherapie ist ohne Nutzen. Adjuvante Tyrosinkinaseinhibition sind ohne Nutzen für das DFS.
Keynote-564
Die am ESMO von Tony Choueri präsentierte Studie wurde von Frau Prof. Anja Lorch, Zürich, vorgestellt. Keynote 564 ist die erste positive Phase-3-Studie zur adjuvanten Immuntherapie bei Nierenzellkarzinom. Die Studie ergab keine klinisch bedeutsamen Unterschiede in der gesundheitsbezogenen Lebensqualität oder im Symptom-Score bei der adjuvanten Behandlung mit Pembrolizumab oder Placebo. Die Werte blieben in beiden Behandlungsgruppen über den berichteten Studienzeitraum stabil.
Krankheitsbezogene Symptome sind im Krankheitsstadium selten schwerwiegend.
Die PRO-Ergebnisse von Keynote 564 unterstützen die Wirksamkeits- und Sicherheitsergebnisse der ersten vordefinierten Analyse von Keynote-564.
Pembrolizumab ist ein potenzieller neuer Therapiestandard für Patienten mit Nierenzellkarzinom in der adjuvanten Situation. Frau Prof- Lorch zeigte ferner eine Zusammenfassung der Studien zu Immuntherapie Kombinationen mit OS Benefit.
Zusammenfassung von Immuntherapie-Kombinationen mit OS Benefit beim Nierenzellkarzinom.
Blasenkarzinom
GETUG/AFU V05 VESPER Phase III Studie
Hohe Dosis von Methotrexat, Vinblastin, Doxirubicin and Cisplatin (dd-MVAC) oder Gemcitabine und Cisplatin (GC) als perioperative Chemotherapie für Patienten mit Muskel-invasivem Blasenkarzinom.
Der Standard of Care für muskelinvasives Blasenkarzinom in 2021 ist Zystektomie und perioperative Chemotherapie, Level I Evidenz für neoadjuvante Chemotherapie.
Der Überlebensbenefit ist beschränkt auf Cisplatin-basierte Chemotherapie. Zwei Regimes werden in der Praxis häufig angewandt: dd-MVAC oder GC. Es existieren keine randomisierten Phase III Studien und es ist kein optimales CT-Regime definiert, so die Feststellungen von Prof. Christian Pfister, Rouen, der die Studie präsentierte.
Die VESPER Studie ist ein Meilenstein in der Geschichte der Chemotherapie des muskelinvasiven Blasenkarzinoms. Das dd-MVAC Regime sollte jetzt der Goldstandard für die neoadjuvante Chemotherapie werden, dank seiner grösseren lokalen Kontrolle und einer signifikanten Verbesserung des 3-Jahres PFS.
Mit den finalen OS-Daten wird erwartet, dass die Resultate untermauert werden und zukünftige Studien mit optimaler Chemotherapie kombiniert mit Immuntherapie geplant werden können.
Session Lungenkarzinom
CHECKMATE 743
Die duale Immuntherapie mit Nivolumab und Ipilimumab, die sich in ihren Wirkmechanismen deutlich ergänzen, hat das Langzeitüberleben bei verschiedenen Tumorarten verbessert, so Prof. Solange Peters, Lausanne, in ihrer Einführung. In der randomisierten Phase-3-Studie Checkmate 743 verlängerte die Erstlinientherapie mit Nivolumab + Ipilimumab das Langzeitüberleben im Vergleich zur Chemotherapie bei Patienten mit inoperablem pleuralem Mesotheliom (MPM) signifikant. Dieses Therapieschema ist jetzt in der EU, den USA und anderen Ländern als Erstlinien -Behandlung für Erwachsene mit inoperablem MPM zugelassen. Es wurden bislang keine Langzeitergebnisse aus klinischen Studien mit Immuntherapie bei MPM berichtet.
Die Referentin präsentierte die ersten 3-Jahres-Überlebensdaten mit Immuntherapie bei Erstlinientherapie von MPM. NIVO + IPI erbrachte weiterhin dauerhafte und langfristige Vorteile gegenüber der Chemotherapie, ohne neue Sicherheitssignale, obwohl die Patienten ein Jahr lang nicht behandelt wurden: 3-Jahres-OS-Raten: 23% vs. 15%; 28 % der Responder sprechen nach 3 Jahren noch an. In explorativen Biomarker-Analysen schien ein hoher Wert der 4-Gene-Entzündungssignatur mit einem verbesserten Überlebensvorteil durch NIVO+IPI zu korrelieren.
Das OS zeigte bei allen LIPI-Scores eine dreifache Begünstigung von NIVO+IPI im Vergleich zur Chemotherapie, TMB korrelierte nicht mit dem Überlebensvorteil.
In einer Post-hoc-Analyse hatte der Abbruch von NIVO+IPI aufgrund von TEAEs keinen negativen Einfluss auf die langfristigen Vorteile, die bei allen randomisierten Patienten beobachtet wurden. 34 % der Responder, bei denen eine TEAE zum Abbruch der Behandlung führte, behielten ihr Ansprechen auch > 3 Jahre nach Absetzen der Behandlung bei.
Mit einer zusätzlichen Nachbeobachtungszeit von 12 Monaten bestätigen diese Daten aus Checkmate 743 NIVO+IPI als Standard für die Behandlung von inoperablem MPM unabhängig von der Histologie.
WJOG9717L Studie
Die primären Ergebnisse einer randomisierten Phase-II Studie mit Osimertinib plus Bevacizumab im Vergleich zu Osimertinib Monotherapie bei unbehandelten Patienten mit nicht-Plattenepithel NSCLC, die EGFR-Mutationen aufweisen, wurden von
Dr. Hirotsugu Kenmotsu, Shizuoka Cancer Center, Japan, vorgestellt.
Diese Studie konnte keine Wirksamkeit von Osimertinib plus Bevacizumab gegenüber Osimertinib Monotherapie in Bezug auf die Verbesserung des PFS bei diesen Patienten zeigen. Für Patienten, die jemals geraucht haben oder eine Deletion im Exon 19 aufweisen, könnte die Kombination von Bevacizumab mit Osimertinib als Erstlinientherapie vorteilhaft sein. Diese Kombination könnte das mit Osimertinib verbundene Risiko einer Pneumonitis verringern.
CHRISALYS Studie: Amivantinib und Lazertinib
Amivantinib ist eine EGFR-MCT bispezifischer Antikörper mit Aktivität gegen Immunzellen. Es ist in den USA zugelassen für die Behandlung von EGFR Exon 20 Insertion bei NSCLC welches während oder nach einer Platin-basierten Chemotherapie fortschreitet, so Dr. Natasha Leighl, Toronto. Lazertinib ist ein hochselektiver, hirndurchlässiger, 3.Generation EGFR TKI mit breitem therapeutischem Index, der eine Aufdosierung bis zu 240mg ohne zusätzliche Toxizität erlaubt. Präklinische Studien deuten auf eine potenziell synergistische Antitumorwirkung hin, wenn sowohl die extrazelluläre als auch die katalytische Domäne von EGFR gleichzeitig angegriffen werden. Diese Analyse untersuchte den Beitrag der Zugabe von Lazertinib zu Amivantinib nach Versagen von Osimertinib.
Die Kombination von Amivantinib + Lazertinib nach Osimertinib scheint eine höhere Aktivität und Dauer des Ansprechens zu haben im Vergleich zu Amivantinib Monotherapie, mit einer potenziell verbesserten ZNS Protektion: AMI+LAZ ORR 36% mDOR = 9.6 Monate (5.3 bis NR). AMI Monotherapie ORR = 19%, mDOR 5.9 Monate (4.2-12.6). Die dokumentierte ZNS Progression war mit beiden AMI Monotherapie und AMI +LAZ niedrig (17% und 7%).
Das Sicherheitsprofil für die beiden Monotherapien und die Kombinationstherapie war mit früher berichteteten Erfahrungen konsistent ohne neue identifizierte Sicherheitssignale. Die beiden Medikamente werden in zahlreichen weiteren Studien bei EGFR NSCLC Populationen evaluiert.
IMpower 010:
IMpower 010 zeigte einen Vorteil für das krankheitsfreie Überleben nach Atezolizumab im Vergleich zur besten adjuvanten Behandlung nach adjuvanter Chemotherapie bei Patienten mit reseziertem NSCLC im Stadium IB-IIIA mit einem ausgeprägten Benefit in der Untergruppe deren Tumoren PD-L1 auf 1% oder mehr der Tumorzellen exprimierten, so Dr. Enriqueta Felip, Barcelona. Die Therapie zeigte keine neuen Sicherheitssignale. Atezolizumab nach adjuvanter Chemotherapie ist eine vielversprechende Behandlungsoption für Patienten mit reseziertem NSCLC im Frühstadium.
Durvalumab-Konsolidierung bei Patienten mit nicht resezierbarem NSCLC im Stadium III mit treibenden Genomveränderungen
Durvalumab ist der Standard of Care als Konsolidierungstherapie nach Radiochemotherapie bei Stadium III nicht resezierbarem NSCLC. Seine Aktivität bei NSCLC Patienten mit Genomänderungen ist nur wenig charakterisiert. In der von Dr. Mariona Riudavets Melia, Villejuif, präsentierten retrospektiven Studie wurden Unterschiede in den Outcomes mit Durvalumab unter den verschiedenen molekularen Subgruppen bei Stadium III nicht resezierbarem NSCLC gefunden. Ähnlich wie bei fortgeschrittener Krankheit, hatten Patienten mit NSCLC mit KRAS Mutationen bessere ICI Outcomes, im Gegensatz zu Patienten mit anderen Treibermutationen wie EGFRm, BRAFm oder ALKr. Die Referentin stellte fest, dass dies eine kleine retrospektive Studie ist und die Daten an einer grösseren Kohorte bestätigt werden müssen.
Session VARIA
GORTEC-REACH trial
Avelumab-Cetuximab-Radiotherapie versus Standards of care bei Patienten mit lokal fortgechrittenem Kopf-Hals-Epithelkarzinom. Die von Prof. Dr. Jean Bourhis, CHUV Lausanne, vorgestellten Resultate zeigten, dass die Kombination aus dem PD-L1-Antikörper Avelumab, Cetuximab und Strahlentherapie die Ergebnisse bei denjenigen, die für Cisplatin geeignet waren, im Vergleich zur Standardtherapie, einer intensitätsmodulierten Radiotherapie plus Cisplatin nicht verbesserten. Eine Zwischenanalyse ergab 1-Jahres Raten für das PFS von 64% für die Avelumab-basierte Therapie und 73% für die Standardbehandlung, womit die Futility-Grenze überschritten und die Standardbehandlung gegenüber der ICI-basierten Kombination bevorzugt wurde. Ein günstiger Trend für die Zugabe von Avelumab zu Cetuximab bei für Cisplatin nicht fitten Patienten wurde für das PFS, lokals regionaler Kontrolle und Fernmetastasen gesehen. Bei diesen fragilen und alten Patienten mit virlen Komorbiditäten ergab sich ein nicht signifikanter Anstieg der Todesfälle ohne Progression in der Tripletkombination ohne direkte Toxizität von Avelumab.
Genexpressionsprofil unterscheidet Kurzeit- und Langzeitüberlebende einer Immuntherapie bei Patienten mit rezidivierendem/metastasierndem Kopf-Hals-Krebs
Trotz der Einführung von Immun-Checkpoint-Inhibitoren zur Behandlung rezidivierter oder metastasierter Plattenepithelkarzinome des Kopfes und Halses überlebt nur eine kleine Untergruppse von Patienten langfristig. Um Prädiktoren für das Ergebnis zu identifizieren, wurden Genexpressionsprofile bei Patienten an den entgegengesetzten Enden des Spektrums des Gesamtüberlebens nach ICI-Therapie untersucht. Die vorläufigen Daten weisen auf grundlegende Unterschiede in den Genexpressionsprofilen zwischen Langzeitüberlebenden und Kurzzeitüberlebenden nach der Behandlung mit Immuncheckpoint-Inhibitoren bei platinrefraktärem rezidivierten oder metastasierten Plattenepithelkarzinomen des Kopfes und Halses hin. Diese Beobachtungen bedürfen weiterer Untersuchungen und könnten translationale Bedeutung für die Verbesserung der Behandlungsauswahl haben, so der Referent Dr. Loris De Cecco, Milano.
Checkmate 651
Die Endergebnisse der Phase-3-Studie CheckMate 651 zeigten keine statistisch signifikante Verbesserung des Gesamtüberlebens (OS) mit Nivolumab plus Ipilimumab im Vergleich zu Cetuximab, Cisplatin oder Carboplatin und Fluorouracil (EXTREME-Schema) in der Erstlinienbehandlung von Patienten mit rezidivierenden oder metastasierten Plattenepithelkarzinomen des Kopfes und Halses (SCCHN), stellte Prof. Athanassios Argiris, Athen, fest. Doch obwohl die CheckMate 651-Studie ihre primären Endpunkte nicht erreichte, zeigte die Kombination von Nivolumab plus Ipilimumab einen positiven Trend in Bezug auf das Gesamtüberleben bei einer Untergruppe von Patienten, deren Tumoren PD-L1 mit einem kombinierten positiven Score (CPS ≥ 20 oder CPS ≥1) exprimierten.
KEYNOTE -122
Die Behandlungsoptionen beim fortgeschrittenen Nasopharynxkarzinom sind limitiert. Den Ergebnissen dieser multizentrischen, offenen, randomisierten Phase-III Studie zufolge, in der die Wirksamkeit und Sicherheit von Pembrolizumab im Vergleich zur Chemotherapie. Epstein-Barr-Virus-Infektion ist ein primärer Risikofaktor für Nasopharynxkarzinom und Exposition für Epstein-Barr-Virus geht mit einer erhöhten PD-L1 Expression einher. Der PD-L1 Inhibitor Pembrolizumab zeigte Antitumoraktivität und beherrschbare Sicherheit bei Patienten mit vorbehandeltem, rekurrentem oder metastasierendem
Nasopharynxkarzinom in der Phase Ib KEYBOTE-028 Studie. Keynote-122 ist eine multizentrische Open-label, randomisierte Phase 3 Studie, die die Wirksamkeit und Sicherheit von Pembrolizumab Monotherapie vs. Chemotherapie bei Patienten, die mit Platin vorbehandelt waren, untersuchte. In dieser Studie verlängerte Pembrolizumab das Gesamtüberleben gegenüber der Chemotherapie in dieser Patientengruppe nicht, wie Prof. Anthony Chan, Hongkong, der Studienpräsentator feststellte. Pembrolizumab verbesserte auch das PFS, ORR oder DOR gegenüber der Chemotherapie nicht. Es zeigte aber ein beherrschbares Sicherheitsprofil und eine geringere Inzidenz behandlungsbedingter unerwünschter Nebenwirkungen im Vergleich zur Chemotherapie
Welches sind die aktuellen Herausforderungen beim Melanom?
Frau Dr. Berna Özdemir, Bern, nannte die folgenden Probleme: Mangel an guten prognostischen Biomarkern, Mangel an prädiktiven Biomarkern, Daten über die optimale Dauer der Behandlung/Abbruch bei Ansprechen fehlen. Hohe Toxizitätsrate der Nivolumab-Ipilimumab-Kombination und maximal 50%ige Ansprechrate der NIVO-IPI-Kombination. Andere Kombinationen als IPI-NIVO fehlen. Fehlen einer adjuvanten Behandlung für Hochrisiko-Melanome im Stadium II. Keine wirksamen Behandlungsmöglichkeiten für mukosales/uveales Melanom. Daten zur optimalen Behandlungssequenz bei BRAF-mutiertem Melanom fehlen.
Phase II Studie zu Ipilimumab, Nivolumab und Tocilizumab bei nicht resezierbarem metastatischem Melanom
IL-6 geht mit einem schlechten Outcome der Immuntherapie beim Melanom und bei Lungenkarzinom einher und ist ein negativer prognostischer Faktor. Es hat sich gezeigt, dass die IL-6-Blockade mit Tocilizumab die steroidrefraktäre Toxizität bei Patienten, die mit Checkpoint-Inhibitoren behandelt werden, umkehrt. Daher wurde eine Phase II-Studie mit Ipilimumab und Nivolumab in «flipped doses» bei gleichzeitiger Verabreichung des IL-6 blockierenden Antikörpers Tocilizumab alle 6 Wochen in einem zweistufigen Simon-Design konzipiert. 18 Patienten waren in Phase 1, und 49 in Phase II, wie der Studienpräsentator Prof. Jeffrey Weber, New York, feststellte.
Insgesamt nahmen 41 Patienten an der Studie teil. Die Rate an Grad 3-4-5 behandlungsbedingten unerwünschten Nebenwirkungen bei den behandelten Patienten betrug 17%, was niedriger ist als die erwartete Rate von 34% in Checkmate 511. Das Ansprechen nach RECIST lag bei 58% und damit höher als bei Checkmate 511 (47%), wobei nur 1/17 Responders und 1/15 stabile Patienten nach einer Nachbeobachtungszeit von 6 Monaten eine Progression aufwiesen. 23 Patienten waren bereits verstorben, alle im Zusammenhang mit einer Progression. 6 von 41 Patienten haben die Therapie aufgrund von Grad 2-3-4 Unerwünschten Wirkungen abgebrochen (14%). Die Biomarkanalysen deuten darauf hin, dass ein hoher IL-8 Wert in Woche 7 mit unerwünschten Wirkungen der Grade 3 und 4 verbunden ist. Diese Daten unterstützen die Durchführung einer randomisierten Phase II Trilogie mit IPI/NOVO vs. TOCI mit der Möglichkeit IL-8 Antikörper in Woche 4 oder 7 hinzuzufügen, so der Referent.
MASTERKEY 265
Masterkey 265 ist eine Phase 3, randomisierte, Placebo-kontrollierte Studie mit Talimogen laherparepvec plus Pembrolizumab bei nicht resezierbarem Stage IIIB-IVM1c Melanom. Die Kombination von Talimogen laherparepvec (T-VEC)/-Pembrolizumab verbesserte weder das PFS noch das OS signifikant gegenüber Placebo-Pembrolizumab bei fortgeschrittenem, nicht resezierbarem Melanom. Ein statistisch signifikanter numerischer Unterschied im medianen PFS von 5.8 Monaten wurde aber zwischen den Behandlungsarmen festgestellt, so Prof. Helen Gogas, Athen, die die Studie präsentierte. Die Ergebnisse zur Sicherheit von T VEC-Pembrolizumab entsprachen den bekannten Sicherheitsprofilen der einzelnen Wirkstoffe. Es wurden keine neuen Sicherheitsbedenken festgestellt.
KEYNOTE-716
Pembrolizumab versus Placebo nach kompletter Resektion von Hochrisiko Stadium II Melanom: Wirksamkeit und Sicherheit. Die Resultate der KEYNOTE-716 Studie wurden von Dr. Jason Luke, Pittsburgh PA, vorgetragen. Bei Patienten mit Melanom im Stadium IIB und IIC besteht ein hohes Risiko eines Krankheitsrückfalls und die Überlebensaussichten sind ähnlich wie beim Melanom im Stadium IIIA und iib. Pembrolizumab verlängerte RFS und DMFS im Vergleich zu Placebo als adjuvante Behandlung für Melanom im Stadium III mit nachaltigem RFS Vorteil: HR für RFS 0.57, HR für DMFS 0.60.
3 Jahres-Follo-Up HR für RFS 0.56, RFS-Rate von 63.7% vs. 44.1%. Pemrolizumab ist für die adjuvante Behandlung von Patienten mit Melanom mit Lymphknotenbefalls nach vollständiger Resektion zugelassen. KEYNOTE-716 ist die erste randomisierte, doppelblinde Phase 3-Studie eine anti-PD-1-Therapie (Pembrolizumab) gegenüber Placebo bei Patienten mit reseziertem Melanom im Stadium IIB und IIC.
Die adjuvante Behandlung mit Pembrolizumab führte bei Patienten mit reseziertem Hochrisiko-Melanom im Stadium II im Vergleich zu Placebo zu einer signifikanten Verringerung des Risikos eines Krankheitsrezidivs oder des Todes: HR 0.65; p=0.00658, medianes RFS in beiden Armen nicht erreicht. Weniger Fernrezidive bei Patienten in der Pembrolizumab-Gruppe im Vegleich zu Placebo (23 vs. 38). Das Sicherheitsprofil von Pembrolizumab stimmte mit dem zuvor definierten überein. Ungefähr 20% der Patienten im Pembrolizumab-Arm erhielten eine Langzeit-Hormontherapie zur Behandlung endokriner Toxizitäten. Die Lebensqualität blieb bei der adjuvanten Behandlung mit Pembrolizumab im Vergleich zu Placebo erhalten. Die adjuvante Behandlung mit Pembrolizumab ist eine wirksame Behandlungsoption mit nachweisbarem Nutzen für Patienten mit Hochrisiko-Melanom im Stadium II.
WRAP Up Session
Highlights Urogenitalkarzinome
Prof. Jörg Beyer stellte zunächst fest, dass die Urogenital-Session wirklich wichtig war und vielleicht sogar wichtiger als ASCO in diesem Jahr. Das erste Highlight war die von Prof. Attard präsentierte Studie, die zeigte, dass das OS verbessert wird durch die Zugabe von Abiraterone während 2 Jahren zum Standard of Care plus Radiotherapie plus ADT bei neu diagnostiziertem, nicht metastasiertem Prostatakarzinom. Die Standardbehandlung war Radiotherapie nicht Chirurgie. Dies wird unsere Praxis wirklich ändern. Abiraterone ist allerdings noch nicht für diese Indikation zugelassen, was unbedingt vorangetrieben werden sollte. Das zweite Highlight war die von Prof. Fizazi vorgestellte PEACE-Studie, ebenfalls beim Prostatakarzinom, aber im hormonsensitiven metastatischen Setting. Patienten mit hohem Risiko, und nur diese, profitierten von einer Triple Therapie aus ADT, Abiraterone und Docetaxel, die das Gesamtüberleben bei neu diagnostiziertem hochvolumigem, metastatischem Prostatakarzinom verbesserte. Auch dies eine Praxis-verändernde Studie. Die Frage nach Möglichkeit, dass auch andere Medikamente ähnliche Wirkung zeigen wie Abiraterone beantwortet Dr. Omlin positiv. Enzalutamid und ander Medikamente werden ähnliche günstige Resultate zeigen. Prof. Beyer fasste zusammen «die Behandlung des Androgenrezeptors bringt Haare zum Leben». Das dritte Highlight war die GETUG/AFU V05 VESPER Phase III Studie beim Muskel-invasiven Blasenkarzinom, die zeigte, dass das dd-MVAC Regime zwar toxischer ist, aber ein besseres Ansprechen, besseres Gesamtüberleben und besseres 3-Jahres PFS bietet. Bislang hatte man das besser verträgliche Gemcitabine/Cisplatin-Regimeals eine Art Standard verwendet. Auch diese Studie wird die Praxis verändern, dies zumindest bei fitten Patienten. Eine weitere Studie, die Prof. Beyer gefiel, ist die STAR-Studie, die die klinische Praxis einer intermittierenden Therapie bei ansprechenden Patienten mit Nierenzellkarzinom, die mit TKI Monotherapie behandelt wurde, untersuchte. Gemäss dieser Studie kann man eine intermittierende Therapie mit TKI durchführen und dadurch die Verträglichkeit steigern, sowie Kosten und Nebenwirkungen vermindern. Dies ist zumindest eine Studie, die zum Nachdenken anregt. Prof. Beyer regte zum Schluss an, dass bei Hodenkrebs eines der Expertenzentren aufgesucht werden sollte, damit diese entsprechende Studien durchführen können.
Gastrointestinaltumoren
Hier gab es enttäuschenderweise keine Praxis-verändernden Studien, wie Dr. Helbling feststellte. Bei resezierbarem Pankreaskarzinom bewegt sich das Gebiet in Richtung neoadjuvanter Therapie, ohne dass eine grosse randomisierte Studie durchgeführt worden wäre. Dr. Helbling erwähnte zunächst die NEONAX Studie, eine randomisierte Phase II Studie mit perioperativem oder nur adjuvantem nab-Paclitaxel plus Gemcitabine bei resezierbarem Pankreskarzinom. Die KRYSTAL-1 Studie, die zeigte, dass Adagrasib in Kombination mit Cetuximab eine vielversprechende systemische Therapieoption bei KRASG12C mutierten resezierbaren Pankreaskarzinompatienten ist. Er erwähnte ferner die Checkmate 649 mit Chemotherapie plus Nivolumab als Therapieoption beim metastasierten Magen, bei gastroösophagealen Übergangskarzinomen und CPS ≥5 bei hoher Mikrosatelliteninstabilität. mDFS betrug 11.4 Monate im perioperativen und 5.9 Monate im adjuvanten Arm in der ITT Analyse. Eine grössere Gruppe von Patienten kann profitieren, wenn die Chemotherapie vor der Chirurgie verabreicht wird, aber nicht alle Patientenpopulationen.
Highlights Brust-/ gynäkologische Karzinome
Eine Praxis-ändernde Studie ist die Phase III Keynote-826 Studie beim metastatischen Zervixkarzinom. Pembrolizumab als Zusatz zum Standard of Care (Platinduplet mit Bevacizumab) in der Erstlinientherapie beim metastasiertem Zervixkarzinom (CPS>10) verlängert PFS und OS, stellte Prof. Ruhstaller fest. Dies wird der neue Standard sein. Etwas offen ist die Frage, ob Bevacizumab notwendig ist, da die Hälfte der Patienten es erhielt die andere nicht. Die Studie war nicht darauf angelegt, diese Frage zu beantworten. Aber Pembrolizumab wird die Erstlinienimmuntherapie beim Cervixkarzinom sein. Die Brustsession war eine ausserordentliche, denn sie enthielt mehr Highlights als die letzten zwei oder drei Kongresse zusammengezählt. Es gab mehrere Praxis-ändernde Studien. Zunächst zum frühen Triple negativen Brustkrebs: Die Zugabe von Carboplatin zu Paclitaxel, gefolgt von Doxorubin und Cyclophosphamid, verbesserte in der BrighTNess, einer randomisierten Phase III Studie das pCR signifikant und führte zu einem verbesserten EFS nach einem medianen Follow-up von 4,5 Jahren. Dies ist eine Praxis-ändernde Studie so Prof. Ruhstaller. Aber auch die KEYNOTE-522 ist Praxis-ändernd. Diese Phase III Studie mit Pembrolizumab plus Chemotherapie vs. Placebo plus Chemotherapie als neoadjuvante Behandlung, gefolgt von Pembrolizumab vs. Placebo als adjuvante Behandlung für frühen triple-negativen Brustkrebs zeigte, dass die Zugabe von Pembrolizumab im neoadjuvanten und adjuvanten Setting das EPS bei triple-negativem Brustkrebs signifikant und klinisch bedeutsam erhöht. Das Highlight der Highlights gemäss Prof. Ruhstaller ist aber die randomisierte Phase III Studie DESTINY. Sie zeigte, dass Trastuzuzmab-Deruxtecan eine gewaltige Verbesserung im Vergleich zu T-DM1 in der Zweitlinien-Behandlung von metastasierendem Brustkrebs ergibt (HR0.28). Trastuzumab ersetzt T-DM1 in dieser Indikation.
Highlights der Lungen-Session
Die Highlights der Session über Lungenkarzinome waren die Checkmate 743 Studie und die IMpower010 Studie stellte Frau PD Dr. Curioni fest. Checkmate 743 bestätgte bei einer zusätzlichen Nachbeobachtungszeit von 12 Monaten die Wirksamkeit der Kombination Nivolumab + Ipilimumab als Standard für die Behandlung von inoperablem metastasierendem pleuralem Mesotheliom unabhängig von der Histologie. IMpower 010 zeigte einen Vorteil für das krankheitsfreie Überleben nach Atezolizumab im Vergleich zur besten adjuvanten Behandlung nach adjuvanter Chemotherapie bei Patienten mit reseziertem NSCLC im Stadium IB-IIIA mit einem ausgeprägten Benefit in der Untergruppe deren Tumoren PD-L1 auf 1% oder mehr der Tumorzellen exprimierten
Zum Schluss dankte Dr. Helbling den 14 Chairpersonen, der Technik, den Sponsoren und allen weiteren Personen, die dieses hervorragende Meeting mit vielen Highlights ermöglicht haben.
Prof. Dr. Dr. h.c. Walter F. Riesen
COVID-19 und Krebs – Resultate vom ESMO
Outcome und prognostische Faktoren der SARS CoV-2 infektion bei Krebspatienten:
Eine Querschnittsstudie (SAKK 80/20 CaSA)
Es gibt eine anhaltende Kontroverse über das Ergebnis von COVID-19 bei Krebspatienten. Dies ist eines der wenigen Register über die Auswirkungen von COVID-19 bei Krebspatienten in einem Land, das stark von der Pandemie betroffen ist.
In dieser Kohortenstudie werden Daten über symptomatische, mit Sars-CoV-2 infizierte Patienten mit einer Krebsdiagnose aus 23 Schweizer Standorten, beginnend am 1. März 2020 erhoben. Das Hauptziel der Studie war es, die Folgen einer COVID-19-Infektion bei Patienten mit soliden und hämatologischen Malignomen zu beurteilen, während das sekundäre Hauptziel die Bestimmung der prognostischen Faktoren für den Ausgang der COVID-19-Infektion war.
Mit Stichtag 16. Juli 2020 wurden 357 Patienten mit einer Krebsdiagnose und symptomatischer COVID-19-Infektion in diese erste Analyse einbezogen. Die häufigsten Malignome waren Brustkrebs in 63 Fällen (18%), Lungenkrebs in 40 Fällen (11 %), Prostatakrebs in 24 Fällen (7%) und Myelom in 16 Fällen (5%), wobei 104 (38%) Patienten eine nicht kurative Erkrankung hatten. Die Krebsbehandlung innerhalb von 3 Monaten vor der Diagnose von COVID-19 war bei 65 Patienten (18%) eine Chemotherapie, bei 54 Patienten (15%) eine gezielte Therapie, bei 39 (11%) Steroide, bei 22 (6%) Checkpoint-Inhibitoren oder bei 155 Patienten (43%) keine Krebsbehandlung. 230 Patienten (65%) wurden wegen COVID-19 im Krankenhaus behandelt oder befanden sich bereits im Krankenhaus; 167 der hospitalisierten Patienten (73%) benötigten eine Sauerstoffbehandlung, 43 Patienten (19%) Intensivpflege, 31 (14%) invasive Beatmung. 63 Patienten starben an einer COVID-19-Infektion, was einer Sterblichkeitsrate von 18 % entspricht. Signifikante Risikofaktoren für Tod waren Alter 65+ versus < 65 (HR 5,84, p < 0,001) und nicht kurative versus kurative Erkrankung (HR 2,34, p < 0,01). Weder das männliche noch das weibliche Geschlecht (HR 1,59, p = 0,12), Krebsart, geographische Region, Chemotherapie (HR 1,31, p = 0,44), Herz-Kreislauf-Erkrankungen (HR 2,25, p¼0,09) noch pulmonale Komorbiditäten (HR 0,93, p = 0,86) waren signifikante Risikofaktoren für den Tod.
Schlussfolgerungen
Die Autoren fanden eine COVID-19-Mortalitätsrate bei realen Krebspatienten in einem Land mit einem dezentralisierten, qualitativ hochwertigen Gesundheitssystem, die deutlich höher ist als bei allen COVID-19-infizierten Patienten in der Schweiz (18% versus 5%). Die Rate von Krankenhausaufenthalten und Intensivpflege aufgrund von COVID-19 bei Krebspatienten ist erheblich.
Prof. Dr. Dr. h.c. Walter F. Riesen
Quelle: Joerger M et al. Annals of Oncology 2020; 31 : Issue S4 – 2020
COVID-19 und Krebsregister
Lehren aus dem ersten Höhepunkt der SARS-CoV-2-Pandemie
Die SARS-Cov-2-Pandemie im Jahr 2020 hat Onkologie-Teams in aller Welt veranlasst, ihre Praxis zum Schutz der Patienten anzupassen. Erste Erkenntnisse aus China deuten darauf hin, dass Krebspatienten, insbesondere solche, die kürzlich einer Chemotherapie oder einer Operation unterzogen wurden, ein erhöhtes Risiko für ein schlechtes Outcome nach einer SARS-Cov-2-Infektion haben. Viele Register von Krebspatienten, die mit SARS-Cov-2 infiziert waren, entstanden während der ersten Welle. Die Erkenntnisse aus diesen nationalen und internationalen Studien wurden in einer Publikation zusammengefasst.
Die Autoren konzentrierten sich zudem auf die Risikofaktoren für Patienten mit soliden Krebserkrankungen und den Beitrag der systemischen Krebsbehandlung (SACT-Chemotherapie, Immuntherapie, gezielte Therapie und Hormontherapie) zu den Ergebnissen nach einer SARS-Cov-2-Infektion. Patienten mit Krebs die mit SARS-Cov-2 infiziert sind, haben im Vergleich zu Patienten ohne Krebs eine höhere Sterbewahrscheinlichkeit. Häufige Risikofaktoren für Sterblichkeit nach einer COVID-19-Infektion sind Alter, männliches Geschlecht, Rauchen in der Vorgeschichte, eine Reihe von Begleiterkrankungen und ein schlechter Leistungsstatus.
Zu den onkologischen Merkmalen, die ein schlechteres Ergebnis vorhersagen können, gehören Tumorstadium, Krankheitsverlauf und Lungenkrebs. Die meisten Studien konnten keinen Zusammenhang zwischen SACT und ungünstigen Ergebnissen feststellen. Jüngste Daten deuten darauf hin, dass der Zeitpunkt der Behandlung mit SACT mit dem Sterberisiko in Verbindung stehen könnte. Die fortlaufende Rekrutierung für diese Register wird es ermöglichen, eine evidenzbasierte Versorgung anzubieten.
WFR
Quelle: Lee AJX and Purshous K. COVID-19 and cancer registries: learning from the first peak of the SARS-CoV-2 pandemic. Brit J Cancer 2021; 124:1777–1784;
Wie erleben Patientinnen und Patienten mit Krebs die COVID-19 Pandemie?
Die COVID-19 Pandemie bedeutet für Krebsbetroffene Veränderungen bei der Behandlung (Termine wurden per Telefon oder Online abgehalten, Behandlungen wurden verschoben oder angepasst, die Betroffenen weisen eine erhöhte Anfälligkeit gegenüber dem Virus auf, es gab Einschränkungen bei der Anwesenheit von Angehörigen und eine soziale Isolierung. Die COVID-19 Umfragen zeigen, dass die psychische Belastung von Krebsbetroffenen höher ist als vor der Pandemie und dass sie vergleichbar ist zur allgemeinen Bevölkerung während der Pandemie.
Die Autorinnen führten eine schriftliche Befragung mit standardisierten Fragen und Antworten, die quantifizierbare Aussagen erlauben, durch. Die schriftliche Befragung war nicht spezifisch für COVID-19. Des Weiteren wurde ein mündliches Interview mit offenen Fragen, freiem Beantworten, Aussagen zum Erleben und der Möglichkeit, die Fragen konkret auf COVID-19 zu beziehen, durchgeführt.
Die Befragung zeigte, dass die erste Welle der COVID-19 Pandemie viele Anforderungen an das tägliche Leben von Krebsbetroffenen stellte. Sie war gekennzeichnet durch Unsicherheit, Sorgen, Bedarf an Beratung und Unterstützung in Bezug auf das Risiko für COVID-19 und Krebs. Währen der zweiten Welle war die Belastung bei dänischen Patientinnen und Patienten relativ gering und die Resilienz relativ hoch Die Studie hat gezeigt, dass Erfahrung mit der Krebserkrankung auch eine Ressource darstellen kann, d.h. die Befähigung weitere Stressoren gut zu bewältigen. Krebsbetroffene zeigen eine gewisse Resilienz.
WFR
Quelle: Vortrag von Dr. phil Karin Ribi, Universität Lausanne et al.
Metastasiertes hormonsensitives Prostatakarzinom
Enzalutamid reduziert Sterblichkeit um ein Drittel
Im Rahmen der randomisierten, doppelblinden, Placebo-kontrollierten Phase-3 ARCHES-Studie wurde bei 1.150 Patienten mit einem hormonsensitiven, metastasierten Prostatakarzinom der Frage nachgegangen, ob die Gabe des Androgenrezeptor-Inhibitor Enzalutamid (Xtandi®) zusätzlich zu einer ADT die Prognose verbessert. Und in der Tat, die Sterblichkeit wurde um 34% reduziert. Das Risiko für eine radiologisch nachgewiesene Progression (rPFS) oder Tod wurde sogar um 61% gesenkt im Vergleich mit der Placebo-Gruppe bei einem medianen Follow-up von 14,4 Monaten. Das mediane OS wurde noch nicht erreicht. Das mediane rPFS lag unter Placebo bei 19 Monaten und war im Enzalutamid-Arm noch nicht erreicht. Die Therapie mir Enzalutamid wurde gut vertragen, die Nebenwirkungsrate lag im Placebobereich (24,3% vs. 25,6%). Die häufigsten Nebenwirkungen unter Enzalutamid waren Flush, Fatigue, Arthralgien, Hypertonie, Nausea, Diarrhoen, Schwindel. Schwäche und muskuloskelettale Schmerzen.
PS
ESMO 2021 LBA25
Metastasiertes kolorektales Karzinom
Benefit von Nivo + Ipi auch noch nach vier Jahren
Im Rahmen der CheckMate 142-Studie konnte gezeigt werden, dass vorbehandelte Patienten mit einem metastasierten MSI-H/dMMR kolorektalen Karzinom (mCRC) von der kombinierten Immuntherapie mit Nivolumab plus Ipilimumab profitieren. Jetzt wurde ein Updating der Studie nach einem Follow-up von 4 Jahren präsentiert. Die ORR stieg von 55% nach 13,4 Monate auf 65% nach 50,9 Monaten. Die DCR lag nach 4 Jahren bei 81%. Eine partielle Remission fand sich nach 4 Jahren bei 52%. Bei 21% konnte eine Stabilisierung erreicht werden und 12% zeigten eine Progression. Bis zum Ansprechen vergingen im Mittel 2,8 Monate und die mediane DOR war noch nicht erreicht. Zum Zeitpunkt des Cutoff fand sich noch bei 48% eine Wirksamkeit. Das mediane PFS und das mediane OS waren ebenfalls noch nicht erreicht. Die PFS-Raten nach 48 Monaten betrugen 53%, die mediane OS-Rate 70,5%. Der ORR-Benefit der Immuntherapie fand sich in allen Subgruppen unabhängig vom BRAF/KRAS-Mutationsstatus, ECOG PS, Alter und Geschlecht. Grad 3 und 4-Nebenwirkungen traten bei 32% der Patienten auf. Fazit der Studie: Die kombinierte Immuntherapie mit Nivo plus Ipi verspricht bei einem Follow-up von 4 Jahren eine anhaltende Wirkung.
PS
ESMO 2021 #437P
Metastasiertes HER2-positives Mammakarzinom
T-DX1 ist T-DM1 deutlich überlegen
Im Rahmen der DESTINY-Breast03-Studie führte Trastuzumab-Deruxtecan (T-DXd) (ENHERTU®) im Vergleich zu Trastuzumab Emtansin (T-DM1) beim HER2-positiven metastasierten Mammakarzinom zu einer 72%igen Risikoreduktion für Krankheitsprogression oder Tod. Diese Daten unterstreichen die Rolle von Trastuzumab-Deruxtecan (T-DXd) als potenziell neuer Behandlungsstandard bei vorbehandelten Patientinnen mit einem HER2-positiven Mammakarzinom.
Eine von fünf Mammakarzinomen ist HER2-positv. HER2 ist ein Protein, das einen Tyrosinkinase-Rezeptor aktiviert, der wiederum das Zellwachstum fördert. Es findet sich auf der Oberfläche von Krebszellen, die sich speziell durch ein aggressives Wachstum auszeichnen. Ein HER2-postiver Status ist somit ein Prädiktor für eine schlechte Prognose.
Die Einführung von HER2-zielgerichteten Substanzen hat die Behandlungsmöglichkeiten von Patientinnen mit einem HER2-positiven, nicht-resezierbaren oder metastasierten Mammakarzinom wesentlich bereichert. Doch kommt es nach zwei oder mehr gegen HER2 gerichteten Therapien zu einem Fortschreiten der Erkrankung, so sind die therapeutischen Optionen sehr begrenzt. Häufig bleibt dann nur noch eine Chemotherapie. Eine etablierte Therapiestrategie ab der dritten Therapiestrategie gibt es bisher nicht. Ein besonderes Problem ist auch die häufig bei HER2-positiven Patientinnen auftretenden Hirnmetastasen. Es besteht deshalb dringender Bedarf an neuen Wirkstoffen gegen das HER2-positive Mammakarzinom.
Eine solche neue vielversprechende Option ist Trastuzumab Deruxtecan (T-DXd). Dabei handelt es sich um ein Antikörper-Wirkstoff-Konjugat, welches eine zielgerichtete zytotoxische Wirkung ermöglicht, da die chemotherapeutische «Ladung» über einen Linker an einen monoklonalen Antikörper gebunden ist, der an spezifische Rezeptoren auf der Oberfläche der Krebszellen bindet. Der Anti-Tumorwirkstoff Deruxtecan ist ein Derivat des Topoisomerase-I-Inhibitors Exatecan. Da Topoisomerase-I-Inhibitoren bisher nur selten bei Mammakarzinomen zum Einsatz kommen, ist die Chance gross, dass die Tumoren noch keine Resistenz gegen eine solche Substanz entwickelt haben.
DESTINY-Breast03-Studie: head-to-head-Vergleich
Im Rahmen der DESTINY-Breast03-Studie wurde T-DXd mit T-DM1 bei Patientinnen mit einem HER2-positiven, nicht resezierbaren bzw. metastasierten Mammakarzinom hinsichtlich Wirksamkeit und Sicherheit verglichen. Dabei handelt es sich um eine globale, head-to-head vergleichende, randomisierte, pivotale Open-label-Phase III-Studie. Die Patientinnen waren zuvor mit Trastuzumab und einem Taxan behandelt worden. Als primärer Endpunkt wurde das PFS festgelegt, das im Rahmen eines verblindeten, unabhängigen zentralen Reviews (BICR) ausgewertet wurde. Sekundäre Endpunkte waren das OS, die objektive Ansprechrate (ORR), die Dauer des Ansprechens (DoR), die klinische Benefit-Rate und das PFS nach Studienarztbewertung. Eingeschlossen in diese Studie wurden 524 Patientinnen. Bei Studieneinschluss wiesen 23,8% der Patienten in der T-DXd- und 19,8% in der T-DM1-Gruppe Hirnmetastasen auf. Zum Stichtag 21. Mai 2021 befanden sich noch 132 Patientinnen unter T-DX1, aber nur 47 Patientinnen unter T-DM1.
T-DX1 deutlich überlegen
Das mediane PFS nach BICR war unter T-DX1 noch nicht erreicht, unter T-DM1 betrug es 6,8 Monate (HR = 0,28; 95% KI 0,22-0,37; p=7,8×10-22). Das entspricht einer Risikoreduktion für Fortschreiten der Erkrankung oder Tod von 72%. Nach 12 Monaten lag das PFS unter T-DX1 bei 75,8% im Vergleich zu 34,1% unter T-DM1. Das PFS nach Studienarzt-Bewertung betrug 25,1 Monate unter T-DX1und 7,2 Monate unter T-DM1. Das mediane OS war in beiden Gruppen noch nicht erreicht. Nach 12 Monaten lag das OS bei T-DX1 bei 94,1% im Vergleich zu 85,9% bei T-DM1.
Bei der ORR standen 79,7% unter T-DX1 34,2% unter T-DM1 gegenüber. Eine komplette Remission erreichten 16,1% in der T-DX1-Gruppe und 8,7% in der T-DM1-Gruppe. Die Krankheitskontrollrate (DCR) betrug unter T-DX1 96,6% im Vergleich zu 76,8% unter T-DM1. Das Sicherheitsprofil von T-DX1 entsprach den Daten aus vorangegangenen Studien, auch was die Rate an interstitielle Lungenerkrankungen betrifft.
Umfassendes Studienprogramm
Weltweit wurde ein umfassendes Studienprogramm zur Evaluation der Wirksamkeit und Sicherheit von T-DX1 als Monotherapie bei unterschiedlichen HER2-exprimierenden Tumorentitäten einschliesslich Mamma-, Magen-, Bronchial- und Kolorektalkarzinom aufgelegt. Darüberhinaus sind Studien mit Kombinationen mit anderen onkologischen Therapien – inklusive Immuntherapien – geplant bzw. gestartet.
NSCLC
Erste Ergebnisse beim NSCLC (91 Patienten) wurden im Rahmen der DESTINY-Lung01 erhoben. Die ORR betrug 54,9%. 1,1% erreichten eine komplette Remission und 53,8% eine partielle. Die DCR betrug 92,3% und die DoR war 9,3 Monate. Das PFS lag bei 8,2 Monaten.
Magenkarzinom
Bei 125 Patienten mit einem lokal fortgeschrittenen Magenkarzinom bzw. distalen Adenokarzinom des Ösophagus (DESTINY-Gastric01-Studie) wurde T-DX1 eingesetzt. Die Dauer der Therapie betrug 4,6 Monate im Vergleich zu nur 2,8 Monate unter Irinotecan/Paclitaxel. In der DESTINY-Gastric02-Studie lag die ORR bei 38,0%. 3,8% erreichten eine komplette und 34,2% eine partielle Remission.
PS
Quelle:- ESMO 2021, Presidential Symposium LBA01 18.9.2021, Professor Javier Cortes, Barcelona
– Sung H et al., CA Cancer J Clin. 2021;103322/caac.21660
– Virtuelles Press Briefing der Fa. Daiichi Sankyo 20.9.2021: «Transforming the Treatment Landscape for
HER2 Targetable Cancers».
Fortgeschrittenes Urothelkarzinom
Erhaltungstherapie auf dem Vormarsch
Am Therapiestandard Gemcitabin plus Cisplatin oder Carboplatin hat sich seit langer Zeit nichts geändert. Mit den Daten der JAVELIN Bladder 100-Studie ist das Konzept der Erhaltungstherapie in den Fokus gerückt. Zeit für ein Resümee.
Die Chemotherapie mit Gemcitabin plus Cisplatin oder Carboplatin ist schon seit den 1990er Jahren der Standard beim fortgeschrittenen Urothelkarzinom. Seitdem sind viele Studien durchgeführt worden, welche diese Behandlung verbessern sollten. Verschiedene Dreifachkombinationen von Chemotherapeutika zeigten jedoch ebenso wenig einen substanziellen Überlebensvorteil wie die Kombination aus Chemo- und Immuntherapie in der ersten Linie. Statt weiterhin zu versuchen, mehrere Wirkstoffe in der ersten Linie zu kombinieren, wurde daher das Vorgehen geändert und das Konzept einer sequenziellen Therapie untersucht. Nach Stabilisierung der Erkrankung unter der platinhaltigen Chemotherapie wurde anschliessend eine Immuntherapie eingesetzt – als Erhaltungstherapie.
Mit diesem Ansatz konnte tatsächlich ein deutlicher Überlebensvorteil erzielt werden. Gemäss JAVELIN Bladder-100 Studie reduziert eine Erhaltungstherapie mit Avelumab das Sterberisiko um 31% im Vergleich zu Best Supportive Care (HR für OS 0.69; 95% CI: 0.56-0.86; P < 0.001) – und zwar unabhängig vom PD-L1-Status. Dabei profitieren Patienten mit vorgängig Cisplatin/Gemcitabin genauso wie Patienten mit vorgängig
Carboplatin/Gemcitabin (HR für OS 0.69; 95% CI: 0.51-0.94 bzw. HR für OS 0.66; 95% CI: 0.47-0.91). Die Anzahl der Chemotherapie-Zyklen hat zwar relativ gesehen keinen Einfluss auf die Überlebenszeit (HR für OS nach 4 Zyklen 0.69; 95%
CI: 0.481-1.000 bzw. HR für OS nach 6 Zyklen 0.66; 95% CI: 0.472-0.915), allerdings konnte nach 6 Zyklen ein um absolut 4.1 Monate längeres Gesamtüberleben als nach 4 Zyklen beobachtet werden (19.9 Monate versus 24.0 Monate). Insgesamt hat damit das Konzept, nach Ansprechen auf eine Chemotherapie auf die Progression der Erkrankung zu warten und erst dann eine weitere Therapie zu initiieren, in den meisten Fällen ausgedient.
Platinungeeignete Patienten
Doch was ist mit den Patienten, die für eine platinhaltige Chemotherapie ungeeignet sind? Hier ist die Datenlage noch immer schwierig. So konnte in der Keynote-361-Studie kein Benefit von Pembrolizumab in der Intention-to-treat-Population (HR für OS 0.83; 95% CI: 0.65-1.06) gezeigt werden, möglicherweise jedoch ein Trend für ein längeres Überleben bei Patienten mit PD-L1 high Status (HR für OS 0.82; 95% CI: 0.57-1.17). In der IMvigor130-Studie wurde ebenfalls kein Überlebensvorteil einer Atezolizumab-Monotherapie gegenüber platinhaltiger Chemotherapie in der Intention-to-treat-Population beobachtet (HR für OS 1.02; 95% CI: 0.83-1.24), bei Patienten mit PD-L1 high Status hingegen schon (HR für OS 0.53; 95% CI: 0.30-0.94). Ähnliches gilt für die DANUBE-Studie, die im sekundären Endpunkt einen Überlebensvorteil unter Durvalumab + Tremelimumab im Vergleich zu platinhaltiger Chemotherapie bei Patienten mit PD-L1 high Status zeigen konnte (HR für OS 0.74; 95% CI: 0.59-0.93). Allenfalls werden die demnächst erwarteten Ergebnisse der CheckMate901-Studie neue Erkenntnisse liefern, da diese auch platinungeeignete Patienten einschliesst.
Ein weiterer vielversprechender Ansatz ist das Antikörper-Wirkstoff-Konjugat Enfortumab-Vedotin. Dieses zeigte in der EV-301-Studie bei Patienten, die bereits eine platinbasierte Chemotherapie erhalten haben und unter oder nach einer Immuntherapie progredient wurden, einen signifikanten Überlebensvorteil gegenüber alleiniger Chemotherapie (HR für OS 0.70; 95% CI: 0.56-0.89; P = 0.00142). Aktuell wird die Therapie unter anderem auch bei Patienten untersucht, die für Cisplatin ungeeignet sind.
red.
Quelle: ESMO 2021 Industrie-Symposium «Patient-Focused Care in a Changing 1L Advanced Bladder Cancer Treatment Landscape», 21. September 2021
Fortgeschrittenes Prostatakarzinom
Die additive Gabe von Apalutamid verbessert das Outcome auch bei älteren Patienten
Sowohl in der TITAN- als auch in der SPARTAN-Studie verbesserte bei Patienten mit einem metastasierten Kastrations-sensitiven (mCSPC) oder nicht-metastasierten Kastrations-resistenten (nmCRPC) Prostatakarzinom die zusätzliche Gabe von Apalutamid zur ADT das Outcome. Der PSA-Wert wurde stärker beeinflusst und auch die klinischen Parameter. Das radiografische Progressions-freie Intervall (rPFS), das Metastasen-freie Überleben (MFS) und das Gesamtüberleben (OS) wurden verlängert. Jetzt wurde an Hand dieser Studiendaten die Wirksamkeit und Sicherheit von Apalutamid altersspezifisch analysiert, wobei drei Altersgruppen gebildet wurden: < 65 Jahre, 65-79 Jahre und ≥ 80 Jahre.
Die mediane Zeit unter dieser Therapie betrug bei < 65-Jährigen 23,6 Monate, bei 65- bis 79-Jährigen 46,2 und bei über 80-Jährigen 33,4 Monate. Bzgl. der Abnahme des PSA-Wertes um mindestens 50% waren die Vergleichswerte 94,2% vs. 92,5% vs. 91,7%. Die Werte für das OS waren noch nicht erreicht vs. 0,14 vs. 0,29. Beim HR bezüglich rPFS lagen die Vergleichswerte bei 0,55 bei unter 65-Jährigen und waren in den beiden anderen Altersgruppen noch nicht erreicht. Beim OS betrugen die HR-Werte 0,74 bzw. 0,39 bzw. 0,89.
Sowohl die Patienten mit einem mCSPC als auch die mit einem nmCRPC erreichten unabhängig vom Alter eine Verbesserung des klinischen Bildes bei erhaltener Lebensqualität. Doch bei den ältesten Patienten zeigte sich ein Trend dahingehend, dass der Benefit etwas geringer war und die Häufigkeit an unerwünschten Ereignissen leicht anstieg und auch die Zeit unter der Medikation war kürzer.
PS
ESMO 2021; Poster-Abstract #618
PRIMORDIUM-Studie
Was bringt bei PSMA-PET-positiven Patienten die zusätzliche Gabe von Apalutamid?
Mit der PRIMORDIUM-Studie will man der Frage nachgehen, ob bei PSMA-PET-positiven Hoch-Risiko-Patienten mit einem Hormon-sensitiven Prostatakarzinom ohne Hinweise für eine Metastasierung die zusätzlich zu einer Radiotherapie (RT) und einem LHRH-Agonisten verabreichte Gabe des nicht-steroidalen Androgen-Rezeptor-Antagonisten einer neuen Generation, nämlich Apalutamid (ERLEADA®), das Outcome verbessert. Zugleich wird damit der Stellenwert des PSMA-PET bei der Risikostratifizierung evaluiert. Die Rationale für diese Studie ergibt sich daraus, dass 25 bis 35% der Patienten, die sich einer radikalen Prostatektomie unterzogen haben, ein biochemisches Rezidiv entwickeln. Auch ist das PSMA-PET sensitiver und spezifischer bei der Detektion von Tumorläsionen als die herkömmliche Bildgebung.
Aufgenommen in diese Studie werden Patienten (bisher 412 Patienten) mit ≥ 1 Läsion im PSMA-PET und einem hohen Risiko für ein biochemisches Rezidiv (PSA-Verdopplungszeit von ≤ 12 Monate oder pathologischer Gleason Score ≥ 8). Sie erhalten randomisiert nach der Prostatektomie entweder nur RT plus LHRH-Agonisten oder zusätzlich Apalutamid. Die PSMA-PET-negativen Patienten werden nur nachbeobachtet. Bei den Studienpatienten wird alle 3 Monate der PSA-Wert kontrolliert, ausserdem zu Beginn und nach 6 Monaten, nach 12 Monaten und dann jährlich das PSMA-PET. Endpunkt der Studie ist die Zeit bis zur Progression des Tumorleidens i.S. einer Metastasierung oder Tod jedweder Ursache.
PS
ESMO 2021; Abstract #649