- Glukokortikoid-induzierte Osteoporose
Das Risiko für osteoporotische Frakturen steigt unter Therapie mit Glukokortikoiden (GC) kurz nach Beginn (3-6 Monaten) um 30-50% an. Das erhöhte Risiko ist unabhängig der zugrunde liegenden Erkrankung, des Geschlechts und des Alters. Bald nach Therapiestopp zeigt sich die Regeneration des Knochens, d.h. das erhöhte Risiko nimmt wieder ab. Aus diesen Gründen ist bei einer Langzeit-GC-Therapie, eine frühe Risikoabklärung einer glukokortikoid-induzierten Osteoporose (GIOP), ab einer Dosis von 5mg Prednisolonäquivalent zur rechtzeitigen Prävention und/oder Behandlung nötig (1)
The risk of osteoporotic fractures increases by 30-50 % with glucocorticoid (GC) therapy shortly after initiation (3-6 months). The increased risk is independent of underlying disease, gender, and age. Soon after therapy is stopped, bone regeneration is evident, i.e., the increased risk decreases again. For these reasons, with long-term GC therapy, early risk assessment of glucocorticoid-induced osteoporosis (GIOP), starting at a dose of 5 mg prednisolone equivalent, is necessary for timely prevention and/or treatment (1).
Key Words: Osteoporosis, GIOP
Wer hat ein Risiko für eine GIOP?
Bei ca. 0.5 Prozent aller Patienten und bei ca. 1.4 % der über 55-Jährigen, wird in einer allgemeinärztlichen Praxis eine GC-Therapie für über 3 Monate verschrieben (2). In den vergangenen 20 Jahren wurde eine Zunahme um 34 % festgestellt (von 0.59 auf 0.79 %). Eine Zunahme fand sich bei Patienten mit Rheumatoider Arthritis (13.6 %) und Polymyalgia Rheumatika, respektive einer Riesenzellartheriitis (62 %), stabil blieb sie bei Colitis Ulzerosa, eine Abnahme der GC-Verschreibung zeigte sich bei Asthma, Chronisch Obstruktiver Pneumopathie und Morbus Crohn (3).
Wie zeigt sich eine steroid-induzierte Osteoporose
In Bezug auf, nach dem Alter ausgeglichenen, gesunden Kontrollen, fand sich unter einer GC-Therapie in der iliakalen Knochenbiopsie von Patienten histomorphologisch eine Abnahme des Knochenvolumens und der Trabekelkonnektivität (4).
Im Vergleich zur postmenopausalen Osteoporose, fand sich in der iliacalen Knochenbiopsie bereits bei niedriger GC-Dosierung von 2.7 mg Prednisolonäquivalent pro Tag, eine verminderte Knochen-neubildung und erhöhte Resorption. Bei höheren GC-Dosen von 23.7 mg Prednisolonäquivalent pro Tag, ein dramatisch verstärkter Verlust an Knochengewebe, widergespiegelt im Verlust der Trabekelkonnektivität (5).
Einfluss der GC-Dosis auf die Frakturrate der GIOP
Unter einer GC-Langzeittherapie (länger als 3 Monate) besteht ein erhöhtes relatives Frakturrisiko (rFR) für vertebrale Frakturen von 2.60 (Konfidenz Intervall (CI) 2.31-2.92), für nicht vertebrale Frakturen von 1.33 (CI 1.29-1.38), für Hüftfrakturen 1.61 (CI 1.47-1.76) und für Radiusfrakturen von 1.09 (CI 1.01-1.17) (6).
Das rFR für vertebrale und Hüftfrakturen ist dabei abhängig von der verschriebenen GC-Tagesdosis, im Gegensatz dazu, kaum bei Radiusfrakturen. Bei unter 2.5mg Prednisolonäquivalent pro Tag, liegt das rFR für vertebrale Frakturen bei 1.55 (1.20-2.01) und steigt bei 2.5-7.5mg Prädnisolonäquivalent pro Tag auf 2.59 (2.16-3.10) und bei über 7.5mg Prednisolonäquivalent pro Tag auf 5.18 (4.25-6.31). Die entsprechenden Dosis-rFR-Zunahme bei Hüftfrakturen sind, 0.99 (CI 0.82-1.20), 1.77 (CI 1.55-2.02) und 2.27 (CI 1.94-2.66) (6). Mit diesen Zahlen, wird das GC-Dosis bezogene Frakturrisiko nur partiell abgebildet, denn bei Therapien mit sehr hohen täglichen GC-Dosen (>=30 mg Prednisolon-Äquivalent, Kumulative Dosis >=5 Gramm), steigt das Frakturrisiko, sowohl für vertebrale, als auch Hüftfrakturen, überproportional weiter an (7). Es konnte gezeigt werden, dass mit steigender GC-Tagesdosis und kumulativer GC-Dosis, das Frakturrisiko sowohl für vertebrale Frakturen, als auch für Hüftfrakturen, ansteigt und bei der höchsten untersuchten Dosis (>=15 mg pro Tag, kumulative Dosis >=1Gramm) am höchsten war. Bei kumulativen GC-Dosen von 5-9.9 Gramm, blieb das rFR für vertebralen Frakturen weiter ansteigend, nicht aber so für Hüftfrakturen (8). Beiden Studien gemeinsam war die Beobachtung, dass das rFR von Radiusfrakturen durch eine GC-Therapie nicht beeinflusst wird, weder durch die Höhe der kumulativen, noch durch die Höhe der Tagesdosis (6, 8).
Verlauf der Knochendichte und der absoluten Frakturrate (aFR) unter GC-Therapie
Für die richtige Einschätzung einer GIOP im klinischen Alltag, ist es wichtig zu wissen, dass ein Paradoxon zwischen Knochendichte (also der Bone Mineral Density BMD) und der Frakturanfälligkeit des Knochens besteht. Unter einer GC-Therapie wird die Frakturanfälligkeit für vertebrale Frakturen erhöht, ohne Änderung der BMD. Das histomorphologische Korrelat ist eine stark beschleunigte Apoptose der Osteozyten, welche eine Störung der ossären, v.a. trabekulären Mikroarchitektur des Knochens zur Folge hat (9, 10).
Verstanden werden muss auch der zeitliche Aspekt der Wirkung der GC-Therapie auf den Knochen. Eine GC-Therapie mit einer mittleren Dosierung von 7.5mg Prednisolonäquivalenz, zeigte nach 20 Wochen eine Abnahme des trabekulären Knochens der LWS von 8.2 % im Dual-Energy-CT. 24 Wochen nach Beendigung der GC-Therapie, findet sich eine Remission um 5.3 %. Der kortikale Knochen zeigt die gleiche Dynamik, aber in sehr abgeschwächter Ausprägung. Es findet sich eine Abnahme um 2.1 % und ein Wiedergewinn nach Therapiestopp um 0.7 % (11).
Ein weiterer wesentlicher Aspekt ist die Abnahme der generell erhöhten Frakturinzidenz im Verlauf einer GC-Therapie. Ein Vergleich der Frakturen in den ersten 6 Monaten, mit derjenigen einer chronischen GC-Therapie (> 6 Monate), zeigte eine höhere jährliche Inzidenz für vertebrale und nicht vertebrale Frakturen von 5.1 % pro Jahr, in den ersten 6 Therapiemonaten, gegenüber 3.2 % bei der chronischen Therapie (12).
Die individuelle Risikoabschätzung für osteoporotische Frakturen unter GC-Therapie
Um eine zutreffende Risikoabschätzung für osteoporotische Frakturen während einer GC-Therapie zu erreichen, kann nicht oft genug wiederholt werden, dass die Bestimmung des absoluten Frakturrisikos, basierend nur auf dem Messwert einer Dual-Energy X-Ray-Absorptiometry (DXA), das Frakturrisiko unterschätzt (9,10). Zwingend muss die Risikoevaluation in dieser Situation mittels eines Risikorechners erfolgen. Zur Verfügung stehen beispielsweise das TOP (Tool Osteoporose Plattform SGR) oder das FRAX®-Tool. Beim FRAX® muss das 10-Jahres-Frakturrisiko bei GC-Dosen über 7.5 mg angepasst werden. Für das 10-Jahres-Risiko für osteoporotische Frakturen um relative15 %, bei Schenkelhalsfrakturen um 20 % (z.B. bei 2.0 % auf 2.4 %) (13). Wie zutreffend diese Adaptation beim FRAX Rechner das Frakturrisiko für GC Dosen über 15 mg/Tag einschätzt muss offengelassen werden, bei fehlender Validierung. Beim TOP Tool kann die entsprechende GC Dosis präzis eingegeben werden, die Beeinflussung des absoluten 10-Jahres-Frakturrisikos ist aber ebenfalls noch nicht validiert.
Für Kinder und Erwachsene unter 40 Jahren, gibt es keine Risikorechner. Gemäss den aktuellsten ACR-Guidelines von 2017, besteht bei diesen PatientInnen per Definition eine Hochrisikosituation, nach dem Erleiden einer osteoporotischen Fraktur. Ein moderaten Risikos wird definiert bei einer GC-Therapie von mehr als 6 Monaten mit einer Prednisonäquivalentsdosis von >= 7.5 mg pro Tag und/oder einem Z-Score im Bereich der Hüfte von kleiner -3, im Bereich der Wirbelsäule von kleiner -2, sowie bei einem BMD-Verlust von >10 % in einem Jahr (LWS und oder Hüfte) (14).
Wirkung der Glukokortikoide auf den Knochen und direkter therapeutischer Ansatz
Glukokortikoide üben einen direkten toxischen Effekt auf die Knochenzellen aus. Über regulatorische Gene wird die Proteinsynthese beschädigt und es kommt zu Fehlregulationen. Ein Polymorphismus in der Hydroxysteroid-dehydrogenase (Enzym zur Umwandlung des aktiven in die inaktive Hormonform) ist die Ursache für eine individuelle Empfindlichkeit auf Glukokortikoide (15).
Die Hemmung der Knochenneubildung funktioniert über verschiedene Signalwege. Einer davon ist die verstärkte Bildung von Wnt-Antagonisten, z.B. Sclerostin. Über diesen Signalweg setzen in der Therapie der GIOP, das Alendronat (ALN) und das Parathormon (PTH) an, beide regulieren Wnt-Antagonisten herunter. Das Romosozumab (Monoklonaler Antikörper gegen Sclerostin) antagonisiert direkt das Sclerostin (16). Glukokortikoide erhöhen die Produktion des Rezeptor-Aktivators des nukleären Faktors Kappa Ligand (RANKL) und vermindern die Produktion von Osteoprotegrin (OPG). Damit wird die Knochenresorption verstärkt (17). Über diesen Signalweg wirkt das Denosumab (Monoklonaler Antikörper gegen RANKL), mit direkter Hemmung des RANKL. Mit einer reduzierten Ausschüttung von Osteoblasten stimulierenden Hormonen (Growth Hormone (GH), Insulin-like Growth Factor (IGF 1)) und Zytokinen (IL-6, Interferon-Beta), erklärt sich der frühe Verlust an Knochensubstanz während einer GC-Therapie (18–20). Die früh im Verlauf der GC-Therapie erhöhte Frakturrate bei unverändertem T-Score, wird mit einer durch das Glukokortikoid verursachten Apoptose der Osteozyten und der damit verbundenen Verschlechterung der trabekulären Mikroarchitektur des Knochens begründet (9, 10).
Therapie der GIOP
Grundsätzlich gilt es hier zu erwähnen, dass die der Therapieempfehlungen zugrundeliegende Datenlage dünn ist und oft die klinische Erfahrung und die pathophysiologischen Kenntnisse des Klinikers über die Wirkung der Glukokortikoide am Knochen die Prävention und/oder die Therapie der GIOP mitbeeinflussen.
Der direkte Einfluss der GC-Therapie auf die Knochendichte, die Knochenqualität und die schädlichen Wirkung der GC-Therapie vor allem auf den trabekulären Knochen, sind die Grundlagen der effektiven Prävention/Therapie einer GIOP (11). Darum ist der umgehende Therapiebeginn zum Schutz der Knochendichte und zur Verhinderung des überproportionalen Anstiegs der Frakturrate bei den vorwiegend trabekulären Wirbelkörpern wichtig (6, 11, 21).
Bei einem Vitamin D-Mangel kann mit der Vitamin D Substitution die Knochendichte erhalten werden; ebenso unter einer GC-Therapie, mit zusätzlicher Reduktion der Frakturrate für osteoporotische Frakturen (vertebral und nicht-vertebral), unbeeinflusst, des Vorliegens einer Osteoporose oder einer zusätzlichen Kalziumsubstitution (22,23). Die Wirkung der Vitamin D Substitution ist der Bisphosphonattherapie unterlegen (23). Standard zur Verhinderung des Knochendichteverlustes und vertebraler Frakturen im Rahmen einer GIOP ist die Bisphosphonat-Therapie (24).
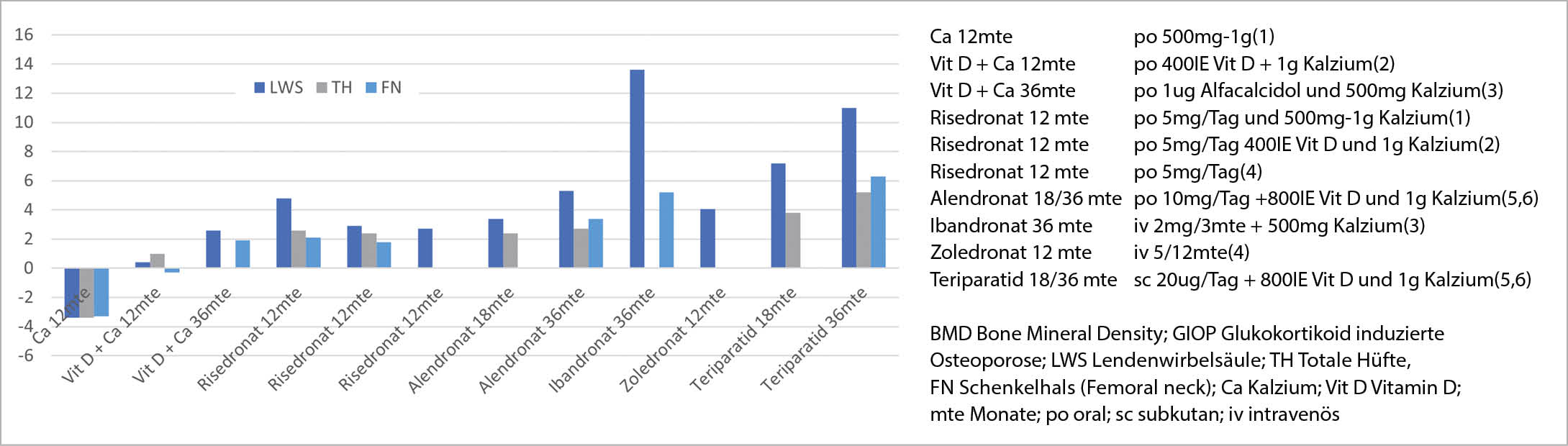
Während einer GC-Therapie in der Höhe von 7.5 mg Prädnisolonäquivalt, wurde mit Alendronat (ALN) (oral 35/70 mg pro Woche nach 48 Wochen) und Risedronat (RIS) (oral 17.5/35 mg pro Woche über 12 Monate) eine Knochendichtezunahme an allen drei gemessenen Lokalisationen (LWS, Total Hüfte, Schenkelhals) erreicht (25,26). Unter RIS konnte diese Wirkung sowohl bei Therapie-Start (Prävention der GIOP) wie bei laufender GC-Langzeit-Therapie (Therapie einer GIOP) gezeigt werden (27). Die Therapie einer GIOP mit intravenös verabreichtem Ibandronat (IBN) (2mg alle 3 Monate über 3 Jahre) zeigte bei beiden Geschlechtern einen Knochendichtezuwachs im Bereich der LWS und dem Schenkelhals (28). Ebenso in einer speziellen Therapiegruppe, nach Herztransplantation (29). Die orale Verabreichung von IBN (oral 150mg alle 4 Wochen über 48 Wochen) unter GC-Therapie zeigte bei osteopenen, asiatischen Patientinnen mit rheumatoider Arthritis an allen drei gemessenen Lokalisationen (LWS, Totale Hüfte, Schenkelhals) einen signifikanten Gewinn an Knochendichte im Vergleich zur Kontrollgruppe (30).
Intravenös verabreichtes Zoledronat (ZOL) (5mg pro Jahr über ein Jahr) verbesserte die Knochendichte im Bereich der LWS präventiv (GC-Therapie unter 3 Monate) und therapeutisch (GC-Therapie über 3 Monate) und war dabei RIS (oral 35mg pro Woche) nicht unterlegen, möglicherweise aber effektiver. In diesem Vergleich fielen die kurzfristigen Nebenwirkung der Zoledronatinfusion in den ersten 3 Tagen nach der Infusion negativ auf (31).
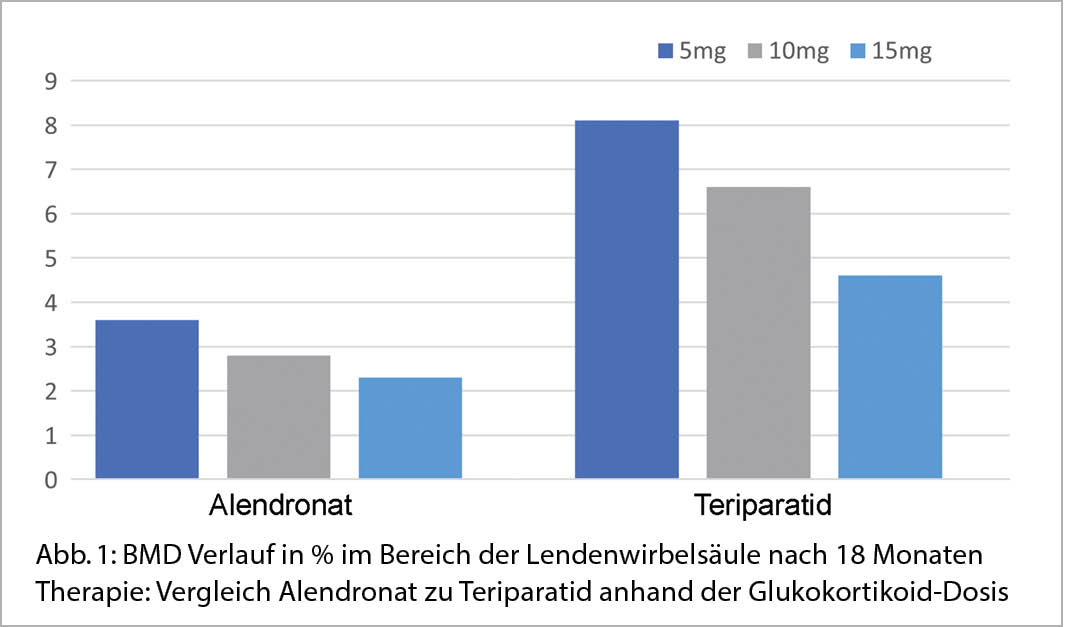
Der Wirkungsvergleich von ALN (70 mg pro Woche) mit Teriparatid (20ug pro Tag) während einer GC-Therapie (>=5mg Prädnisolonäquivalent) zeigte unter Teriparatid eine ausgeprägtere Knochendichtezunahme an allen drei gemessenen Lokalisationen (LWS, Totale Hüfte, Schenkelhals) (32). Die Zunahme der Knochendichte in der LWS schwächte sich bei beiden Therapien, mit zunehmender GC-Dosis (5 mg, 10 mg respektive 15mg Prednisolonäquivalent) ab, ohne Signifikanz zu erreichen (Abb. 1). Im Bereich der Hüfte (Totale Hüfte, Schenkelhals) fand sich keine GC-Dosis abhängige Veränderung der Wirkung unter Teriparatid und ALN (33). In Abbildung 2 wurde eine Übersicht der BMD-Veränderung unter unterschiedlichen GIOP Therapien bei Patienten mit einer GIOP und einer Langzeit-GC-Therapie zusammengestellt.
Es gibt Studien, welche eine Risikoreduktion für vertebrale Frakturen zeigen konnten, für ALN (25, 34), RIS (28, 35) und IBN (28, 29), nicht aber für ZOL. Teriparatid senkt das Risiko für vertebrale Frakturen signifikant im Vergleich zu Alendronat (32, 36).
Gemäss den vorhandenen Studien, müssen etwa 31 Personen mit Bisphosphonaten behandelt werden, um neue Wirbelfrakturen zu verhindern (24). Aufgrund kleiner Teilnehmerzahlen, mit wenig Frakturen, sind diese Frakturdaten vorsichtig zu betrachten.
Die Anwendung der Bisphosphonate wird als relativ sicher bewertet, trotz Hinweisen eines vermehrten Auftretens von Kieferosteonekrosen unter hohen GC-Dosen über längere Zeit bei 18-49-jährigen PatientInnen mit chronisch entzündlichen Erkrankungen (37).
In der Schweiz sind für die Behandlung der GIOP ALN (70 mg pro Woche) und RIS (35 mg pro Woche) zugelassen, ab einem T-Score unter -2,0 in einer der gemessenen Lokalisation (LWS, Totale Hüfte, Schenkelhals und Radius). ZOL intravenös 5 mg/Jahr ist zugelassen, ab einem T-Score von <= -2,5 in einer der gemessenen Lokalisation (LWS, Totale Hüfte, Schenkelhals und Radius) oder nach einer osteoporotischen Fraktur. Denosumab besitzt in der Therapie der GIOP keine Kassenpflicht in der Schweiz und ist mit einem relevanten Verlust an Knochendichte (Rebound) nach Absetzen, wenig geeignet bei zeitlich limitiertem Einsatz während einer GC-Therapie (38). Teriparatid ist in der Schweiz zugelassen für den Einsatz bei Versagen der initialen Therapie (Bisphosphonate) oder deren Unverträglichkeit.
Zusammenfassend die Therapierichtlinien nach ACR 2017 (14):
- Niedriges Frakturrisiko, Therapie mit Vitamin D und Calcium
- Moderates bis Hohes Frakturrisiko, Therapie mit BP (oral bevorzugt)
- Wechsel von oBP zu einer anderen Therapie der Osteoporose (in der Schweiz Teriparatid) wenn oBP ungeeignet oder die GC-Therapie über die Dauer eines BP-Therapiezyklus hinausgeht.
Abkürzungen: ALN Alendronat; BMD Knochendichte (Bone Mineral Densitiy); BP Bisphosphonate; oBP orale Bisphosphonate; CI Konfidenz Intervall; DXA Dual-energy X-ray absorptiometry; aFR absolute Fraktturrate; rFR relatives Frakturrisiko; GC Glukokortikoid; GIOP Glukokortikoid-induzierte Osteoporose; IBN Ibandronat; PMOP Postmenopausale Osteoporose; RANK/ RANKL Rezeptoraktivator des nukleären Faktors Kappa B/Ligand; OPG Osteoprotegrin; OR Odds Ratio; SGR Schweizerische Gesellschaft für Rheumatologie; TOP Tool Osteoporose Plattform der SGR; TPTD Teriparatid; TVT tiefe Venenthrombose; ZOL Zoledronat
Copyright bei Aerzteverlag medinfo AG
Zentrum für Rheuma- und Knochenerkrankungen
Klinik Hirslanden
Bellariastrasse 38
8038 Zürich
soser@rheumazentrum.ch
Zentrum für Rheuma- und Knochenerkrankungen
Bellariastrasse 38
8038 Zürich
S.O. deklariert Honorare für Beratung/Gutachten für Amgen; Wissenschaftliche Tätigkeit für Rheumaliga CH, Osteoporose-Plattform SGR; Fortbildung/Kongress-Kostenerstattung von IBSA, Amgen.
◆ Alle Patienten unter einer GC-Therapie über 3 Monate müssen auf das Risiko für osteoporotische Frakturen geprüft werden, ungeachtet der GC-Dosis, des Alters, des Geschlechts oder der zugrundeliegenden Erkrankung.
◆ Eine Prävention und/oder Therapie der Glukokortikoid-induzierten Osteoporose, muss umgehend nach Beginn der GC-Therapie begonnen werden. Die Prävention kann mit Beendigung der Glukokortikoid Therapie gestoppt werden, vorausgesetzt, dass PatientInnen im Verlauf der letzten 12 Monate keinen Knochendichteverlust von >= 10%, bzw. keine Fraktur während der GC-Therapie erlitten.
◆ Unter einer GC-Therapie ist die Substitution von Vitamin D und Kalzium zum Schutz der Knochen generell indiziert, ausser in Einzelfällen (z.B. Hyperkalzämie, Sarkoidose).
◆ Die Glukokortikoid-induzierte Osteoporose wird in erster Linie mit Bisphosphonaten behandelt unter Beachtung der Zulassung gemäss der Spezialitäten-Liste des Bundesamtes für Gesundheit oder mittels Kostengutsprache bei der Krankenkasse. Zweitlinientherapie ist das Teriparatid, mit überlegenem Anstieg der Knochendichte und einer Reduktion von vertebralen Frakturen gegenüber oralen Bisphosphonaten.
◆ Der Kliniker muss immer im Auge behalten, ob das individuelle Frakturrisko den Einsatz einer der BP Therapie überlegenen osteoanabolen Therapie (Teriparatid) rechtfertigt (39). In der Schweiz muss er den bevorzugten Einsatz von Teriparatid durch eine Kostengutsprache bei der Krankenkasse begründen.
1. van Staa TP, Leufkens HGM, Cooper C. The epidemiology of corticosteroid-induced osteoporosis: a meta-analysis. Osteoporos Int J Establ Result Coop Eur Found Osteoporos Natl Osteoporos Found USA 2002;13:777–87. https://doi.org/10.1007/s001980200108.
2. Walsh LJ, Wong CA, Pringle M, Tattersfield AE. Use of oral corticosteroids in the community and the prevention of secondary osteoporosis: a cross sectional study. BMJ 1996;313:344–6. https://doi.org/10.1136/bmj.313.7053.344.
3. Fardet L, Petersen I, Nazareth I. Prevalence of long-term oral glucocorticoid prescriptions in the UK over the past 20 years. Rheumatol Oxf Engl 2011;50:1982–90. https://doi.org/10.1093/rheumatology/ker017.
4. Chappard D, Legrand E, Basle MF, Fromont P, Racineux JL, Rebel A, et al. Altered trabecular architecture induced by corticosteroids: a bone histomorphometric study. J Bone Miner Res Off J Am Soc Bone Miner Res 1996;11:676–85. https://doi.org/10.1002/jbmr.5650110516.
5. Dalle Carbonare L, Arlot ME, Chavassieux PM, Roux JP, Portero NR, Meunier PJ. Comparison of trabecular bone microarchitecture and remodeling in glucocorticoid-induced and postmenopausal osteoporosis. J Bone Miner Res Off J Am Soc Bone Miner Res 2001;16:97–103. https://doi.org/10.1359/jbmr.2001.16.1.97.
6. Van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Use of oral corticosteroids and risk of fractures. J Bone Miner Res Off J Am Soc Bone Miner Res 2000;15:993–1000. https://doi.org/10.1359/jbmr.2000.15.6.993.
7. van Staa T-P, Geusens P, Pols H a. P, de Laet C, Leufkens HGM, Cooper C. A simple score for estimating the long-term risk of fracture in patients using oral glucocorticoids. QJM Mon J Assoc Physicians 2005;98:191–8. https://doi.org/10.1093/qjmed/hci029.
8. Amiche MA, Abtahi S, Driessen JHM, Vestergaard P, de Vries F, Cadarette SM, et al. Impact of cumulative exposure to high-dose oral glucocorticoids on fracture risk in Denmark: a population-based case-control study. Arch Osteoporos 2018;13:30. https://doi.org/10.1007/s11657-018-0424-x.
9. Van Staa TP, Laan RF, Barton IP, Cohen S, Reid DM, Cooper C. Bone density threshold and other predictors of vertebral fracture in patients receiving oral glucocorticoid therapy. Arthritis Rheum 2003;48:3224–9. https://doi.org/10.1002/art.11283.
10. Luengo M, Picado C, Del Rio L, Guañabens N, Montserrat JM, Setoain J. Vertebral fractures in steroid dependent asthma and involutional osteoporosis: a comparative study. Thorax 1991;46:803–6.
11. Laan RF, van Riel PL, van de Putte LB, van Erning LJ, van’t Hof MA, Lemmens JA. Low-dose prednisone induces rapid reversible axial bone loss in patients with rheumatoid arthritis. A randomized, controlled study. Ann Intern Med 1993;119:963–8. https://doi.org/10.7326/0003-4819-119-10-199311150-00001.
12. Amiche MA, Albaum JM, Tadrous M, Pechlivanoglou P, Lévesque LE, Adachi JD, et al. Fracture risk in oral glucocorticoid users: a Bayesian meta-regression leveraging control arms of osteoporosis clinical trials. Osteoporos Int J Establ Result Coop Eur Found Osteoporos Natl Osteoporos Found USA 2016;27:1709–18. https://doi.org/10.1007/s00198-015-3455-9.
13. Kanis JA, Johansson H, Oden A, McCloskey EV. Guidance for the adjustment of FRAX according to the dose of glucocorticoids. Osteoporos Int J Establ Result Coop Eur Found Osteoporos Natl Osteoporos Found USA 2011;22:809–16. https://doi.org/10.1007/s00198-010-1524-7.
14. Buckley L, Guyatt G, Fink HA, Cannon M, Grossman J, Hansen KE, et al. 2017 American College of Rheumatology Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis. Arthritis Rheumatol Hoboken NJ 2017;69:1521–37. https://doi.org/10.1002/art.40137.
15. Diederich S, Eigendorff E, Burkhardt P, Quinkler M, Bumke-Vogt C, Rochel M, et al. 11β-Hydroxysteroid Dehydrogenase Types 1 and 2: An Important Pharmacokinetic Determinant for the Activity of Synthetic Mineralo- and Glucocorticoids. J Clin Endocrinol Metab 2002;87:5695–701. https://doi.org/10.1210/jc.2002-020970.
16. Hayashi K, Yamaguchi T, Yano S, Kanazawa I, Yamauchi M, Yamamoto M, et al. BMP/Wnt antagonists are upregulated by dexamethasone in osteoblasts and reversed by alendronate and PTH: potential therapeutic targets for glucocorticoid-induced osteoporosis. Biochem Biophys Res Commun 2009;379:261–6. https://doi.org/10.1016/j.bbrc.2008.12.035.
17. Adami G, Saag KG. Glucocorticoid-induced osteoporosis: 2019 concise clinical review. Osteoporos Int J Establ Result Coop Eur Found Osteoporos Natl Osteoporos Found USA 2019;30:1145–56. https://doi.org/10.1007/s00198-019-04906-x.
18. Mazziotti G, Formenti AM, Adler RA, Bilezikian JP, Grossman A, Sbardella E, et al. Glucocorticoid-induced osteoporosis: pathophysiological role of GH/IGF-I and PTH/VITAMIN D axes, treatment options and guidelines. Endocrine 2016;54:603–11. https://doi.org/10.1007/s12020-016-1146-8.
19. Dovio A, Perazzolo L, Saba L, Termine A, Capobianco M, Bertolotto A, et al. High-dose glucocorticoids increase serum levels of soluble IL-6 receptor alpha and its ratio to soluble gp130: an additional mechanism for early increased bone resorption. Eur J Endocrinol 2006;154:745–51. https://doi.org/10.1530/eje.1.02147.
20. Takuma A, Kaneda T, Sato T, Ninomiya S, Kumegawa M, Hakeda Y. Dexamethasone enhances osteoclast formation synergistically with transforming growth factor-beta by stimulating the priming of osteoclast progenitors for differentiation into osteoclasts. J Biol Chem 2003;278:44667–74. https://doi.org/10.1074/jbc.M300213200.
21. Hall GM, Spector TD, Griffin AJ, Jawad AS, Hall ML, Doyle DV. The effect of rheumatoid arthritis and steroid therapy on bone density in postmenopausal women. Arthritis Rheum 1993;36:1510–6. https://doi.org/10.1002/art.1780361105.
22. Richy F, Ethgen O, Bruyere O, Reginster J-Y. Efficacy of alphacalcidol and calcitriol in primary and corticosteroid-induced osteoporosis: a meta-analysis of their effects on bone mineral density and fracture rate. Osteoporos Int J Establ Result Coop Eur Found Osteoporos Natl Osteoporos Found USA 2004;15:301–10. https://doi.org/10.1007/s00198-003-1570-5.
23. de Nijs RNJ, Jacobs JWG, Algra A, Lems WF, Bijlsma JWJ. Prevention and treatment of glucocorticoid-induced osteoporosis with active vitamin D3 analogues: a review with meta-analysis of randomized controlled trials including organ transplantation studies. Osteoporos Int J Establ Result Coop Eur Found Osteoporos Natl Osteoporos Found USA 2004;15:589–602. https://doi.org/10.1007/s00198-004-1614-5.
24. Allen CS, Yeung JH, Vandermeer B, Homik J. Bisphosphonates for steroid-induced osteoporosis. Cochrane Database Syst Rev 2016;10:CD001347. https://doi.org/10.1002/14651858.CD001347.pub2.
25. Saag KG, Emkey R, Schnitzer TJ, Brown JP, Hawkins F, Goemaere S, et al. Alendronate for the prevention and treatment of glucocorticoid-induced osteoporosis. Glucocorticoid-Induced Osteoporosis Intervention Study Group. N Engl J Med 1998;339:292–9. https://doi.org/10.1056/NEJM199807303390502.
26. Reid DM, Hughes RA, Laan RF, Sacco-Gibson NA, Wenderoth DH, Adami S, et al. Efficacy and safety of daily risedronate in the treatment of corticosteroid-induced osteoporosis in men and women: a randomized trial. European Corticosteroid-Induced Osteoporosis Treatment Study. J Bone Miner Res Off J Am Soc Bone Miner Res 2000;15:1006–13. https://doi.org/10.1359/jbmr.2000.15.6.1006.
27. Reid DM, Adami S, Devogelaer JP, Chines AA. Risedronate increases bone density and reduces vertebral fracture risk within one year in men on corticosteroid therapy. Calcif Tissue Int 2001;69:242–7. https://doi.org/10.1007/s00223-001-1060-8.
28. Ringe JD, Dorst A, Faber H, Ibach K, Sorenson F. Intermittent intravenous ibandronate injections reduce vertebral fracture risk in corticosteroid-induced osteoporosis: results from a long-term comparative study. Osteoporos Int J Establ Result Coop Eur Found Osteoporos Natl Osteoporos Found USA 2003;14:801–7. https://doi.org/10.1007/s00198-003-1425-0.
29. Fahrleitner-Pammer A, Piswanger-Soelkner JC, Pieber TR, Obermayer-Pietsch BM, Pilz S, Dimai HP, et al. Ibandronate prevents bone loss and reduces vertebral fracture risk in male cardiac transplant patients: a randomized double-blind, placebo-controlled trial. J Bone Miner Res Off J Am Soc Bone Miner Res 2009;24:1335–44. https://doi.org/10.1359/jbmr.090216.
30. Shin K, Park S-H, Park W, Baek HJ, Lee YJ, Kang SW, et al. Monthly Oral Ibandronate Reduces Bone Loss in Korean Women With Rheumatoid Arthritis and Osteopenia Receiving Long-term Glucocorticoids: A 48-week Double-blinded Randomized Placebo-controlled Investigator-initiated Trial. Clin Ther 2017;39:268-278.e2. https://doi.org/10.1016/j.clinthera.2017.01.008.
31. Reid DM, Devogelaer J-P, Saag K, Roux C, Lau C-S, Reginster J-Y, et al. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet Lond Engl 2009;373:1253–63. https://doi.org/10.1016/S0140-6736(09)60250-6.
32. Saag KG, Zanchetta JR, Devogelaer J-P, Adler RA, Eastell R, See K, et al. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum 2009;60:3346–55. https://doi.org/10.1002/art.24879.
33. Devogelaer J-P, Adler RA, Recknor C, See K, Warner MR, Wong M, et al. Baseline glucocorticoid dose and bone mineral density response with teriparatide or alendronate therapy in patients with glucocorticoid-induced osteoporosis. J Rheumatol 2010;37:141–8. https://doi.org/10.3899/jrheum.090411.
34. Adachi JD, Saag KG, Delmas PD, Liberman UA, Emkey RD, Seeman E, et al. Two-year effects of alendronate on bone mineral density and vertebral fracture in patients receiving glucocorticoids: a randomized, double-blind, placebo-controlled extension trial. Arthritis Rheum 2001;44:202–11. https://doi.org/10.1002/1529-0131(200101)44:1<202::AID-ANR27>3.0.CO;2-W.
35. Wallach S, Cohen S, Reid DM, Hughes RA, Hosking DJ, Laan RF, et al. Effects of risedronate treatment on bone density and vertebral fracture in patients on corticosteroid therapy. Calcif Tissue Int 2000;67:277–85. https://doi.org/10.1007/s002230001146.
36. Saag KG, Shane E, Boonen S, Marín F, Donley DW, Taylor KA, et al. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med 2007;357:2028–39. https://doi.org/10.1056/NEJMoa071408.
(37. Horton DB, Haynes K, Denburg MR, Thacker MM, Rose CD, Putt ME, et al. Oral glucocorticoid use and osteonecrosis in children and adults with chronic inflammatory diseases: a population-based cohort study. BMJ Open 2017;7:e016788. https://doi.org/10.1136/bmjopen-2017-016788.
38. Tsourdi E, Langdahl B, Cohen-Solal M, Aubry-Rozier B, Eriksen EF, Guañabens N, et al. Discontinuation of Denosumab therapy for osteoporosis: A systematic review and position statement by ECTS. Bone 2017;105:11–7. https://doi.org/10.1016/j.bone.2017.08.003.
38. Adler RA.Glucocorticoid-induced Osteoporosis and the New ACR Guidelines. Clin Rev Bone Miner Metab 2017;15:123-127
der informierte @rzt
- Vol. 12
- Ausgabe 4
- April 2022