- Ausgewählte Studien aus der Hämato-Onkologie
The cancer premium – explaining differences in prices for cancer vs non-cancer drugs with efficacy and epidemiological endpoints in the US, Germany, and Switzerland: a cross sectional study
Serra-Burriel M, Perényi G, Laube Y, Mitchell AP, Vokinger KN.
EClinicalMedicine. 2023 Jul 13;61:102087. doi: 10.1016/j.eclinm.2023.102087. eCollection 2023 Jul. PMID: 37521033
In dieser Studie untersucht die Arbeitsgruppe von K. Vokinger von der Universität Zürich die “Cancer Premium” d.h. die zusätzlichen Kosten, die neue Krebsmedikamente verursachen, im Vergleich zu neuen Medikamenten, die nicht für Krebserkrankungen indiziert sind. Dies geht von der Hypothese aus, dass die Industrie für Krebserkrankungen zusätzliche Preisaufschläge vornimmt. Zu diesem Zweck untersuchten sie Neuregistrationen in den USA, Deutschland und in der Schweiz 2011-2020.
Die Untersuchung analysiert, ob nach Korrektur in Regressionsanalysen für Inzidenz, Prävalenz und Mortalität einer Erkrankung, die Wirksamkeit, die einer Substanz zugeschrieben wird, unterschiedliche Preise für Krebs- und Nicht-Krebserkrankungen berechnet werden.
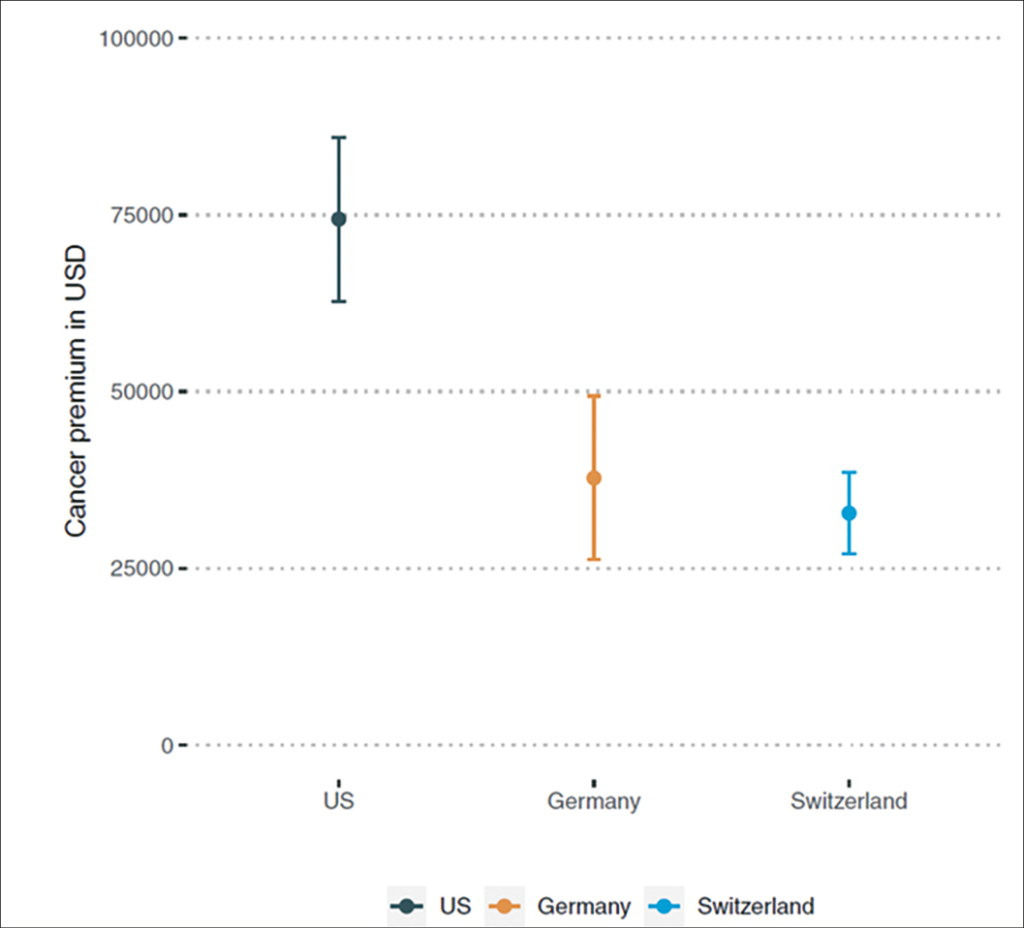
181 Medikamente wurden in die Studie aufgenommen, 68 für Krebserkrankungen. Eine negative Korrelation zwischen Inzidenz/Prävalenz und Preis wurde gefunden, d.h. je seltener die Erkrankung, desto höher der Preis und eine positive Korrelation zwischen Mortalität und Preis, d.h. je tödlicher eine Erkrankung, desto höher der Preis. Soweit wie erwartet. Ebenso fanden die Autoren eine Korrelation zwischen Wirksamkeit und Preis. Nach Korrektur für diese Faktoren waren Krebsmedikamente circa dreimal teurer als Nicht-Krebsmedikamente. Der errechnete Aufpreis betrug in den USA 74,412 USD, in Deutschland 37,770 USD und in der Schweiz 32,801 (siehe Graphik, «Cancer Premium»). Durch das Regressionsmodell wurde 72% der Variabilität erklärt.
Die Autoren kommen zum Schluss, dass für Krebserkrankungen bei neu eingeführten Medikamenten korrigiert für Wirksamkeit, Häufigkeit und Mortalität der Erkrankung in den USA in Deutschland und in der Schweiz ein Aufpreis zu zahlen ist. Von Interesse: Dieser Aufpreis ist in den USA deutlich höher als in Deutschland und in der Schweiz. Die Mechanismen der Preisverhandlungen sind in den Ländern unterschiedlich.
Kommentar
Drug Pricing ist für Kliniker ein Buch mit sieben Siegeln. Es ist erstaunlich, dass mit solchen Kohorten Studien Licht ins Dunkel gebracht werden kann.
Mezigdomide plus Dexamethasone in Relapsed and Refractory Multiple Myeloma
Richardson PG, Trudel S, Popat R, Mateos MV, Vangsted AJ, Ramasamy K, et al. N Engl J Med. 2023 Sep 14;389(11):1009-1022.
Patienten mit Plasmazellmyelom werden mehrfach behandelt, und Therapien in fortgeschrittener Erkrankung sind wichtige Neuentwicklungen. Der Cereblon E3 Ubiquitin Ligase Modulator Mezigdomid, eine Substanz mit neuen Wirkmechanismus, hat starke antiproliferative und tumorizide Wirkung in präklinischen Modellen, auch wenn die Zellen resistent auf Immunmodulatoren wie Lenalidomid / Pomalidomid sind.
Dies ist eine Phase-1-2-Studie: Patienten erhielten orales Mezigdomid kombiniert mit Dexamethason zur Behandlung von rezidiviertem und oder refraktärem Plasmazellmyelom. In einer Phase-1-Dosis-Eskalations-Kohorte wurde Sicherheit und Pharmakokinetik evaluiert. In der Phase-2-Studie wurde die in der Phase 1 etablierte Dosis weitergeführt.
In der Phase 1 wurden 77 Patienten eingeschlossen. Dosislimitierende Toxizität waren Neutropenie und neutropenes Fieber. Die weiteruntersuchte Dosis von Mezigdomid war 1,0 mg oral qd zusammen mit Dexamethason für 21 Tage mit einer Woche Pause, Zykluswiederholung alle 28 Tage. In der Phase 2 wurden 101 Patienten eingeschlossen. Diese Patienten waren tripel-refraktär (Imid, Proteasom Inhibitor, CD38 Antikörper). Neutropenie wurde in 77% der Patienten Infektionen in 65% beobachtet. Ein Ansprechen PR oder besser wurde bei 41 (31-51) % gesehen mit einer mittleren Dauer von 7.6 Monaten mit einem mittleren PFS von 4.4 Monaten (95% CI, 3.0 – 5.5).
Die Autoren beurteilten das Ansprechen als vielversprechend angesichts der schwer vorbehandelten Patienten.
Kommentar
Cereblon E3 Ubiquitin Ligase Modulatoren sind eine neue Substanzklasse in der Behandlung des Plasmazellmyeloms. Die bisher beobachtete Ansprechrage darf als bescheiden beschrieben werden. Zu diesem Zeitpunkt sind natürlich noch viele Fragen offen. Behandlungsstrategien beim Plasmazellmyelom beinhalten 3er- und 4er-Kombinationen und die neuen Immuntherapien. Die Zukunft wird zeigen, wie Cereblon E3 Ubiquitin Ligase Modulatoren da hineinpassen.
Results from a phase I/II trial of cusatuzumab combined with azacitidine in patients with newly diagnosed acute myeloid leukemia who are ineligible for intensive chemotherapy.
Pabst T, Vey N, Adès L, Bacher U, Bargetzi M, Fung S, Gaidano et al.
Haematologica. 2023 Jul 1;108(7):1793-1802. doi: 10.3324/haematol.2022.281563. PMID: 36779592
In einer Arbeit aus dem Inselspital wird Cusatuzumab, ein hochaffiner monoklonaler anti-CD70 Antikörper, bei Patienten mit akuter myeloischer Leukämie (AML) untersucht. CD70 ist ein Tumornekrose Faktor Ligand und ist auf AML Blasten und Leukämiestammzellen exprimiert. Die Blockade der CD70/CD27 Bindung blockiert die Proliferation von Leukämiestammzellen. Hypomethylierende Substanzen wie Azacytidine erhöhen die CD70 Expression auf Leukämiestammzellen und könnten so synergistisch zu einer CD70 Blockade wirken.
Diese Phase-I/II-Studie untersuchte Cusatuzumab in Kombination mit Azacytidine bei neu diagnostizierten AML Patienten, die für eine intensive Chemotherapie nicht in Frage kommen.
Patienten erhielten eine einzelne Cusatuzumab Dosis (1, 3, 10, or 20 mg/kg) in 4 Dosisniveaus 14 Tage zu Beginn der Kombinationstherapie und dann an den Tage 3 und 17 in Kombination mit Azacytidine in der Standarddosierung.
Die in der Phase I gewählte Dosis war 10 mg/kg, und diese wurde in der Phase II weiter untersucht. 38 Patienten wurden eingeschlossen, 12 in der Phase I und 26 in der Phase II.
Ein Ansprechen, d.h. partielle Remission oder besser, wurde bei 19/38 Patienten beobachtet, einschliesslich bei 8/26 in der Phase II der Studie. In 14/38 Patienten wurde eine komplette Remission erreicht. Die mediane Ansprechdauer war 4,5 Monate und das mediane Gesamtüberleben 11,5 Monate. Die häufigste Nebenwirkungen waren Infektionen (84%) und Hämatootxizität (79%).
Die Autoren schliessen, dass die Kombination Cusatuzumab plus Azacyitine gut verträglich und wirksam ist. Weiterführende Studien sollen Cusatuzumab in Kombination mit Azacytidine und Venetoclax (ein neuer Standard bei Patienten mit AML, die für intensive Chemotherapien nicht in Frage kommen) untersuchen.
Kommentar
Das Konzept der CD70-Blockade ist bestechend, die Wirksamkeit in dieser Studie nicht überragend, die Frage ist, ob mit Azacyitidne alleine eine ähnlich gute Wirkung hätte erzielt werden können. Weitere Studien sind sicher vonnöten.
Klinik für Hämatologie
Hämatologische Diagnostik Labormedizin
Universitätsspital Basel und Blutspendezentrum beider Basel SRK
Petersgraben 4
4031 Basel
jakob.passweg@usb.ch