- Kardiologie Reviewkurs Zürich
Vom 20. bis 22. März 2025 fand der traditionelle Reviewkurs Kardiologie Zürich organisiert von der Klinik im Park und der Agentur andfrank am Flughafen Zürich statt. Die Organisatoren hatten in Zusammenarbeit mit der Mayo Clinic Rochester wiederum ein reichhaltiges und spannendes Programm zusammengestellt. Der folgende Bericht fasst einige der zahlreichen Vorträge zusammen.
Koronare Herzkrankheit (KHK) durch Stress und Sport – ein Paradox?

Das Sportparadox: Sport als Auslöser von Herzerkrankungen und plötzlichem Herztod. Prof. Dr. med. Christian Schmied, HerzGefässZentrum im Park, Zürich, stellte den Fall eines 31-jährigen professionellen Athleten vor, der sich präsentierte, um seine Herz-CT-Ergebnisse zu diskutieren. Der Patient fühlt sich gesund, ist aber gestresst, hat atypische Brustschmerzen, nimmt regulär «Snus», keine anderen Drogen oder reguläre Medikation, NSAR selten, Familienanamnese unverdächtig. Der Referent zeigte die Beziehung zwischen dem Trainingsumfang und dem Gesundheitsrisiko, welches eine U-Form darstellt mit der «optimalen» Bewegungsdosis zwischen keiner Bewegung (höchstes Risiko) und extremer Bewegungshypothese (hohes Risiko). Der grösste Nutzen der Bewegung liegt bei 75 Min/d (9 h/Woche), 4000–5000 kcal/Woche.
Koronare Atherosklerose bei Spitzensportlern
Die Vermutung, dass langfristiges Ausdauertraining zu einer paradoxen Zunahme von Atherosklerose der Herzkranzgefässe führen kann, wurde mit der Master@Heart-Studie bestätigt. Ausdauersportler mit lebenslangem intensivem Training hatten mehr koronare Plaques als fitte und gesunde Personen mit einem ähnlich niedrigen kardiovaskulären Risikoprofil. Emotionaler Stress verstärkte dieses Problem zusätzlich.
Zusammenfassung
Der Referent fasste seine Ausführungen wie folgt zusammen: Regelmässige intensive körperliche Betätigung kann in Verbindung mit anderen Faktoren (insbesondere emotionalem Stress) zu einer chronischen Entzündung führen, die ihrerseits zu koronarer Atherosklerose führt.
Die Unterscheidung zwischen gesundem und belastendem Sport ist schwierig (Selbstreflexion ist entscheidend).
Ist die Koronarsklerose erst einmal etabliert, ist eine Modifizierung /Stabilisierung der Plaque zwingend erforderlich.
Ob regelmässige körperliche Betätigung (und in welcher Intensität) als «natürlicher» Plaque-Stabilisator dient, bleibt umstritten. Eine generelle Bewegungseinschränkung bei KHK wäre jedoch fatal. Verlässliche Ergebnisdaten in diesem Bereich werden dringend benötigt, stellte der Referent abschliessend fest.
Neues bei GLP-1 und GLP-1/GIP-Rezeptoragonisten
Komorbiditäten bei Typ-2-Diabetes

In der Schweiz leiden 6,4 % der Bevölkerung an Typ-2-Diabetes (T2D). Davon sind 60–90 % adipös (11 % in der Allgemeinbevölkerung). Weitere Komorbitäten sind: 20–50 % der T2D-Patienten haben eine kardiovaskuläre Erkrankung, 25 % einen Insulinmangel, 25 % Herzinsuffizienz, 25 % eine chronische Niereninsuffizienz, 50–70 % haben eine mit metabolischer Dysfunktion assoziierte Fettleber, 30-40% eine mit metabolischer Dysfunktion assoziierte Steato-Hepatitis.
Prof. Dr. med. Roger Lehmann vom Universitätsspital Zürich erläuterte, dass makrovaskuläre Erkrankungen bei T2D mit steigendem HbA1c-Wert assoziiert sind: Bereits ab einem HbA1c von > 5,5 % steigt das Risiko für koronare Herzkrankheit oder Schlaganfall um 50–55 %.
GLP-1-Rezeptoragonisten (GLP-1 RA) führen zu einer deutlichen Senkung des HbA1c. Die grösste Reduktion wird durch GLP-1RA/GIP-RA-Kombinationen erzielt, wie im SURPASS-2-Studienvergleich (Tirzepatid [Mounjaro®] vs. Semaglutid) gezeigt wurde: Alle drei Dosierungen von Mounjaro® waren wirksamer als Semaglutid 1 mg.
Komorbidität bei Adipositas
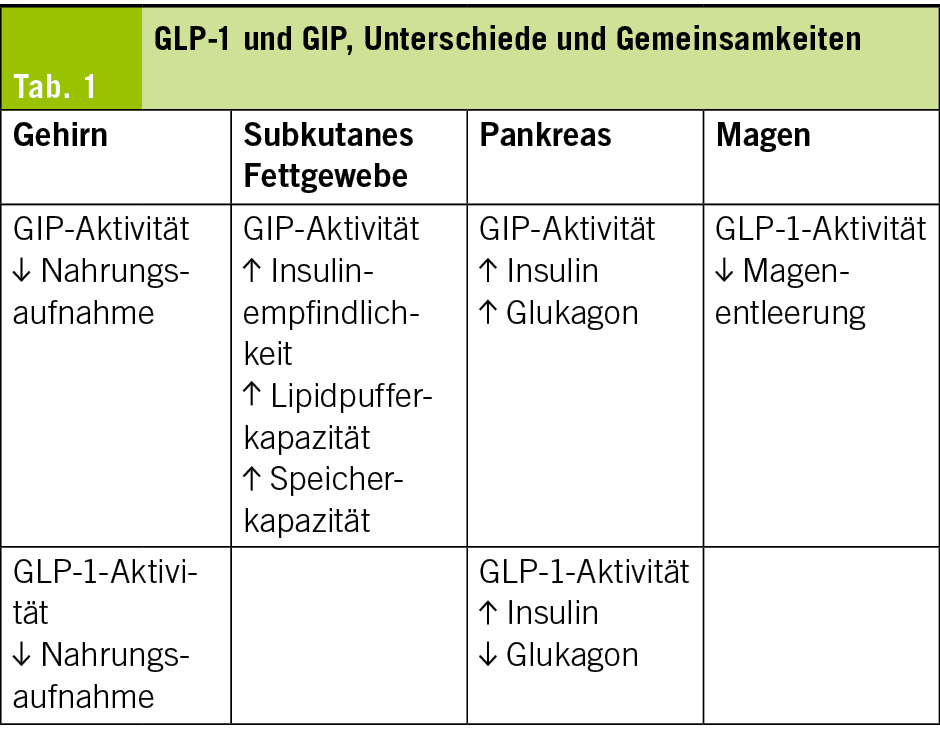
Adipositas ist eng mit einer Vielzahl schwerwiegender Erkrankungen verknüpft. Dazu zählen Typ-2-Diabetes (20–25 %), Schlafapnoe (40–45 %), Hypertonie (50–55 %), metabolisch-assoziierte Fettlebererkrankung (MAFLD) (50–70 %), Metabolische Dysfunktion-assoziierte Steatohepatitis (MASH) (30–35 %) und Dyslipidämien (65–70 %) (Tab. 1).
Gewicht- und Glukosemanagement
GLP-1 RA
Wirksamkeit: Höhere Dosen verbessern den Gewichtsverlust, steigern aber auch Nebenwirkungen. Dies gilt nicht für die Glukosesenkung. Die beste Wirksamkeit und kardiorenaler Schutz wird mit einer hohen Dosis Semaglutid erzielt.
GLP-1/GIP RA
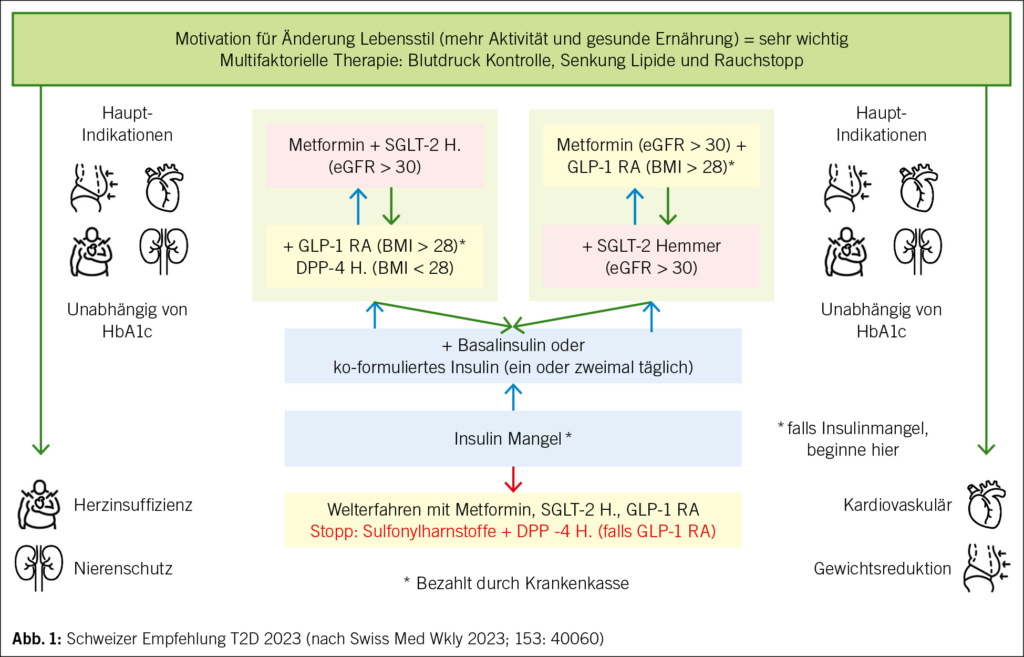
Tirzetrapid ist eine neue Substanz mit hoher Wirksamkeit. Die kardiovaskuläre Endpunktstudie läuft. Tirzetrapid ist ein dualer Agonist und hat womöglich weniger Nebenwirkungen als hoch dosierte GLP-1 RA. 2,4 mg Semaglutid (Wegovy®) haben das Gewicht von 107,2 kg auf 89,2 kg gesenkt. Der Gewichtsverlust durch Semaglutid betrug 18 kg, durch den Wechsel zu Placebo 6 kg und durch Tirzetrapid 5–15 mg 24 kg. Die Lücke zwischen bariatrischer Chirurgie und medikamentöser Therapie schliesst sich (Abb. 1).
Aktuelle Studien
Die aktuelle Studienlage bestätigt den breiten Nutzen von GLP-1- und GLP-1/GIP-Agonisten über die glykämische Kontrolle hinaus.
Im FLOW-Trial (Perkovic V et al., NEJM 2024) konnte Semaglutid 1,0 mg subkutan eine signifikante Reduktion des primären Nierenendpunktes um 24 % erreichen. Zusätzlich zeigte sich in einer Subgruppenanalyse eine 27 %ige Senkung der zusammengesetzten Herzinsuffizienz-Ereignisse, einschliesslich kardiovaskulärem Tod. Diese Effekte traten unabhängig von einer bestehenden Herzinsuffizienz auf.
Auch bei metabolisch-assoziierten Lebererkrankungen gibt es Fortschritte: Die ESSENCE-Trial (Mitteilung Novo Nordisk) untersuchte 1200 Patienten mit MAFLD und/oder MASH. Nach 72 Wochen zeigten 37,0 % der Patienten unter Semaglutid 2,4 mg eine Verbesserung der Leberfibrose ohne Verschlechterung der Entzündung, im Vergleich zu 22,5 % unter Placebo. Zudem verschwand bei 62,9 % der Patienten unter Semaglutid MASH, ohne dass sich die Fibrose verschlechterte – ein klarer Vorteil gegenüber 34,1 % unter Placebo.
Tirzepatid überzeugte ebenfalls durch seine Wirksamkeit: In Studien führte der duale Agonist bei einer beachtlichen Anzahl von Patienten zum Verschwinden von MASH. Auch der neuere Wirkstoff Retatrutid zeigte vielversprechende Resultate, indem der hepatische Fettgehalt bei behandelten Patienten auf unter fünf Prozent gesenkt werden konnte (Synergy-MASH Trial und Phase-2-Obesity Trial).
Die SELECT-Studie (Linkoff AM et al., NEJM 2023) untersuchte 17 604 Patienten mit bestehender kardiovaskulärer Erkrankung, einem BMI ≥ 27 und ohne bekannten Diabetes mellitus. Über einen Zeitraum von 40 Monaten führte die Therapie mit Semaglutid zu einer 20 %igen Reduktion schwerwiegender kardiovaskulärer Ereignisse (MACE), mit einer absoluten Risikoreduktion von 1,5 % und einer Number Needed to Treat (NNT) von 67.
Zusätzlich unterstützt die Real-World-Evidenz den Einsatz von Kombinationstherapien. Die Kombination von GLP-1 RA mit einem SGLT2-Hemmer senkte das Risiko für 3-Punkte-MACE um etwa 30 % im Vergleich zu einer GLP-1-Monotherapie (NNT 30). Im Vergleich zur SGLT2-Hemmer-Monotherapie zeigte sich unter der Kombinationstherapie ebenfalls eine 29 %ige Risikoreduktion (NNT 32).
Dauer und Strategien der Therapie
Die Anwendung von GLP-1- und GLP-1/GIP-Agonisten sollte grundsätzlich kontinuierlich erfolgen, wobei eine individuelle Dosisanpassung wichtig ist, um den erreichten Gewichtsverlust langfristig zu stabilisieren. Alternativ sind auch intermittierende Ansätze – etwa nach dem Prinzip „Start–Stopp–erneuter Start“ – möglich. In bestimmten Fällen kann auch eine einmalige Therapie über ein bis zwei Jahre erwogen werden, vorausgesetzt, sie wird von konsequenten Lebensstilmassnahmen begleitet.
Nutzen-Risiko-Abwägung
Die Vorteile der Therapie sind überzeugend: Ein umfassender kardiorenaler und hepatischer Schutz, eine Reduktion der Mortalität sowie Verbesserungen bei Apoplexierisiko, Blutdruck und Lipidprofil wurden nachgewiesen. Gastrointestinale Nebenwirkungen sind zwar häufig, bleiben aber in der Regel mild und ungefährlich. In Bezug auf das Kosten-Nutzen-Verhältnis sind SGLT2-Hemmer aktuell klar positiv bewertet. Bei GLP-1-Rezeptoragonisten ist die Einschätzung derzeit neutral, könnte sich jedoch mit sinkenden Kosten eindeutig ins Positive verschieben.
Testosteron und DHEA: Welche Substitution macht Sinn bei Männern und Frauen?
Der alternde Mann: Erwartungen und Realität der Testosterontherapie

Lange Zeit galt Testosteron als Hoffnungsträger, um den alternden Mann zu «verjüngen» und seine Gesundheit zu verbessern. Doch wie Prof. Dr. med. Bernd Schultes (St. Gallen) feststellte, haben neue Studien diese Hoffnungen weitgehend entkräftet.
Für die Labordiagnostik werden heute folgende Empfehlungen gegeben: Eine Mehrfachbestimmung des Gesamttestosterons, mindestens zweimalig, sollte erfolgen. Die Blutentnahme sollte morgens zwischen 7 und 10 Uhr stattfinden, da zu dieser Zeit die höchsten Werte gemessen werden können. Zusätzlich wird die Messung des Sexualhormon-bindenden Globulins (SHBG) sowie die Berechnung des freien Testosterons empfohlen. Bei Verdacht auf sekundären Hypogonadismus sollte eine Differenzialdiagnostik unter Einschluss von LH, Prolaktin und Ferritin erfolgen, ergänzt durch eine weiterführende endokrine Abklärung. Die Indikation für eine MRI sollte dabei eher zurückhaltend gestellt werden.
Testosteronspiegel sind alters- und BMI-abhängig: Mit zunehmendem Alter und steigendem Körpergewicht sinkt das freie Testosteron, während es nach einem Magenbypass wieder ansteigt. Studien zeigten, dass bei adipösen Männern die Gabe von Aromatasehemmern den LH- und Testosteronspiegel steigen lässt, Estradiol hingegen abfällt. Jedoch hatte diese Intervention keinen nachweisbaren Effekt auf metabolische Parameter, körperliche Leistungsfähigkeit oder Stimmung.
Wirkung einer Testosteronbehandlung bei älteren Männern
Eine Zusammenfassung von sieben Placebo-kontrollierten Studien bei Männern über 65 Jahre mit Symptomen und einem Gesamttestosteronwert unter 9 nmol/l zeigte, dass die sexuelle Funktion durch eine Testosteronsubstitution deutlich verbessert werden konnte. Die körperliche Leistungsfähigkeit wurde subjektiv ebenfalls als besser empfunden, jedoch zeigte sich keine signifikante Verbesserung der Vitalität.
Metabolische Effekte
In zahlreichen kontrollierten Studien in verschiedenen Populationen mit niedrigen Testosteronwerten und Symptomen konnte eine eindeutige Verbesserung der Körperzusammensetzung festgestellt werden: Der Fettanteil nahm ab, während die Muskelmasse zunahm. Das Körpergewicht reduzierte sich moderat. Ergebnisse zum Glukosestoffwechsel waren gemischt, reichten von neutralen Effekten bis hin zu leichten Verbesserungen, auch bei Typ-2-Diabetes-Patienten. Die Lipidprofile zeigten tendenziell leichte Verbesserungen. Weniger erfreulich sind Hinweise aus einer kleinen Studie (n = 209) im New England Journal of Medicine (Basaria et al., 2010), die bei Männern über 65 Jahre mit eingeschränkter Mobilität eine Häufung kardiovaskulärer Ereignisse unter Testosteronsubstitution zeigte, was zum vorzeitigen Studienabbruch führte. Eine neuere Untersuchung zur kardiovaskulären Sicherheit ergab eine nicht signifikante Hazard Ratio von 0,96, wobei die Nichtunterlegenheit (p < 0,001) nachgewiesen wurde.
Indikation zur Testosteronsubstitution
Ein allgemeiner Konsens besteht darin, dass eine Testosterontherapie bei einem Gesamttestosteronwert unter 8 nmol/l (230 ng/dl) und entsprechender Symptomatik indiziert ist. Liegt der Wert über 12 nmol/l, besteht keine Indikation zur Therapie. Bei Werten zwischen 8 und 12 nmol/l sollte das freie Testosteron berechnet werden. Liegt dieser Wert unter 225 pmol/l (65 pg/ml), kann eine Therapie erwogen werden.
Risiken und Kontraindikationen der Testosterontherapie
Die Inzidenz von Prostatakarzinomen wird unter Testosteronsubstitution nicht erhöht. Allerdings kann der Hämatokrit ansteigen, ebenso können sich eine benigne Prostatahyperplasie (BPH) oder eine Schlafapnoe verschlechtern.
Absolute Kontraindikationen für eine Testosterontherapie sind ein bestehendes Prostatakarzinom, ein PSA-Wert über 4 ng/ml, Mammakarzinom, bestehender Kinderwunsch, ein Hämatokrit über 50 % sowie schwere Symptome einer BPH oder einer unbehandelten Schlafapnoe (letztere gelten als relative Kontraindikationen).
Testosteronbehandlung und Frakturrisiko
Eine aktuelle Publikation im New England Journal of Medicine (Snyder PJ et al., 2024) untersuchte den Zusammenhang zwischen Testosterontherapie und Frakturrisiko bei Männern mit Hypogonadismus. Entgegen der Erwartungen führte die Testosteronsubstitution nicht zu einer Reduktion des Frakturrisikos, sondern war mit einem signifikant erhöhten Risiko verbunden.
Dehydroepiandrosteron (DHEA) bei Frauen
Die Anwendung von DHEA bei Frauen mit primärer oder sekundärer Nebenniereninsuffizienz oder Anorexia nervosa zeigte in Studien nur geringe Vorteile hinsichtlich Lebensqualität und Stimmung. Positive Effekte auf Angstzustände oder sexuelle Funktionen konnten nicht eindeutig belegt werden. Bei gesunden Frauen wurden keine konsistent positiven Effekte auf Wechseljahrsbeschwerden, sexuelle Funktionen, kognitive Leistungen oder das allgemeine Wohlbefinden nachgewiesen.
Eine Ausnahme bildet die lokale Anwendung von DHEA, die bei vulvovaginaler Atrophie signifikante Vorteile zeigte. Die systemische Verabreichung von DHEA zur Verbesserung der Ovulationsinduktion bei Frauen mit reduzierter Ovarialreserve wird hingegen nicht empfohlen. Zu den Risiken einer hochdosierten oder langfristigen DHEA-Verabreichung zählen androgene und östrogene Nebenwirkungen, die insbesondere bei längerer Anwendung relevant werden.
Testosterontherapie bei Frauen
Ein globaler Konsensus (Davis SR et al., JCEM 2019) stellte fest, dass es keine einheitliche Definition für einen Androgenmangel bei Frauen gibt, da spezifische Cutoff-Werte für DHEAS oder Testosteron fehlen.
In der Praxis wird bei Frauen eher die Gabe von Testosteron als von DHEA bevorzugt. Positive Effekte wurden insbesondere hinsichtlich der sexuellen Funktion, vor allem der Libido, sowie bei urogenitalen Symptomen beobachtet. Selbst bei Patientinnen mit primärer oder sekundärer Nebenniereninsuffizienz wird eine Testosterontherapie jedoch nicht generell empfohlen. Zu beachten sind mögliche Nebenwirkungen wie Hirsutismus und Akne. Langfristige Sicherheitsdaten zur Testosterontherapie bei Frauen liegen derzeit nicht vor.
riesen@medinfo-verlag.ch