- Fetale Neurosonographie im 2. Trimenon – ein praxisnaher Überblick
Die fetale Neurosonographie im zweiten Trimenon ermöglicht eine gezielte Darstellung zentralnervöser Strukturen zur frühzeitigen Erkennung von Fehlbildungen. Dieser Artikel vermittelt praxisnah die Grundlagen der standardisierten Schnittführung in drei transversalen Ebenen und erläutert ergänzende koronare und sagittale Ebenen bei Verdachtsbefunden. Typische Pathologien wie Plexus choroideus-Zysten, Corpus-callosum-Agenesie, Ventrikulomegalie und Anomalien der hinteren Schädelgrube werden differenziert dargestellt.
Fetal neurosonography in the second trimester allows systematic imaging of central nervous system structures to detect anomalies early. This article provides a practical overview of standard transverse imaging planes and discusses coronal and sagittal extensions in selected cases. Key CNS pathologies such as choroid plexus cyst, agenesis of the corpus callosum, ventriculomegaly and posterior fossa anomalies are addressed.
Keywords: fetale Neurosonographie, ZNS, Routinescreening, erweiterte Untersuchung, Anomalien
Einleitung
Die fetale Neurosonographie ist ein fester Bestandteil der pränatalen Diagnostik (1, 2, 5). Im zweiten Organscreening (SSW 20+0 bis 23+0) liegt der Fokus auf der strukturierten Darstellung zentralnervöser Strukturen zur frühzeitigen Detektion von Auffälligkeiten, denn ZNS-Anomalien zählen, neben Herzfehlern, zu den häufigsten angeborenen Fehlbildungen (7). Grundlage der Untersuchung sind drei definierte transversale Ebenen: transthalamisch, transventrikulär und transzerebellär (1, 2, 7, 12). Bei auffälligen Befunden oder erhöhtem Risiko werden ergänzend sagittale und koronare Schnitte empfohlen (2, 5). Die Untersuchung erfolgt vorzugsweise transabdominal, bei speziellen Fragestellungen auch transvaginal. Entscheidend ist ein systematisiertes Vorgehen unter Berücksichtigung der fetalen Lage und fundierter Kenntnisse der normalen Sonoanatomie.
Standardschnittebenen
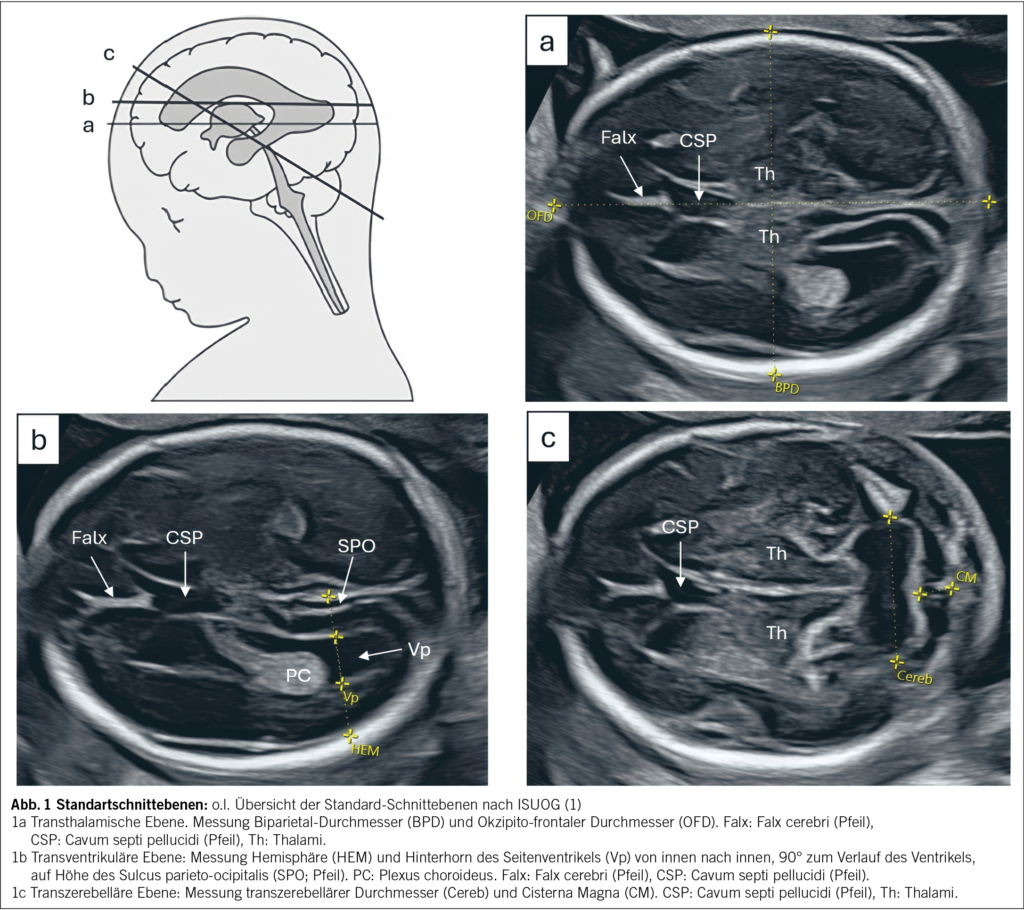
Folgende drei Ebenen des Kopfs, nebst Beurteilung der Wirbelsäule im Längs- und Querschnitt, sind Bestandteil des Routine-Screenings jeder risikoarmen Schwangerschaft (1, 2, 6).
Die transthalamische Ebene zeigt eine ovale Schädelform, das Cavum septi pellucidi (CSP), zwei symmetrische Thalami und die zentrale Falx (1, 2, 5, 12). Das Cerebellum darf dabei nicht sichtbar sein. In dieser Ebene werden Biparietal-Durchmesser (BPD), Okzipito-frontaler Durchmesser (OFD) und Kopfumfang (HC) gemessen (Abb. 1a).
Die transventrikuläre Ebene dient der Beurteilung der Seitenventrikel (1, 3, 12). Die Weite des Atriums wird zwischen den inneren Rändern (innen-innen), 90° zum Verlauf des Ventrikels und auf Höhe des Sulcus parieto-occipitalis gemessen. Werte <10 mm gelten als unauffällig. Zusätzlich werden die Hemisphärenbreite und die Lage der Plexus choroidei beurteilt. Dabei ist die orthogonale Ausrichtung zur Mittellinie essenziell (Abb. 1b).
Die transzerebelläre Ebene zeigt das Kleinhirn und die Cisterna magna (1, 5, 12). Wichtig sind die Darstellung des Vermis, der Hemisphären sowie des CSP. Der transzerebelläre Durchmesser (TCD) korreliert mit der Schwangerschaftswoche. Eine Cisterna magna >10 mm gilt als auffällig und erfordert eine weiterführende Abklärung (Abb. 1c).
Erweiterte Untersuchung
Bei auffälligen Befunden oder Risikokonstellationen, wie familiärer Belastung, Infektionen (z. B. Zytomegalie, Toxoplasmose, Zikavirus) oder auffälliger Genetik, sollte eine weiterführende sonographische Beurteilung erfolgen. Ergänzend werden sagittale und koronare Ebenen eingesetzt, die eine differenzierte Darstellung zentraler Hirnstrukturen ermöglichen (2, 5, 9).
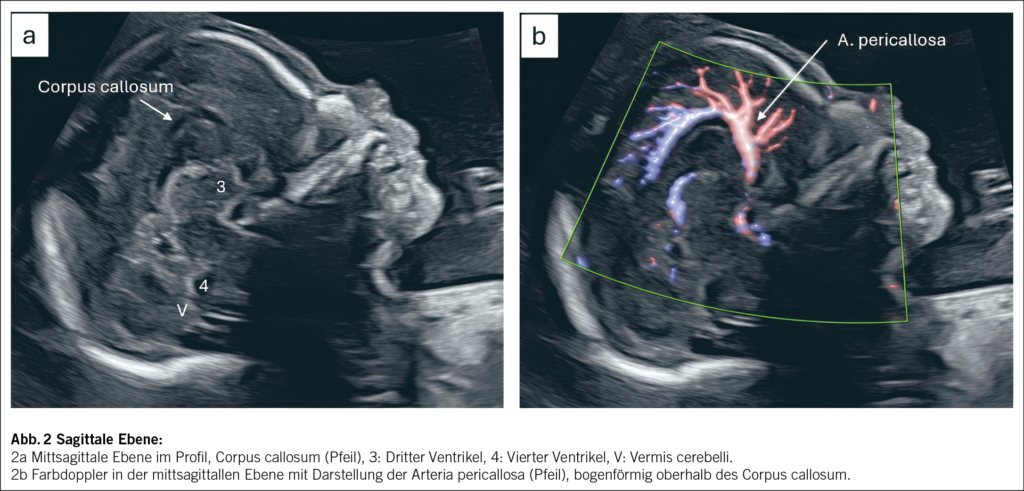
Die mittsagittale Ebene erlaubt die direkte Darstellung des Corpus callosum. Der Verlauf der Arteria pericallosa kann mittels Farbdoppler beurteilt werden: Bei normaler Ausprägung verläuft sie bogenförmig oberhalb des Balkens. Ebenfalls beurteilbar sind Position, Grösse und Form des Vermis, Lage des Tentoriums und deren Winkel zum Hirnstamm. Diese sind entscheidend, um die Differenzialdiagnosen Blake-Pouch-Zyste, Vermishypoplasie und Dandy-Walker-Malformation abzugrenzen (5, 9) (Abb. 2a und 2b).
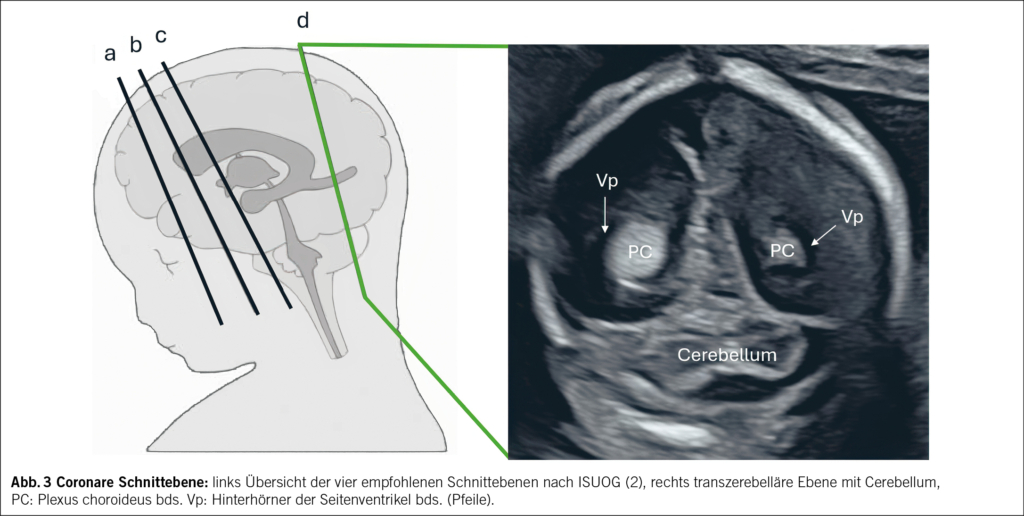
Koronare Ebenen ermöglichen die Beurteilung der kortikalen Reifung (Gyrierung), Symmetrie der Hemisphären sowie der lateralen Ventrikelsysteme. Auffälligkeiten wie Asymmetrien oder Hinweise auf Migrationsstörungen lassen sich so frühzeitig erfassen (Abb. 3).
Typische auffällige ZNS-Befunde
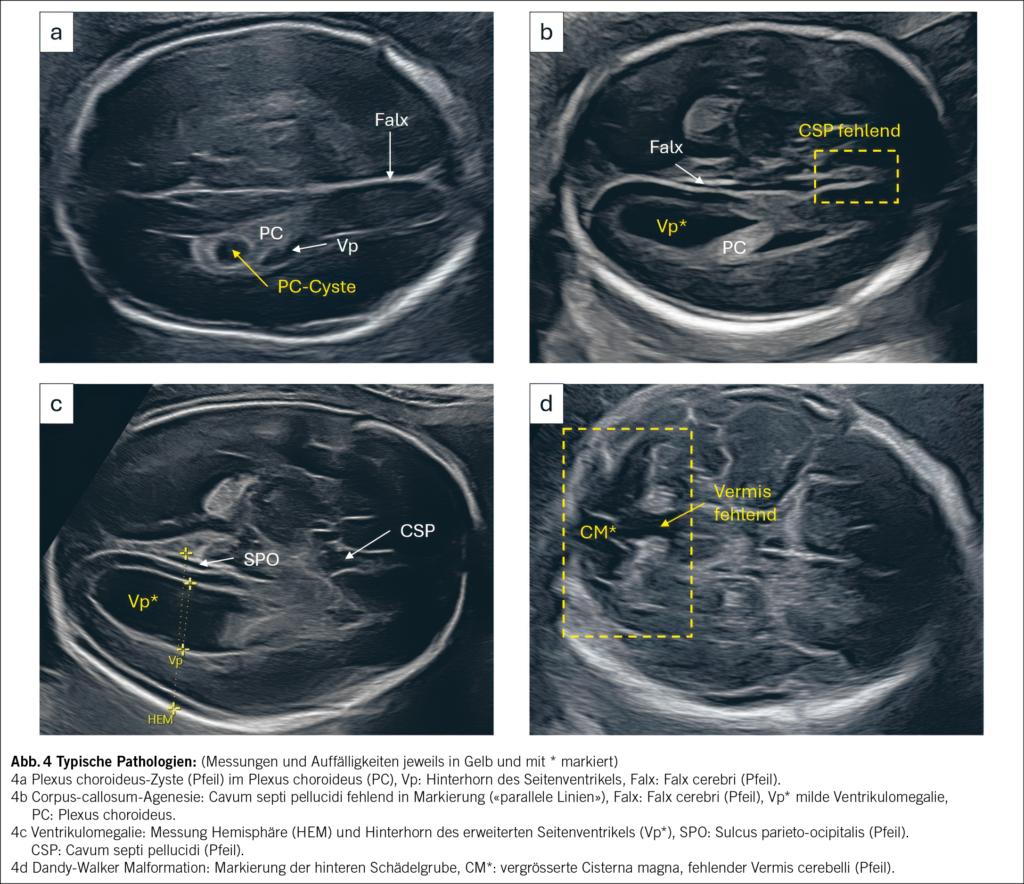
Plexus choroideus-Zysten treten bei 1–2 % der Schwangerschaften auf (3, 5). Sie erscheinen als anechogene Strukturen im Plexus choroideus, meist bilateral. Überwiegend sind es transiente Befunde ohne klinische Relevanz. Entscheidend ist die detaillierte Sonographie inklusive Neurosonographie zum Ausschluss assoziierter Fehlbildungen und einer möglichen Assoziation zu Chromosomenstörungen, vor allem zu einer Trisomie 18. Bei ansonsten unauffälligem Ultraschallbefund und unauffälliger, vollständiger Ersttrimesterdiagnostik ist eine invasive Diagnostik oder NIPT nicht zwingend erforderlich. (1, 3, 5) (Abb. 4a).
Corpus-callosum-Agenesie ist eine der häufigsten pränatal diagnostizierten ZNS-Fehlbildungen (3–7/1000) (3, 5). Neben indirekten Zeichen wie Kolpozephalie, divergierenden Seitenventrikeln und fehlendem CSP in der transversalen Ebene ist die sagittale Darstellung des Fehlens des Corpus callosum entscheidend. Die Farbdoppleruntersuchung kann durch den Nachweis oder das Fehlen des bogenförmigen Verlaufs der Arteria pericallosa oberhalb des Corpus callosum zur Diagnose beitragen. Die Prognose der Balkenagenesie hängt im Wesentlichen von intra- und extracerebralen Begleitfehlbildungen und etwaigen genetischen Auffälligkeiten ab; ergänzend wird deswegen die genetische Diagnostik empfohlen sowie im Verlauf auch eine fetale Magnetresonanztomografie (MRT) (3, 5, 9) (Abb. 4b).
Ventrikulomegalie ist mit einer Prävalenz von 3–5/1000 eine der häufigsten ZNS-Anomalien (3, 5). Die Diagnose erfolgt in der transventrikulären Ebene anhand der präzisen Messung der Ventrikelweite: mild (10–12 mm), moderat (12–15 mm), schwer (>15 mm). Differenzialdiagnostisch kommen Infektionen, Migrationsstörungen, genetische Syndrome und Obstruktionen, Blutungen infrage (3, 5, 9). Die Prognose korreliert mit der Ventrikelweite und ist von der Ursache der Ventrikulomegalie abhängig (Abb. 4c).
Anomalien der hinteren Schädelgrube reichen von Normvarianten bis zu komplexen Fehlbildungen (3, 5, 8). Häufige Diagnosen sind die Dandy-Walker-Malformation (Abb. 4d) und die Vermis-Hypoplasie sowie die prognostisch benigneren Befunde wie die Blake-Pouch-Zyste, oder die isolierte Megacisterna magna. Die sonografische Beurteilung erfolgt vorrangig in der transzerebellären und midsagittalen Ebene (9). Tab. 1 fasst die wichtigsten sonografischen Merkmale und Unterschiede zusammen (Ref. 8–11). Ergänzend können 3D-Sonografie oder fetale MRT zur weiteren Diagnostik beitragen (1, 5, 8, 9).
Quellenangabe Abbildungen
Abbildung 1 oben links und Abbildung 3 links stammen aus den ISUOG-Guidelines (Quellen 1 und 2).
Alle weiteren Ultraschallbilder stammen aus der Frauenklinik des Universitätsspitals Basel.
Copyright
Aerzteverlag medinfo AG
Gyn. Sonographie und Pränataldiagnostik – Frauenklinik
Universitätsspital Basel
Spitalstrasse 21
4001 Basel
Gyn. Sonographie und Pränataldiagnostik – Frauenklinik
Universitätsspital Basel
Spitalstrasse 21
4001 Basel
gwendolin.manegold-brauer@usb.ch
Die Autorinnen haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Eine strukturierte Darstellung der drei transversalen Ebenen (transthalamisch, transventrikulär und transzerebellär) ist die Grundlage jeder fetalen ZNS-Sonographie.
- Bei auffälligen Befunden werden ergänzend sagittale und koronare Ebenen eingesetzt.
- Die sagittale Ebene mit ggf. Farbdoppler ist essenziell für die Beurteilung des Corpus callosum und der Differentialdiagnose der Strukturen der hinteren Schädelgrube.
- Plexus choroideus-Zysten zeigen sich, wenn isoliert, meist als transiente Befunde ohne klinische Relevanz, die sich im weiteren Schwangerschaftsverlauf spontan zurückbilden – wichtig ist der Ausschluss weiterer sonographischer Auffälligkeiten und ggf. eine genetische Diagnostik.
- Eine Cisterna magna >10 mm in der transzerebellären Ebene sollte eine fetale Neurosonografie mit Einstellung der mittleren Sagittalebene zur Beurteilung von Vermis und Tentorium nach sich ziehen.
1. Malinger G et al. ISUOG Practice Guidelines: CNS Part 1. Ultrasound Obstet Gynecol. 2020;56(3):476–484.
2. Malinger G et al. ISUOG Practice Guidelines: CNS Part 2. Ultrasound Obstet Gynecol. 2020;56(3):485–500.
3. Karl K et al. Sonografische Differenzialdiagnose bei ZNS-Anomalien. Ultraschall Med. 2011;32(4):342–361.
4. Manegold-Brauer G. Fetale Neurosonographie im ersten Trimenon. info@gynäkologie 01/2017.
5. Chaoui R, Heling KS. Sonografie des fetalen ZNS. In: Praxishandbuch Pränataldiagnostik. Thieme; 2022.
6. Merz E et al. Aktualisierte Qualitätsanforderungen an die weiterführende differenzierte Ultraschalluntersuchung in der pränatalen Diagnostik (= DEGUM-Stufe II) im Zeitraum von 18+0 bis 21+6 Schwangerschaftswochen. Ultraschall Med. 2012;33:593–596.
7. SGUM/SGGG. Empfehlungen zur Ultraschalluntersuchung in der Schwangerschaft – Grundlagen und Qualitätsanforderungen. Version 2.2, 2021.
8. Radiopaedia, The Fetal Medicine Foundation, ISUOG – Beiträge zu Blake-Pouch-Zyste, Dandy-Walker-Komplex, Vermis-Hypoplasie und Megacisterna magna (2024).
9. Katrin Karl, Annegret Geipel, Fehlbildungen des Gehirns, (Kapitel 21.1, 21.2, 21.3 und 21.5), Kursbuch Ultraschall in der Gynäkologie und Geburtshilfe, Thieme; 2022.
10. D’Addario V, Volpe P, Pinto V, et al. Posterior fossa anomalies: prenatal sonographic diagnosis and classification. Ultrasound Obstet Gynecol. 2001;17(5):360–367.
11. Pooh RK, Kurjak A. Three-dimensional neurosonography of the fetal brain. Donald School J Ultrasound Obstet Gynecol. 2012;6(1):6–15.
12. Annegret Geipel, Kapitel 6 Normale Sonoanatomie im 2. Trimenon, Kursbuch Ultraschall in der Gynäkologie und Geburtshilfe, Thieme; 2022.
info@gynäkologie
- Vol. 15
- Ausgabe 3
- Juni 2025