- Biomarqueurs de la maladie d’Alzheimer
La maladie d’Alzheimer (MA) est la principale cause de démence dans le monde. Malgré sa prévalence élevée, une grande proportion de cas reste non diagnostiquée ou diagnostiquée tardivement. Le développement de biomarqueurs in vivo a profondément transformé le paradigme diagnostique de la MA, en permettant une détection plus précoce et plus précise des altérations neuro-pathologiques caractéristiques, notamment les plaques amyloïdes (Aß) et la tauopathie. Les biomarqueurs sont désormais regroupés dans le cadre conceptuel AT(N), intégrant les anomalies amyloïdes (A), tau (T) et la neurodégénérescence (N). Les techniques d’imagerie moléculaire (PET amyloïde, tau, FDG) et structurelle (IRM), ainsi que les analyses de fluides biologiques (LCR et plasma), permettent une stadification fine de la maladie, depuis les phases précliniques jusqu’aux stades avancés. L’intégration de ces outils dans la pratique clinique est guidée par des algorithmes décisionnels en plusieurs étapes, tenant compte des caractéristiques cliniques et des performances respectives des biomarqueurs. Toutefois, leur utilisation doit être contextualisée, car la présence de biomarqueurs pathologiques chez des individus cognitivement normaux n’indique pas nécessairement une conversion vers la démence. De plus, l’interprétation diagnostique repose sur une approche clinico-biologique, associant données objectives et évaluation du patient. Dans cette revue, nous explorons les différents types de biomarqueurs, leurs performances, leurs limites, ainsi que leur rôle croissant dans le diagnostic des patients atteints ou à risque de MA.
Alzheimer’s disease (AD) is the leading cause of dementia worldwide. Despite its high prevalence, a large proportion of cases remain undiagnosed or are diagnosed at an advanced stage. The development of in vivo biomarkers has radically changed the diagnostic paradigm of AD by enabling earlier and more accurate detection of its key neuropathological features, notably amyloid-beta (Aß) plaques and tauopathy. Biomarkers are now integrated into the AT(N) framework, encompassing amyloid pathology (A), tau pathology (T), and neurodegeneration (N). Molecular imaging techniques (amyloid PET, tau PET, FDG PET), structural MRI, and biofluid analysis (CSF and plasma) allow for precise staging of the disease across its entire continuum, from preclinical to advanced stages. Their clinical integration follows structured diagnostic algorithms based on clinical presentation and the diagnostic performance of each biomarker. However, interpretation requires a clinico-biological integration, as pathological biomarkers may be present in cognitively normal individuals without necessarily indicating future dementia. Thus, diagnosis must rely on a combined clinico-biological approach that incorporates objective biomarker data and clinical evaluation. This review outlines the different types of biomarkers, their diagnostic and prognostic value, their limitations, and their growing role in guiding diagnosis in patients with or at risk for AD.
Keywords: Amyloid PET, Tauopathy, Biomarker Integration, Neurodegeneration, Plasma Biomarkers
Introduction
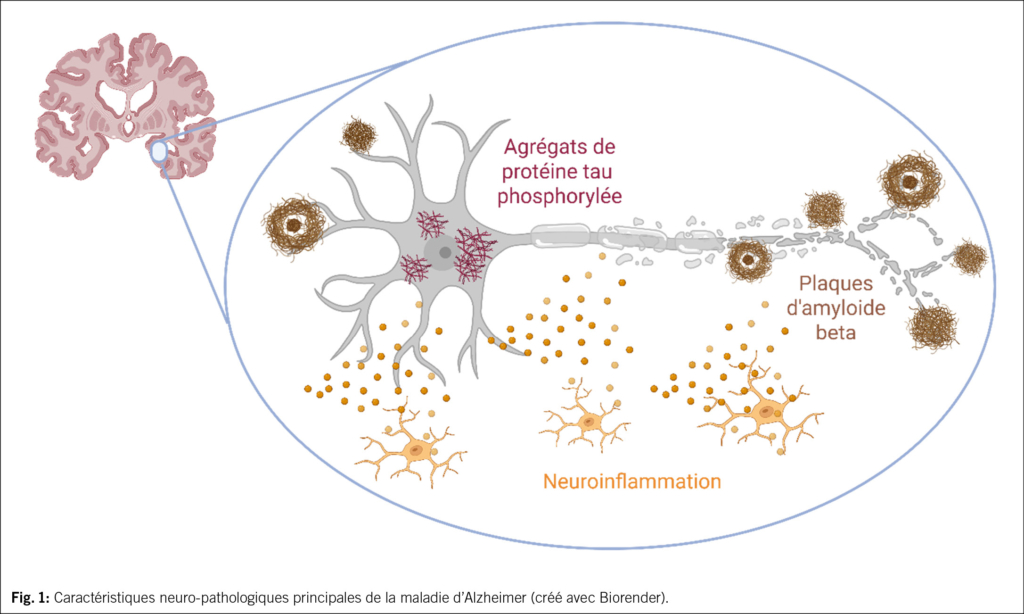
La maladie d’Alzheimer (MA) est une maladie neurodégénérative se caractérisant sur le plan neuro-pathologique par l’accumulation extracellulaire de plaques amyloïdes composées de peptides amyloïdes bêta (Aβ) agrégés, ainsi que par des dépôts intracellulaires neurofibrillaires de protéines tau hyperphosphorylée (1) (Fig. 1). Ces anomalies sont corrélées à une perte synaptique et neuronale, à des déficits en neurotransmetteurs, à une neuro-inflammation chronique, conduisant de manière progressive à la neurodégénérescence et au déclin cognitif. Le phénotype clinique typique de la MA se manifeste par une démence d’évolution progressive, marquée par un syndrome amnésique affectant la mémoire épisodique. Toutefois, des formes cliniques atypiques ou focales ont également été décrites, rendant le diagnostic fondé uniquement sur les manifestations cliniques particulièrement complexe (2,3). En effet, 15 à 30 % des patients ayant reçu un diagnostic clinique de MA dans des centres mémoire spécialisés et en l’absence de recours aux biomarqueurs, ne remplissent pas les critères biologiques et neuro-pathologiques requis pour confirmer ce diagnostic (4,5). Du point de vue épidémiologique, la MA constitue la forme de démence la plus prévalente à l’échelle mondiale, représentant environ 60-70 % des cas diagnostiqués (6) et exerçant un impact majeur sur les systèmes de santé et de protection sociale ainsi que sur les populations concernées (7–9). De plus, on estime que 75 % des individus atteints de démence demeurent non diagnostiqués à l’échelle mondiale, ce qui suggère que la prévalence réelle et l’impact de la MA sont probablement bien plus importants que les estimations actuelles ne le reflètent (10). Dans ce contexte, les limites du diagnostic clinique isolé, combinées à la fréquence élevée de cas non identifiés, mettent en évidence la nécessité d’une détection plus précoce et plus fiable de la maladie. Une identification anticipée de la MA est en effet essentielle pour optimiser les interventions thérapeutiques, retarder la progression vers la démence avérée et permettre une prise en charge globale et adaptée dès les stades prodromiques.
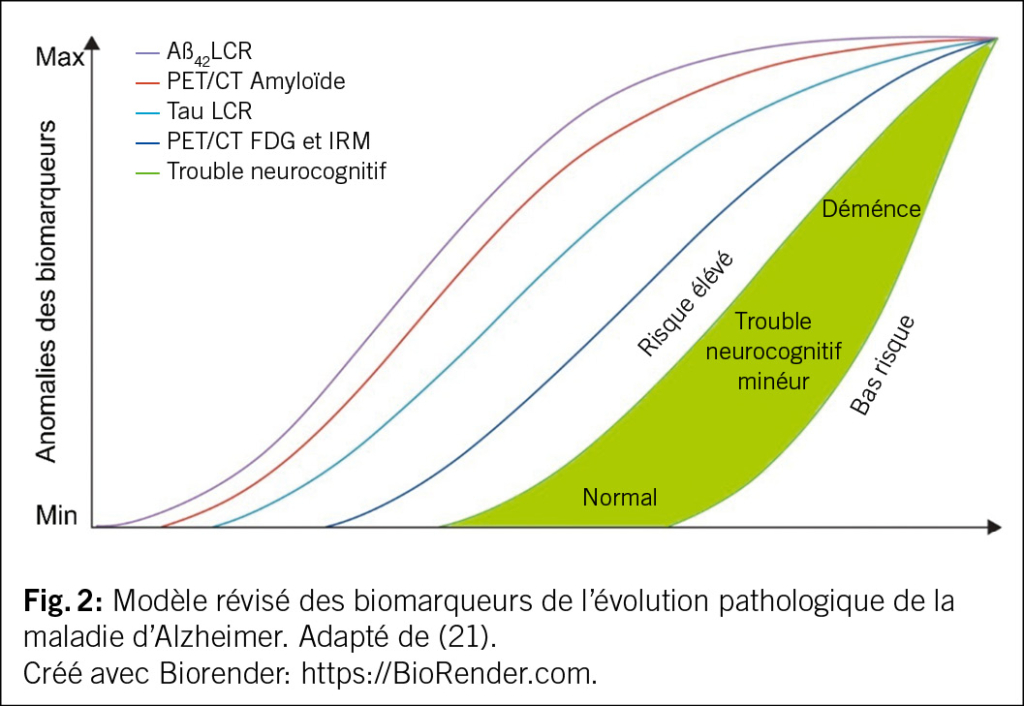
L’émergence de biomarqueurs in vivo reflétant les altérations neuro-pathologiques caractéristiques de la MA, a profondément transformé le paradigme diagnostique, en offrant des outils permettant de surmonter les défis précédemment évoqués. En premier lieu, l’utilisation des biomarqueurs de la MA a permis une détection plus précoce de la pathologie (11) et a mis en évidence que la progression de la MA s’inscrit dans un continuum allant de la phase préclinique (présence de biomarqueurs pathologiques sans symptômes cognitifs ou avec des troubles subtils), au stade prodromique (trouble neurocognitif mineur dû à la MA), jusqu’aux stades de démence débutante, puis modérée à sévère (2,11) (Fig. 2). L’introduction des biomarqueurs a aussi profondément modifié le paradigme diagnostique de la MA, en faisant évoluer ce dernier d’une approche exclusivement clinique vers un cadre clinico-biologique (2). De plus, l’utilisation des biomarqueurs a également permis d’affiner le diagnostic dans des situations où les données cliniques et d’imagerie cérébrale structurelle ne permettaient pas de distinguer la MA d’autres affections présentant un tableau clinique similaire (3,12). Le diagnostic précis et précoce a permis aussi de maximiser l’efficacité des traitements modificateurs de la maladie qui sont désormais approuvés dans certains pays ou en cours de développement, ciblant principalement les stades précoces de la MA. Ces thérapies, telles que le lecanemab – un anticorps monoclonal dirigé contre les formes agrégées d’Aβ récemment approuvé en Europe pour le traitement de la MA précoce (13) – ont démontré une efficacité maximale lorsqu’elles sont administrées précocement (14). Par ailleurs, un diagnostic précis facilite également la mise en place d’interventions ciblées visant à prévenir ou à réduire les facteurs de risque associés à la MA (18,19). Cette revue propose une analyse approfondie des différents biomarqueurs disponibles pour la MA, en abordant leur classification, leurs méthodes de détection, leur utilité diagnostique et pronostique, ainsi que leur intégration progressive dans la pratique clinique à travers un parcours décisionnel structuré.
Profils de biomarqueurs de la maladie d’Alzheimer
L’un des principaux systèmes de classification des biomarqueurs de la MA est le système AT(N), qui regroupe ces biomarqueurs en trois grandes catégories: A pour les dépôts Aβ, T pour les agrégats de protéine tau, et (N) pour la neurodégénérescence (20). Les biomarqueurs Aβ incluent la Tomographie par Émission de Positons (PET)/tomographie axiale computérisée (CT) amyloïde, les concentrations des peptides Aβ dans le liquide cérébrospinal (LCR) (le plus souvent Aβ42 ou le ratio Aβ42/40), ainsi que, plus récemment, l’Aβ plasmatique. Les biomarqueurs de la protéine tau comprennent la PET tau et les concentrations de tau phosphorylée (p-tau)181 et p-tau231 dans les biofluides. Enfin, les biomarqueurs de la neurodégénérescence comprennent la PET au 18F-fluorodésoxyglucose, l’IRM structurelle, ainsi que la tau totale (t-tau) dans le LCR. Concernant la chronologie d’apparition des altérations des biomarqueurs de la MA, comme mentionné dans la section précédente, ces modifications précèdent l’émergence des symptômes cliniques (11). Selon le cadre conceptuel de la MA préclinique proposé en 2010 et modifié en 2013 (11,21), le stade initial est caractérisé par une positivité du biomarqueur amyloïde (Aβ), détectée d’abord dans le LCR, puis par imagerie PET/CT amyloïde, en l’absence de signes de lésion neuronale ou de perturbation cognitive. Le stade suivant se définit par la persistance d’une positivité Aβ, accompagnée de signes biologiques de neurodégénérescence induite par l’accumulation de la protéine tau, mais toujours sans manifestation clinique cognitive significative. Enfin, le dernier stade est marqué par l’accumulation d’amyloïde, la présence de biomarqueurs de neurodégénérescence, et l’apparition de troubles cognitifs subtils évoluant progressivement vers un tableau de démence avancée (Fig. 2).
Dans les prochaines sections, nous allons explorer les différents biomarqueurs, leur rôle dans le diagnostic et dans l’évaluation de la progression de la MA.
Marqueurs PET/CT
L’imagerie par PET/CT amyloïde et PET tau permettent non seulement de fournir une classification binaire des résultats (positif vs négatif), mais aussi d’apporter des informations de résolution spatiale, permettant une stadification fondée sur la progression de la distribution des lésions, facilitant non seulement le diagnostic, mais permettant également dans le contexte de la recherche, le suivi de la progression de la MA chez les patients atteints.
PET/CT amyloïde
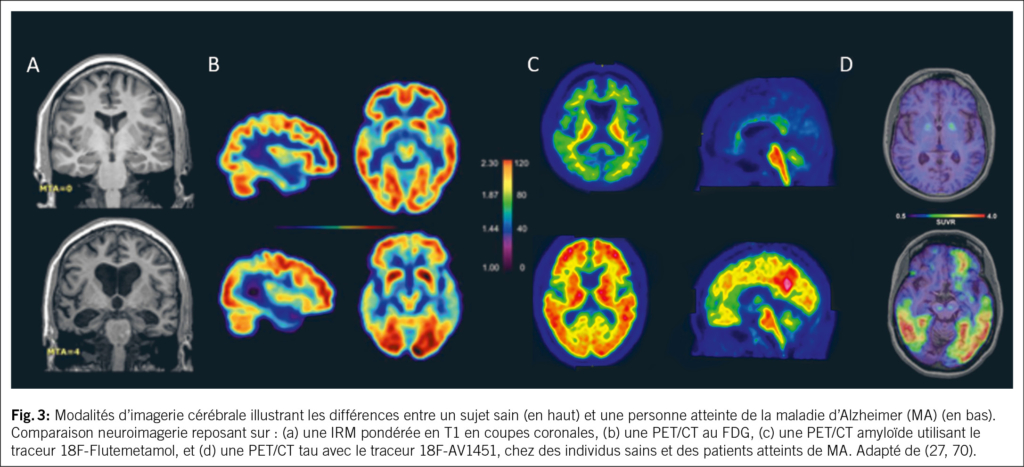
Le PET/CT amyloïde permet la visualisation in vivo des dépôts de plaques amyloïdes à l’aide de traceurs spécifiques. Trois radiotraceurs sont actuellement disponibles en pratique clinique, présentant des performances diagnostiques comparables : le ¹⁸F-florbétapir (22), le ¹⁸F-flutémétamol (23) et le ¹⁸F-florbétabène (24). Le PET/CT amyloïde représente aujourd’hui le biomarqueur le plus rigoureusement validé pour identifier les dépôts d’Aβ, avec une haute précision. En effet, les études corrélant l’imagerie PET/CT amyloïde aux données d’autopsie retrouvent une sensibilité de 91-98% et une spécificité de 87-100 % (22–24). La séquence d’accumulation régionale de l’Aβ, représentée par la distribution du radiotraceurs, indique une accumulation initiale dans les cortex d’association médians du néocortex, tels que le cortex préfrontal médian, le cingulaire postérieur et le précuneus, suivie par les régions sensori-motrices (Fig. 3) (25–27). De plus, une alternative à la stadification topographique de la pathologie Aβ est la mesure de la charge amyloïde globale via l’échelle Centiloid, qui permet d’harmoniser les rapports de fixation standardisés (SUVR) du PET/CT amyloïde entre différents traceurs (28). Un score de 0 correspond à des sujets jeunes Aβ-négatifs, et 100 à des patients atteints de MA légère à modérée. La positivité amyloïde est généralement définie autour de 20–25 Centiloids, seuil à partir duquel les dépôts deviennent significatifs (28, 29). Malgré les nombreux avantages énumérés ci-dessus, cette technique présente également certaines limitations. Celles-ci incluent les difficultés de standardisation et de reproductibilité entre les différents radiotraceurs, cohortes et méthodes analytiques (30), ainsi que le fait que ces valeurs atteignent un plateau dès les premiers stades symptomatiques de la MA, ce qui peut en limiter l’utilité aux stades cliniques plus avancés (31). De plus, l’utilisation et la disponibilité de cette technique sont également limitées par les coûts élevés.
PET/CT tau
Le PET/CT tau permet de cibler la tauopathie en visualisant les enchevêtrements neurofibrillaires intracellulaires composés de protéine tau hyperphosphorylée (32). Le PET/CT tau fournit non seulement une information binaire (positif ou négatif), mais également des données sur la distribution topographique du radiotraceur, avec des implications à la fois diagnostiques et pronostiques. Il constitue, à ce jour, le seul biomarqueur de la tauopathie dont la distribution anatomique reflète la progression des stades de Braak, tels que décrits dans les études neuro-pathologiques post-mortem (Fig. 3), et il est également celui qui présente la meilleure corrélation avec les symptômes cognitifs (32–37). En raison de sa corrélation avec les manifestations cliniques, le PET/CT tau représente un outil qui pourrait être utilisé pour l’estimation du risque de déclin cognitif. En effet, la présence d’un signal tau néocortical élevé chez des individus asymptomatiques est associée à une probabilité accrue de progression vers une démence, contrairement à une pathologie amyloïde isolée, dont le potentiel évolutif demeure plus limité (35, 38). Toutefois, contrairement au PET/CT amyloïde, cet examen n’est pas encore disponible en pratique clinique courante et reste, pour l’instant, limité au domaine de la recherche.
PET/CT fluorodeoxyglucose
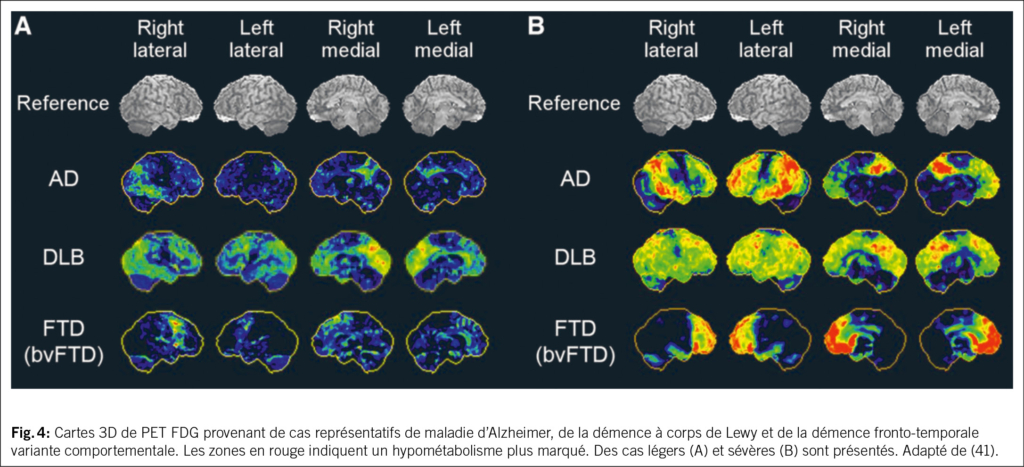
Le PET/CT au fluorodeoxyglucose (FDG) est un biomarqueur qui permet de visualiser l’hypométabolisme régional et donc la dysfonction neuronale, phénomène tardif dans l’histoire naturelle de la MA (11) (Fig. 2). Chez les patients atteints de MA, on observe généralement une réduction bilatérale du métabolisme dans les régions pariétales et temporales médiales, incluant le précunéus (39, 40). Ce profil peut contribuer à distinguer la MA des autres formes de démence, telles que la démence à corps de Lewy ou la démence fronto-temporale, qui présentent des profils de neurodégénérescence distincts, associés à une distribution caractéristique du radiotraceur (39, 41) (Fig. 3–4).
Autres traceurs
D’autres traceurs PET/CT sont en cours d’investigation, notamment ceux ciblant la densité synaptique (via la protéine SV2A) (42–44) ou la neuro-inflammation (45, 46). Bien que ces outils ne soient pas encore utilisés en pratique clinique, ils pourraient néanmoins jouer un rôle important dans le futur dans l’évaluation du stade de la maladie et de son pronostic.
Marqueurs d’imagerie par résonance magnétique
L’imagerie par résonance magnétique (IRM) structurelle constitue un biomarqueur de la MA permettant de visualiser l’atrophie cérébrale et la perte de volume associées à la neurodégénérescence (47). L’échelle visuelle de Scheltens permet de graduer l’atrophie du lobe temporal mésial (MTA), une région précocement touchée dans la forme typique de la MA, à partir de coupes coronales d’IRM pondérées en T1, selon une échelle ordinale allant de MTA 0 à 4 (Fig. 3) (48). Les altérations détectées à l’IRM correspondent à celles mises en évidence par le PET/CT FDG, mais apparaissent généralement à un stade plus avancé de l’évolution de la maladie. Par ailleurs, les scores obtenus aux tests neuropsychologiques ciblant la mémoire chez les patients présentant un syndrome amnésique ont montré une corrélation significative avec le volume hippocampique évalué par IRM (49). Des techniques plus avancées d’IRM, telles que l’IRM de diffusion, l’IRM fonctionnelle, permettent d’explorer des dimensions complémentaires telles que l’état de la substance blanche et la connectivité cérébrale (50–52). Bien qu’elles ne soient pas encore intégrées à la pratique clinique, leur rôle pourrait devenir essentiel dans le futur.
Biomarqueurs du liquide céphalorachidien
Les biomarqueurs de la MA dans le LCR représentent une alternative aux techniques d’imagerie pour la stadiation in vivo de la MA avec une bonne corrélation avec la pathologie amyloïde et tau, les résultats PET/CT, ainsi qu’avec le diagnostic et le pronostic clinique (53, 54). Les biomarqueurs du LCR utilisé couramment dans la pratique clinique comprennent l’Aβ42, Aβ40, p-tau181, p-tau231 et t-tau. Une diminution de la concentration de Aβ42, ainsi qu’un abaissement du ratio Aβ42/Aβ40, est fortement associée à la présence de plaques amyloïdes (55). Les taux de t-tau et de p-tau181 et p-tau231 sont corrélés à la gravité de la neurodégénérescence et au développement des enchevêtrements neurofibrillaires respectivement (56, 57). Contrairement à l’imagerie, qui reflète l’accumulation pathologique dans le temps, les biomarqueurs fluides renseignent sur l’état biologique dynamique au moment du prélèvement (production, libération, clairance) (58, 59). Certaines études suggèrent qu’ils permettent de détecter plus précocement la pathologie amyloïde du PET/CT amyloïde (60, 61). En plus de leur intérêt diagnostique, les biomarqueurs fluides offrent des avantages logistiques notables, tels qu’un coût réduit, une mise en œuvre simplifiée et la possibilité d’analyser plusieurs marqueurs simultanément à partir d’un seul échantillon. Toutefois, l’un des aspects critiques de ces biomarqueurs réside dans la variabilité des seuils définissant la distinction entre des valeurs normales et pathologiques, en fonction des méthodes analytiques utilisées et de l’hétérogénéité des procédures de manipulation des échantillons, malgré les tentatives de standardisation des dosages (62, 63).
Biomarqueurs sanguins
Les biomarqueurs sanguins représentent une avancée prometteuse en raison de leur accessibilité. Le ratio plasmatique Aβ42/40, ainsi que les dosages de p-tau181, p-tau217 et p-tau231, ont montré une bonne corrélation avec les concentrations LCR et les résultats du PET/CT (64–66). Ces marqueurs pourraient, dans un avenir proche, permettre d’évaluer le profil de risque individuel et servir d’outils de dépistage ou de triage pour orienter les patients vers une évaluation neurocognitive plus poussée (65, 67). Notons que de grandes études validant leur utilisation dans la population générale sont encore nécessaires afin de confirmer leur utilité clinique. Les biomarqueurs plasmatiques n’ont pas encore été approuvés pour l’utilisation dans la pratique clinique mais devraient l’être dans l’année à venir.
Intégration des biomarqueurs dans la pratique clinique
Face au nombre de biomarqueurs de la MA aujourd’hui disponibles, des incertitudes peuvent subsister quant à la séquence optimale de leur utilisation et leur interprétation dans la pratique clinique. Dans cette perspective, des recommandations européennes ont été établies afin de proposer un parcours diagnostique structuré, permettant aux spécialistes de sélectionner les biomarqueurs les plus pertinents en fonction du contexte, afin d’optimiser l’évaluation des troubles cognitifs (68). Ce parcours s’articule en plusieurs étapes : il débute par une évaluation clinique visant à exclure les causes secondaires et à établir un diagnostic syndromique fondé sur les caractéristiques cognitives et les données d’imagerie structurelle par IRM ou CT. Ces syndromes orientent ensuite le choix des biomarqueurs de deuxième ligne. Le diagnostic est considéré comme causal lorsque les biomarqueurs permettent de confirmer la pathologie moléculaire sous-jacente, comme l’amyloïdose ou la tauopathie dans la MA. Ce parcours souligne également qu’un diagnostic fondé exclusivement sur les biomarqueurs, en l’absence d’évaluation clinique, peut s’avérer inapproprié. En effet, la progression de la MA varie considérablement d’un individu à l’autre, en raison de facteurs comme la réserve cognitive, la résilience ou la résistance cérébrale (2). De plus, l’interprétation des biomarqueurs, notamment chez les sujets asymptomatiques, mais positifs, nécessite un accompagnement adapté, car un résultat positif ne prédit pas systématiquement l’apparition de symptômes (69).
Conclusion
L’intégration des biomarqueurs dans le diagnostic de la MA a profondément transformé la pratique clinique, en permettant une détection plus précoce, une meilleure caractérisation des stades de la maladie et une orientation thérapeutique plus ciblée. Leur utilisation conjointe à l’évaluation clinique favorise une approche diagnostique plus précise et personnalisée. Toutefois, leur interprétation nécessite prudence et contextualisation, notamment face à la variabilité interindividuelle. Parmi les avancées récentes, les biomarqueurs plasmatiques constituent une innovation majeure, en raison de leur accessibilité et de leur potentiel à élargir l’accès au diagnostic biologique. Ils pourraient devenir des outils efficaces de dépistage ou de triage. Néanmoins, leur utilisation hors contexte clinique spécifique soulève encore certaines réserves, notamment en l’absence de validation à large échelle dans la population générale. À terme, l’optimisation de l’accessibilité des biomarqueurs existants et émergents, leur standardisation et leur intégration dans des parcours diagnostiques harmonisés permettront d’améliorer le diagnostic, le suivi et la prise en charge globale des patients atteints ou à risque de MA.
Copyright
Aerzteverlag medinfo AG
Centre de la Mémoire
Service de réadaptation et gériatrie,
Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 6
1205 Genève
Centre de la Mémoire
Service de réadaptation et gériatrie,
Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 6
1205 Genève
Les auteurs n’ont pas déclaré de conflit d’intérêts en rapport avec cet article.
1. DeTure MA, Dickson DW. The neuropathological diagnosis of Alzheimer’s disease. Mol Neurodegener. 2 août 2019;14(1):32.
2. Dubois B, Villain N, Schneider L, Fox N, Campbell N, Galasko D, et al. Alzheimer Disease as a Clinical-Biological Construct—An International Working Group Recommendation. JAMA Neurol. 1 déc 2024;81(12):1304‑11.
3. Graff-Radford J, Yong KXX, Apostolova LG, Bouwman FH, Carrillo M, Dickerson BC, et al. New insights into atypical Alzheimer’s disease in the era of biomarkers. Lancet Neurol. mars 2021;20(3):222‑34.
4. Beach TG, Monsell SE, Phillips LE, Kukull W. Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. avr 2012;71(4):266‑73.
5. Therriault J, Pascoal TA, Benedet AL, Tissot C, Savard M, Chamoun M, et al. Frequency of Biologically Defined Alzheimer Disease in Relation to Age, Sex, APOE ε4, and Cognitive Impairment. Neurology. 16 févr 2021;96(7):e975‑85.
6. World Health Organization. Fact sheet: dementia. [Internet]. [cité 28 mars 2025]. Disponible sur: https://www.who.int/news-room/fact-sheets/detail/dementia
7. Global, regional, and national burden of disorders affecting the nervous system, 1990-2021: a systematic analysis for the Global Burden of Disease Study 2021. Lancet Neurol. avr 2024;23(4):344‑81.
8. Li X, Feng X, Sun X, Hou N, Han F, Liu Y. Global, regional, and national burden of Alzheimer’s disease and other dementias, 1990-2019. Front Aging Neurosci. 2022;14:937486.
9. GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. févr 2022;7(2):e105‑25.
10. Alzheimer’s disease international. Dementia: facts and figures. [Internet]. [cité 28 mars 2025]. Disponible sur: https://www.alzint.org/about/dementia-facts-figures/
11. Jack CR, Knopman DS, Jagust WJ, Shaw LM, Aisen PS, Weiner MW, et al. Hypothetical model of dynamic biomarkers of the Alzheimer’s pathological cascade. Lancet Neurol. janv 2010;9(1):119‑28.
12. Bjerke M, Engelborghs S. Cerebrospinal Fluid Biomarkers for Early and Differential Alzheimer’s Disease Diagnosis. J Alzheimers Dis. 62(3):1199‑209.
13. European Medicines Agency: Leqembi recommended for treatment of early Alzheimer’s disease. [Internet]. [cité 14 nov 2024]. Disponible sur: https://www.ema.europa.eu/en/news/leqembi-recommended-treatment-early-alzheimers-disease
14. Dyck CH van, Swanson CJ, Aisen P, Bateman RJ, Chen C, Gee M, et al. Lecanemab in Early Alzheimer’s Disease. N Engl J Med. 4 janv 2023;388(1):9‑21.
15. Rasmussen J, Langerman H. Alzheimer’s Disease – Why We Need Early Diagnosis. Degener Neurol Neuromuscul Dis. 24 déc 2019;9:123‑30.
16. Birks J. Cholinesterase inhibitors for Alzheimer’s disease. Cochrane Database Syst Rev. 25 janv 2006;2006(1):CD005593.
17. Kishi T, Matsunaga S, Oya K, Nomura I, Ikuta T, Iwata N. Memantine for Alzheimer’s Disease: An Updated Systematic Review and Meta-analysis. J Alzheimers Dis JAD. 2017;60(2):401‑25.
18. Dementia prevention, intervention, and care: 2024 report of the Lancet standing Commission – The Lancet [Internet]. [cité 13 avr 2025]. Disponible sur: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(24)01296-0/fulltext
19. Altomare D, Molinuevo JL, Ritchie C, Ribaldi F, Carrera E, Dubois B, et al. Brain Health Services: organization, structure, and challenges for implementation. A user manual for Brain Health Services—part 1 of 6. Alzheimers Res Ther. 11 oct 2021;13(1):168.
20. Jack CR, Bennett DA, Blennow K, Carrillo MC, Feldman HH, Frisoni GB, et al. A/T/N: An unbiased descriptive classification scheme for Alzheimer disease biomarkers. Neurology. 2 août 2016;87(5):539‑47.
21. Jack CR, Knopman DS, Jagust WJ, Petersen RC, Weiner MW, Aisen PS, et al. Tracking pathophysiological processes in Alzheimer’s disease: an updated hypothetical model of dynamic biomarkers. Lancet Neurol. 1 févr 2013;12(2):207‑16.
22. Clark CM, Pontecorvo MJ, Beach TG, Bedell BJ, Coleman RE, Doraiswamy PM, et al. Cerebral PET with florbetapir compared with neuropathology at autopsy for detection of neuritic amyloid-β plaques: a prospective cohort study. Lancet Neurol. août 2012;11(8):669‑78.
23. Salloway S, Gamez JE, Singh U, Sadowsky CH, Villena T, Sabbagh MN, et al. Performance of [18F]flutemetamol amyloid imaging against the neuritic plaque component of CERAD and the current (2012) NIA-AA recommendations for the neuropathologic diagnosis of Alzheimer’s disease. Alzheimers Dement Amst Neth. 2017;9:25‑34.
24. Sabri O, Sabbagh MN, Seibyl J, Barthel H, Akatsu H, Ouchi Y, et al. Florbetaben PET imaging to detect amyloid beta plaques in Alzheimer’s disease: phase 3 study. Alzheimers Dement J Alzheimers Assoc. août 2015;11(8):964‑74.
25. Fantoni E, Collij L, Lopes Alves I, Buckley C, Farrar G, AMYPAD consortium. The Spatial-Temporal Ordering of Amyloid Pathology and Opportunities for PET Imaging. J Nucl Med Off Publ Soc Nucl Med. févr 2020;61(2):166‑71.
26. Mattsson N, Palmqvist S, Stomrud E, Vogel J, Hansson O. Staging β-Amyloid Pathology With Amyloid Positron Emission Tomography. JAMA Neurol. 1 nov 2019;76(11):1319‑29.
27. Matsuda H, Ito K, Ishii K, Shimosegawa E, Okazawa H, Mishina M, et al. Quantitative Evaluation of 18F-Flutemetamol PET in Patients With Cognitive Impairment and Suspected Alzheimer’s Disease: A Multicenter Study. Front Neurol [Internet]. 13 janv 2021 [cité 17 avr 2025];11. Disponible sur: https://www.frontiersin.org https://www.frontiersin.org/journals/neurology/articles/10.3389/fneur.2020.578753/full
28. Klunk WE, Koeppe RA, Price JC, Benzinger T, Devous MD, Jagust W, et al. The Centiloid Project: Standardizing Quantitative Amyloid Plaque Estimation by PET. Alzheimers Dement J Alzheimers Assoc. janv 2015;11(1):1-15.e4.
29. Pemberton HG, Collij LE, Heeman F, Bollack A, Shekari M, Salvadó G, et al. Quantification of amyloid PET for future clinical use: a state-of-the-art review. Eur J Nucl Med Mol Imaging. août 2022;49(10):3508‑28.
30. Fantoni E, Collij L, Alves IL, Buckley C, Farrar G. The Spatial-Temporal Ordering of Amyloid Pathology and Opportunities for PET Imaging. J Nucl Med. 1 févr 2020;61(2):166‑71.
31. Jack CR, Wiste HJ, Lesnick TG, Weigand SD, Knopman DS, Vemuri P, et al. Brain β-amyloid load approaches a plateau. Neurology. 5 mars 2013;80(10):890‑6.
32. Macedo AC, Tissot C, Therriault J, Servaes S, Wang YT, Fernandez-Arias J, et al. The Use of Tau PET to Stage Alzheimer Disease According to the Braak Staging Framework. J Nucl Med Off Publ Soc Nucl Med. août 2023;64(8):1171‑8.
33. St-Onge F, Chapleau M, Breitner JCS, Villeneuve S, Pichet Binette A. Tau accumulation and its spatial progression across the Alzheimer’s disease spectrum. Brain Commun. 2024;6(1):fcae031.
34. Johnson KA, Schultz A, Betensky RA, Becker JA, Sepulcre J, Rentz D, et al. Tau positron emission tomographic imaging in aging and early Alzheimer disease. Ann Neurol. janv 2016;79(1):110‑9.
35. Macedo AC, Durço DFPA, Tissot C, Therriault J, Vilela de Faria AO, Aumont É, et al. Clinical Correlates of the PET-based Braak Staging Framework in Alzheimer’s Disease. J Prev Alzheimers Dis. 2024;11(2):414‑21.
36. Ossenkoppele R, Smith R, Mattsson-Carlgren N, Groot C, Leuzy A, Strandberg O, et al. Accuracy of Tau Positron Emission Tomography as a Prognostic Marker in Preclinical and Prodromal Alzheimer Disease: A Head-to-Head Comparison Against Amyloid Positron Emission Tomography and Magnetic Resonance Imaging. JAMA Neurol. 1 août 2021;78(8):961‑71.
37. Rullmann M, Brendel M, Schroeter ML, Saur D, Levin J, Perneczky RG, et al. Multicenter 18F-PI-2620 PET for In Vivo Braak Staging of Tau Pathology in Alzheimer’s Disease. Biomolecules. 16 mars 2022;12(3):458.
38. Ossenkoppele R, Pichet Binette A, Groot C, Smith R, Strandberg O, Palmqvist S, et al. Amyloid and tau PET-positive cognitively unimpaired individuals are at high risk for future cognitive decline. Nat Med. nov 2022;28(11):2381‑7.
39. Minoshima S, Cross D, Thientunyakit T, Foster NL, Drzezga A. 18F-FDG PET Imaging in Neurodegenerative Dementing Disorders: Insights into Subtype Classification, Emerging Disease Categories, and Mixed Dementia with Copathologies. J Nucl Med Off Publ Soc Nucl Med. juin 2022;63(Suppl 1):2S-12S.
40. Chételat G, Arbizu J, Barthel H, Garibotto V, Law I, Morbelli S, et al. Amyloid-PET and 18F-FDG-PET in the diagnostic investigation of Alzheimer’s disease and other dementias. Lancet Neurol. 1 nov 2020;19(11):951‑62.
41. Minoshima S, Cross D, Thientunyakit T, Foster NL, Drzezga A. 18F-FDG PET Imaging in Neurodegenerative Dementing Disorders: Insights into Subtype Classification, Emerging Disease Categories, and Mixed Dementia with Copathologies. J Nucl Med. 1 juin 2022;63(Supplement 1):2S-12S.
42. Snellman A, Tuisku J, Koivumäki M, Wahlroos S, Aarnio R, Rajander J, et al. SV2A PET shows hippocampal synaptic loss in cognitively unimpaired APOE ε4/ε4 homozygotes. Alzheimers Dement J Alzheimers Assoc. déc 2024;20(12):8802‑13.
43. Mecca AP, Chen MK, O’Dell RS, Naganawa M, Toyonaga T, Godek TA, et al. In vivo measurement of widespread synaptic loss in Alzheimer’s disease with SV2A PET. Alzheimers Dement J Alzheimers Assoc. juill 2020;16(7):974‑82.
44. Bavarsad MS, Grinberg LT. SV2A PET imaging in human neurodegenerative diseases. Front Aging Neurosci. 2024;16:1380561.
45. Zhou R, Ji B, Kong Y, Qin L, Ren W, Guan Y, et al. PET Imaging of Neuroinflammation in Alzheimer’s Disease. Front Immunol. 16 sept 2021;12:739130.
46. Werry EL, Bright FM, Piguet O, Ittner LM, Halliday GM, Hodges JR, et al. Recent Developments in TSPO PET Imaging as A Biomarker of Neuroinflammation in Neurodegenerative Disorders. Int J Mol Sci. 28 juin 2019;20(13):3161.
47. Hampel H, Cummings J, Blennow K, Gao P, Jack CR, Vergallo A. Developing the ATX(N) classification for use across the Alzheimer disease continuum. Nat Rev Neurol. sept 2021;17(9):580‑9.
48. Visual rating and volumetry of the medial temporal lobe on magnetic resonance imaging in dementia: a comparative study | Journal of Neurology, Neurosurgery & Psychiatry [Internet]. [cité 13 avr 2025]. Disponible sur: https://jnnp.bmj.com/content/69/5/630
49. Sarazin M, Chauviré V, Gerardin E, Colliot O, Kinkingnéhun S, de Souza LC, et al. The amnestic syndrome of hippocampal type in Alzheimer’s disease: an MRI study. J Alzheimers Dis JAD. 2010;22(1):285‑94.
50. Feng F, Huang W, Meng Q, Hao W, Yao H, Zhou B, et al. Altered Volume and Structural Connectivity of the Hippocampus in Alzheimer’s Disease and Amnestic Mild Cognitive Impairment. Front Aging Neurosci. 2021;13:705030.
51. Gyebnár G, Szabó Á, Sirály E, Fodor Z, Sákovics A, Salacz P, et al. What can DTI tell about early cognitive impairment? – Differentiation between MCI subtypes and healthy controls by diffusion tensor imaging. Psychiatry Res Neuroimaging. 28 févr 2018;272:46‑57.
52. Eyler LT, Elman JA, Hatton SN, Gough S, Mischel AK, Hagler DJ, et al. Resting State Abnormalities of the Default Mode Network in Mild Cognitive Impairment: A Systematic Review and Meta-Analysis. J Alzheimers Dis JAD. 2019;70(1):107‑20.
53. Olsson B, Lautner R, Andreasson U, Öhrfelt A, Portelius E, Bjerke M, et al. CSF and blood biomarkers for the diagnosis of Alzheimer’s disease: a systematic review and meta-analysis. Lancet Neurol. juin 2016;15(7):673‑84.
54. Kokkinou M, Beishon LC, Smailagic N, Noel-Storr AH, Hyde C, Ukoumunne O, et al. Plasma and cerebrospinal fluid ABeta42 for the differential diagnosis of Alzheimer’s disease dementia in participants diagnosed with any dementia subtype in a specialist care setting. Cochrane Database Syst Rev. 10 févr 2021;2(2):CD010945.
55. Janelidze S, Zetterberg H, Mattsson N, Palmqvist S, Vanderstichele H, Lindberg O, et al. CSF Aβ42/Aβ40 and Aβ42/Aβ38 ratios: better diagnostic markers of Alzheimer disease. Ann Clin Transl Neurol. 1 janv 2016;3(3):154‑65.
56. Wattmo C, Blennow K, Hansson O. Cerebro-spinal fluid biomarker levels: phosphorylated tau (T) and total tau (N) as markers for rate of progression in Alzheimer’s disease. BMC Neurol. 9 janv 2020;20(1):10.
57. Ashton NJ, Benedet AL, Pascoal TA, Karikari TK, Lantero-Rodriguez J, Brum WS, et al. Cerebrospinal fluid p-tau231 as an early indicator of emerging pathology in Alzheimer’s disease. EBioMedicine. févr 2022;76:103836.
58. Patterson BW, Elbert DL, Mawuenyega KG, Kasten T, Ovod V, Ma S, et al. Age and Amyloid Effects on Human CNS Amyloid-Beta Kinetics. Ann Neurol. sept 2015;78(3):439‑53.
59. Spies PE, Verbeek MM, van Groen T, Claassen JAHR. Reviewing reasons for the decreased CSF Abeta42 concentration in Alzheimer disease. Front Biosci Landmark Ed. 1 juin 2012;17(6):2024‑34.
60. Palmqvist S, Mattsson N, Hansson O, Alzheimer’s Disease Neuroimaging Initiative. Cerebrospinal fluid analysis detects cerebral amyloid-β accumulation earlier than positron emission tomography. Brain J Neurol. avr 2016;139(Pt 4):1226‑36.
61. Schindler SE, Bollinger JG, Ovod V, Mawuenyega KG, Li Y, Gordon BA, et al. High-precision plasma β-amyloid 42/40 predicts current and future brain amyloidosis. Neurology. 22 oct 2019;93(17):e1647‑59.
62. Vanderstichele H, Bibl M, Engelborghs S, Le Bastard N, Lewczuk P, Molinuevo JL, et al. Standardization of preanalytical aspects of cerebrospinal fluid biomarker testing for Alzheimer’s disease diagnosis: a consensus paper from the Alzheimer’s Biomarkers Standardization Initiative. Alzheimers Dement J Alzheimers Assoc. janv 2012;8(1):65‑73.
63. Perret-Liaudet A, Pelpel M, Tholance Y, Dumont B, Vanderstichele H, Zorzi W, et al. Risk of Alzheimer’s disease biological misdiagnosis linked to cerebrospinal collection tubes. J Alzheimers Dis JAD. 2012;31(1):13‑20.
64. Teunissen CE, Verberk IMW, Thijssen EH, Vermunt L, Hansson O, Zetterberg H, et al. Blood-based biomarkers for Alzheimer’s disease: towards clinical implementation. Lancet Neurol. janv 2022;21(1):66‑77.
65. Hansson O, Blennow K, Zetterberg H, Dage J. Blood biomarkers for Alzheimer’s disease in clinical practice and trials. Nat Aging. mai 2023;3(5):506‑19.
66. Varesi A, Carrara A, Pires VG, Floris V, Pierella E, Savioli G, et al. Blood-Based Biomarkers for Alzheimer’s Disease Diagnosis and Progression: An Overview. Cells. 17 avr 2022;11(8):1367.
67. Hampel H, Hu Y, Cummings J, Mattke S, Iwatsubo T, Nakamura A, et al. Blood-based biomarkers for Alzheimer’s disease: Current state and future use in a transformed global healthcare landscape. Neuron. 20 sept 2023;111(18):2781‑99.
68. Frisoni GB, Festari C, Massa F, Cotta Ramusino M, Orini S, Aarsland D, et al. European intersocietal recommendations for the biomarker-based diagnosis of neurocognitive disorders. Lancet Neurol. mars 2024;23(3):302‑12.
69. Brookmeyer R, Abdalla N. Estimation of lifetime risks of Alzheimer’s disease dementia using biomarkers for preclinical disease. Alzheimers Dement J Alzheimers Assoc. août 2018;14(8):981‑8.
70. Imaging Techniques in Alzheimer’s Disease: A Review of Applications in Early Diagnosis and Longitudinal Monitoring [Internet]. [cité 17 avr 2025]. Disponible sur: https://www.mdpi.com/1422-0067/22/4/2110
la gazette médicale
- Vol. 14
- Ausgabe 4
- Juni 2025