- Katheterablation bei Vorhofflimmern – State of the Art 2025
Die Katheterablation ist eine etablierte Therapie für Vorhofflimmern (VHF), insbesondere bei paroxysmalem VHF, und wird durch die 2024 ESC-Leitlinien im Rahmen des AF-CARE-Ansatzes unterstützt, der Komorbiditätenmanagement, Schlaganfallprophylaxe, Rhythmus- und Frequenzkontrolle sowie regelmässige Reevaluation integriert. Die Pulmonalvenenisolation (PVI) bleibt der Goldstandard, wobei neuere Ablations-Technologien wie die Pulsed-Field-Ablation (PFA) hohe Erfolgsquoten und ein potentiell verbessertes Sicherheitsprofil bieten. Multiple Studien belegen die Überlegenheit der Ablation gegenüber medikamentöser Therapie in Bezug auf Symptomkontrolle und Lebensqualität. Dieser Artikel liefert eine evidenzbasierte Übersicht über Indikationen, Techniken, Energieformen und Langzeitergebnisse der Katheterablation.
Catheter ablation is a well-established therapy for symptomatic atrial fibrillation (AF), particularly in paroxysmal AF, supported by the 2024 ESC Guidelines through the AF-CARE approach, which integrates comorbidity management, stroke prevention, rhythm and rate control, and regular reevaluation. Pulmonary vein isolation (PVI) remains the gold standard, with emerging technologies like pulsed-field ablation (PFA) offering high success rates and potentially improved safety. Multiple studies confirm ablation’s superiority over pharmacological therapy for symptom control and quality of life. This article provides an evidence-based overview of indications, techniques, energy forms, and long-term outcomes of catheter ablation, updated with the latest research findings up to January 2025.
Keywords: Vorhofflimmern, Katheterablation, Pulmonalvenenisolation, ESC-Leitlinien 2024, Pulsed-Field-Ablation
Einleitung
Vorhofflimmern (VHF) ist die häufigste anhaltende Herzrhythmusstörung weltweit und mit einem erhöhten Risiko für Schlaganfall, Herzinsuffizienz, reduzierte Lebensqualität und erhöhte Mortalität verbunden. Die 2024 ESC-Leitlinien betonen den patientenzentrierten AF-CARE-Ansatz und fördern die Katheterablation als effektive Methode zur Rhythmuskontrolle, insbesondere bei zunehmender Evidenz für verbesserte Patientenoutcomes (1). Dieser Artikel bietet eine aktuelle, evidenzbasierte Übersicht über den Stand der Katheterablation unter Berücksichtigung neuester technologischer Entwicklungen und Studienergebnisse.
Der AF-CARE-Ansatz der ESC-Leitlinien 2024
Die 2024 ESC-Leitlinien implementieren den AF-CARE-Pfad zur Optimierung des VHF-Managements (1):
• Comorbidities: Kontrolle von Risikofaktoren wie Hypertonie, Diabetes, Bewegungsmangel und Adipositas. Ein gutes Risikofaktorenmanagement verbessert potentiell die Resultate einer Katheterablation.
• Avoidance of stroke: Antikoagulation basierend auf dem CHA₂DS₂-VA-Score.
• Rate and rhythm control: Frequenz- und Rhythmuskontrolle mit Katheterablation als zentrale Komponente.
• Evaluation: Regelmässige Reevaluation zur Verbesserung der Langzeitprognose.
Pulmonalvenenisolation: Der Goldstandard
Die Pulmonalvenenisolation (PVI) ist die massgebliche Technik zur Behandlung von VHF, da ektope Trigger aus den Lungenvenen häufig die Ursache darstellen (2). Sie isoliert die Pulmonalvenen elektrisch vom linken Vorhof, wobei die Dauerhaftigkeit der Isolation entscheidend für den Langzeiterfolg ist.
Vorbereitungen vor PVI
Vor der PVI sind gründliche Vorbereitungen unerlässlich. Patienten durchlaufen Anamnese und Untersuchungen wie EKG, Echokardiographie und Bluttests, um Herzfunktion, Vorhofgrösse und Komorbiditäten zu bewerten (1). Die Antikoagulation wird 3–4 Wochen vorab gemäss CHA₂DS₂-VA-Score begonnen, um das Thrombembolierisiko zu minimieren.
Vorgehen bei PVI
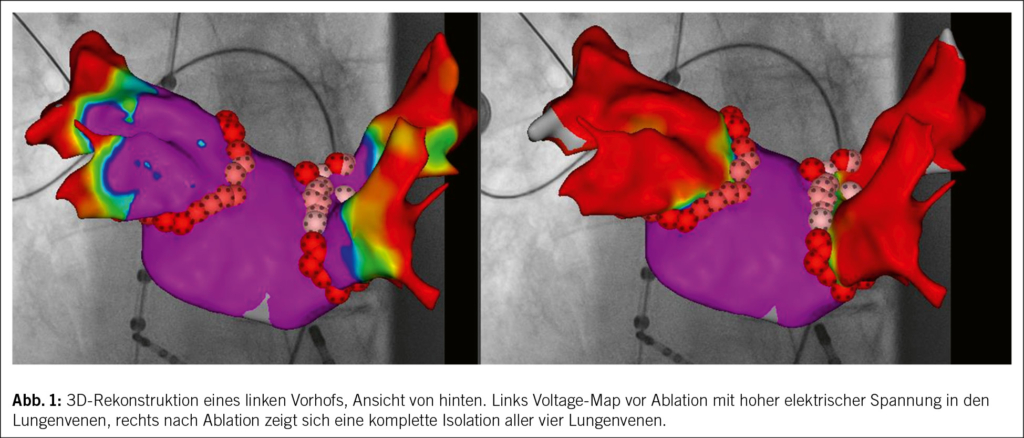
Bei der PVI werden unter Sedierung oder Vollnarkose Katheter über die Vena femoralis nach Transseptalpunktion in den linken Vorhof eingeführt. Mithilfe von 3D-Mapping-Technologie (Abb. 1) werden die Pulmonalvenen präzise lokalisiert, und Energieformen wie Kryo-Ablation, Radiofrequenz (RF) oder Pulsed-Field-Ablation (PFA) isolieren die Venen, um ektope Trigger zu blockieren (2, 4). Die Prozedurdauer variiert zwischen 30 und 90 Minuten, abhängig von Technik und Anatomie (3). Ein stationäres Setting gewährleistet hohe Sicherheit.
Nachsorge nach PVI
Die Nachsorge ist essenziell für die Überwachung von Rezidiven und Komplikationen. Die Antikoagulation wird für mindestens zwei Monate fortgesetzt, unabhängig vom Ablationserfolg, um das Schlaganfallrisiko zu minimieren (1). EKG- und Holter-Monitoring nach 3 und 6 Monaten sowie eine Reevaluation nach 12 Monaten (z. B. via EHRA-Score und evtl. Echokardiographie) sind ratsam.
Indikationen und Patientenauswahl
Die 2024 ESC-Leitlinien geben klare Indikationen für eine Pulmonalvenenisolation (1):
• Paroxysmales VHF: First-Line-Therapie (Klasse I), auch bei asymptomatischen Patienten mit Ziel der Rhythmuskontrolle, mit verbesserter Lebensqualität.
• Therapieversagen von Antiarrhythmika: Etabliert bei paroxysmalem oder persistierendem VHF nach Medikamentenversagen (Klasse I).
• Tachymyopathie: Stark empfohlen bei tachykardieinduzierter Kardiomyopathie (Klasse I), da die Ejektionsfraktion im Sinusrhythmus steigen kann.
• Herzinsuffizienz mit reduzierter Ejektionsfraktion (Klasse IIa).
Bei persistierendem VHF profitieren insbesondere Patienten ohne umfangreiches endokardiales Substrat. Präzises Mapping ist entscheidend für die Patientenauswahl (6). Faktoren wie Alter, Komorbiditäten (z. B. Herzinsuffizienz), VHF-Dauer und Vorhofgrösse beeinflussen den Erfolg, wobei jüngere Patienten mit minimalem Remodeling bessere Ergebnisse zeigen.
Häufigst verwendete Technologien
• Kryo-Ablation: Nutzt Kälte für standardisierte Läsionen mit einer Erfolgsquote von ca. 70–80 % nach 12 Monaten (3, 10).
• Radiofrequenz-Ablation (RFA) inkl. High Power Short Duration (HPSD): Erzeugt durch hochfrequente Wechselströme gezielte Wärme zur Gewebedenaturierung; HPSD verbessert Effizienz mit ca. 80–85 % Erfolg nach 12 Monaten (3).
• Pulsed-Field-Ablation (PFA): Nicht-thermische Methode mit elektrischen Impulsen, die Herzzellen selektiv abtötet, mit ca. 80 % Erfolg nach 12 Monaten und geringem Komplikationsrisiko (4).
Erfolgsraten der Pulmonalvenenisolation
Die Erfolgsraten nach 12 Monaten liegen bei etwa 80 % (5, 6). Die SHAM-PVI-Studie (2024) zeigte eine VHF-Last-Reduktion um 60 % nach PVI versus 35 % in der Kontrolle (6). Die CASTLE-HTx-Studie bestätigt eine Mortalitätsreduktion bei terminaler Herzinsuffizienz (15,5 % vs. 38,1 %) (7). Langfristig sinkt die Erfolgsquote bei Kryo auf 55–60 % nach fünf Jahren (FIRE AND ICE) (8), während PFA 80 % nach zwei Jahren erreicht, wobei Langzeitdaten noch begrenzt sind (9). Meta-Analysen zeigen vergleichbare Erfolge (70–80 % stabiler Sinusrhythmus nach einem Jahr) und ähnliche Komplikationsraten über alle Methoden.
Wahl der Energieform: Evidenz und Langzeitergebnisse
Die Energieformwahl sollte auf VHF-Typ, Anatomie, Sicherheitsprofil und Operatorerfahrung basieren. Obwohl die Hoffnung besteht, dass die PFA-Ablation eine herzmuskelspezifische Behandlung darstellt und dadurch sicherer und schneller sein könnte, zeigt bislang nur eine Studie (10) einen besseren Erfolg im Vergleich zur Kryoablation. Bisher gibt es keine randomisierte Studie, die einen überlegenen Erfolg von PFA gegenüber der Radiofrequenzablation belegt. Bei Redo-Eingriffen und adipösen Patienten erscheint PFA jedoch vielversprechend.
Komplikationen und Unterschiede der Energiemodalitäten
Komplikationen treten in 1–5 % auf, darunter Perikardtamponade (1–2 %), Schlaganfall (0.5–1 %) und Phrenikusnervlähmung (1 %). PFA weist eine niedrigere Rate an PV-Stenose, atrioösophagealen Fisteln und Phrenikuslähmungen auf im Vergleich zu thermischen Verfahren.
Zukunftsperspektiven
Wahrscheinlich wird die PFA-Ablation den Elektrophysiologie-Markt aufgrund ihrer Einfachheit für neue Operateur*innen und der Hoffnung auf höhere Sicherheit allmählich dominieren. Es bleibt jedoch unklar, ob wir nur mit einer neuen Technologie, ohne bessere Kenntnis der Pathophysiologie, auch die Erfolgsraten bei persistierendem Vorhofflimmern verbessern werden. Die Kombination von PFA und RF-Energie, vereint in einem System bzw. Katheter, wird es erlauben, eine auf den Patienten abgestimmte Ablationstechnik anzuwenden. Fortschritte in 3D-Mapping und Robotik könnten die Präzision steigern, insbesondere bei anatomischen Herausforderungen.
Nachsorge, Langzeitmanagement und Reevaluation
Die Nachsorge umfasst eine 1–2-tägige stationäre Überwachung und Antikoagulation für zwei Monate gemäss CHA₂DS₂-VA-Score (1). EKG- und Holter-Monitoring nach 3, 6 und 12 Monaten sowie jährliche Reevaluation von Symptomen (EHRA-Score) und Risikofaktoren sind essenziell, um Rezidive und Komplikationen frühzeitig zu erkennen.
Copyright
Aerzteverlag medinfo AG
Cardiopuls Medical Center Luzern
Zentralstrasse 1
6003 Luzern
Hirslandenklinik St. Anna
St. Anna-Strasse 32
6006 Luzern
Cardiopuls Medical Center Luzern
Zentralstrasse 1
6003 Luzern
Hirslandenklinik St. Anna
St. Anna-Strasse 32
6006 Luzern
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
Die Katheterablation von Vorhofflimmern ist eine effektive und sichere Therapie für symptomatisches VHF. Der AF-CARE-Ansatz der 2024 ESC-Leitlinien integriert Komorbiditätenmanagement und Rhythmuskontrolle, was zu einer höheren Erfolgsrate der Katheterablation führt. Kryo- und RF-Ablation sind etablierte Verfahren. PFA ist vielversprechend mit potentiell besseren Sicherheitsdaten, wobei längere Langzeitdaten für Kryo und RFA vorliegen. Hausärzte und Internisten spielen eine Schlüsselrolle bei Patientenauswahl, Nachsorge und Optimierung von Begleiterkrankungen.
2. Haïssaguerre M, Jaïs P, Shah DC, Takahashi A, Hocini M, Quiniou G, Garrigue S, Le Mouroux A, Le Métayer P, Clémenty J. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 1998 Sep 3;339(10):659-66. doi: 10.1056/NEJM199809033391003. PMID: 9725923.
3. Tzeis S, Gerstenfeld EP, Kalman J, Saad EB, Sepehri Shamloo A, Andrade JG, Barbhaiya CR, Baykaner T, Boveda S, Calkins H, Chan NY, Chen M, Chen SA, Dagres N, Damiano RJ, De Potter T, Deisenhofer I, Derval N, Di Biase L, Duytschaever M, Dyrda K, Hindricks G, Hocini M, Kim YH, la Meir M, Merino JL, Michaud GF, Natale A, Nault INava S, Nitta T, O’Neill M, Pak HN, Piccini JP, Pürerfellner H, Reichlin T, Saenz LC, Sanders P, Schilling R, Schmidt B, Supple GE, Thomas KL, Tondo C, Verma A, Wan EY. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. J Arrhythm. 2024 Oct 6;40(6):1217-1354. doi: 10.1002/joa3.13082. PMID: 39669937; PMCID: PMC11632303.
4. Reddy VY, Gerstenfeld EP, Natale A, Whang W, Cuoco FA, Patel C, Mountantonakis SE, Gibson DN, Harding JD, Ellis CR, Ellenbogen KA, DeLurgio DB, Osorio J, Achyutha AB, Schneider CW, Mugglin AS, Albrecht EM, Stein KM, Lehmann JW, Mansour M; ADVENT Investigators. Pulsed Field or Conventional Thermal Ablation for Paroxysmal Atrial Fibrillation. N Engl J Med. 2023 Nov 2;389(18):1660-1671. doi: 10.1056/NEJMoa2307291. Epub 2023 Aug 27. PMID: 37634148.
5. O’Neill L, El Haddad M, Berte B, Kobza R, Hilfiker G, Scherr D, Manninger M, Wijnmaalen AP, Trines SA, Wielandts JY, Gillis K, Lycke M, De Becker B, Tavernier R, Le Polain De Waroux JB, Knecht S, Duytschaever M. Very High-Power Ablation for Contiguous Pulmonary Vein Isolation: Results From the Randomized POWER PLUS Trial. JACC Clin Electrophysiol. 2023 Apr;9(4):511-522. doi: 10.1016/j.jacep.2022.10.039. Epub 2023 Jan 18. PMID: 36752467.
6. Dulai R, Sulke N, Freemantle N, Lambiase PD, Farwell D, Srinivasan NT, Tan S, Patel N, Graham A, Veasey RA. Pulmonary Vein Isolation vs Sham Intervention in Symptomatic Atrial Fibrillation: The SHAM-PVI Randomized Clinical Trial. JAMA. 2024 Sep 2;332(14):1165–73. doi: 10.1001/jama.2024.17921. Epub ahead of print. PMID: 39221629; PMCID: PMC11369784.
7. Sohns C, Fox H, Marrouche NF, Crijns HJGM, Costard-Jaeckle A, Bergau L, Hindricks G, Dagres N, Sossalla S, Schramm R, Fink T, El Hamriti M, Moersdorf M, Sciacca V, Konietschke F, Rudolph V, Gummert J, Tijssen JGP, Sommer P; CASTLE HTx Investigators. Catheter Ablation in End-Stage Heart Failure with Atrial Fibrillation. N Engl J Med. 2023 Oct 12;389(15):1380-1389. doi: 10.1056/NEJMoa2306037. Epub 2023 Aug 27. PMID: 37634135.
8. Kuck KH, Brugada J, Fürnkranz A, Metzner A, Ouyang F, Chun KR, Elvan A, Arentz T, Bestehorn K, Pocock SJ, Albenque JP, Tondo C; FIRE AND ICE Investigators. Cryoballoon or Radiofrequency Ablation for Paroxysmal Atrial Fibrillation. N Engl J Med. 2016 Jun 9;374(23):2235-45. doi: 10.1056/NEJMoa1602014. Epub 2016 Apr 4. PMID: 27042964.
9. Reddy VY, Dukkipati SR, Neuzil P, Anic A, Petru J, Funasako M, Cochet H, Minami K, Breskovic T, Sikiric I, Sediva L, Chovanec M, Koruth J, Jais P. Pulsed Field Ablation of Paroxysmal Atrial Fibrillation: 1-Year Outcomes of IMPULSE, PEFCAT, and PEFCAT II. JACC Clin Electrophysiol. 2021 May;7(5):614-627. doi: 10.1016/j.jacep.2021.02.014. Epub 2021 Apr 28. PMID: 33933412.
10. Reichlin T, Kueffer T, Badertscher P, Jüni P, Knecht S, Thalmann G, Kozhuharov N, Krisai P, Jufer C, Maurhofer J, Heg D, Pereira TV, Mahfoud F, Servatius H, Tanner H, Kühne M, Roten L, Sticherling C; SINGLE SHOT CHAMPION Investigators. Pulsed Field or Cryoballoon Ablation for Paroxysmal Atrial Fibrillation. N Engl J Med. 2025 Apr 17;392(15):1497-1507. doi: 10.1056/NEJMoa2502280. Epub 2025 Mar 31. PMID: 40162734.
der informierte @rzt
- Vol. 15
- Ausgabe 8
- August 2025