- Wirksame Prophylaxe bei rezidivierenden Harnwegsinfektionen
Harnwegsinfekte (HWI) gehören zu den häufigsten bakteriellen Infektionen bei Frauen und stellen aufgrund der zunehmenden antimikrobiellen Resistenzen (AMR) eine wachsende Herausforderung dar. Obwohl Antibiotika eine wirksame Therapie darstellen, sind sie mit Risiken wie Resistenzentwicklung, Nebenwirkungen und Störungen des Mikrobioms verbunden. Daher rücken nicht-antibiotische Präventionsstrategien für nicht-komplizierte, rezidivierende HWIs bei nicht-schwangeren Frauen zunehmend in den Fokus. Der Artikel beleuchtet die epidemiologischen Hintergründe, Risikofaktoren in verschiedenen Lebensphasen sowie differenzialdiagnostische Aspekte und stellt evidenzbasierte nicht-antibiotische Massnahmen wie Verhaltensänderungen, lokale Östrogentherapie oder Phytotherapeutika vor.
Urinary tract infections (UTIs) are among the most common bacterial infections in women and represent a growing challenge due to increasing antimicrobial resistance (AMR). Although antibiotics are an effective therapy, they are associated with risks such as development of resistance, side effects and disruption of the microbiome. Therefore, non-antibiotic prevention strategies for non-complicated, recurrent UTIs in non-pregnant women are increasingly coming into focus. The article highlights the epidemiological background, risk factors in different life stages as well as differential diagnostic aspects and presents evidence-based non-antibiotic measures such as behavioral changes, local estrogen therapy or phytotherapeutics.
Keywords: Harnwegsinfekte, Nicht-antibiotische Prophylaxe, Antimikrobielle Resistenzen, Urogenitales Mikrobiom
«Für einen Menschen ist es unmöglich, das zu erlernen, was er bereits zu wissen meint.»
Epiktet, griechischer Philosoph (ca. 50–138 n. Chr.)
Einführung
Antibiotika wirken sowohl beim akuten Harnwegsinfekt (HWI) als auch in der Prophylaxe rezidivierender HWI. Doch angesichts der Zunahme der antimikrobiellen Resistenzen (AMR) und der damit assoziierten Komplikationen sind wirksame Alternativtherapien und eine nicht-antibiotische Prophylaxe notwendig. Im folgenden Artikel sei – Epiktets Einsicht folgend – unser Blick auf in der Schweiz aktuell zur Verfügung stehende, wirksame alternative, nicht-antibiotische Präventionsansätze bei nicht-schwangeren Frauen mit wiederkehrenden nicht-komplizierten Harnwegsinfekten gerichtet. Damit leisten wir auch einen wichtigen Beitrag zur Vermeidung von Antibiotikaresistenzen.
Definition
Ein HWI ist eine Infektion des Urogenitaltrakts mit typischen Symptomen einer Zystitis wie Dysurie, Harndrang, Pollakisurie, suprapubischem Schmerz oder Hämaturie. Beim aufsteigenden Infekt wie Pyelonephritis kommen Flankenschmerzen, Fieber, Übelkeit oder Erbrechen hinzu. Diagnostisch wegweisend sind eine Pyurie und eine positive Urinkultur mit Nachweis eines spezifischen Uropathogens. Ein HWI gilt als kompliziert bei anatomischen oder funktionellen Anomalien, Dauerkatheterisierung, Schwangerschaft oder Nierentransplantation. Rezidivierende HWIs sind mindestens 2 Infektionen innerhalb von 6 Monaten oder mindestens 3 innerhalb von 12 Monaten. Ein erneuter Infekt durch denselben Erreger innerhalb von 2 Wochen nach Therapieende heisst dagegen Relapse. Die Symptome einer idiopathischen überaktiven Blase oder eines Bladder-Pain-Syndroms ähneln gelegentlich einem HWI, was bei fehlender Besserung trotz Antibiotika und unauffälliger Urinanalyse bedacht werden sollte.
Epidemiologie
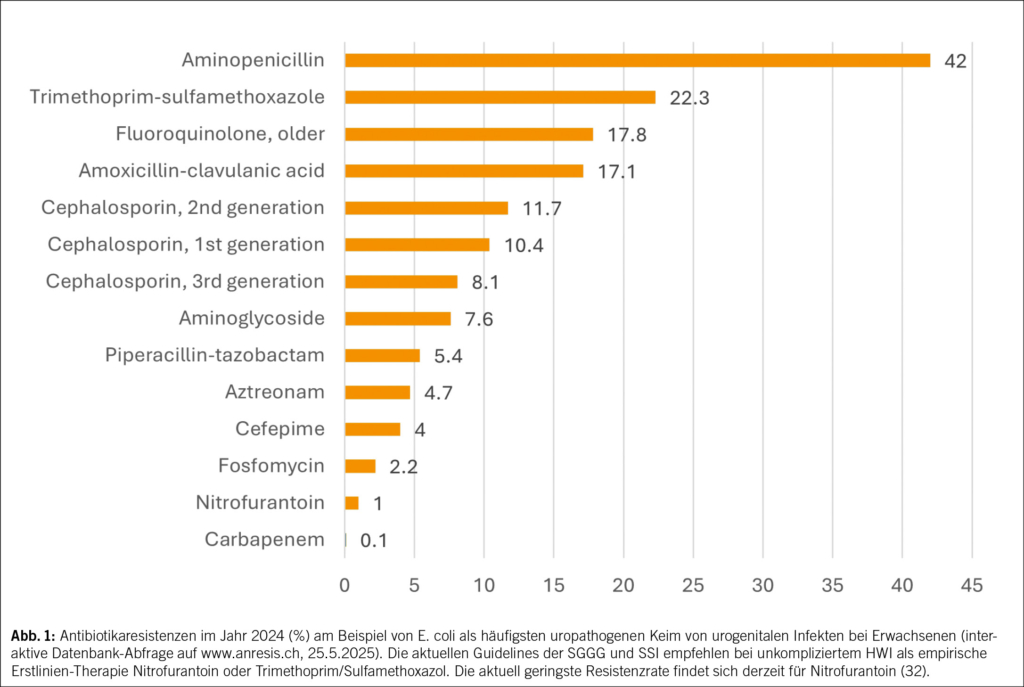
HWI zählen zu den häufigsten bakteriellen Infektionen weltweit und zu den häufigsten bei der Frau: Jede zweite Frau erleidet in ihrem Leben einen HWI und jede vierte mehrere (1). Die erste Häufung fällt mit dem Beginn der sexuellen Aktivität zusammen, und die weiteren stehen im Zusammenhang mit Schwangerschaft und Menopause. 20 % aller Antibiotika im klinischen Alltag werden wegen HWI verordnet (2, 3). Damit lassen sich akute und rezidivierende HWI effizient behandeln, wenn nicht-antibiotische Therapien versagen (4–7). Weltweit übergeordnet steht dagegen eine der grössten medizinischen Herausforderungen: der Anstieg antimikrobieller Resistenzen (AMR) (Abb. 1) mit multiresistenten Erregern und eine dadurch substanzielle Zunahme der Morbidität und Mortalität (8).
Dies beschäftigt auch die World Health Organisation WHO (https://www.who.int/health-topics/antimicrobial-resistance). Mittlerweile ist AMR weltweit eine der häufigsten Todesursachen und übertrifft HIV/AIDS oder Malaria. 2019 schätzte ein Review, dass AMR direkt zu 1.27 Millionen Todesfällen führte und bei weiteren 4.95 Millionen Todesfällen eine Rolle spielte (9). Daher werden dringend neue Antibiotika benötigt, doch Neuzulassungen sind rar.
Antimikrobielle Resistenzen
Erst seit kurzem steht mit Gepotidacin (FDA-Zulassung am 25.3.2025) ein neues Antibiotikum zur Behandlung unkomplizierter Harnwegsinfekte und der Gonorrhoe zur Verfügung (10). Dessen dualer Wirkmechanismus hemmt die bakterielle DNA-Gyrase und die Topoisomerase IV und könnte damit die Entwicklung von Resistenzen reduzieren. Ob dies in vivo funktionieren wird, bleibt abzuwarten. Life finds a way, und so auch die Bakterien. Ob in neue Antibiotika investiert wird oder nicht, ist vor allem ein ökonomischer Entscheid. Doch mit einem rationalen Einsatz können AMR reduziert und unsere Gesundheitssysteme geschützt werden (11). Deshalb hat der Bundesrat am 26. Juni 2024 den One-Health-Aktionsplan im Rahmen seiner Strategie gegen Antibiotikaresistenzen (StAR) 2024–2027 gestartet (12). Ziel ist die Stärkung erfolgreicher Massnahmen und die Umsetzung von StAR mit verbindlichen, innovativen und nachhaltigen Massnahmen in Zusammenarbeit mit den Bundesämtern für Gesundheit, Lebensmittelsicherheit und Veterinärwesen, Landwirtschaft und Umwelt sowie den Kantonen und weiteren Akteuren. Somit sind präventive Massnahmen gegen HWI sinnvoll, um den Antibiotikaverbrauch und die Resistenzentwicklung zu reduzieren. Davon abgesehen ist der Antibiotikaeinsatz auch wegen folgender Nebenwirkungen nachteilig: Häufig treten gastrointestinale Beschwerden oder Vaginalsoor auf, seltener allergische Reaktionen oder, wie unter Nitrofurantoin, eine induzierte Lungenfibrose. Zudem kann die Beeinträchtigung des Mikrobioms von Blase, Scheide und Darm das Risiko für erneute Harnwegsinfektionen und andere Infektionen, wie z. B. mit Clostridioides difficile, erhöhen (4–7, 10) (13, 14). Auch die Nieren- und Leberfunktion der Patientinnen sollte bei einer Antibiotikatherapie berücksichtigt werden, ebenso wie mögliche Wechselwirkungen mit anderen Medikamenten, insbesondere bei älteren Patientinnen mit Polypharmazie. Übrigens endet der antibiotische Schutz erfahrungsgemäss nach Therapieende.
Kann auf Antibiotika verzichtet werden?
Doch wann ist der Einsatz von Antibiotika sinnvoll? Der Nachweis uropathogener Keime in der Urinkultur erfordert jedenfalls ohne Symptome eines HWI (asymptomatische Bakteriurie) ausserhalb von Schwangerschaft oder urologischen Eingriffen meist keine Antibiotikagabe. Auch bei einem nicht-komplizierten HWI kann zumindest bei ausgewählten Patientinnen ohne Vorgeschichte einer Pyelonephritis und bei einer Symptomdauer von maximal 5 Tagen symptomatisch für 48 Stunden ein nicht-antibiotischer Therapieversuch mit erhöhter Hydratation und nichtsteroidalen Entzündungshemmern unternommen werden (Guideline SSI).
Risikofaktoren für rezidivierende HWI
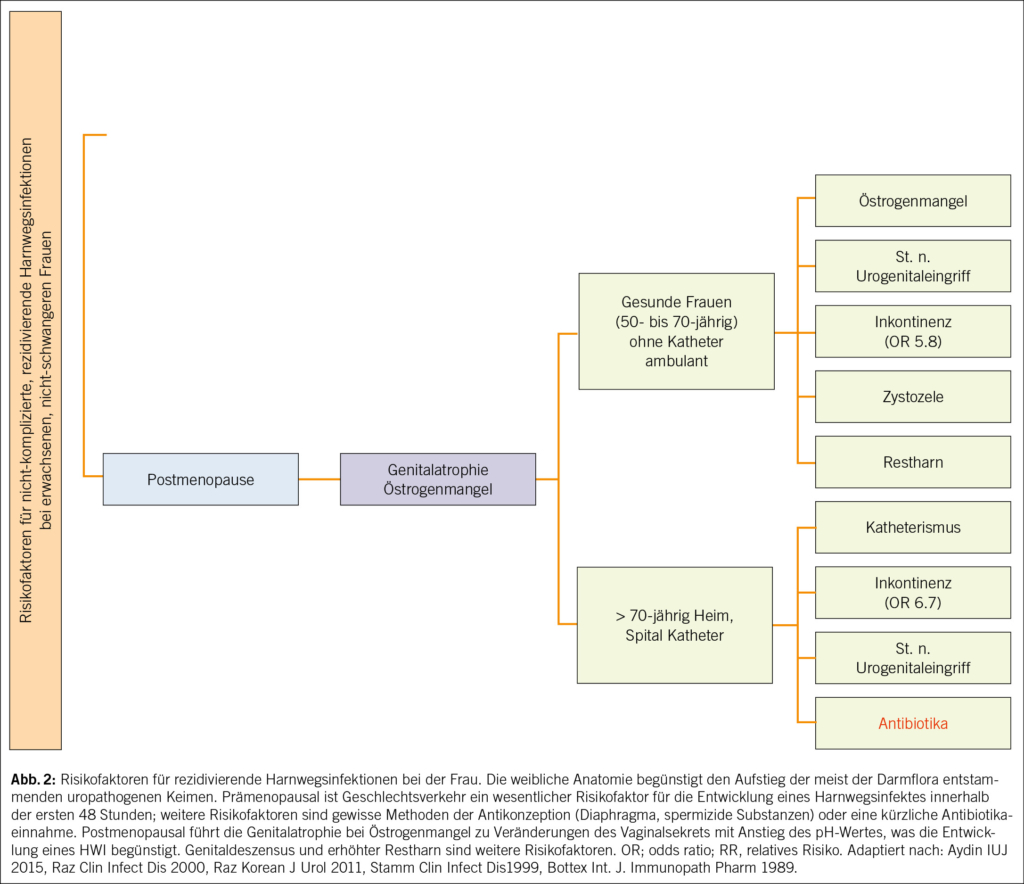
2012 kam es zum Paradigma-Wechsel: Urin ist auch bei gesunden Frauen nicht steril (15, 16). Überhaupt scheinen gewisse E. coli und Enterokokken einen protektiven Effekt zu haben (17). Wenn die antibiotische Therapie also nicht immer zielführend und mitunter kontraproduktiv ist, dann wären nicht-antibiotische Optionen sinnvoll. Ein wichtiger Ansatz ist somit die Reduktion von Risikofaktoren. Diese variieren für Frauen vor und nach der Menopause (Abb. 2).
Zu den anatomischen Risikofaktoren zählen die periurethralen Schleimhäute, die kurze Urethra sowie die Abstände ihrer äusseren Mündung zu Vagina und Anus, was die Exposition gegenüber den meist der Darmflora entstammenden uropathogenen Keimen und deren Aufstieg in die Harnwege und damit HWIs begünstigt (18, 19). Und je kürzer diese Abstände, desto eher kommt es zu Rezidiven. Prämenopausale Risikofaktoren sind v.a. Geschlechtsverkehr, die Anwendung von Spermiziden, ein neuer Sexualpartner, wenn die eigene Mutter rezidivierende HWIs in der Anamnese hat, HWIs in der Kindheit sowie die Behandlung einer asymptomatischen Bakteriurie. Postmenopausale Risikofaktoren sind die atrophe Kolpitis infolge des Östrogenmangels, eine Zystozele und erhöhte Restharnmengen (20). Der Östrogenmangel und das dadurch veränderte Urothel mit verändertem urogenitalem Mikrobiom bzw. «Urobiom» erhöhen das Risiko für HWIs (21, 22). Postmenopausale Frauen mit wiederkehrenden HWIs und täglicher Antibiotikaeinnahme zeigen ein verändertes Urobiom mit vermehrt anaeroben Bakterien im Vergleich zu Frauen ohne HWIs (23). Vermutlich ist aber nicht ein einzelner spezifischer Mikroorganismus im Urobiom mit rezidivierenden HWIs assoziiert, sondern vielmehr ein verändertes Gleichgewicht und Verhältnis bestimmter Lactobacillus-Arten zu den anaeroben Bakterien. Antibiotika beeinflussen das Mikrobiom negativ und erhöhen damit wiederum das Risiko für HWIs. Zukünftige therapeutische Strategien könnten auf die Beeinflussung des Urobioms abzielen.
Diagnostik
Bei rezidivierenden HWIs ist eine gynäkologische oder urogynäkologische Abklärung indiziert. Zur Basisabklärung gehören Anamnese (Beginn der HWIs, auslösende Faktoren, Begleiterkrankungen und Risikofaktoren), die Urinanalyse (Urinteststreifen, Urinsediment sowie Urinkultur mit Resistenzprüfung), die Erhebung des gynäkologischen Status (Beurteilung eines allfälligen Genitaldeszensus, der Trophik und des Nativpräparats) und die (sonographische) Restharnbestimmung. Die Sonographie des Harntrakts dient dem Ausschluss anatomischer Anomalien (Urethraldivertikel, Urolithiasis). Bei Risikofaktoren oder schmerzloser Hämaturie ist eine Zystoskopie im infektfreien Intervall indiziert. Zur Abgrenzung einer überaktiven Blase oder eines Blasenschmerzsyndroms bzw. einer interstitiellen Zystitis dienen die urodynamische Untersuchung und der Uroflow.
Therapie- und Prophylaxeoptionen
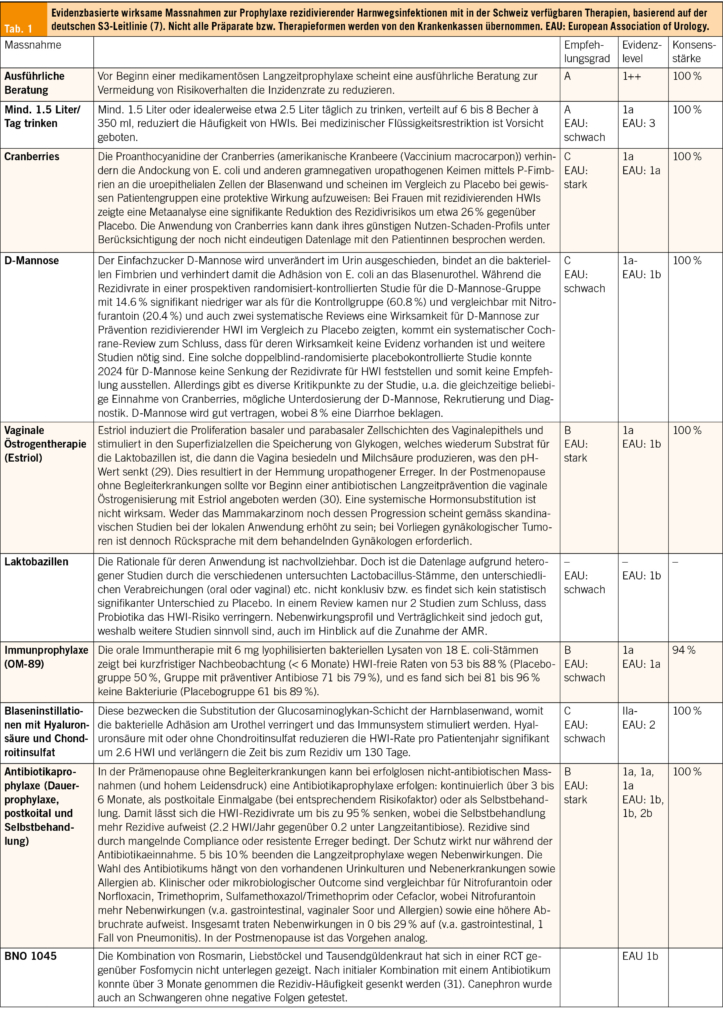
Akute HWIs können nach Möglichkeit in den ersten Tagen symptomatisch und antibiotikafrei behandeln werden (24). Bis zu 50 % der unkomplizierten HWIs heilen damit ab, es dauert dafür einige Tage länger (25, 26). Grosse Angst vor einem aufsteigenden Infekt muss man trotzdem nicht haben: Nur 0.4 bis 2.6 % der unkomplizierten HWIs entwickeln sich unbehandelt zu einer Pyelonephritis (27), welche sich typischerweise mit Fieber oder Flankenschmerzen zeigt. Zur Linderung von Blasenbeschwerden und zur Förderung der Heilung empfiehlt es sich, genügend zu trinken, was die Ausschwemmung der Bakterien begünstigt. Zusätzlich können nichtsteroidale Antirheumatika (NSAR) wie Ibuprofen oder auch Phytotherapeutika helfen (26, 28). Letztlich sind Antibiotika den NSAR bei unkomplizierten Harnwegsinfekten überlegen, da sie auch eine bessere bakterielle Eradikation erzielen. Bei rezidivierenden HWIs wiederum stehen die Prophylaxe und das Erkennen und Reduzieren der Risikofaktoren im Vordergrund. Ausgewählte evidenzbasierte Massnahmen sind in Tab. 1 zusammengefasst.
PD Dr. med. David Scheiner, 1, 2, 3
PD Dr. med. Daniele Perucchini 1
Dr. med. Olivia Ziviello 1
Dr. med. Rebecca Zachariah 2, 3
Dr. med. Sören Lange 2, 3
Dr. med.Nicole Keller 2, 3, 4
Prof. Dr. med. Cornelia Betschart 2, 3
1 Blasenzentrum Zürich, Gottfried Keller-Strasse 7, 8001 Zürich
2 Klinik für Gynäkologie, Universitätsspital Zürich, Frauenklinikstrasse 10, 8091 Zürich
3 Universität Zürich, Rämistrasse 71, 8006 Zürich
4 Gynäkologie und Geburtshilfe, Spital Grabs, Spitalstrasse 44, 9472 Grabs
Copyright
Aerzteverlag medinfo AG
Blasenzentrum Zürich
Gottfried Keller-Strasse 7
8001 Zürich
Klinik für Gynäkologie, Universitätsspital Zürich
Frauenklinikstrasse 10
8091 Zürich
Universität Zürich
Rämistrasse 71
8006 Zürich
Universität Zürich
Rämistrasse 71
8006 Zürich
Die Autorenschaft hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Die wachsende Problematik der Antibiotikaresistenzen erfordert die Anwendung und Entwicklung alternativer, nicht-antibiotischer Ansätze zur Prävention rezidivierender Harnwegsinfektionen.
- Rezidivierende Harnwegsinfektionen sind definiert als mindestens zwei Infektionen innerhalb von sechs Monaten oder drei innerhalb von zwölf Monaten.
- Anatomische und funktionelle Risikofaktoren unterscheiden sich bei prä- und postmenopausalen Frauen und beeinflussen die Anfälligkeit für Harnwegsinfektionen sowie die therapeutischen Massnahmen.
- Bei akuten Harnwegsinfektionen kann zuerst eine symptomatische Behandlung ohne Antibiotika versucht werden.
1. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Am J Med. 2002;113 Suppl 1A:5S-13S.
2. Wawrysiuk S, Naber K, Rechberger T, Miotla P. Prevention and treatment of uncomplicated lower urinary tract infections in the era of increasing antimicrobial resistance-non-antibiotic approaches: a systemic review. Arch Gynecol Obstet. 2019;300(4):821-8.
3. Bevölkerungsumfrage zu Antibiotikaresistenzen 2020. Schlussbericht im Auftrag des Bundesamts für Gesundheit BAG: Demo SCOPE AG; [updated 30.9.2020. Available from: https://www.newsd.admin.ch/newsd/message/attachments/63835.pdf.
4. Ahmed H, Davies F, Francis N, Farewell D, Butler C, Paranjothy S. Long-term antibiotics for prevention of recurrent urinary tract infection in older adults: systematic review and meta-analysis of randomised trials. BMJ Open. 2017;7(5):e015233.
5. Zeng G, Zhu W, Lam W, Bayramgil A. Treatment of urinary tract infections in the old and fragile. World J Urol. 2020;38(11):2709-20.
6. Price JR, Guran LA, Gregory WT, McDonagh MS. Nitrofurantoin vs other prophylactic agents in reducing recurrent urinary tract infections in adult women: a systematic review and meta-analysis. Am J Obstet Gynecol. 2016;215(5):548-60.
7. S3-Leitlinie Epidemiologie, Diagnostik, Therapie, Prävention und Management unkomplizierter, bakterieller, ambulant erworbener Harnwegsinfektionen bei Erwachsenen (HWI). AWMF Leitlinien-Register. 2024.
8. O‘Neill J. Tackling Drug-Resistant Infections Globally: Final Report and Recommendations. London: Wellcome Trust & UK Government Review on Antimicrobial Resistance; 2016.
9. Antimicrobial Resistance C. Global burden of bacterial antimicrobial resistance in 2019:a systematic analysis. Lancet. 2022.
10. FDA. Novel Drug Approvals for 2025 2025 [Available from: https://www.fda.gov/drugs/novel-drug-approvals-fda/novel-drug-approvals-2025.
11. Linhares I, Raposo T, Rodrigues A, Almeida A. Incidence and diversity of antimicrobial multidrug resistance profiles of uropathogenic bacteria. Biomed Res Int. 2015;2015:354084.
12. Strategie Antibiotikaresistenzen Bereich Mensch 2024 [Available from: https://www.bag.admin.ch/bag/de/home/strategie-und-politik/nationale-gesundheitsstrategien/strategie-antibiotikaresistenzen-schweiz.html.
13. Frey N, Bircher A, Bodmer M, Jick SS, Meier CR, Spoendlin J. Antibiotic Drug Use and the Risk of Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: A Population-Based Case-Control Study. J Invest Dermatol. 2018;138(5):1207-9.
14. Szajewska H, Scott KP, de Meij T, Forslund-Startceva SK, Knight R, Koren O, et al. Antibiotic-perturbed microbiota and the role of probiotics. Nature Reviews Gastroenterology & Hepatology. 2025;22(3):155-72.
15. Wolfe AJ, Brubaker L. “Sterile Urine” and the Presence of Bacteria. European Urology. 2015;68(2):173-4.
16. Fouts DE, Pieper R, Szpakowski S, Pohl H, Knoblach S, Suh MJ, et al. Integrated next-generation sequencing of 16S rDNA and metaproteomics differentiate the healthy urine microbiome from asymptomatic bacteriuria in neuropathic bladder associated with spinal cord injury. J Transl Med. 2012;10:174.
17. Rudick CN, Taylor AK, Yaggie RE, Schaeffer AJ, Klumpp DJ. Asymptomatic bacteriuria Escherichia coli are live biotherapeutics for UTI. PLoS One. 2014;9(11):e109321.
18. Foxman B, Brown P. Epidemiology of urinary tract infections: transmission and risk factors, incidence, and costs. Infect Dis Clin North Am. 2003;17(2):227-41.
19. Hooton TM, Stapleton AE, Roberts PL, Winter C, Scholes D, Bavendam T, et al. Perineal anatomy and urine-voiding characteristics of young women with and without recurrent urinary tract infections. Clin Infect Dis. 1999;29(6):1600-1.
20. Cai T. Recurrent uncomplicated urinary tract infections: definitions and risk factors. GMS Infect Dis. 2021;9:Doc03.
21. Jung C, Brubaker L. The etiology and management of recurrent urinary tract infections in postmenopausal women. Climacteric. 2019;22(3):242-9.
22. Park MG, Cho S, Oh MM. Menopausal Changes in the Microbiome-A Review Focused on the Genitourinary Microbiome. Diagnostics (Basel). 2023;13(6).
23. Vaughan MH, Mao J, Karstens LA, Ma L, Amundsen CL, Schmader KE, et al. The Urinary Microbiome in Postmenopausal Women with Recurrent Urinary Tract Infections. J Urol. 2021;206(5):1222-31.
24. Betschart C, Albrich WC, Brandner S, Faltin D, Kuhn A, Surbek D, et al. Guideline of the Swiss Society of Gynaecology and Obstetrics (SSGO) on acute and recurrent urinary tract infections in women, including pregnancy. Swiss Med Wkly. 2020;150:w20236.
25. Hoffmann T, Peiris R, Mar CD, Cleo G, Glasziou P. Natural history of uncomplicated urinary tract infection without antibiotics: a systematic review. Br J Gen Pract. 2020;70(699):e714-e22.
26. Sachdeva A, Rai BP, Veeratterapillay R, Harding C, Nambiar A. Non-steroidal anti-inflammatory drugs for treating symptomatic uncomplicated urinary tract infections in non-pregnant adult women. Cochrane Database Syst Rev. 2024;12(12):Cd014762.
27. Christiaens TC, De Meyere M, Verschraegen G, Peersman W, Heytens S, De Maeseneer JM. Randomised controlled trial of nitrofurantoin versus placebo in the treatment of uncomplicated urinary tract infection in adult women. Br J Gen Pract. 2002;52(482):729-34.
28. Wagenlehner FM, Abramov-Sommariva D, Höller M, Steindl H, Naber KG. Non-Antibiotic Herbal Therapy (BNO 1045) versus Antibiotic Therapy (Fosfomycin Trometamol) for the Treatment of Acute Lower Uncomplicated Urinary Tract Infections in Women: A Double-Blind, Parallel-Group, Randomized, Multicentre, Non-Inferiority Phase III Trial. Urol Int. 2018;101(3):327-36.
29. Raz R, Stamm WE. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med. 1993;329(11):753-6.
30. Tan-Kim J, Shah NM, Do D, Menefee SA. Efficacy of vaginal estrogen for recurrent urinary tract infection prevention in hypoestrogenic women. Am J Obstet Gynecol. 2023;229(2):143 e1- e9.
31. Sabadash M, Shulyak A. Canephron® N in the treatment of recurrent cystitis in women of child-bearing Age: a randomised controlled study. Clinical Phytoscience. 2017;3(1):9.
32. Huttner A, Kronenberg A, Hasse B, Galperine TK. Harnwegsinfekt (HWI). 2025.
info@gynäkologie
- Vol. 15
- Ausgabe 4
- September 2025