- PAVK, Herz-Kreislauf-Erkrankungen und chronisch-venöse Insuffizienz
Herz-Kreislauf-Erkrankungen wie die periphere arterielle Verschlusskrankheit (PAVK) und die chronisch venöse Insuffizienz (CVI) werden im klinischen Alltag oft als unterschiedliche Entitäten betrachtet. Chronisch venöse Erkrankungen und Herz-Kreislauf-Erkrankungen haben gemeinsame Risikofaktoren und eine gemeinsame Pathophysiologie. Studien konnten zeigen, dass häufig eine Koexistenz beider Krankheitsbilder vorhanden ist, die sich gegenseitig beeinflussen. Dieser Artikel soll eine Übersicht verschaffen über die epidemiologische Koexistenz, die pathophysiologischen Interaktionen sowie die therapeutischen Herausforderungen im klinischen Alltag.
Cardiovascular diseases such as peripheral arterial disease (PAD) and chronic venous insufficiency (CVI) are often regarded as distinct entities in clinical practice. However, chronic venous disorders and cardiovascular diseases share common risk factors and pathophysiological mechanisms. Studies have demonstrated that the coexistence of both conditions is frequent and that they can mutually influence each other. This article aims to provide an overview of the epidemiological coexistence, pathophysiological interactions, and therapeutic challenges in clinical practice.
Keywords: PAVK, CVI, Herz-Kreislauf-Erkrankungen, Komorbidität, Gesamtsterblichkeit
Epidemiologie und Relevanz der Komorbidität im klinischen Alltag
Die PAVK manifestiert sich häufig im Rahmen einer systemischen Arteriosklerose und betrifft in Europa ca. 15–20 % der über 65-Jährigen (1). Kardiovaskuläre Erkrankungen wie die zerebrovaskuläre Verschlusskrankheit und die koronare Herzkrankheit sind häufige Komorbiditäten bei der PAVK und führen zu einer deutlich erhöhten Mortalität. Als kardiovaskuläre Risikofaktoren gelten die positive Familienanamnese, Bewegungsmangel, Nikotin, Diabetes mellitus, Adipositas, arterielle Hypertonie und Dyslipidämie.
Die CVI hat eine Prävalenz von 30–40 % in der erwachsenen Bevölkerung, wobei mit zunehmendem Alter und Adipositas die Prävalenz der schweren Fälle zunimmt (2, 4). Als rein venöse Erkrankung wird die CVI im klinischen Alltag häufig als alleinstehende Entität betrachtet.
Obwohl die PAVK und CVI unterschiedliche Gefässsysteme betreffen, zeigen Studien, dass eine CVI das Risiko für Arteriosklerose und kardiovaskuläre Ereignisse erhöht (3, 4). In einer grossen Untersuchung von Prochaska et al. wurde bei 12‘423 Teilnehmern der bevölkerungsbasierten Kohortenstudie zwischen 40 und 80 Jahren nachgewiesen, dass das Risiko, in den nächsten 10 Jahren an einer Herz-Kreislauf-Erkrankung wie Herzinfarkt, Schlaganfall, Herzinsuffizienz oder Vorhofflimmern zu erkranken, bei Patienten mit einer chronisch venösen Insuffizienz doppelt so hoch ist wie bei Patienten ohne CVI (4). In einer weiteren Untersuchung mit PAVK-Patienten konnte eine gleichzeitige Prävalenz einer CVI von 21 % nachgewiesen werden (5).
Pathophysiologie, Risikofaktoren
Die Pathophysiologie beider Erkrankungen ist zwar im Wesentlichen unterschiedlich, da die PAVK auf arteriosklerotischen Veränderungen der Arterien beruht, während die Ursache der CVI auf eine venöse Hypertension bei Venenklappeninsuffizienz oder auf eine funktionelle venöse Insuffizienz bei intakten Venenklappen zurückgeführt werden kann.
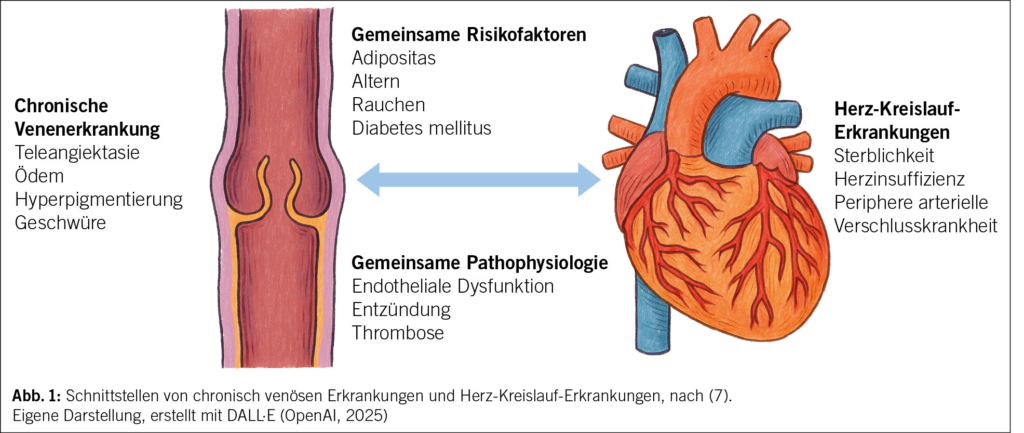
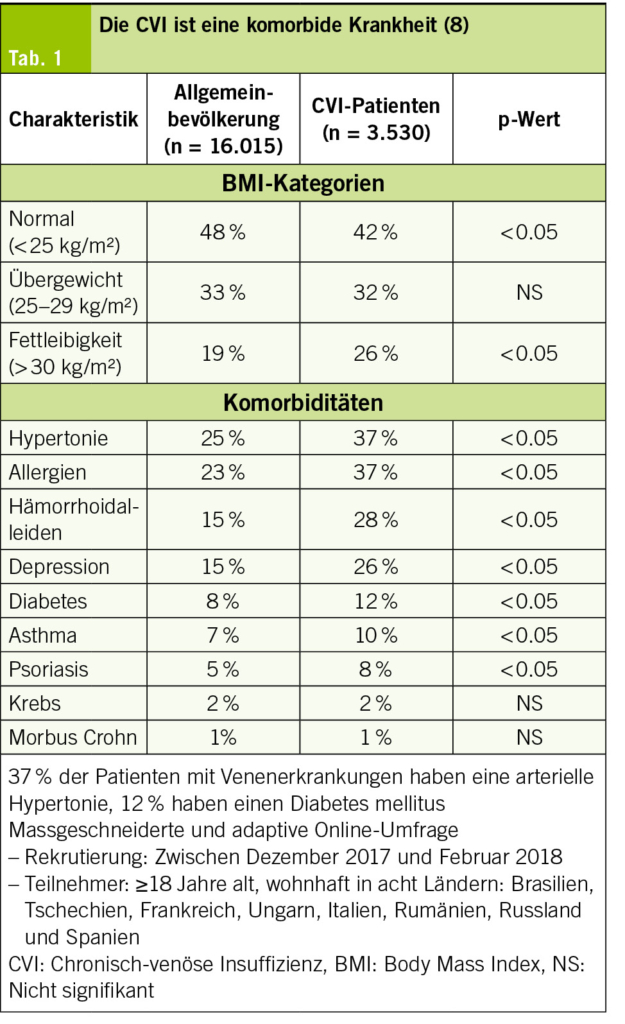
Sie teilen jedoch gemeinsame Risikofaktoren und Schnittstellen in der Pathophysiologie (Abb. 1). Gemeinsame Risikofaktoren wie Adipositas, arterielle Hypertonie, Nikotin, Diabetes mellitus und Alter spielen eine zentrale Rolle bei der Ausbildung beider Erkrankungen. In einer Studie von Rabe et al. (2) konnte gezeigt werden, dass 37 % der Patienten mit chronischen Venenerkrankungen eine arterielle Hypertonie und 12 % einen Diabetes mellitus haben (Tab. 1).
Auf pathophysiologischer Ebene findet man als Gemeinsamkeit der Erkrankungen die endotheliale Dysfunktion, Inflammation und Thromboseneigung. Eine chronisch venöse Stauung bewirkt über eine Endothelaktivierung eine Mikroangiopathie und lokale Hypoxie (6), die durch eine arterielle Minderperfusion noch verstärkt wird. Bei einer fortgeschrittenen CVI kommt es zu einer erhöhten Kapillarpermeabilität und fibrinogener Exsudation in das Interstitium, so dass die Diffusion von Sauerstoff und Nährstoffen beeinträchtigt wird und dadurch die Ischämietoleranz im Gewebe sinkt. Durch eine gleichzeitig vorhandene PAVK potenziert sich die Hypoxie.
Eine relevante PAVK wird bei ca. 10–15 % der Patienten mit schwerer CVI übersehen, da die venösen Beschwerden die arterielle Symptomatik überlappen können. Das führt dazu, dass die Symptome einer falschen Ätiologie zugeordnet werden, was die adäquate Versorgung des Patienten verzögert. Eine eingeschränkte arterielle Perfusion kann wie die CVI zu trophischen Störungen wie Ulzerationen führen und diese bei bestehender CVI noch verschlechtern. Ödeme können wiederum die arterielle Perfusion kompromittieren und ebenfalls zu einer eingeschränkten Wundheilung von Ulzera führen.
Die Kombination aus PAVK und CVI bleibt im klinischen Alltag oft unterdiagnostiziert. Dabei treten beide Erkrankungen häufig zusammen auf und sind prognostisch relevant. Eine Komorbidität mit der PAVK führt ausserdem zu einem höheren Risiko für Ulzerationen, schlechte Wundheilung und eingeschränkte Mobilität.
Diagnostische und therapeutische Herausforderungen
Das gleichzeitige Auftreten einer PAVK und CVI kann im klinischen Alltag die Diagnosestellung erschweren, insbesondere da ähnliche Symptome sowie Ulzerationen arteriell, venös oder arterio-venös auftreten können. Die parallele Diagnostik der arteriellen und venösen Strombahn ist klinisch anspruchsvoll.
Die PAVK-Diagnostik in der hausärztlichen Praxis orientiert sich an der Anamnese (kardiovaskuläre Risikofaktoren, typische Claudicatio), der klinischen Untersuchung und dem Knöchel-Arm-Index (ABI). Die Einteilung der PAVK erfolgt in den Stadien I–IV nach Fontaine, um den Schweregrad der Erkrankung anhand der klinischen Symptome zuzuordnen. Die ABI-Messung zur Abschätzung einer möglichen PAVK kann durch Symptome der CVI wie Ödemen und Ulzerationen an den unteren Extremitäten nur erschwert durchgeführt werden. Da viele dieser Patienten auch einen Diabetes mellitus haben, können die Arterien im Knöchelbereich bei einer Mediasklerose oftmals nicht oder nicht mehr vollständig komprimiert werden, so dass es zu falsch hohen Messwerten kommt. Der ABI-Wert kann so nicht mehr für die Diagnostik herangezogen werden. Auch bei Patienten mit gut kollateralisierten, chronischen arteriellen Verschlüssen, kann die Diagnose einer PAVK aufgrund einer alleinigen ABI-Messung verpasst werden, da diese Patienten auch normale Druckwerte aufweisen können. In diesen Situationen ist die Durchführung einer Duplexsonographie sinnvoll.
Die CVI-Diagnostik erfolgt in der hausärztlichen Praxis primär durch die Anamnese und klinische Untersuchung. Die chronisch venöse Insuffizienz ist eine klinische Diagnose mit Nachweis einer Corona phlebectatica paraplantaris. Zusätzlich kann es zur Ausbildung von Varizen, Ödemen, Ulzerationen, Hyperpigmentationen sowie Zeichen einer Stauungsdermatitis kommen. Im klinischen Alltag wird die CVI im Rahmen der CEAP-Klassifizierung (C0–C6) eingeteilt oder in die ältere, einfachere Klassifikation nach Widmer. Im Rahmen der CEAP-Klassifikation werden die pathophysiologischen Kategorien auf nachweisbare strukturelle Venenklappenveränderungen oder postthrombotische Veränderungen fokussiert. Aber
nicht jeder Patient mit Zeichen einer chronisch venösen Insuffizienz weist sonographisch relevante Klappeninsuffizienzen oder postthrombotische Veränderungen auf. Durch Faktoren wie Immobilität, Muskelschwäche oder neurologische Erkrankungen kann eine funktionelle venöse Insuffizienz vorliegen, bei der die muskuläre Venenpumpe unzureichend arbeitet. In dieser Situation kommt es trotz suffizienter Venenklappen zu einer chronisch venösen Hypertonie.
Therapeutisch sind bei der PAVK und CVI verschiedene Massnahmen notwendig. Bei der PAVK steht je nach Stadium eine konservative Behandlung im Vordergrund mit Elimination der kardiovaskulären Risikofaktoren, strukturiertem Gehtraining und einer medikamentösen Therapie mit Statinen und eventuell weiteren cholesterinsenkenden Substanzen (LDL-Ziel: <1,4mmol/l) und einem Thrombozytenaggregationshemmer. In weiter fortgeschrittenen Stadien stehen bei entsprechender Symptomatik revaskularisierende Massnahmen zur Verfügung.
Bei der CVI steht die Kompressionstherapie im Vordergrund, mittels Kompressionsverbänden oder -strümpfen der Klasse 2. Ausserdem stehen venotonische Medikamente zur Verfügung sowie interventionelle Verfahren zur Varizensanierung wie die Thermoablation und das klassische Varizenstripping.
Die Herausforderung liegt im Management der Behandlung der chronisch venösen Insuffizienz bei gleichzeitig vorhandener PAVK, da eine Kompressionstherapie bei einem ABI unter 0.5 kontraindiziert ist. Bei einem ABI von 0.5–0.8 besteht eine relative Kontraindikation, eine Kompressionstherapie sollte dann nur unter strenger Indikationsstellung und Monitoring stattfinden. Daher ist eine genaue Standortbestimmung mittels nicht-invasiver Messmethoden und Duplexsonographie der arteriellen Strombahn notwendig, bevor eine Kompressionstherapie durchgeführt werden darf. Mittels farbkodierter Duplexsonographie kann eine simultane Beurteilung des arteriellen und venösen Gefässsystems erfolgen.
Klinische Relevanz
Die PAVK und die CVI sind Ausdruck einer systemischen vaskulären Dysfunktion, insbesondere bei älteren Patienten oder solchen mit multiplen kardiovaskulären Risikofaktoren. Es konnte gezeigt werden, dass die CVI das Risiko für Arteriosklerose und kardiovaskuläre Ereignisse erhöht. Im klinischen Alltag wird die Koexistenz von PAVK, Herz-Kreislauf-Erkrankungen und chronisch venöser Insuffizienz häufig unterschätzt. Folge davon ist, dass die kardiovaskuläre Risikokonstellation von CVI-Patienten leicht übersehen werden kann. Eine weitere Folge sind inadäquate Therapien, insbesondere die unkritische Verordnung einer Kompressionstherapie bei fortgeschrittener PAVK, die zu ischämischen Ereignissen führen kann. Auch für die Bewertung von Ulzerationen ist eine Standortbestimmung beider Gefässsysteme essentiell, da diese je nach Ätiologie arteriell, venös oder arterio-venös auftreten können und jeweils einer anderen Therapie bedürfen.
Copyright
Aerzteverlag medinfo AG
Innere Medizin und Angiologie FMH
Römerhofplatz 5
8032 Zürich
Die Autorin hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- PAVK, kardiovaskuläre Erkrankungen und CVI treten häufig zusammen auf und teilen sich die typischen kardiovaskulären Risikofaktoren.
- Die häufige chronisch venöse Insuffizienz sollte als Indikator für eine kardiovaskuläre Erkrankung in Erwägung gezogen werden.
- Eine arterio-venöse Erkrankung ist mit einer erhöhten Morbidität und einer eingeschränkten Lebensqualität assoziiert. Die Patienten haben eine signifikant schlechtere Prognose hinsichtlich kardiovaskulärer Ereignisse, Ulcusheilung, Mobilität und Gesamtsterblichkeit.
- Eine unerkannte Komorbidität kann zu Komplikationen und Fehleinschätzungen führen.
- Eine differenzierte Diagnostik beider Gefässsysteme ist essentiell für eine optimale Patientenversorgung.
- Eine Kompressionstherapie ist bei schwerer PAVK kontraindiziert ohne vorherige Abklärung der arteriellen Strombahn.
1. Diehm C, et al. High prevalence of peripheral arterial disease and co-morbidity in 6880 primary care patients: Cross-sectional study. Atherosclerosis. 2004; 172(1):95-105
2. Rabe E, et al. Epidemiology of chronic venous disorders in Germany. Phlebology. 2016
3. Singh TP, et al. Association of chronic venous disease with major adverse cardiovacular events. J Vasc Surg Venous Lymphat Disord. 2022 May;(3):683-688.
4. Prochaska JH, et al. Chronic venous insufficiency, cardiovascular disase and mortality: a population study. Eur HeartJ. 2021 Aug13:ehab495. EHJ 2021, Oct 21;42(40):4157-4165
5. Ammermann F, et al. Concomitant chronic venous insufficiency in patients with peripheral artery disease: insights from MR angiography. Eur Radiol.2020 Jul;30(7):3908-3914.
6. Bergan J., Molecular mechanisms in chronic venous insufficiency. Ann Vasc Surg. 2007 May;21(3):260-6.
7. Hamburg N.M., The legs are a pathway to the heart: connections between chronic venous insufficiency and cardiovascular disease, European Heart Journal (2021) 42,4166–4168
8. Rabe E. et al., The prevalence, disease characteristics and treatment of chronic venous disease: an international web-based survey, J Comp Eff Res, 2020:9(17):1205-1218
der informierte @rzt
- Vol. 15
- Ausgabe 9
- September 2025