- Immunothérapie du cancer
Les inhibiteurs de points de contrôle immunitaires ont transformé la prise en charge de nombreux cancers. Cette immunothérapie permet potentiellement un contrôle prolongé, voire la guérison, chez certains patients atteints de cancer avancé. Toutefois, malgré ces avancées notables, seuls environ 20 % des patients avec maladie avancée en bénéficient, et moins encore sur le long terme. Les effets indésirables, parfois tardifs, et potentiellement sévères, exigent vigilance, et une prise en charge rapide en centre expert. Transformer des tumeurs résistantes plus sensible à l’immunothérapie est un des défis majeurs. Optimiser l’administration – en termes de dose, durée, etc. – en est un autre.
Immune checkpoint inhibitors have transformed the management of many cancers. Immunotherapy can lead to prolonged disease control, and even cure, in some patients with advanced cancer. However, despite these notable advances, only about 20 % benefit from immunotherapy in the advanced setting, and even fewer in the long term. Adverse events, sometimes occurring late and potentially severe, require close monitoring and rapid management in expert centers. Among future challenges is the need to make resistant tumors more sensitive to immunotherapy. Optimizing its use – in terms of dose, duration, etc. – is another important goal.
Keywords: Immune checkpoint inhibitors; anti-tumoral immunity; oncology; PD1; CTLA-4
Introduction
Bien que le terme immunothérapie englobe diverses approches, ce terme fait le plus souvent référence aux inhibiteurs de points de contrôle immunitaires (checkpoint inhibitors), que nous allons décrire ici. Ces inhibiteurs de points de contrôle immunitaires constituent certainement l’avancée la plus importante en oncologie de ces deux dernières décennies. Pour certains patients – par exemple ceux atteints de cancer du poumon ou de mélanome – elle a permis de transformer des maladies métastatiques autrefois incurables en affections contrôlées à long terme, permettant même parfois de parler de guérison, y compris dans des stades initialement extrêmement avancés. Toutefois, ces situations favorables, bien qu’elles fassent désormais partie de la pratique quotidienne, restent limitées à un nombre restreint de types tumoraux. En situation de maladie avancée, seule une minorité de patients bénéficie réellement de l’immunothérapie. Par ailleurs, les effets secondaires, pouvant concerner pratiquement n’importe quel organe par des mécanismes immuno-médiés, ne doivent pas être minimisées. Savoir les reconnaître et les prendre en charge est d’une importance capitale pour le praticien. Dans ce travail, nous revenons sur le rationnel biologique, les données cliniques d’efficacité et de tolérance de l’immunothérapie, ainsi que les directions envisagées pour le futur de l’immunothérapie.
Rationnel biologique
Toute personne possède une immunité naturelle anti-tumorale, dont l’objectif est d’éliminer les cellules anormales. Cette immunité est finement régulée afin qu’elle ne soit ni excessive, ni insuffisante, notamment grâce à ce que l’on appelle des points de contrôle immunitaires (immune checkpoints). Il s’avère que ces points de contrôle peuvent être détournés par les cellules cancéreuses pour échapper à la surveillance immunitaire (1).
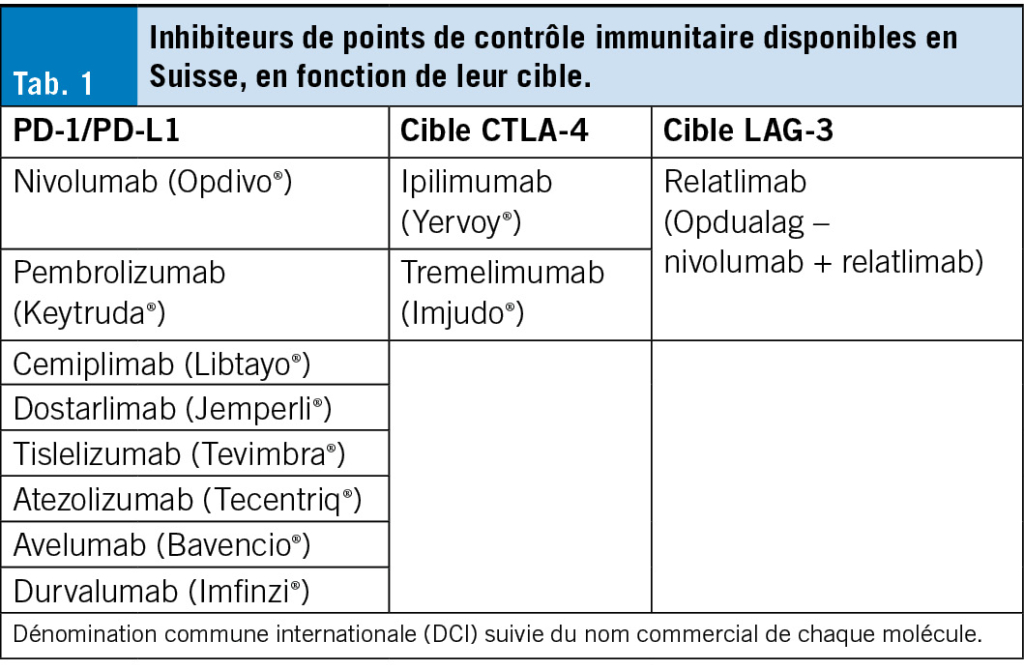
Parmi ces points de contrôle, ceux qui ont révolutionné l’oncologie sont principalement l’interaction entre PD-1 et PD-L1, ainsi que celle entre CTLA-4 et les cellules présentatrices d’antigènes (2). D’autres points de contrôle, comme LAG-3, TIGIT ou TIM-3, font l’objet de développements récents, mais ne seront pas abordés dans ce manuscrit (3). La Tab. 1 décrit le nom des molécules, et leur cible, disponibles en Suisse.
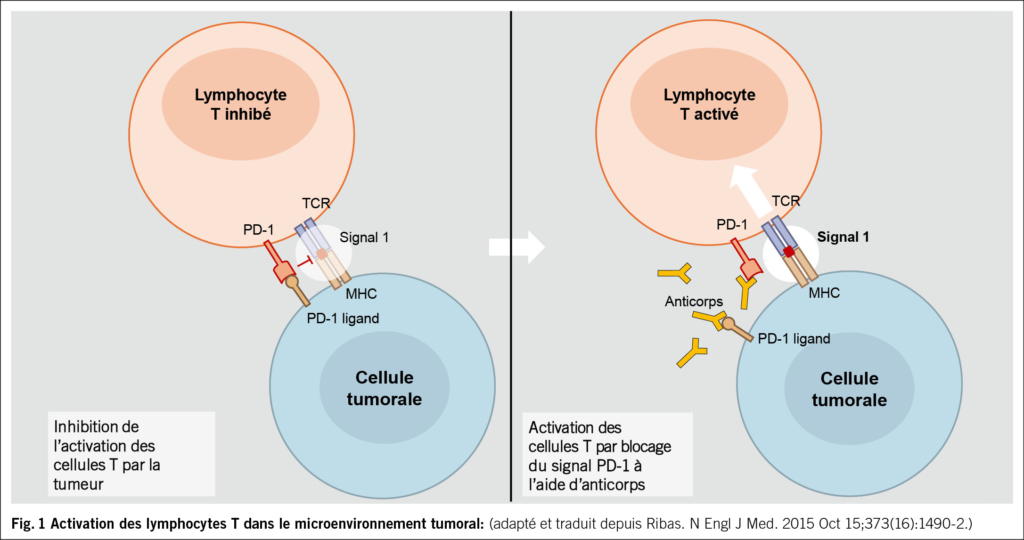
Prenons l’exemple de l’interaction entre PD-1, exprimé à la surface des lymphocytes T, et PD-L1, exprimé par les cellules tumorales: cette interaction inhibe le lymphocyte, l’empêchant d’exercer son effet cytotoxique anti-tumoral. Le cancer, notamment via une surexpression de PD-L1, parvient ainsi à échapper à la réponse immunitaire et à poursuivre sa progression. Ce mécanisme est illustré dans la Fig. 1.
C’est précisément à ce niveau que l’immunothérapie intervient: des anticorps monoclonaux (monoclonal antibodies – «mab») bloquent cette interaction, restaurant la capacité des lymphocytes T à reconnaître et à détruire les cellules cancéreuses. L’immunothérapie n’agit donc pas directement contre la tumeur, mais indirectement, en levant les freins exercés sur la réponse immunitaire (immune checkpoint inhibitors).
Données en situations métastatiques
Une revue exhaustive des données d’immunothérapie des vingt dernières années dépasserait le cadre de ce travail. Toutefois, des exemples marquants illustrent le potentiel de cette nouvelle approche thérapeutique.
Le mélanome était autrefois associé à un pronostic très réservé, avec une espérance de vie de quelques mois dans beaucoup des situations métastatiques. C’est dans ce contexte que l’immunothérapie a été la plus révolutionnaire. Nous disposons désormais des résultats à 10 ans de l’étude CheckMate 067, qui a comparé une combinaison d’immunothérapie (anti-CTLA-4 et anti-PD-1), les anti-PD-1 seuls, et les anti-CTLA-4 seuls, en 1ère ligne de traitement pour des patients avec maladie avancée ou métastatique (4). Avec les stratégies contenant un anti-PD-1 (seul ou en combinaison), environ 40 % des patients sont encore en vie à 10 ans. Chez ces patients, on peut véritablement parler de guérison.
D’autres cancers ont vu leur prise en charge radicalement transformée par l’immunothérapie. Par exemple, le cancer du poumon, qui, en dehors de cas particuliers, est aujourd’hui traité par immunothérapie dès la première ligne en situation métastatique, avec là aussi un potentiel de bénéfice à très long terme en cas de réponse tumorale (5, 6, 7).
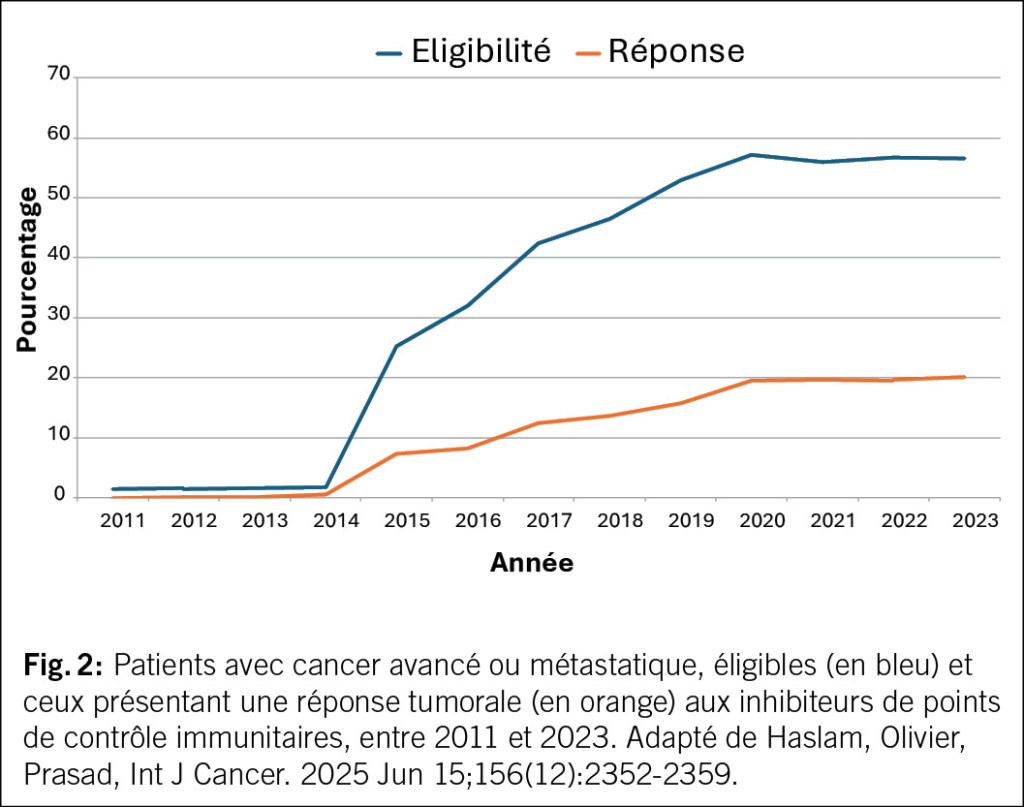
L’exemple du mélanome illustre également les limites de l’immunothérapie: il s’agit d’un cancer relativement rare, en situation avancée, comparé à d’autres. Cela explique qu’à ce jour, si l’on tient compte de la fréquence de chaque type de cancer, seulement environ 20 % des patients atteints de maladie avancée bénéficient d’une réponse tumorale à l’immunothérapie (8). De plus, seule une fraction de ces patients va avoir un bénéfice durable dans le temps. L’évolution au cours du temps du nombre de patients avec maladie avancée ou métastatique étant éligible, c’est à dire avec une indication à recevoir la thérapie, et ceux présentant une réponse tumorale, est représenté dans la Fig. 2. En d’autres termes, bien que l’immunothérapie représente une révolution pour certains patients, elle ne bénéficie encore qu’à une minorité des personnes atteintes de maladie avancée.
Et en situation néoadjuvante et adjuvante?
Après les résultats impressionnants observés dans certaines situations de maladie avancée, il a été logique d’étudier l’impact de l’immunothérapie dans des contextes plus précoces, notamment en situation néoadjuvante (avant chirurgie) et/ou adjuvante (après chirurgie) (9, 10).
Dans le cancer du poumon par exemple, un nombre considérable d’études de phase 3 a montré un bénéfice en survie sans maladie, et plusieurs d’entre elles ont également mis en évidence un bénéfice en survie globale, lié à l’adjonction d’immunothérapie aux traitements conventionnels de chimiothérapie péri-opératoire (11, 12 13). Aujourd’hui, l’immunothérapie peut être proposée en situation péri-opératoire dans de nombreux types tumoraux.
Il convient toutefois d’apporter certaines nuances : en effet, plusieurs études soutenant l’utilisation précoce de l’immunothérapie ont été menées y compris dans certains pays à ressources limitées. Dans ces pays, les patients du groupe contrôle qui récidivaient n’avaient pas un accès optimal aux traitements après l’essai clinique (10). Dans ces cas, il est difficile de savoir si le bénéfice observé en survie est réellement dû à l’administration précoce de l’immunothérapie, ou s’il résulte d’un traitement sous-optimal dans le groupe contrôle lors de la rechute. Un autre point important concerne la toxicité, qui, dans une situation où les patients sont potentiellement déjà guéris de leur maladie, doit être évaluée avec encore plus d’attention dans le cadre d’une véritable décision médicale partagée.
Toxicité et qualité de vie: savoir repérer et ne pas minimiser
Les toxicités potentielles de l’immunothérapie ne doivent pas être sous-estimées. Bien que sévères dans une minorité de cas, et souvent contrôlables médicalement, certaines toxicités peuvent entraîner des dommages à long terme (14), avec un impact potentiel sur la qualité de vie (15), voire des effets secondaires fatals (16).
Pour le praticien, les messages clés sont les suivants:
1. Les toxicités immuno-induites sont des atteintes d’organes qui peuvent mimer d’autres pathologies, rendant leur diagnostic parfois piégeux. Par exemple, une pneumonite immuno-médiée peut se présenter comme une pneumonie infectieuse. Les atteintes les plus fréquentes concernent les glandes endocrines (thyroïdites) poumons (pneumonites), le côlon (colites), le foie (hépatites), la peau, ainsi qu’une asthénie marquée. Des atteintes plus rares mais sévères, telles que des myosites cardiaques ou des atteintes neurologiques, peuvent également survenir (17).
2. Contrairement à la chimiothérapie, les effets indésirables de l’immunothérapie peuvent apparaître tardivement, plusieurs semaines voire plusieurs mois après le début, ou même l’arrêt, du traitement (18).
3. La corticothérapie à forte dose, initiée rapidement, constitue la base du traitement de première intention, en visant à freiner une réponse immunitaire devenue excessive. En cas de résistance, d’autres immunosuppresseurs peuvent être nécessaires, comme les anti-IL6, anti-TNF alpha, ou d’autres molécules (19) (20).
4. La gestion optimale de ces toxicités repose sur une expertise spécialisée. L’implication précoce de l’oncologue référent est essentielle pour éviter des retards de diagnostic ou de traitement.
En conclusion, bien que généralement bien tolérée, l’immunothérapie peut provoquer des effets indésirables sévères. Leur reconnaissance rapide, leur prise en charge en centre expert, et une information claire au patient comme à son entourage sont des éléments clés pour assurer la sécurité et l’efficacité du traitement.
Défis pour le futur
Sur le plan de l’efficacité, une question centrale demeure: est-il possible que l’immunothérapie ne bénéficie plus seulement à une minorité, mais à une majorité de patients? Différentes stratégies sont actuellement explorées pour atteindre cet objectif, notamment en ciblant d’autres points de contrôle immunitaires, ou en cherchant à transformer des cancers dits «froids» (résistants à l’immunothérapie) en cancers «chauds», c’est-à-dire plus sensibles.
Parallèlement, un autre défi majeur réside dans l’optimisation des traitements déjà approuvés, avec une approche centrée sur le patient (21). Par exemple:
– Les doses actuellement utilisées sont-elles réellement optimales? Certaines études suggèrent qu’une efficacité comparable pourrait être obtenue avec des doses significativement plus faibles (22).
– Le moment d’administration joue-t-il un rôle? Plusieurs données préliminaires indiquent que l’administration le matin pourrait être plus efficace que l’après-midi, mais cette hypothèse mérite d’être validée par des essais randomisés rigoureux (23).
– La durée du traitement est-elle justifiée? Beaucoup de protocoles prévoient une immunothérapie sur un ou deux ans. Or, évaluer si des durées plus courtes peuvent offrir une efficacité équivalente permettrait de limiter les toxicités, mais aussi de réduire considérablement les coûts pour la société (24).
Conclusion
Les inhibiteurs de points de contrôle immunitaires ont représenté une véritable révolution en oncologie, permettant à certains patients d’obtenir un contrôle durable de la maladie, voire une guérison, alors que leur pronostic aurait été rapidement létal en l’absence de ce traitement. Malgré tout, cela ne concerne encore qu’une minorité de patients atteints de maladie avancée. Comprendre comment élargir le bénéfice de l’immunothérapie à un plus grand nombre de patients reste un défi majeur. Les toxicités, des atteintes d’organes immuno-médiées pouvant survenir plusieurs semaines, voire plusieurs mois après le début du traitement, doivent être repérées précocement et traitées sans délai (la corticothérapie étant le traitement de première intention), avec une implication rapide de l’oncologue. En situation néoadjuvante ou adjuvante, ces toxicités, ainsi que certains biais méthodologiques parfois présents dans les essais cliniques, doivent être pleinement pris en compte dans le cadre d’une décision médicale partagée optimale.
Copyright
Aerzteverlag medinfo AG
Service d’oncologie
Hôpitaux Universitaires Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
Service d’oncologie
Hôpitaux Universitaires Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
Timothée Olivier n’a pas de conflits d’intérêt à déclarer. Alfredo Addeo: Consulting or Advisory Role: BMS, Astrazeneca, Boehringer-Ingelheim, Roche, MSD, Pfizer, Eli Lilly, Astellas. Speaker Bureau: Eli Lilly, Astrazeneca, Regeneron
- L’immunothérapie permet, dans certains types de cancers y compris en situations très avancés ou métastatiques, un contrôle durable, voire une guérison – mais cela reste limité à une minorité de patients.
- Les effets indésirables immuno-médiés peuvent survenir tardivement et toucher divers organes ; ils doivent être identifiés et pris en charge rapidement, en centre expert, avec une corticothérapie en première intention.
- En situation néoadjuvante ou adjuvante, l’immunothérapie est de plus en plus proposée, mais impose une évaluation rigoureuse du rapport bénéfice-risque dans une véritable décision médicale partagée.
- Pour élargir le bénéfice à plus de patients, des pistes sont explorées pour transformer des tumeurs résistantes en maladies plus sensibles à l’immunothérapie.
- Optimiser la dose, la durée d’administration, et d’autres éléments
en lien avec l’administration d’immunothérapie déjà utilisée, pourrait potentiellement en réduire la toxicité et les coûts.
1. Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013 Jul 25;39(1):1–10.
2. Ribas Antoni. Releasing the Brakes on Cancer Immunotherapy. New England Journal of Medicine. 2015;373(16):1490–2.
3. Borgeaud M, Sandoval J, Obeid M, Banna G, Michielin O, Addeo A, et al. Novel targets for immune-checkpoint inhibition in cancer. Cancer Treatment Reviews [Internet]. 2023 Nov 1 [cited 2025 Jun 22];120. Available from: https://www.cancertreatmentreviews.com/article/S0305-7372(23)00107-X/fulltext
4. Wolchok JD, Chiarion-Sileni V, Rutkowski P, Cowey CL, Schadendorf D, Wagstaff J, et al. Final, 10-Year Outcomes with Nivolumab plus Ipilimumab in Advanced Melanoma. New England Journal of Medicine. 2025 Jan 1;392(1):11–22.
5. Garassino MC, Gadgeel S, Speranza G, Felip E, Esteban E, Dómine M, et al. Pembrolizumab Plus Pemetrexed and Platinum in Nonsquamous Non–Small-Cell Lung Cancer: 5-Year Outcomes From the Phase 3 KEYNOTE-189 Study. JCO. 2023 Apr 10;41(11):1992–8.
6. Novello S, Kowalski DM, Luft A, Gümüs M, Vicente D, Mazières J, et al. Pembrolizumab Plus Chemotherapy in Squamous Non–Small-Cell Lung Cancer: 5-Year Update of the Phase III KEYNOTE-407 Study. JCO. 2023 Apr 10;41(11):1999–2006.
7. Desai A, Peters S. Immunotherapy-based combinations in metastatic NSCLC. Cancer Treat Rev. 2023 May;116:102545.
8. Haslam A, Olivier T, Prasad V. How many people in the US are eligible for and respond to checkpoint inhibitors: An empirical analysis. Int J Cancer. 2025 Jun 15;156(12):2352–9.
9. Boydell E, Sandoval JL, Michielin O, Obeid M, Addeo A, Friedlaender A. Neoadjuvant Immunotherapy: A Promising New Standard of Care. Int J Mol Sci. 2023 Jul 24;24(14):11849.
10. Olivier T, Haslam A, Prasad V. Postrecurrence Treatment in Neoadjuvant or Adjuvant FDA Registration Trials: A Systematic Review. JAMA Oncology [Internet]. 2024 Jun 20 [cited 2024 Aug 15]; Available from: https://doi.org/10.1001/jamaoncol.2024.1569
11. Han Y, Xiao X, Qin T, Yao S, Liu X, Feng Y, et al. Efficacy and safety of perioperative immunotherapy combinations for resectable non-small cell lung cancer: a systematic review and network meta-analysis. Cancer Immunol Immunother. 2024 Oct 9;73(12):262.
12. Spicer JD, Garassino MC, Wakelee H, Liberman M, Kato T, Tsuboi M, et al. Neoadjuvant pembrolizumab plus chemotherapy followed by adjuvant pembrolizumab compared with neoadjuvant chemotherapy alone in patients with early-stage non-small-cell lung cancer (KEYNOTE-671): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet. 2024 Sep 28;404(10459):1240–52.
13. Forde PM, Spicer JD, Provencio M, Mitsudomi T, Awad MM, Wang C, et al. Overall Survival with Neoadjuvant Nivolumab plus Chemotherapy in Lung Cancer. New England Journal of Medicine [Internet]. [cited 2025 Jun 22];0(0). Available from: https://www.nejm.org/doi/full/10.1056/NEJMoa2502931
14. Ghisoni E, Wicky A, Bouchaab H, Imbimbo M, Delyon J, Gautron Moura B, et al. Late-onset and long-lasting immune-related adverse events from immune checkpoint-inhibitors: An overlooked aspect in immunotherapy. European Journal of Cancer. 2021 May 1;149:153–64.
15. Olivier T, Haslam A, Prasad V. Informative censoring due to missing data in quality of life was inadequately assessed in most oncology randomized controlled trials. Journal of Clinical Epidemiology. 2021 Nov 1;139:80–6.
16. Wang DY, Salem JE, Cohen JV, Chandra S, Menzer C, Ye F, et al. Fatal Toxic Effects Associated With Immune Checkpoint Inhibitors: A Systematic Review and Meta-analysis. JAMA Oncol. 2018 Dec 1;4(12):1721–8.
17. Thouvenin L, Olivier T, Banna G, Addeo A, Friedlaender A. Immune checkpoint inhibitor-induced aseptic meningitis and encephalitis: a case-series and narrative review. Therapeutic Advances in Drug Safety. 2021;12:20420986211004745.
18. Postow Michael A., Sidlow Robert, Hellmann Matthew D. Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. New England Journal of Medicine. 2018 Jan 11;378(2):158–68.
19. Martins F, Sykiotis GP, Maillard M, Fraga M, Ribi C, Kuntzer T, et al. New therapeutic perspectives to manage refractory immune checkpoint-related toxicities. Lancet Oncol. 2019 Jan;20(1):e54–64.
20. Haanen J, Obeid M, Spain L, Carbonnel F, Wang Y, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology. 2022 Dec 1;33(12):1217–38.
21. Bouche G, Gilbert D, Quartagno M, Dehbi HM, Merrick S, Doorn-Khosrovani SB van W van, et al. Determining the optimal use of approved drugs in oncology. The Lancet Oncology. 2025 May 1;26(5):e282–94.
22. Patil VM, Noronha V, Menon N, Rai R, Bhattacharjee A, Singh A, et al. Low-Dose Immunotherapy in Head and Neck Cancer: A Randomized Study. JCO. 2023 Jan 10;41(2):222–32.
23. Özdemir BC, Bill R, Okyar A, Scheiermann C, Hayoz S, Olivier T. Chrono-immunotherapy as a low-hanging fruit for cancer treatment? A call for pragmatic randomized clinical trials. J Immunother Cancer. 2025 Mar 3;13(3):e010644.
24. Birkmire J, Haslam A, Olivier T, Fernandez E, Prasad V. Why the duration of cancer treatment requires a closer look: An empirical analysis of recent FDA approvals. JCO. 2025 Jun;43(16_suppl):11022–11022.
la gazette médicale
- Vol. 14
- Ausgabe 5
- September 2025