- Update zum Management der postpartalen Blutung
Die postpartale Hämorrhagie (PPH) ist weltweit eine der häufigsten Ursachen mütterlicher Mortalität und in der Schweiz die führende direkte Todesursache. Eine standardisierte Blutverlustmessung verbessert die Erkennung erheblich und kann schwere Blutungen sowie Komplikationen um bis zu 60 % reduzieren. Wichtige Risikofaktoren sind u. a. höheres maternales Alter, Sectio-Narben, Mehrlingsschwangerschaften, Plazentationsstörungen und präpartale Anämie, jedoch tritt die Mehrzahl der schweren Fälle ohne erkennbare Risikofaktoren auf. Das Management erfordert ein strukturiertes, interdisziplinäres Vorgehen mit rascher Alarmierung, frühzeitiger Gabe von Uterotonika und Tranexamsäure sowie dem Einsatz mechanischer Verfahren wie der vakuum-induzierten Tamponade. Frühzeitige Diagnose, standardisierte Blutverlustmessung und Teamkoordination sind entscheidend, um Morbidität und Mortalität bei PPH nachhaltig zu senken.
Postpartum hemorrhage (PPH) is one of the most common causes of maternal mortality worldwide and the leading direct cause of death in Switzerland. Standardized blood loss measurement significantly improves detection and can reduce severe bleeding and complications by up to 60 %. Important risk factors include advanced maternal age, cesarean section scars, multiple pregnancies, placental disorders, and prepartum anemia, however, the majority of severe cases occur without any identifiable risk factors. Management requires a structured, interdisciplinary approach with rapid alerting, early administration of uterotonics and tranexamic acid, and the use of mechanical procedures such as vacuum-induced tamponade. Early diagnosis, standardized blood loss measurement, and team coordination are crucial to sustainably reducing morbidity and mortality in PPH.
Keywords: Postpartale Hämorrhagie, Blutverlustmessung, Uterusatonie, Vakuum-induzierte Tamponade
Einleitung
Die postpartale Hämorrhagie (PPH) gehört weltweit zu den häufigsten Ursachen der maternalen Mortalität und ist auch in der Schweiz immer noch die Hauptursache direkter mütterlicher Todesfälle (1, 2). Nach Definition der WHO liegt eine PPH bei einem Blutverlust von mindestens 500 ml innerhalb der ersten 24 Stunden nach der Geburt vor; eine schwere PPH wird ab 1000 ml oder bei hämodynamischer Instabilität diagnostiziert (3). Die aktuelle D-A-CH Leitlinie (AWMF 2022) definiert entsprechend, differenziert jedoch zwischen vaginaler Geburt (≥ 500 ml) und Sectio caesarea (≥ 1000 ml) (4). Bei einem Schockindex > 0.9 ist unabhängig von der Blutmenge von einer klinisch relevanten PPH auszugehen. Die frühzeitige Erkennung und das konsequente Management einer PPH sind entscheidend, um schwere Komplikationen wie disseminierte intravasale Gerinnung, multiorganisches Versagen oder den hypovolämischen Schock zu verhindern. Die zeitgerechte Erkennung und koordinierte Behandlung der PPH im Team sind Bestandteile eines geburtshilflichen Notfallmanagements.
Epidemiologie und klinische Bedeutung
In der älteren Literatur wird die Häufigkeit der PPH mit etwa 4 % angegeben (5). Allerdings kristallisiert sich zunehmend heraus, dass die Daten zur Häufigkeit der PPH und zum Blutverlust nach Geburten stark divergieren, abhängig davon, wie gut und strukturiert der Blutverlust gemessen wurde. Es zeigen sich demnach eklatante Unterschiede, je nachdem ob die PPH-Rate aus (nationalen) Registern/ Kodierungen stammt oder aus prospektiven Studien, welche den Blutverlust real-time messen. In einer grossen prospektiven Studie 2020 von Bell et al (7) wurde eine standardisierte quantitative Messung des Blutverlusts bei 31 341 Gebärenden in 12 walisischen Geburtskliniken eingeführt. Dadurch konnte die Erkennung von PPH signifikant gesteigert werden. Die Inzidenz eines Blutverlusts von ≥ 500 ml betrug 34 %, > 1000 ml 8.6 %, > 1500 ml 3.3 % und > 2000 ml 1.3 %. Dies zeigt, und entspricht auch dem gesunden Menschenverstand, dass eine strukturierte quantitative Blutverlustmessung zu höheren Raten postpartaler Hämorrhagien führt (wir erkennen, wonach wir suchen). Daten aus einer prospektiven Untersuchung mit konsequenter Blutverlustmessung am Universitätsspital Zürich (USZ) zeigen eine ähnliche Tendenz: 28 % der Frauen nach vaginaler Geburt erlitten eine PPH, 7 % verloren ≥ 1000 ml und 2.4 % ≥ 1500 ml (6).
Insgesamt belegen weitere internationale Beobachtungen ebenfalls eine Zunahme schwerer PPH in den letzten zwei Jahrzehnten (8). Während in Ländern mit hoher Versorgungsqualität die Mortalität zurückgegangen ist, nimmt die schwere Morbidität zu.
Risikofaktoren und Antizipation einer PPH
Häufige Risikofaktoren für die PPH sind das maternale Alter, der Status nach Sectio caesarea, der Status nach schwerer PPH oder manueller Plazentalösung sowie die Mehrlingsschwangerschaften. Ebenfalls dazu zählen Uterusmyome, Präeklampsie, präpartale Anämie in der aktuellen Schwangerschaft oder eine vorbekannte Koagulopathie. Neben den anamnestischen Risikofaktoren können auch prolongierter Geburtsverlauf, vaginaloperative Entbindung, manuelle Plazentalösung sowie die Verabreichung von Tokolytika peripartal die Wahrscheinlichkeit einer PPH erhöhen.
Das individuelle Risikoprofil jeder Frau durch eine systemische Anamnese sollte idealerweise in der Frühschwangerschaft erhoben und bei der Planung der Geburt berücksichtigt werden (4).
Eine besondere Bedeutung haben Plazentationsstörungen, v.a. im Sinne von Placenta accreta Spektrum (PAS), die sich bei Risikopatientinnen – nach Sectio, transmuraler Myomektomie oder wiederholten intrauterinen Eingriffen – häufig bereits im Verlauf der Schwangerschaft sonographisch erkennen lassen (8). Frauen mit Verdacht auf PAS müssen in einem Zentrum mit kontinuierlich verfügbarer interdisziplinärer Expertise (Gynäkologen/ Geburtshelfer mit Erfahrung bei Plazentationsstörungen, erfahrene Anästhesisten, Blutbank, interventionelle Radiologen 24/7) entbunden werden (9). Die steigende Tendenz der PPH-Raten in den letzten Jahren wird teils auf das höhere maternale Alter bei Geburt, die steigenden Sectioraten und Mehrlingsschwangerschaften zurückgeführt. Eine grosse norwegische Kohortenstudie mit über 330 000 Schwangeren zeigte ebenfalls fast eine Verdreifachung der schweren PPH von 2000 bis 2020 (10).
Aber auch wenn zahlreiche anerkannte Risikofaktoren bestehen, tritt die Mehrzahl der schweren PPH-Fälle bei Frauen ohne bekannte Risikofaktoren auf, bei denen zuvor keine prädiktiven Risikofaktoren bekannt waren. Entsprechend muss jederzeit mit einer PPH gerechnet und der Blutverlust ab dem Zeitpunkt der Geburt konsequent erfasst werden.
Blutverlustmessung als diagnostische Grundlage
Eine zuverlässige Quantifizierung des Blutverlusts ist essenziell. Die visuelle Schätzung ist unzuverlässig und führt meist zur Unterschätzung (11).
Die E-MOTIVE-Studie hat gezeigt, dass die frühzeitige Erkennung und standardisierte Messung der postpartalen Blutung die Rate schwerer Blutungen und damit assoziierter Komplikationen nach der Geburt um rund 60 % senken konnte. Die Intervention erwies sich zudem als kosteneffektiv und praktikabel in ressourcenarmen Umgebungen (12).
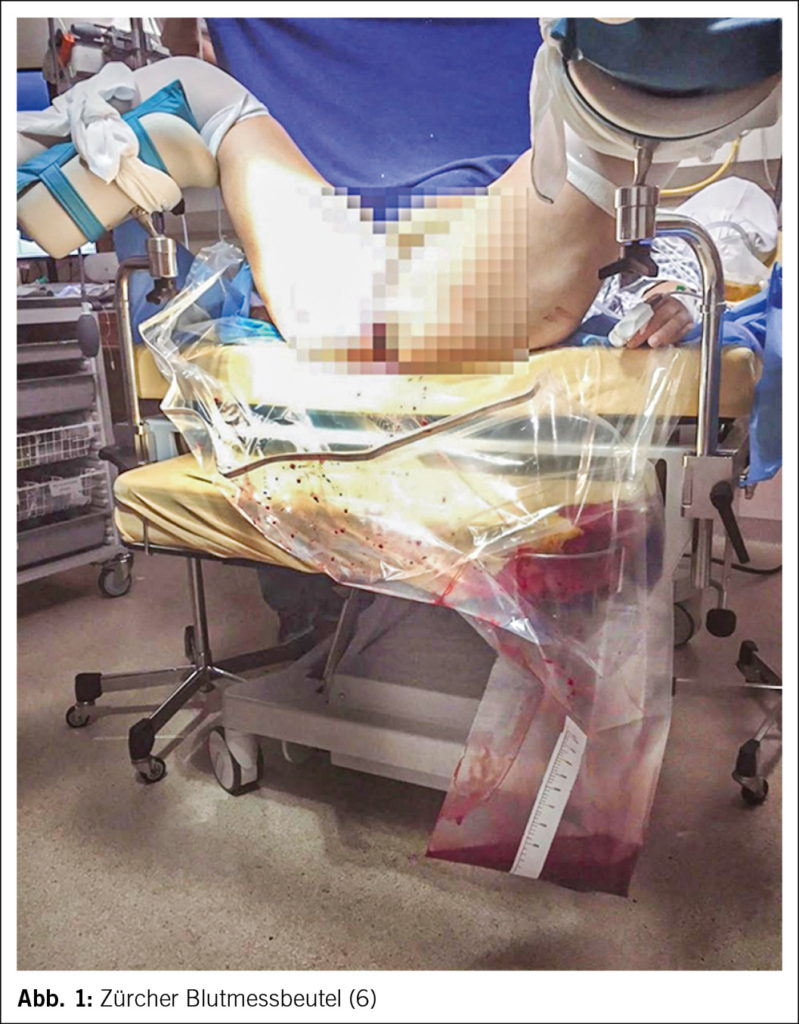
Am USZ wird bei vaginalen Geburten nach der Kindsentwicklung eine neue Unterlage unter das Gesäss gegeben; diese Unterlage wird gewogen (Babywaagen in jedem Gebärsaal) und danach niederschwellig der Zürcher Blutmessbeutel eingesetzt (Abb. 1). Bei einer Sectio wird zunächst das Fruchtwasser abgesaugt, die Flüssigkeitsmenge registriert und sämtliche weitere Flüssigkeit als Blut gewertet; ausserdem werden Blut-getränkte Bauchtücher gewogen und das Flüssigkeitsgewicht zur Blutmenge dazugezählt (6). Am USZ wurde gezeigt, dass die Korrelation zwischen gemessenem und berechnetem Blutverlust nach vaginalen Geburten exzellent ist, während bei Sectios tatsächlich niedrige Blutverluste oft überschätzt und – von grösserer Bedeutung – tatsächlich hohe Blutverlustmengen unterschätzt werden (6).
Vorgehen bei postpartaler Hämorrhagie
Unmittelbar nach Feststellen einer übermässigen Blutung erfolgt die Alarmierung des geburtshilflichen ärztlichen Teams sowie einer zusätzlichen Hebamme und zeitnah der Anästhesie. Hierbei ist es entscheidend, die Situation eindeutig als Notfall zu benennen und den geschätzten Blutverlust sowie die bereits eingeleiteten Massnahmen klar zu rapportieren. Ein zweiter intravenöser Zugang erlaubt die Volumensubstitution mit kristalloiden Lösungen. Kolloidale Volumenersatzmittel sind – mindestens am Beginn der PPH – zu vermeiden, da dadurch eine Verschlechterung der Gerinnungssituation verursacht werden kann.
Parallel dazu beginnen das kontinuierliche Monitoring der Vitalparameter sowie die Abklärung der Blutungsursache(n). Die Inspektion der Geburtsverletzungen (manueller Druck, falls traumatisch bedingte Rissblutung!), die manuelle Kontrolle des Uterustonus (kontinuierliche Uteruskompression, falls Atonie!) und der sonographische Ausschluss von Plazentarestgewebe ermöglichen die Orientierung für die nächsten therapeutischen Schritte, welche teils parallel erfolgen müssen.
Medikamentöse Ersttherapie
Nach Ursachenabklärung anhand der «4 T» (Tonus (Uterusatonie 70 %), Trauma (Geburtsverletzung 17 %), Tissue (Plazentaretention oder –rest 20 %), Thrombin (ca. 3 %)) steht bei atonischer PPH die medikamentöse Therapie im Vordergrund (4). Wie oben erwähnt, dürfen trotz aller Neuerungen der letzten Zeit die Basics der Geburtshilfe nicht in Vergessenheit geraten: Im Falle der Uterusatonie muss parallel zum Aufgleisen der weiteren Massnahmen an die Kompression des Uterus gedacht werden («Uterus halten»). Wichtig ist, dass die Gabe von Uterotonika stets in der empfohlenen Dosierung rechtzeitig erfolgt. Mittel der Wahl ist Oxytocin, im Falle der Atonie 3–5 E als Kurzinfusion, gefolgt von 10–40 IE in 500-1000 ml als Dauertropfinfusion innert 30 Minuten (4). Bei anhaltender Blutung sollte Oxytocin abgesetzt und die Therapie auf Sulproston 500µg in 500 ml, gemäss aktueller AWMF-Leitlinie als Dauertropfinfusion mit deeskalierender Laufgeschwindigkeit (500 ml/h für 3 Minuten, 100 ml/h für 7 Minuten und dann 10–20 ml/h), umgestellt werden. Achtung: Die maximale tägliche Dosis von Sulproston beträgt 1500µg (3 Ampullen). Sulproston darf niemals gleichzeitig mit Oxytocin verabreicht werden (4). Misoprostol sollte aufgrund des verzögerten Wirkungseintritts und der höheren Nebenwirkungsrate nur eingesetzt werden, wenn andere Medikamente nicht verfügbar sind.
Ergänzend sollte frühzeitig Tranexamsäure 1 g i.v. ab einem Blutverlust von 500ml verabreicht werden. Die Gabe sollte idealerweise innerhalb von 20 Minuten nach Diagnosestellung erfolgen, bei persistierender Blutung kann nach 30 Minuten eine zweite Gabe erfolgen. Die frühe Gabe ist mit einer signifikanten Reduktion der maternalen Mortalität assoziiert (13).
Mechanische und interventionelle Verfahren
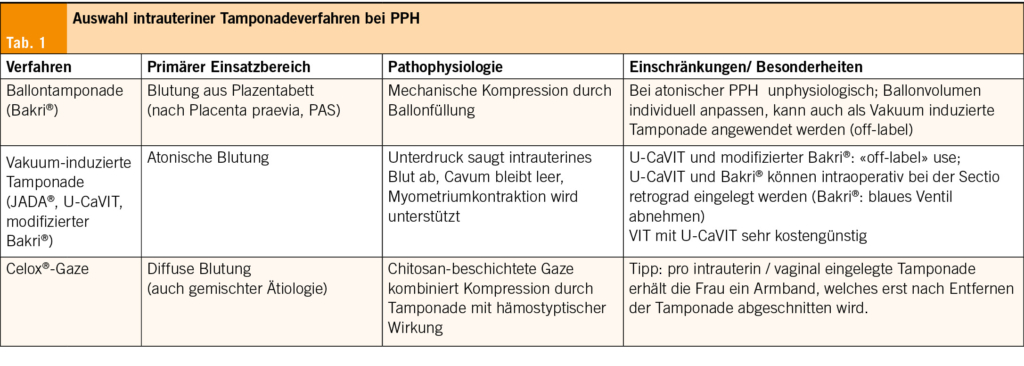
Neben medikamentösen Massnahmen stehen mechanische Verfahren wie die Uterus-Ballon-Tamponade (UBT) seit Jahren zur Verfügung.
Bei der UBT wird ein Ballonkatheter (z. B. Bakri®-Ballon) in die Gebärmutter eingeführt und mit Flüssigkeit gefüllt. Der dadurch entstehende mechanische Druck auf die Uteruswand und die zuführenden Gefässe soll die Blutung stillen. Beobachtungsstudien berichten von Erfolgsraten von 80–90 % (14), randomisierte Daten haben keinen Erfolg bei Uterusatonie gezeigt.
Besonders bei atoner PPH erscheint die Methode pathophysiologisch problematisch, da das Aufdehnen des Uteruscavums die notwendige Myometriumkontraktion eher behindern könnte.
Hier setzt eine Neuheit an, die vakuuminduzierte Tamponade (VIT) (15, 16). Anstatt den Uterus zu dehnen, erleichtert sie durch kontinuierlichen Unterdruck das Absaugen von intrauterinem Blut und unterstützt die Volumenreduktion, fördert somit die Kontraktion des Myometriums und unterstützt so den physiologischen Verschluss der Spiralarterien. Das Verfahren wurde 2016 erstmals beschrieben und wird seither in verschiedenen technischen Varianten untersucht resp. angewendet (16).
Das international in Studien vermutlich am besten untersuchte System ist JADA®, ein Einmal-Device mit Vakuumanschluss, welches in den USA zugelassen ist. Zwei prospektive Studien ohne Kontrollgruppen berichten Erfolgsraten von 84–94 %. Einschränkungen sind jedoch die notwendige Zervixdilatation von ≥ 3 cm sowie die fehlende intraoperative Anwendbarkeit bei Sectio. Hinzu kommen die hohen Kosten bei diesem Produkt (17, 18).
Neben JADA® existieren weitere, kostengünstigere Alternativen für die VIT. Am USZ wird seit 2017 ein modifizierter Bakri®-Ballon mit Vakuumanwendung verwendet («off-label»), mit Erfolgsraten bis 100 % bei reiner Uterusatonie (15). Seit 2023 wird am USZ alternativ ein urologischer Katheter für die VIT eingesetzt. Beim sogenannten U-CaVIT-System (Uro-Catheter Vacuum-induced Tamponade) verwenden wir zur Behandlung einer atonen Nachblutung einen einfachen 24 Ch-Dreilumen-Katheter mit geringer Ballonfüllung zur Etablierung eines intrauterinen Vakuums. Beide Systeme (Bakri®-Ballon und U-CaVIT) werden auch bei Kaiserschnitten eingesetzt, mit problemloser intraoperativer Anwendung (retrograde Einlage durch offene Uterotomie).
Die vakuuminduzierte intrauterine Tamponade stellt eine pathophysiologisch überzeugende, praktikable und je nachdem kostengünstige Ergänzung im PPH-Management dar. Bevor sie jedoch breit eingeführt wird, sind randomisierte kontrollierte Studien erforderlich, um die Wirksamkeit und Sicherheit im Vergleich zu anderen Therapieansätzen zweifelsfrei zu belegen.
Hämostyptische Gazen können bei diffuser Blutung in diversen Situationen (Plazentabettblutung, Trauma) hilfreich sein. Die Anwendung der chitosanbeschichteten Celox®-Tamponade zeigte in einer grossen Registerkohorte eine hohe Erfolgsrate bei der Behandlung postpartaler Hämorrhagien (Gesamterfolg 91.3 %) (19). Der Wirkmechanismus des chitosanbeschichteten Tampons beruht auf der Bildung eines Gerinnungspfropfs, der die Blutung mechanisch abdichtet und die lokale Hämostase unterstützt. Die Tamponade kann als rasch einsetzbare Massnahme eingesetzt werden und bietet eine praktikable Alternative zu den oben erwähnten intrauterinen Methoden (Tab. 1).
Bzgl. des konkreten Vorgehens ist es so, dass am USZ bei klassischer Atonie mittlerweile routinemässig die vakuuminduzierte Uterustamponade (VIT) angewendet wird und hier vor allem das U-CaVIT System. Sowohl Bakri®-Ballon als auch U-CaVIT-Katheter sind einfach in der Handhabung, sowohl nach vaginalen Geburten, aber auch nach resp. während Sectios. Bei Kaiserschnitten ist eine retrograde Einlage intraoperativ durch die offene Uterotomie problemlos möglich, wobei das Katheterende durch eine Hilfsperson vaginal entgegengenommen werden muss und nach aussen geleitet wird. Eine mögliche Limitation bei Sectios könnte bei jenen Frauen bestehen, bei denen die Cervix noch sehr eng und verschlossen ist; hier kann der Bakri®-Ballon etwas einfacher als der U-CaVIT-Katheter retrograd platziert werden (alternativ vorgängig vorsichtiges Dilatieren der Cervix). Der zweite Grund, den Bakri®-Ballon und nicht den urologischen Katheter einzusetzen, ist bei Frauen mit Blutung aus dem isthmischen Plazentabett (etwa bei Sectio wegen Plazentatiefsitz oder Plazenta praevia). Insbesondere bei Blutungen im isthmischen Bereich des Uterus, wo sich der Uterus aufgrund der Anatomie generell nicht gut kontrahieren kann, dürfte die eingangs beschriebene UBT ihre Berechtigung haben. Möglicherweise könnte bei diesen Patientinnen eine Kombination der mechanischen Kompression auf das Plazentabett durch einen stärker gefüllten Bakri®-Ballon («UBT») mit dem applizierten Vakuum («VIT») von Vorteil sein, indem eine sekundäre Atonie (durch intrauterine Blutansammlung oberhalb des Ballons) infolge des angesetzten Vakuums vermieden wird und eine starke Uteruskontraktion unterstützt wird. Erste Erfahrungen zur VIT mit Bakri®-Ballon sowie die einzelnen Schritte der Handhabung (diese sind gleich wie bei U-CaVIT) können in der entsprechenden Publikation detailliert nachgelesen werden (15). Zusammengefasst wird der Ballon – im Unterschied zur konventionellen Ballontamponade – lediglich mit 50–100 ml 0.9 % NaCl gefüllt (in unserer sehr mechanistischen Vorstellung soll dies dem intrauterinen Verbleib des Ballons dienen – ob ein Ballon überhaupt nötig ist bei der VIT, werden zukünftige Studien zeigen). Über einen Verbindungsschlauch wird der Ballon an das Vakuumgerät angeschlossen, an dem ein Unterdruck von 60–70 kPa eingestellt wird. Eine erfolgreiche Behandlung der Atonie durch VIT zeigt sich dadurch, dass nach dem Absaugen des intrauterinen Blutes innert Minuten eine gute Uteruskontraktion mit kaum noch frisch angesaugtem Blut im Auffangbeutel zu beobachten ist. Bei kontinuierlichem Ansaugen von relevanten Blutmengen funktioniert VIT nicht; hier muss differentialdiagnostisch neben der Atonie an weitere Ursachen für die PPH gedacht werden (Plazentarest, Trauma Uterus oder Geburtswege, Blutung aus isthmischem Uterinbereich).
Persistiert die Blutung weiterhin, sind chirurgische oder interventionell-radiologische Verfahren indiziert. Die Embolisation der Aae. uterinae bietet bei hämodynamisch stabilen Patientinnen eine uterus-erhaltende Option (20). Intraoperativ kann eine B-Lynch-Naht oder andere Kompressionsnähte zur myometranen Kompression eingesetzt werden (21), wobei am USZ seit Einführung von VIT gar keine Kompressionsnähte mehr durchgeführt wurden. Die Hysterektomie bleibt das Verfahren der letzten Wahl und sollte in einem vorbereiteten Setting ohne Verzögerung erfolgen, wenn andere Massnahmen versagen (4). Am USZ sind Hysterektomien im Anschluss an schwere atonische PPH nach Einführung der oben genannten Neuerungen zur absoluten Rarität geworden.
Gerinnungsmanagement
Eine point-of-care-Diagnostik wie ROTEM® kann helfen, die Gerinnselfestigkeit schnell zu überprüfen und die Therapie gezielt einzuleiten. Mit den üblichen bedside-Tests wird vor allem eine Hypofibrinogenämie verlässlich angezeigt. Jede schwere PPH führt rasch zu einer erworbenen Koagulopathie. Neben der frühzeitigen Gabe von Tranexamsäure sind die Sicherung der Normothermie, ein pH-Wert ≥ 7.2 und ein ionisiertes Kalzium > 0.9 mmol/l entscheidend (22).
Drei von drei randomisiert kontrollierten Studien (aus Dänemark, UK, Frankreich) zeigten allerdings keinen Nutzen einer Fibrinogengabe am Beginn einer schweren PPH – weder bei klinisch hohem Blutverlust mit notwendigem Therapiewechsel noch FIBTEM-gesteuert (23, 24, 25). Eine prospektive Studie mit 1300 Gebärenden zeigte eine hochsignifikante Assoziation von präpartaler Konzentration des Gerinnungsfaktors XIII mit dem postpartalen Blutverlust (26). Die Ergebnisse der aktuell in mehreren schweizerischen Kliniken laufenden multizentrischen, randomisierten, kontrollierten SWIFT-Studie werden Klarheit zum Einsatz von Faktor XIII bei der PPH bringen (27). Der Einsatz von Faktor XIII würde aufgrund seiner Gerinnsel-stabilisierenden und Fibrinolyse-hemmenden Eigenschaften pathophysiologisch jedenfalls Sinn machen. Daten aus anderen chirurgischen Fächern sind vielversprechend bei zudem exzellentem Safety-Profile.
Bei schwerem Blutverlust ist die Gabe von rekombinantem Faktor VIIa (rFVIIa) zugelassen, wenn trotz Uterotonika keine ausreichende Hämostase erreicht wird.
Entsprechend der aktuellen D-A-CH-Leitlinie sollte rFVIIa aber höchstens zum Einsatz kommen, wenn die Patientinnen mit anderen Blutprodukten adäquat vorbehandelt wurden und andere Methoden zur Blutstillung ungenügend wirksam waren (4). Es gibt bislang nur eine einzige randomisiert-kontrollierte Studie zum Einsatz von rFVIIa bei der schweren PPH mit insgesamt 84 Frauen. Dabei zeigte sich ein positiver Effekt in Bezug auf verringerten Einsatz von invasiven Zweitlinienbehandlungen nach Gabe von rFVIIa, jedoch hatten auch 2 von 42 Frauen in der rFVIIa-Gruppe thromboembolische Ereignisse (eine Ovarialvenenthrombose und eine Lungenembolie nach tiefer Beinvenenthrombose) ((28). Vor einem breiten Einsatz von rFVIIa sollte insofern auf grössere prospektive Studien mit überzeugenden Daten zur Sicherheit gepocht werden. Retrospektive Untersuchungen, Register ausserhalb prospektiver Interventionsstudien oder Reviews stellen keine ausreichende Evidenz dar. Entsprechend kommt rFVIIa am USZ nur in Ausnahmesituationen zum Einsatz (etwa bei seltenen Thrombozytopathien).
Teamarbeit und Kommunikation
Ein strukturierter Austausch zwischen den verschiedenen Berufsgruppen (ÄrztInnen, Hebammen, AnästhesistInnen) ist in Notfallsituationen entscheidend. Die erfolgreiche Behandlung der PPH erfordert ein koordiniertes, interdisziplinäres Vorgehen. Standardisierte Kommunikationsprotokolle mit klarer Benennung des Problems, konkreten Handlungsanweisungen, Zeitvorgaben und Rückmeldungen («close the loop») verbessern die Abläufe (29). Gleichzeitig soll das Team Ruhe bewahren und die Patientin bzw. das Paar über die laufenden Massnahmen und geplanten Schritte informieren. Regelmässiges interprofessionelles Simulationstraining stärkt sowohl technische als auch kommunikative Kompetenzen.
Langzeitfolgen
Postpartale Hämorrhagien können neben den akuten physischen Komplikationen auch erhebliche psychologische Langzeitfolgen haben (Angststörungen, Depressionen oder Symptome einer posttraumatischen Belastungsstörung) (30). Als wichtigster Risikofaktor für psychologische Langzeitprobleme wurden dabei der «Transfer in den Operationssaal» identifiziert, neben den Bereichen «angespannte Atmosphäre» und «Alarmrufe»; weitere identifizierte Bereiche waren Vermittlung von Sicherheit durch «verständliche Information» und «Trennung von Partner und/ oder Kind». Entsprechend sollen die genannten Punkte vermieden werden. Die sogenannten Soft Skills erfordern Zusammenarbeit im interdisziplinären Team und entsprechendes Training. Eine psychologische oder psychotherapeutische Betreuung könnte in manchen Fällen angezeigt sein.
Fazit
Die PPH erfordert eine sofortige und strukturierte Behandlung. Frühzeitige Erkennung, konsequente Blutverlustmessung ab dem Zeitpunkt der Geburt, parallele diagnostische und therapeutische Schritte sowie eine funktionierende Teamkoordination sind entscheidend für den Therapieerfolg.
Copyright
Aerzteverlag medinfo AG
Universitätsspital Zürich
Rämistr.100
8091 Zürich
Universitätsspital Zürich
Rämistr.100
8091 Zürich
Universitätsspital Zürich
Rämistr.100
8091 Zürich
Die Autorenschaft hat keine Interessenskonflikte in Zusammenhang mit diesem Artikel deklariert.
- Früherkennung rettet Leben: Postpartale Hämorrhagie (PPH) ist weltweit eine der führenden Ursachen maternaler Mortalität – entscheidend sind frühzeitige Diagnose, konsequente Blutverlustmessung und sofortiges Handeln.
- Quantitative Blutverlustmessung ist unverzichtbar: Visuelle Schätzungen unterschätzen den Blutverlust häufig. Standardisierte Messverfahren (z.B. Blutmessbeutel, Wägen) verbessern die Erkennung und senken schwere Komplikationen um bis zu 60 %.
- Strukturiertes, interdisziplinäres Management: Das Vorgehen umfasst rasche Alarmierung, Uterotonika (Oxytocin, Sulproston), Tranexamsäure sowie bei Bedarf mechanische Verfahren. Teamkoordination und klare Kommunikation sind entscheidend.
- Ganzheitliche Versorgung einschliesslich psychologischer Aspekte: Neben der Akuttherapie sind Prävention von Langzeitfolgen, gute Aufklärung der Patientin und Simulationstrainings für das Team wichtige Bausteine einer erfolgreichen Versorgung.
- Neue Therapiekonzepte wie die vakuuminduzierte Tamponade oder die Gabe von Gerinnungsfaktoren zeigen vielversprechende Ergebnisse. Diese müssen jedoch in weiteren Studien noch umfassend evaluiert werden.
1. WHO. WHO recommendations: Uterotonics for the prevention of postpartum haemorrhage. Geneva: World Health Organization; 2018.
2. Say L, Chou D, Gemmill A, Tunçalp Ö, Moller AB, Daniels J, et al. Global causes of maternal death: a WHO systematic analysis. Lancet Glob Health 2014;2:e323–33.
3. WHO. Recommendations: prevention and treatment of postpartum haemorrhage. Geneva: World Health Organization; 2012.
4. D-A-CH-Leitlinie Postpartale Hämorrhagie. AWMF 015/063; 2022.
5. Carroli G, Cuesta C, Abalos E, Gulmezoglu AM. Epidemiology of postpartum haemorrhage: a systematic review. Best Pract Res Clin Obstet Gynaecol 2008;22:999–1012.
6. Kahr MK, Brun R, Zimmermann R, Franke D, Haslinger C. Validation of a quantitative system for real-time measurement of postpartum blood loss. Arch Gynecol Obstet. 2018 Dec;298(6):1071-1077. Epub 2018 Sep 17. PMID: 30225686.
7. Bell SF, Watkins A, John M, Macgillivray E, Kitchen TL, James D, Scarr C, Bailey CM, Kelly KP, James K, Stevens JL, Edey T, Collis RE, Collins PW. Incidence of postpartum haemorrhage defined by quantitative blood loss measurement: a national cohort. BMC Pregnancy Childbirth. 2020 May 6;20(1):271. PMID: 32375687; PMCID: PMC7201938.
8. Knight M, Callaghan WM, Berg C, Alexander S, Bouvier-Colle MH, Ford JB, et al. Trends in postpartum haemorrhage in high-income countries. BMC Pregnancy Childbirth 2009;9:55.
9. Jauniaux E, Ayres-de-Campos D, Langhoff-Roos J, Fox KA, Collins S, FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. Diagnosis and management of placenta accreta spectrum. Am J Obstet Gynecol 2019;221:219–34.
10. Mentzoni CT, Klungsøyr K, Engjom HM. Trends in severe postpartum haemorrhage among nulliparous women with spontaneous onset of labour: A population-based cohort study. BJOG. 2024 Oct;131(11):1475-1483. Epub 2024 May 10. PMID: 38726911.
11. Toledo P, McCarthy RJ, Hewlett BJ, Fitzgerald PC, Wong CA. The accuracy of blood loss estimation after vaginal delivery. Anesth Analg 2007;105:1736–40.
12. Vannevel V, Okunade K, Gidiri MF, et al.; E-MOTIVE Trial Collaborators. Early detection of postpartum hemorrhage and care using a bundle approach (E-MOTIVE): a cluster-randomised trial. N Engl J Med. 2023;389(19):
13. WOMAN Trial Collaborators. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with postpartum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet 2017;389:2105–16.
14. Doumouchtsis SK, Papageorghiou AT, Arulkumaran S. Systematic review of conservative management of postpartum haemorrhage: what to do when medical treatment fails. BJOG 2008;115:599–608.
15. Haslinger C, Weber K, Zimmermann R. Vacuum-Induced Tamponade for Treatment of Postpartum Hemorrhage. Obstet Gynecol. 2021 Sep 1;138(3):361-365. PMID: 34352848; PMCID: PMC8366764.
16. Purwosunu Y, Sarkoen W, Arulkumaran S, Segnitz J. Control of Postpartum Hemorrhage Using Vacuum-Induced Uterine Tamponade. Obstet Gynecol. 2016 Jul;128(1):33-36.
17. D’Alton ME, Rood KM, Smid MC, et al. Intrauterine vacuum-induced hemorrhage-control device for rapid treatment of postpartum hemorrhage. Obstet Gynecol. 2020 Nov;136(5):882–891.
18. Goffman, Dena MD; Rood, et al. Real-World Utilization of an Intrauterine, Vacuum-Induced, Hemorrhage-Control Device. Obstetrics & Gynecology 142(5):p 1006-1016, November 2023
19. Leichtle, C., Aigner, A., Biele, C. et al. Chitosan-covered tamponade for the treatment of postpartum hemorrhage: a registry-based cohort study assessing outcomes and risk factors for treatment failure. BMC Pregnancy Childbirth 25, 120 (2025).
20. Salomon LJ, deTayrac R, Castaigne V, et al. Fertility and pregnancy outcome following pelvic arterial embolization for severe postpartum haemorrhage: a cohort study. BJOG 2003;110:926–30.
21. B-Lynch C, Coker A, Lawal AH et al. The B-Lynch surgical technique for the control of massive postpartum haemorrhage: an alternative to hysterectomy? Five cases reported. BJOG 1997;104:372–5.
22. Hunt BJ. The coagulopathy of postpartum haemorrhage. Curr Opin Hematol 2015;22:460–7.
23. Wikkelsø AJ, Edwards HM, Afshari A, Stensballe J, Langhoff-Roos J, Albrechtsen C, et al. Pre-emptive treatment with fibrinogen concentrate for postpartum haemorrhage: randomized controlled trial. Br J Anaesth 2015;114:623–33.
24. Collins PW, Cannings-John R, Bruynseels D, Mallaiah S, Dick J, Elton C, et al. Viscoelastometric-guided early fibrinogen concentrate replacement during postpartum haemorrhage (OBS2): a double-blind randomized controlled trial. Br J Anaesth 2017;119:411–21.
25. Ducloy-Bouthors AS, Mercier FJ, Grouin JM, Bayoumeu F, Corouge J, Le Gouez A, et al. Early and systematic administration of fibrinogen concentrate in postpartum haemorrhage following vaginal delivery: the FIDEL randomized controlled trial. BJOG 2021;128:1814–23.
26. Haslinger C, Korte W, Hothorn T et al, The impact of prepartum factor XIII activity on postpartum blood loss. J Thromb Haemost. 2020 Jun;18(6):1310-1319. doi: 10.1111/jth.14795. Epub 2020 Apr 16. PMID: 32176833.
27. Haslinger C, Hothorn T et al. Effects of early factor XIII replacement in postpartum haemorrhage: study protocol for a multicentre, open label, randomised, controlled, investigator initiated trial. BMJ Open. 2025 May 8;15(5):e100262
28. Lavigne-Lissalde G, Aya AG, Mercier FJ, et al. Recombinant human FVIIa for reducing the need for invasive second-line therapies in severe refractory postpartum hemorrhage: a multicenter, randomized, open controlled trial. J Thromb Haemost. 2015 Apr;13(4):520-9. Epub 2015 Mar 11. PMID: 25594352.
29. Haslinger, C. (2019). „Postpartale Hämorrhagie: effiziente Teamarbeit ist das A und O.“ Der Gynäkologe 52.
30. Latt. Plos one 2023. Primary postpartum haemorrhage and longer-term physical, psychological, and psychosocial health outcomes for women and their partners in high income countries: A mixed-methods systematic review.
info@gynäkologie
- Vol. 15
- Ausgabe 5
- Oktober 2025