- Quels vaccins pour les personnes ≥ 65 ans?
Avec le vieillissement de la population, chaque médecin sera amené à prendre en charge des patients plus âgés, à risque accru de développer des formes sévères d’ infection et de décompenser des comorbidités telles l’ insuffisance cardiaque ou les maladies pulmonaires chroniques; des mesures de prévention sont donc indispensables. La vaccination constitue une des stratégies les plus efficaces. Dès l’ âge de 65 ans, plusieurs vaccins sont recommandés. Entre la grippe, le COVID-19, le zona, les pneumocoques, le tétanos et le virus respiratoire syncytial, il n’ est pas toujours facile de s’ y retrouver. Cet article propose aux cliniciens des outils pratiques et des recommandations pour améliorer la couverture vaccinale de leurs patients âgés de 65 ans et plus.
With the aging of the population, every healthcare worker will take care of older patients, who are at higher risk of developing severe infections and decompensation of their comorbidities. Preventive measures are therefore essential, and vaccination is one of the most effective strategies. From the age of 65, several vaccines are recommended. With influenza, COVID-19, shingles, pneumococcus, tetanus, and respiratory syncytial virus, it can be confusing. This article provides clinicians with practical tools and recommendations to help improve vaccine coverage among patients aged 65 and older.
Keywords: Vaccine-preventable diseases, Vaccination recommendations, prevention, gerontology, Vaccine hesitancy
Introduction
La population âgée de 65 ans et plus est en augmentation (1). Selon l’ Organisation Mondiale de la Santé (OMS), un vieillissement en bonne santé repose sur le maintien « des capacités fonctionnelles permettant le bien-être à un âge avancé » (2). La vaccination constitue une mesure préventive sûre et efficace qui contribue à cet objectif. Les personnes de plus de 65 ans ont un risque accru d’ infections sévères avec des complications cardio-respiratoires, neurologiques et une perte d’ autonomie (3). L’ Office Fédérale de la Santé Publique (OFSP) actualise tous les ans le plan de vaccination dont une partie est spécifiquement destinée à cette tranche de la population (4). Pourtant, la couverture vaccinale y reste faible alors qu’ elle est essentielle pour prévenir des maladies graves dans cette population vulnérable. Cet article fournit aux cliniciens et cliniciennes des outils pratiques pour la vaccination des ≥ 65 ans et réactualise les données sur les vaccins conjugués antipneumococciques (PCV) et ceux contre le virus respiratoire syncytial (VRS).
Quels vaccins pour la personne de ≥ 65 ans?
Le système immunitaire évolue au cours de la vie. L’ immunosénescence est caractérisée par des modifications en nombre et en qualité des cellules immunitaires innées et adaptatives en lien avec le vieillissement, comme: une diminution du nombre de cellules B et T naïves, une diminution de la production d’ anticorps et une augmentation de la production de cytokines pro inflammatoires. Un état d’ inflammation chronique de bas grade, appelé «inflammaging», peut ainsi apparaitre et persister. Ces modifications du système immunitaire augmentent le risque de complication en cas d’ infection et réduisent les réponses vaccinales (5, 6). Même si l’ efficacité des vaccins peut être réduite dans cette population, elle permet de diminuer la sévérité de la maladie et de limiter les hospitalisations, les complications et la mortalité (7).
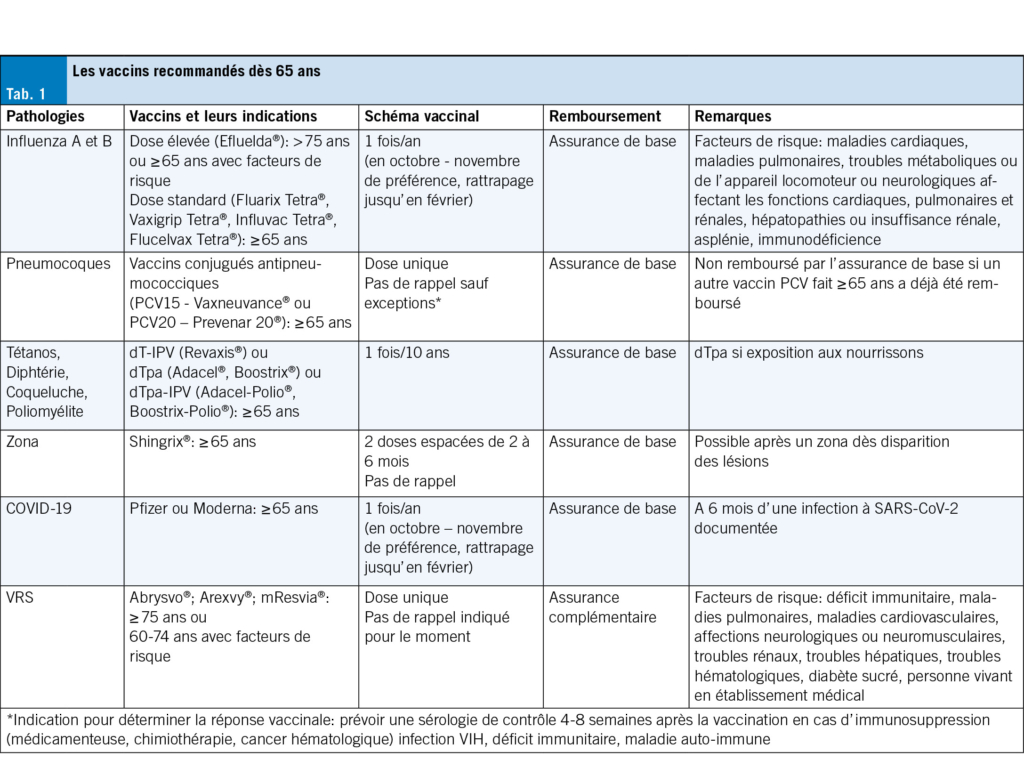
Les vaccins recommandés dès 65 ans, selon le plan de vaccination de 2025, sont résumés dans le Tab. 1 (4).
Vaccins contre la grippe saisonnière
Les personnes de 65 ans et plus infectées par le virus de la grippe sont à risque de développer des complications pulmonaires mais aussi extra-pulmonaires. Chaque année, le vaccin est actualisé si nécessaire selon les souches virales en circulation. Son efficacité varie en fonction de l’ âge, des comorbidités mais aussi selon la correspondance entre les souches vaccinales sélectionnées et celles en circulation (8). Pour améliorer la réponse immunitaire chez les personnes âgées, un vaccin à haute dose (HD) contenant quatre fois plus d’ antigène hémagglutinine qu’ un vaccin standard est disponible. Il renforce l’ immunogénicité et réduit d’ environ 15 % le risque d’ hospitalisation liée à la grippe chez les ≥ 65 ans par rapport au vaccin à dose standard (9, 10). Le vaccin antigrippal a pour but d’ éviter les formes sévères de l’ infection, les hospitalisations, les complications mais également de limiter les événements cardiovasculaires et la mortalité (3). En Suisse, le vaccin HD est remboursé chez les personnes ≥ 75 ans et les personnes ≥ 65 ans avec facteurs de risque (Tab. 1). Les vaccins contre la grippe sont sûrs et bien tolérés. En moyenne, 1 personne sur 2 présente des réactions locales (douleur au site d’ injection, rougeur localisée, gonflement ou induration) et 1 personne sur 3 présente des signes généraux (myalgies, fièvre, etc.).
Vaccin contre le COVID-19
Le SARS-CoV-2 circule toujours. En Suisse, la vaccination contre le COVID-19 est recommandée 1x/an à l’ automne pour les personnes âgées de 65 ans et plus (4). La vaccination réduit les risques de formes sévères, d’ hospitalisations, de complications et de décès, mais la protection contre l’ infection et la transmission reste très faible. Selon une étude cas-témoins en Angleterre, l’ efficacité contre les hospitalisations est maximale durant le premier mois (environ 50 %), puis diminue progressivement (jusqu’ à environ 13 %) (11). Cela souligne l’ importance d’ une revaccination annuelle chez les personnes âgées. Les vaccins sont bien tolérés dans cette population. Les effets indésirables, similaires à ceux du vaccin contre la grippe, sont généralement bénins et transitoires. L’ administration de plusieurs doses semble réduire le risque de développer un COVID long (12).
Vaccin contre le Zona
Le zona est lié à la réactivation du virus varicelle-zona (VZV) et se manifeste généralement par une éruption vésiculeuse. Le risque de réactivation du VZV augmente avec l’ âge: une personne sur trois développera un zona au cours de sa vie et une personne sur deux après 85 ans (13). La complication la plus fréquente est la névralgie post-zostérienne, qui peut entrainer une polymédication, une dépression et une perte d’ autonomie. Des complications ophtalmologiques et neurologiques peuvent également survenir (14). Le vaccin recombinant contre le zona (RZV) composé de la glycoprotéine E du VZV (gE) et l’ adjuvant AS01B est administré en deux doses, à un intervalle de 2 à 6 mois. Il réduit de 87 % le risque de névralgie post-zostérienne et 78 % celui de zona ophtalmique (15). L’ efficacité est bien plus faible après une seule dose (15, 16), d’ où l’ importance d’ informer les patients sur la nécessité des deux doses. Le RZV peut être administré après un épisode de zona, dès les lésions cutanées cicatrisées. Son efficacité pour prévenir un épisode de zona persiste dans le temps (70–84 %) sans différence significative selon l’ âge (17,18). Les effets secondaires comme la douleur au site d’ injection, les myalgies, et la fatigue sont fréquents, généralement d’ intensité légère à modérée et transitoires (19). Il est important d’ informer les patients de ces effets secondaires et de les rassurer: une réaction après la première injection ne signifie pas qu’ ils en auront une après la deuxième, et inversement.
Vaccins contre le tétanos, la diphtérie (+/– la coqueluche, +/– la poliomyélite)
Il existe uniquement des vaccins contre le tétanos-diphtérie combinés à la coqueluche et/ou à la poliomyélite. A partir de 65 ans, un rappel contre le tétanos tous les 10 ans est recommandé. En cas d’ exposition aux nourrissons, un vaccin incluant la coqueluche est préconisé. En cas de voyage dans un pays à risque, un vaccin protégeant contre la poliomyélite est indiqué.
Les nouveautés
Vaccins conjugués antipneumococciques
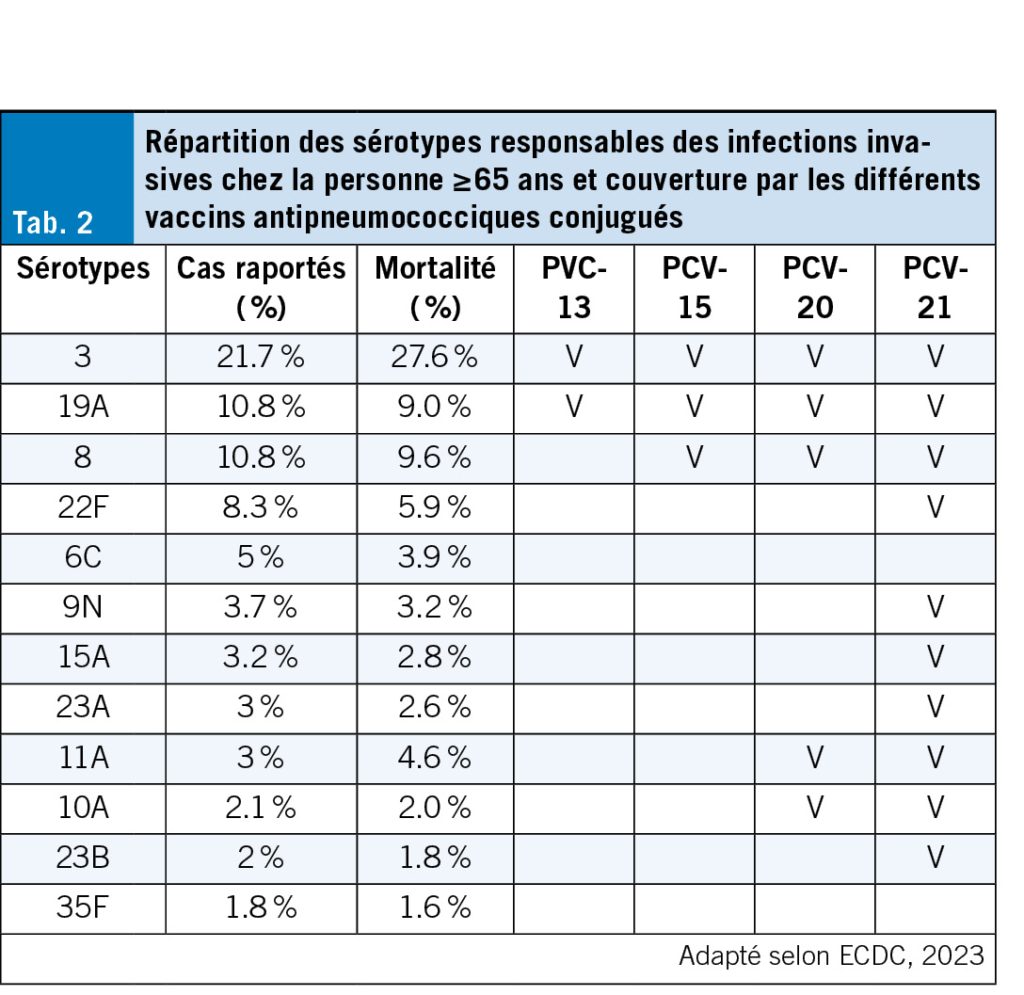
Plus de 100 sérotypes de Streptococcus pneumoniae ont été identifiés et certains sont associés à des maladies invasives comme des bactériémies ou des méningites. L’ incidence et la mortalité des infections invasives à S. pneumoniae touchent principalement les enfants de moins de 5 ans et les adultes de plus de 65 ans (20). Chez ces derniers, une infection à pneumocoques peut entrainer des complications cardiovasculaires, pulmonaires et une perte d’ autonomie. Les vaccins conjugués antipneumococciques (PCV) ont été développés afin d’ améliorer l’ immunogénicité et prolonger la durée de protection (21). Contrairement aux vaccins polysaccharidiques, les PCV associent les polysaccharides à une protéine porteuse, permettant une immunité mémoire et des anticorps à haute affinité (22). En raison de la couverture des sérotypes restreinte des premiers PCV, certains pays ont continué d’ utiliser le vaccin polysaccharidique 23-valent, parfois en l’ administrant après une dose de PCV-13. L’ arrivée des PCV à valence plus élevée (PCV-15, PCV-20) élargit désormais les options. Le Tab. 2 illustre les dix sérotypes de pneumocoques les plus fréquemment responsables d’ infections invasives (IIP) chez les personnes ≥ 65 ans en Europe ainsi que leur couverture par les PCV selon les données du centre Européen de prévention et de contrôle des maladies (ECDC). En Europe, la couverture des sérotypes responsables d’ IIP chez les ≥ 65 ans est d’ environ 33 % pour le PCV13, 43 % pour le PCV15 et 56.7 % pour le PCV-20 (23). Un PCV-21, conçu pour mieux couvrir les sérotypes responsables de maladies invasives chez les personnes âgées, a déjà reçu l’ autorisation de la FDA et de l’ EMA. Il est en cours d’ évaluation par Swissmedic. Ces nouveaux vaccins permettent une meilleure protection que le PPSV-23.
En Suisse, il est recommandé de vacciner les personnes de ≥ 65 ans avec le PCV-15 ou le PCV-20. En cas de vaccination antérieure avec le vaccin polysaccharidique ou PCV-13, une vaccination peut être réalisée un an après le rappel. Attention, si un PCV-13 a été administré à 65 ans ou plus et pris en charge par l’ assurance de base, cette dernière ne remboursera pas le nouveau PCV. Les vaccins conjugués sont sûrs et bien tolérés. Chez les personnes de plus de 65 ans, l’ effet indésirable le plus fréquent est l’ érythème au site d’ injection (30 %), suivi d’ un gonflement localisé (18 %), de la douleur au point d’ injection et de la fatigue.
Vaccins contre le Virus Respiratoire Syncytial
Le VRS est responsable d’ infections respiratoires, allant de simples infections des voies respiratoires supérieures à des infections sévères, potentiellement mortelles, des voies respiratoires inférieures. Il peut aussi entraîner des complications cardiovasculaires ou aggraver certaines comorbidités. Les symptômes cliniques du VRS sont similaires à ceux d’ autres virus respiratoires. Les hospitalisations concernent principalement les adultes avec des pathologies sous-jacentes telles que l’ asthme, la bronchopneumonie chronique obstructive (BPCO) ou l’ insuffisance cardiaque congestive (24).
Trois vaccins contre le VRS sont autorisés et disponibles en Suisse : Abrysvo®, vaccin non adjuvanté contenant la protéine de surface pré-fusion RSVPreF des deux sous-types de VRS (A et B); Arexvy®, vaccin adjuvanté contenant la protéine de surface pré-fusion RSVpreF3 du sous-type de VRS A2 et l’ adjuvant AS01E. Il s’ agit du même adjuvant que dans le Shingrix® mais à mi-dose; et mRESVIA®, vaccin à ARNm codant pour la protéine de surface pré-fusion RSVpreF du sous-type A, encapsulé dans des nanoparticules. Les études de phase 3 n’ ont pas choisi les mêmes critères d’ évaluation ce qui ne permet pas leur comparaison. Leur efficacité contre les infections des voies respiratoires inférieures semble cependant similaire avec un profil de tolérance acceptable (25–27). Une étude aux États-Unis chez les ≥ 60 ans a montré une efficacité vaccinale de 80 % (IC 95 %: 71–85) contre les hospitalisations associées au VRS (28).
En Suisse, ces trois vaccins sont recommandés pour les personnes de 75 ans et plus et de 60–74 ans avec facteurs de risque (Tab. 1). Ils ne sont pas encore remboursés par l’ assurance de base pour cette population. Les données actuelles montrent une durée d’ efficacité d’ au moins 2 saisons après la vaccination avec ces vaccins (29–31). Il n’ est pour le moment pas recommandé d’ effectuer de dose supplémentaire.
Questions – réponses concernant la pratique de la vaccination
Quand et comment vacciner?
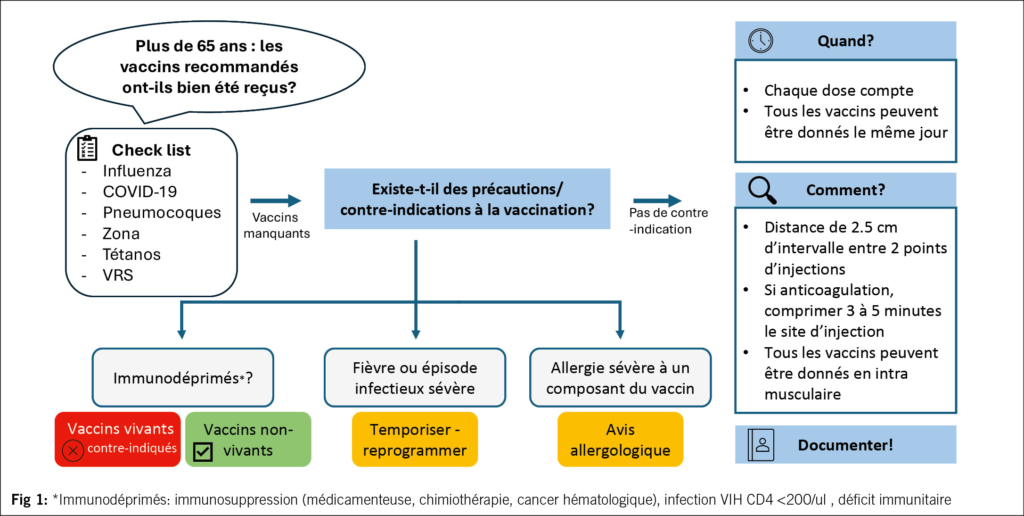
La Fig. 1 reprend les aspects pratiques de la vaccination en termes de modalités d’ injection, de délai entre chaque vaccin et de précautions/contre-indications. La co-administration est sûre et efficace (32). Elle n’ entraine pas plus d’ effets secondaires. Une mise à jour vaccinale peut être réalisée le même jour ou être étalée dans le temps à la convenance des patients et du praticien. Il n’ est jamais trop tard pour mettre à jour les vaccins pour son/sa patient(e).
Les patient(e)s immunodéprimé(e)s en raison de leur pathologie sous-jacente ou des traitements immunosuppresseurs qu’ils reçoivent sont plus à risque de développer des infections et ont une moins bonne réponse humorale aux vaccins (33). Le suivi de la réponse immunitaire pour des vaccins tels que les pneumocoques et le tétanos peut guider les vaccinations ultérieures (doses de rappel, utilisation de doses élevées). Cette analyse est réalisable au laboratoire de vaccinologie des HUG. Les vaccins vivants atténués sont contre-indiqués sous immunosuppression en raison du risque de maladie vaccinale.
Quels outils pour y penser?
Le manque de connaissance, le manque de temps du personnel de santé pour la prévention, l’ absence de documentation de l’ anamnèse vaccinale, la vaccino-hésitance des patients et des soignants, la diffusion de fausses informations, le coût et l’ accès à certains vaccins sont des exemples de freins à la vaccination.
Soutenue par l’ OFSP, la plateforme Infovac (www.infovac.ch) est composée d’ un réseau d’ experts en vaccination qui fournit des informations régulièrement mises à jour sur les maladies à prévention vaccinales et un service de réponses aux questions sur la vaccination aux abonnés.
Encourager les patients à compléter leur carnet de vaccination est un moyen d’ améliorer la documentation. Certains dossiers personnalisés informatiques ont un endroit spécifique pour rapporter les vaccinations. Identifier de manière systématique les patients non à jour et mettre en place des protocoles de vaccination facilitent la mise à jour vaccinale (34). Tous les professionnels de santé, y compris en intra hospitalier, jouent un rôle pour lutter contre la désinformation et la promotion de la vaccination. La vaccination en intra hospitalier ne prolonge pas la durée d’ hospitalisation. Elle est même associée à une diminution des réhospitalisations (35).
L’ admission en établissement médico-social est un moment stratégique pour évaluer le statut vaccinal des patients et les informer ainsi que leurs représentants thérapeutiques sur les vaccins à réaliser. Chaque année une campagne d’ information contre la grippe et le COVID-19 devrait permettre d’ assurer une mise à jour de ces vaccinations.
Que dire à mon/ma patient(e) avant de le vacciner?
Il semble primordial que le/la patient(e) comprenne quelles maladies sont prévenues par la vaccination et l’ impact que ces maladies peuvent avoir pour qu’ il/elle adhère aux propositions de vaccination. Informer son/sa patient(e) des possibles effets secondaires des vaccins permet également une meilleure acceptabilité pour les vaccinations futures.
Comment faire face à un patient vaccino-hésitant?
Une approche motivationnelle contrairement à une approche factuelle permet d’ accompagner les patients vaccino-hésitants et/ou leurs représentants thérapeutiques en cas de troubles cognitifs vers une meilleure adhésion aux vaccins. Un entretien motivationnel se déroule généralement en plusieurs étapes: créer une relation de confiance en écoutant avec empathie, sans porter de jugement, explorer et comprendre les raisons personnelles de l’ hésitation de la personne afin d’ identifier le type d’ information qui pourrait modifier son point de vue, avec sa permission, fournir des informations claires et pertinentes qui soutiennent une prise de décision éclairée et autonome et respecter son autonomie tout en guidant la conversation vers une vision plus positive de la vaccination (36).
Conclusion
Les maladies infectieuses comptent parmi les principales causes de mortalité chez les personnes âgées de 65 ans et plus. La vaccination est une mesure de prévention sûre et efficace; elle protège contre l’ infection mais aussi contre les hospitalisations, les décompensations de comorbidités et la perte d’ autonomie. Pourtant, les taux de couverture vaccinale restent faibles dans cette population à risque. Mettre en place des programmes de vaccination adaptés aux besoins des seniors, tout en renforçant l’ information et la communication, peut contribuer à diminuer l’ hésitance vaccinale et à mieux protéger les 65 ans et plus.
Copyright
Aerzteverlag medinfo AG
Service de médecine interne de l’ âgé
Département de Réadaptation et Gériatrie
Hôpitaux Universitaires de Genève
– Service de médecine interne de l’ âgé
Département de Réadaptation et Gériatrie
Hôpitaux Universitaires de Genève
– Service de maladies infectieuses
Département de Médecine
Hôpitaux Universitaires de Genève
Centre de vaccinologie
Hôpitaux Universitaires de Genève
Service de médecine interne de l’ âgé
Département de Réadaptation et Gériatrie
Hôpitaux Universitaires de Genève
Les autrices n’ ont pas déclaré de conflit d’ intérêts en rapport avec cet article
- Les personnes ≥ 65 ans sont plus à risque de développer des infections sévères et de faire des complications notamment cardio-respiratoires et neurologiques après une infection.
- La vaccination est une mesure de prévention sûre et efficace qui permet de limiter les infections à prévention vaccinale, leur sévérité et leurs complications.
- La vaccination a également un effet indirect cardioprotecteur et sur la mortalité toute cause confondue.
- Penser à la vaccination, informer les patients voire leur famille, répondre à leurs interrogations, documenter et mettre à jour les vaccins selon les recommandations sont autant d’ étapes essentielles à intégrer dans la pratique quotidienne pour protéger nos patients et préserver leur autonomie.
1. Ageing and health [Internet]. [cité 18 juill 2024]. Disponible sur: https://www.who.int/news-room/fact-sheets/detail/ageing-and-health
2. WHO’ s work on the UN Decade of Healthy Ageing (2021-2030) [Internet]. [cité 5 août 2024]. Disponible sur: https://www.who.int/initiatives/decade-of-healthy-ageing
3. Addario A, Célarier T, Bongue B, Barth N, Gavazzi G, Botelho-Nevers E. Impact of influenza, herpes zoster, and pneumococcal vaccinations on the incidence of cardiovascular events in subjects aged over 65 years: a systematic review. GeroScience. déc 2023;45(6):3419‑47.
4. Plan de vaccination suisse [Internet]. [cité 1 juill 2025]. Disponible sur: https://www.bag.admin.ch/fr/plan-de-vaccination-suisse
5. Chambers ES, Akbar AN. Can blocking inflammation enhance immunity during aging? J Allergy Clin Immunol. mai 2020;145(5):1323‑31.
6. Ecarnot F, Maggi S. Vaccination against Respiratory Infections in the Immunosenescent Older Adult Population: Challenges and Opportunities. Semin Respir Crit Care Med. févr 2025;46(1):53‑62.
7. Ciarambino T, Crispino P, Buono P, Giordano V, Trama U, Iodice V, et al. Efficacy and Safety of Vaccinations in Geriatric Patients: A Literature Review. Vaccines. 24 août 2023;11(9):1412.
8. Recommended composition of influenza virus vaccines for use in the 2025-2026 northern hemisphere influenza season [Internet]. [cité 25 juin 2025]. Disponible sur: https://www.who.int/publications/m/item/recommended-composition-of-influenza-virus-vaccines-for-use-in-the-2025-2026-nh-influenza-season
9. DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, et al. Efficacy of high-dose versus standard-dose influenza vaccine in older adults. N Engl J Med. 14 août 2014;371(7):635‑45.
10. Lee JKH, Lam GKL, Shin T, Samson SI, Greenberg DP, Chit A. Efficacy and effectiveness of high-dose influenza vaccine in older adults by circulating strain and antigenic match: An updated systematic review and meta-analysis. Vaccine. 15 mars 2021;39 Suppl 1:A24‑35.
11. Kirsebom FCM, Stowe J, Bernal JL, Allen A, Andrews N. Effectiveness of autumn 2023 COVID-19 vaccination and residual protection of prior doses against hospitalisation in England, estimated using a test-negative case-control study. J Infect [Internet]. 1 juill 2024 [cité 25 juin 2025];89(1). Disponible sur: https://www.journalofinfection.com/article/S0163-4453(24)00111-7/fulltext
12. Byambasuren O, Stehlik P, Clark J, Alcorn K, Glasziou P. Effect of covid-19 vaccination on long covid: systematic review. BMJ Med. 2023;2(1):e000385.
13. Forbes HJ, Thomas SL, Langan SM. The Epidemiology and Prevention of Herpes Zoster. Curr Dermatol Rep. 1 mars 2012;1(1):39‑47.
14. Kennedy PGE. The Spectrum of Neurological Manifestations of Varicella-Zoster Virus Reactivation. Viruses. 30 juill 2023;15(8):1663.
15. Zerbo O, Bartlett J, Fireman B, Goddard K, Duffy J, Glanz J, et al. Recombinant Zoster Vaccination and Risk of Postherpetic Neuralgia or Zoster Ophthalmicus. JAMA Netw Open. 10 juin 2025;8(6):e2514615.
16. Zerbo O, Bartlett J, Fireman B, Lewis N, Goddard K, Dooling K, et al. Effectiveness of Recombinant Zoster Vaccine Against Herpes Zoster in a Real-World Setting. Ann Intern Med. févr 2024;177(2):189‑95.
17. Izurieta HS, Wu X, Forshee R, Lu Y, Sung HM, Agger PE, et al. Recombinant Zoster Vaccine (Shingrix): Real-World Effectiveness in the First 2 Years Post-Licensure. Clin Infect Dis Off Publ Infect Dis Soc Am. 15 sept 2021;73(6):941‑8.
18. Boutry C, Hastie A, Diez-Domingo J, Tinoco JC, Yu CJ, Andrews C, et al. The Adjuvanted Recombinant Zoster Vaccine Confers Long-Term Protection Against Herpes Zoster: Interim Results of an Extension Study of the Pivotal Phase 3 Clinical Trials ZOE-50 and ZOE-70. Clin Infect Dis Off Publ Infect Dis Soc Am. 28 avr 2022;74(8):1459‑67.
19. Parikh R, Singer D, Chmielewski-Yee E, Dessart C. Effectiveness and safety of recombinant zoster vaccine: A review of real-world evidence. Hum Vaccines Immunother. 15 déc 2023;19(3):2263979.
20. Humphreys H, Corcoran M, Mereckiene J, Cunney R, Cotter S. Invasive pneumococcal surveillance to assess the potential benefits of extended spectrum conjugate vaccines (PCV15/PCV20) in older adults. Epidemiol Infect. 26 janv 2023;151:e27.
21. Vadlamudi NK, Parhar K, Altre Malana KL, Kang A, Marra F. Immunogenicity and safety of the 13-valent pneumococcal conjugate vaccine compared to 23-valent pneumococcal polysaccharide in immunocompetent adults: A systematic review and meta-analysis. Vaccine. 14 févr 2019;37(8):1021‑9.
22. Pollard AJ, Perrett KP, Beverley PC. Maintaining protection against invasive bacteria with protein-polysaccharide conjugate vaccines. Nat Rev Immunol. mars 2009;9(3):213‑20.
23. Surveillance Atlas of Infectious Diseases [Internet]. [cité 15 juill 2025]. Disponible sur: https://atlas.ecdc.europa.eu/public/index.aspx?Dataset=27&HealthTopic=40
24. Landi SN, Garofalo DC, Reimbaeva M, Scott AM, Jiang L, Cappell K, et al. Hospitalization Following Outpatient Diagnosis of Respiratory Syncytial Virus in Adults. JAMA Netw Open. 19 nov 2024;7(11):e2446010.
25. Walsh EE, Pérez Marc G, Zareba AM, Falsey AR, Jiang Q, Patton M, et al. Efficacy and Safety of a Bivalent RSV Prefusion F Vaccine in Older Adults. N Engl J Med. 20 avr 2023;388(16):1465‑77.
26. Papi A, Ison MG, Langley JM, Lee DG, Leroux-Roels I, Martinon-Torres F, et al. Respiratory Syncytial Virus Prefusion F Protein Vaccine in Older Adults. N Engl J Med. 16 févr 2023;388(7):595‑608.
27. Wilson E, Goswami J, Baqui AH, Doreski PA, Perez-Marc G, Zaman K, et al. Efficacy and Safety of an mRNA-Based RSV PreF Vaccine in Older Adults. N Engl J Med. 14 déc 2023;389(24):2233‑44.
28. Payne AB, Watts JA, Mitchell PK, Dascomb K, Irving SA, Klein NP, et al. Respiratory syncytial virus (RSV) vaccine effectiveness against RSV-associated hospitalisations and emergency department encounters among adults aged 60 years and older in the USA, October, 2023, to March, 2024: a test-negative design analysis. The Lancet. 19 oct 2024;404(10462):1547‑59.
29. Walsh EE, Eiras D, Woodside J, Jiang Q, Patton M, Marc GP, et al. Efficacy, Immunogenicity, and Safety of the Bivalent Respiratory Syncytial Virus (RSV) Prefusion F Vaccine in Older Adults Over 2 RSV Seasons. Clin Infect Dis. 10 févr 2025;ciaf061.
30. Ison MG, Papi A, Athan E, Feldman RG, Langley JM, Lee DG, et al. Efficacy, safety, and immunogenicity of the AS01E-adjuvanted respiratory syncytial virus prefusion F protein vaccine (RSVPreF3 OA) in older adults over three respiratory syncytial virus seasons (AReSVi-006): a multicentre, randomised, observer-blinded, placebo-controlled, phase 3 trial. Lancet Respir Med. juin 2025;13(6):517‑29.
31. Priddy F. – Safety & Immunogenicity in 18-59 Year Olds at increased Risk for RSV Disease* – Revaccination of Adults at 12 or 24 Months. 2025;
32. Chang YC, Chou YJ, Liu JY, Yeh TF, Huang N. Additive benefits of pneumococcal and influenza vaccines among elderly persons aged 75 years or older in Taiwan–a representative population-based comparative study. J Infect. sept 2012;65(3):231‑8.
33. Eperon G, Bühler S, Enriquez N, Vaudaux B. [The immunosuppressed traveler : vaccination guidelines]. Rev Med Suisse. 2 mai 2018;14(605):922‑33.
34. Frangos E, Barratt J, Michel JP, Ecarnot F. Vaccines in Long-Term Care Settings: A Narrative Review. Gerontology. 2024;70(3):241‑7.
35. Tartof SY, Qian L, Liu ILA, Tseng HF, Sy LS, Hechter RC, et al. Safety of Influenza Vaccination Administered During Hospitalization. Mayo Clin Proc. mars 2019;94(3):397‑407.
36. Verger P, Cogordan C, Fressard L, Gosselin V, Donato X, Biferi M, et al. A postpartum intervention for vaccination promotion by midwives using motivational interviews reduces mothers’ vaccine hesitancy, south-eastern France, 2021 to 2022: a randomised controlled trial. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. sept 2023;28(38):2200819.
la gazette médicale
- Vol. 14
- Ausgabe 6
- November 2025