- Inflammation als Risikofaktor bei Patienten mit etablierter atherosklerotischer Erkrankung
Atherosklerotische Erkrankungen bleiben trotz Kontrolle klassischer Risikofaktoren eine Hauptursache kardiovaskulärer Morbidität und Mortalität, u. a. wegen eines entzündlich bedingten Restrisikos (RIR). Chronische subklinische Inflammation
fördert über das NLRP3-Inflammasom und die IL-1β/IL-6-Achse Plaque-Wachstum, -Instabilität und Thrombogenität. Biomarker wie hs-CRP und IL-6 korrelieren unabhängig von LDL-C mit Ereignissen und können zur Risikostratifikation beitragen. In der CANTOS-Studie senkte Canakinumab kardiovaskuläre Endpunkte, war jedoch mit mehr schweren Infektionen assoziiert. Niedrig dosiertes Colchizin reduziert nicht-tödliche Ereignisse moderat, ohne Mortalitätsvorteil, während Methotrexat wirkungslos blieb. Zukünftig könnten personalisierte, kombinierte lipid- und entzündungsmodulierende Therapien an Bedeutung gewinnen, sofern Langzeitsicherheit und Kosten-Nutzen stimmen.
Despite control of classic risk factors, atherosclerotic diseases remain a major cause of cardiovascular morbidity and mortality, partly due to residual inflammatory risk (RIR). Chronic subclinical inflammation promotes plaque growth, instability, and thrombogenicity via the NLRP3 inflammasome and the IL-1β/IL-6 axis. Biomarkers such as hs-CRP and IL-6 correlate with events independently of LDL-C and can contribute to risk stratification. In the CANTOS study, canakinumab reduced cardiovascular endpoints but was associated with more serious infections. Low-dose colchicine moderately reduces non-fatal events without mortality benefit, while methotrexate remained ineffective. In the future, personalized, combined lipid- and inflammation-modulating therapies could gain importance, provided that long-term safety and cost-benefit are appropriate.
Keywords: Colchizin/Canakinumab, Entzündungsrisiko, NLRP3-Inflammasom, kardiovaskulären Risikostratifikation
Hintergrund
Obwohl wir mittlerweile ein grosses Verständnis für die Pathobiologie und das Management atherosklerotischer Erkrankungen – einschliesslich der koronaren Herzkrankheit (KHK), zerebrovaskulärer Durchblutungsstörungen und der peripheren arteriellen Verschlusskrankheit – besitzen, zählen diese weltweit weiterhin zu den führenden Ursachen für Morbidität und Mortalität (1–3). Daran dürfte sich auch in absehbarer Zukunft wenig ändern (3).
Die klassischen Risikofaktoren wie Dyslipidämie, arterielle Hypertonie, Diabetes mellitus, Nikotinkonsum und auch Adipositas lassen sich häufig durch Lebensstilveränderungen sowie ein breites Spektrum pharmakologischer Therapien wirksam beeinflussen. Dennoch besteht häufig ein relevantes Restrisiko für erneute kardiovaskuläre Ereignisse beziehungsweise das Fortschreiten der atherosklerotischen Erkrankung (engl. Atherosclerotic Cardiovascular Disease, ASCVD) – ein Risiko, das durch die etablierten therapeutischen Massnahmen allein nicht vollständig kontrolliert werden kann. Ein wesentlicher Anteil dieses Restrisikos ist entzündlicher Natur beziehungsweise durch (subklinische) inflammatorische Prozesse bedingt. Entsprechend wurde von verschiedenen Experten und Konsortien der Begriff des residualen inflammatorischen Risikos (engl. Residual Inflammatory Risk, RIR) etabliert.
Chronische, subklinische, Inflammation spielt eine zentrale Rolle bei der Entstehung, Progression und klinischen Manifestation atherosklerotisch bedingter Erkrankungen. Verschiedene zelluläre und humorale inflammatorische Prozesse sind sowohl in den Frühphasen (z. B. endotheliale Dysfunktion, Lipidakkumulation) als auch in den Spätphasen (z.B. Plaque-Instabilität, Thrombogenität) der Atherosklerose massgeblich beteiligt (1).
Dieser Beitrag gibt einen Überblick über die Pathobiologie, klinische Evidenz, praktischen Implikationen sowie antiinflammatorische Therapieansätze bei ASCVD-Patient/-innen und bietet eine aktuelle Zusammenfassung laufender Studien und neuer therapeutischer Entwicklungen.
Pathophysiologische Grundlagen
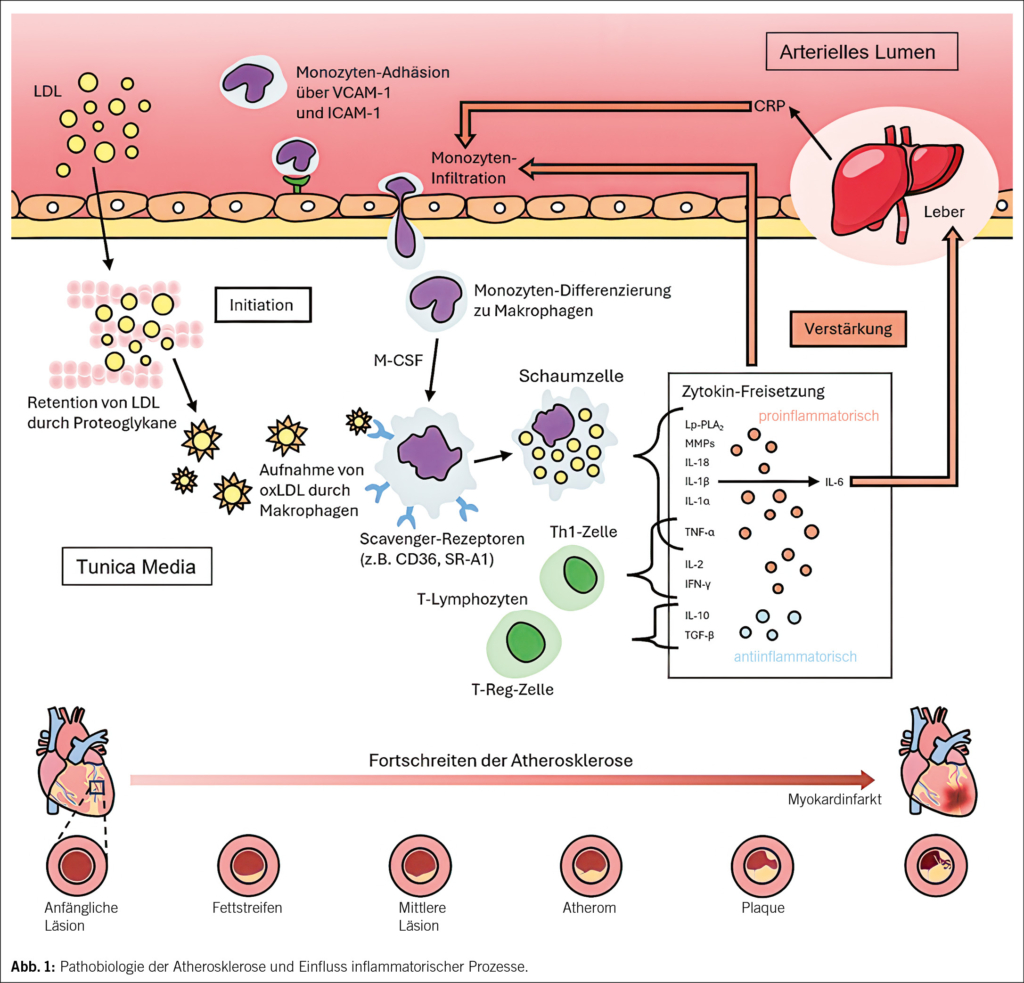
Atherosklerose wird grundsätzlich bereits in frühen Stadien durch eine endotheliale Dysfunktion initiiert. Diese entsteht infolge klassischer Risikofaktoren wie oxidiertem Low-Density-Lipoprotein (oxLDL) respektive Dyslipidämie, arterieller Hypertonie oder Hyperglykämie. OxLDL induziert die Expression von Adhäsionsmolekülen wie VCAM-1 und ICAM-1 auf Endothelzellen und fördert dadurch die Rekrutierung von Monozyten in die Intima (1). Dort differenzieren sich diese zu Makrophagen und entwickeln sich weiter zu Schaumzellen (1, 2, 4). Diese sezernieren proinflammatorische Zytokine wie IL-1β, IL-6 und Tumornekrosefaktor-α (TNF-α), welche die Entzündung in der Gefässwand verstärken und aufrechterhalten (1, 2, 4). Diese chronische Inflammation trägt wesentlich zur Plaque-Entwicklung und -Progression bei.
In diesem Zusammenhang ist besonders das NLRP3-Inflammasom hervorzuheben – ein zellulärer Proteinkomplex, der eine zentrale Rolle in der angeborenen Immunabwehr und bei Entzündungsreaktionen spielt. Nach seiner Aktivierung fördert es die Reifung und Freisetzung von IL-1β, das wiederum die Produktion von IL-6 induziert (1, 2, 4). Letzteres stimuliert die hepatische Synthese von Akut-Phasen-Proteinen, wie dem C-reaktiven Protein (CRP). Hierdurch wird das entzündliche Geschehen weiter vorangetrieben.
Parallel fördern die freigesetzten Entzündungsmediatoren die Expression von Tissue Factor, hemmen die endotheliale NO-Synthese, fördern die Migration glatter Muskelzellen sowie die Aktivierung von Matrix-Metalloproteinasen. Diese Prozesse begünstigen die Plaque-Destabilisierung und erhöhen die Thrombogenität (1, 2, 4).
Die Abb. 1 illustriert die Pathobiologie der Atherosklerose und verdeutlicht den Einfluss inflammatorischer Prozesse.
Inflammatorische Biomarker und Risikostratifikation
Zahlreiche Studien konnten zeigen, dass inflammatorische Biomarker wie hs-CRP, IL-6 und Lipoprotein-assoziierte Phospholipase A2 (Lp-PLA₂) direkt mit dem Risiko für atherosklerotische Ereignisse korrelieren, dem residualen kardiovaskulären Risiko – unabhängig vom Lipidstatus und der Glukosehomöostase (4).
Besonders hervorzuheben sind zwei grosse Beobachtungsstudien – die Framingham Heart Study und die Women’s Health Study –, in denen erhöhte hs-CRP-Werte als Prädiktor für Myokardinfarkt, Schlaganfall und kardiovaskulären Tod identifiziert wurden – unabhängig von LDL-C. Diese Assoziation scheint robust über Altersgruppen und Geschlechter hinweg und bestätigt die unabhängige Risikodimension «Inflammation». Die klinische Relevanz dieser inflammatorischen Achse wurde zudem durch mehrere Interventionsstudien mit gezielter Immunmodulation bestätigt (siehe unten).
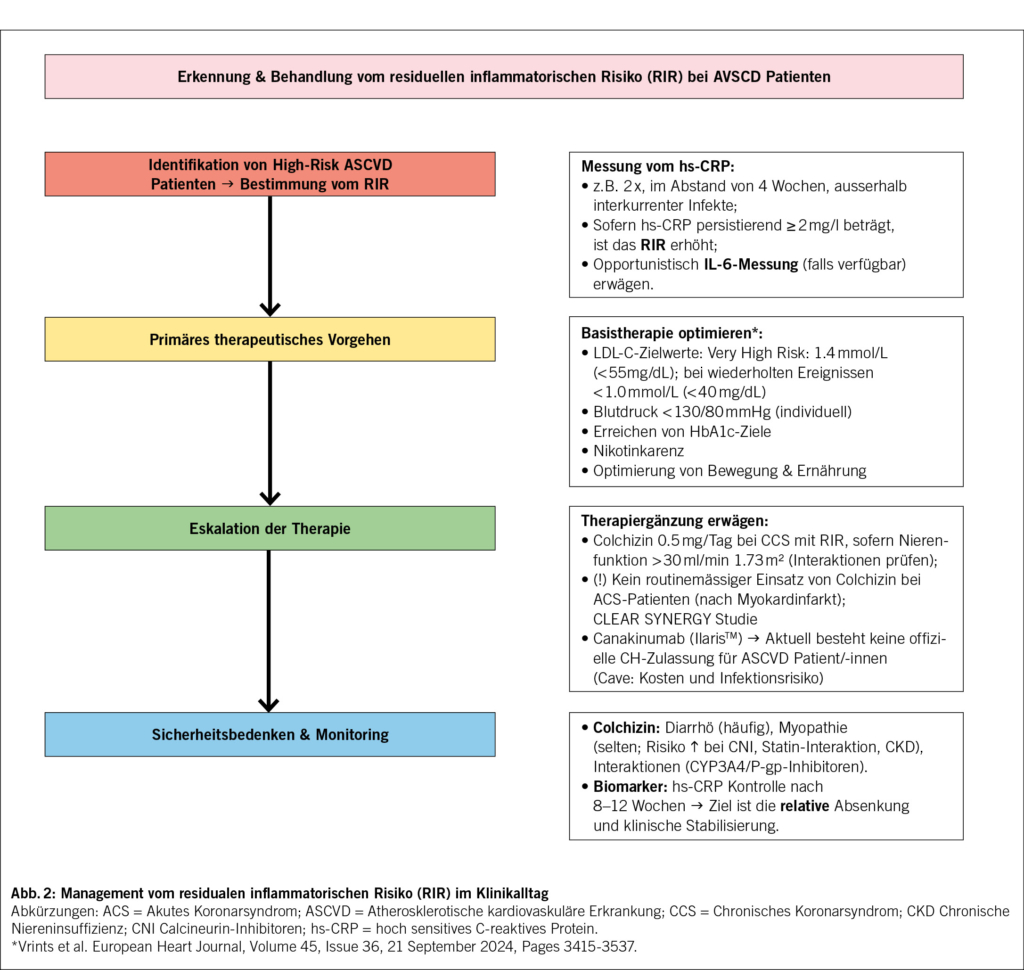
Die punktuelle Messung von humoralen Entzündungswerten, namentlich des hs-CRP, wird mittlerweile auch in den Richtlinien der europäischen Gesellschaft für Kardiologie bei ASCVD Patient/-innen empfohlen. Wobei dies jedoch insbesondere bei Hoch-RisikoPatient/-innen und zur Standortbestimmung respektive Optimierung der Sekundärprävention erwogen werden sollte. Hierzu ist anzumerken, dass die Messung des hs-CRP relativ einfach ist, und bei Patient/-innen bestimmt werden soll, welche keinen akuten Entzündungszustand haben (beispielsweise akute Infektion, Gichtschub oder aufflammende rheumatologische Erkrankung). Sofern dieser Wert im Abstand von mehreren Wochen repetitiv erhöht ist (≥2 mg/l), kann dies mit einem erhöhten residualen inflammatorischen Risiko (RIR) gleichgesetzt werden. Man sollte vorgängig auch sicherstellen, dass das Lipidprofil optimiert und der LDL-C-Wert im Zielbereich ist. Sofern verfügbar, ist im Einzelfall auch eine Bestimmung von IL-6 zu erwägen. In der CANTOS-Studie (siehe unten) korrelierte dessen Senkung mit einem geringeren kardiovaskulären Risiko.
Antiinflammatorische Substanzen bei ASCVD-Patient/-innen
Canakinumab
Interleukin-1β (IL-1β) spielt eine zentrale Rolle in der Regulation inflammatorischer Prozesse und ist massgeblich an der Aktivierung der Interleukin-6 (IL-6)-Signalkaskade beteiligt. Canakinumab ist ein monoklonaler Antikörper, der IL-1β spezifisch bindet und dadurch ausgeprägte antiinflammatorische Effekte entfaltet. Diese wurden bislang vor allem in der Therapie verschiedener rheumatischer Erkrankungen genutzt (5).
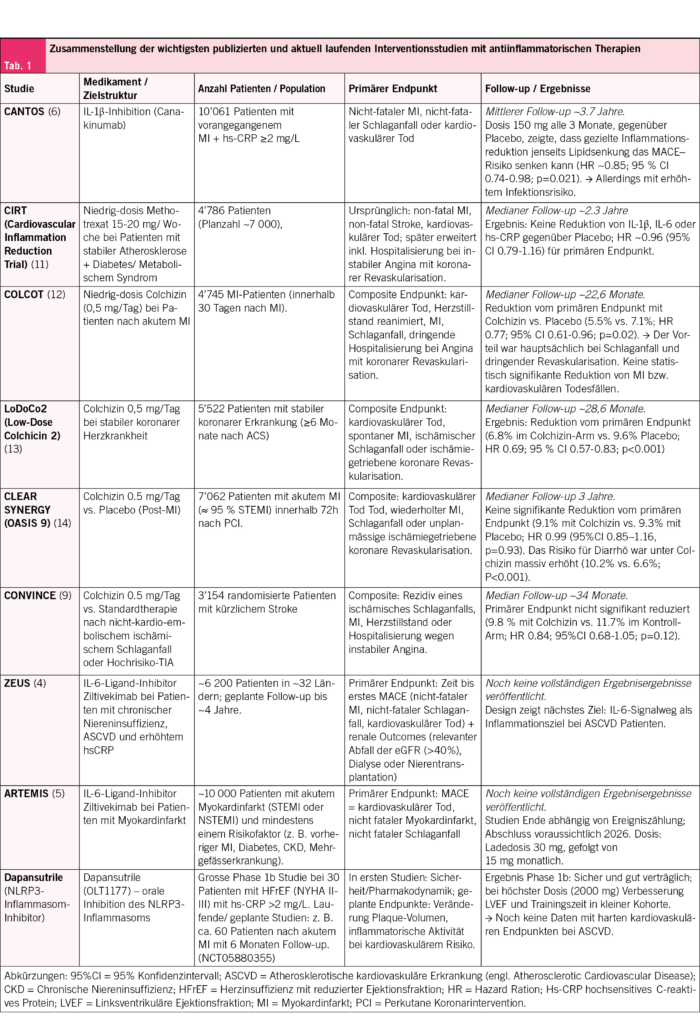
Die CANTOS-Studie (Canakinumab Anti-Inflammatory Thrombosis Outcomes Study), in der über 10 000 Patient/-innen mit vorangegangenem Myokardinfarkt und erhöhtem hs-CRP-Wert (≥2 mg/l) alle drei Monate randomisiert Canakinumab (50 mg, 150 mg oder 300 mg) oder Placebo erhielten, konnte zeigen, dass die 150 mg-Dosis das Risiko für den primären kombinierten Endpunkt (Myokardinfarkt, Schlaganfall, kardiovaskulärer Tod) um 15 % senkte (6).
Bemerkenswert war, dass das Ausmass der IL-6-Reduktion unter der Therapie mit Canakinumab prädiktiv für den klinischen Nutzen war (6). Allerdings war die Behandlung auch mit einem erhöhten Risiko für schwerwiegende, teils tödlich verlaufende Infektionen assoziiert. Ungeachtet dessen bleibt CANTOS eine der ersten randomisierten Interventionsstudien, die einen direkten Zusammenhang zwischen gezielter Entzündungshemmung – unabhängig von lipidsenkenden Massnahmen – und der Reduktion kardiovaskulärer Ereignisse belegen konnte.
Colchizin
Die am besten untersuchte antiinflammatorische Substanz bei ASCVD-Patient/-innen ist Colchizin – ein Alkaloid, das aus der Herbstzeitlosen (Colchicum autumnale) entstammt (5, 7, 8). Colchizin hemmt nicht nur die Mikrotubuli-Polymerisation, wodurch die Aktivität der Neutrophilen unterbunden wird. Es beeinflusst auch das NLRP3-Inflammasom und die nachfolgende Freisetzung von Interleukin-1β, wodurch die Entzündungskaskade gehemmt wird. Obschon die Resultate verschiedener grosser randomisierter Studien etwas divergent waren, haben wir Evidenz dafür, dass Colchizin in niedriger Dosis (z. B. 0.5 mg täglich) zu einer moderaten Reduktion von nicht-tödlichen kardiovaskulären Ereignissen, wie Myokardinfarkten, wiederholten koronaren Revaskularisationen und ischämischen Schlaganfällen, führt, wenn es zusätzlich zur Standardtherapie bei ASCVD-Patient/-innen eingesetzt wird (9). Dies wurde von einer grossen, kürzlich publizierten Meta-Analyse unterstrichen (9). Jedoch gilt es zu betonen, dass keine Senkung der kardiovaskulären oder Gesamtmortalität gezeigt werden konnte und die Number Needed to Treat (NNT) (4) mit 114 hoch ist (9).
Nebenwirkungen, insbesondere gastrointestinale Beschwerden, aber auch Interaktionen mit anderen Medikamenten treten gehäuft auf, weshalb eine individuelle Nutzen-Risiko-Abwägung erforderlich ist. Die aktuellen Leitlinien sprechen eine vorsichtige Empfehlung aus: Klasse IIa bei stabiler respektive chronischer Erkrankung und Klasse IIb in bestimmten Situationen (beispielsweise nach Myokardinfarkt), jeweils mit dem höchsten Evidenzniveau (A) aufgrund mehrerer randomisierter Studien und Meta-Analysen (7, 10).
Methotrexat
Auch Methotrexat, welches seit Jahrzehnten als immunmodulierendes Medikament breit eingesetzt wird, wurde als mögliches Medikament zur Risikomodulation bei ASCVD-Patient/-innen untersucht (7, 11). Methotrexat zeigte jedoch weder lipidsenkende noch inflammationshemmende Effekte in Studien und brachte keinen kardiovaskulären Vorteil. Im Cardiovascular Inflammation Reduction Trial führte eine niedrig dosierte Methotrexat-Therapie (Zieldosis 15–20 mg einmal wöchentlich) bei 4786 Patient/-innen mit zurückliegendem Myokardinfarkt oder koronarer Mehrgefässerkrankung sowie zusätzlichem Diabetes mellitus oder metabolischem Syndrom nicht zu einer Reduktion des kombinierten Endpunkts aus kardiovaskulärem Tod, nicht-tödlichem Myokardinfarkt, nicht-tödlichem Schlaganfall oder revaskularisierenden Massnahmen aufgrund instabiler Angina pectoris (11). Die Studie musste vorzeitig (mittlere Nachbeobachtungszeit 2.3 Jahre) wegen fehlender Wirksamkeit beendet werden (11). Schlussendlich könnte diese Erkenntnis hinweisend sein, dass eine zielgerichtete Immunmodulation – beispielsweise durch IL-1 oder IL-6 Hemmung – gegenüber einer unspezifischen Immunmodulation, wie mit Methotrexat, vielversprechender bei ASCVD-Patient/-innen sein könnte (11).
Sicherheit von antiinflammatorischen Therapien
Im Allgemeinen gilt es anzumerken, dass sämtliche etablierten und in Erprobung stehenden antiinflammatorischen Pharmazeutika für Patient/-innen mit atherosklerotischen Erkrankungen weitreichende Nebenwirkungen zur Folge haben können, welche im direkten Zusammenhang mit der Inhibition des Immunsystems stehen. Hervorzuheben ist hier das Risiko für opportunistische Infektionen (z.B. unter IL-1β-Blockade) (4, 6).
Unter Therapie mit Colchizin treten häufig gastrointestinale Nebenwirkungen (~10 %), wie Diarrhö und Nausea auf, welche regelmässig zu einem frühzeitigen Absetzen des Medikaments führen. Weiter ist auch das Risiko für die Entwicklung von Myopathien (v.a. bei Interaktionen/Niereninsuffizienz) erhöht (4, 8).
Es ist auch wichtig zu beachten, dass Colchizin ein Substrat von CYP3A4 und P-Glykoprotein (P-GP) ist und somit mit einer beachtlichen Zahl von Medikamenten, u. a. mit Makroliden, Azolen und bestimmten Kalziumantagonisten, direkt interagieren kann (8). Patient/-innen im fertilen Alter sollten auf mögliche teratogene Effekte von Colchizin hingewiesen werden.
Generell besteht ein gewisser Respekt vor weitreichenden Off-target-Effekten bei der langfristigen Entzündungshemmung mit den aktuellen und in Erprobung stehenden Therapien (5). Grundsätzlich möchte man eine systemische Immunsuppression vermeiden, und lediglich eine gezielte Modulation der Inflammation mittels niedrig-dosierter pharmakologischer Strategien erreichen (5).
Zukunftsperspektiven und offene Fragen
Es ist zu erwarten, dass der klinische Stellenwert von Inflammation in der kardiovaskulären Risikostratifikation und im Management von ASCVD-Patient/-innen in naher Zukunft weiter zunimmt. Grund hierfür ist die stetig wachsende Evidenzlage, welche die Bedeutung entzündlicher Prozesse nicht nur als Risikofaktor, sondern auch als potenzielles therapeutisches Ziel aufzeigt.
Neben der routinemässigen Bestimmung des Lipidprofils – inklusive Lipoprotein(a) – werden zunehmend auch sensitive inflammatorische Biomarker wie hs-CRP und IL-6 in die klinische Praxis Einzug halten (4). Darüber hinaus könnten molekular-genetische Tests sowie hochauflösende bildgebende Verfahren (z. B. PET-CT zur Identifikation entzündlich aktiver Hochrisiko-Plaques) eine zunehmend wichtige Rolle in der individuellen Risikoabschätzung spielen.
Auch therapeutisch rückt die Inflammationsmodulation stärker in den Fokus. Derzeit befinden sich mehrere Substanzen, die gezielt entzündliche Signalwege adressieren, in klinischer Erprobung – teils in frühen Phasen, teils bereits in Phase III (4). Tab. 1 gibt einen Überblick über die wichtigsten abgeschlossenen und laufenden Studien. Untersucht werden unter anderem Interventionen gegen die IL-1-, IL-6- und TNF-Signalwege sowie Inhibitoren des NLRP3-Inflammasoms.
Kombinierte Therapieansätze, die sowohl das Lipidprofil verbessern als auch inflammatorische Prozesse gezielt modulieren, könnten synergistische Effekte erzielen und das kardiovaskuläre Risiko bei atherosklerotischen Erkrankungen signifikant senken. Hierfür sind jedoch umfangreichere klinische Daten erforderlich. Zudem sind bei neuen antiinflammatorischen Therapien insbesondere Langzeitdaten essenziell, um die Sicherheit über mehrere Jahre hinweg beurteilen zu können. Dabei müssen potenzielle Risiken – wie eine erhöhte Anfälligkeit für opportunistische Infektionen oder die Entstehung von Malignomen – sorgfältig evaluiert werden, bevor ein breiter klinischer Einsatz erfolgen kann.
Nicht zuletzt wird auch der Kosten-Nutzen-Faktor massgeblich (4) entscheiden, ob und in welchem Umfang sich neue Medikamente zur Inhibition inflammatorischer Signalwege in der Therapie der Atherosklerose etablieren können. Die Abb. 2 fasst zusammen, wie im klinischen Alltag das residuale inflammatorische Risiko (RIR) zu erfassen ist und entsprechend therapeutische Massnahmen ergriffen werden können.
Fazit
Chronische Inflammation ist ein wesentlicher Risikofaktor für die Entstehung und das Fortschreiten der Atherosklerose. Insgesamt stellt Entzündung ein zunehmend mehr beachtetes therapeutisches Ziel bei atherosklerotisch bedingten kardiovaskulären Erkrankungen (ASCVD) dar. In der Klinik kann die Bestimmung inflammatorischer Biomarker – wie hs-CRP und IL-6 – hilfreich sein, um das residuale inflammatorische Risiko (RIR) abzuschätzen und die Risikostratifikation bei ASCVD Patient/-innen zu verbessern.
Klinische Studien haben gezeigt, dass eine gezielte Entzündungshemmung – insbesondere mit Canakinumab und Colchizin – das Risiko für kardiovaskuläre Ereignisse bei Atherosklerose, zumindest im chronischen Krankheitsstadium, unabhängig von lipidsenkenden Massnahmen reduzieren kann. Bisher kann einzig der Einsatz von niedrig dosiertem Colchizin (0,5 mg/Tag) bei auserwählten Hochrisiko-ASCVD-Patient/-innen in Erwägung gezogen werden – vorausgesetzt, eine optimale Behandlung der übrigen Risikofaktoren ist sichergestellt, und es gibt Anhaltspunkte für ein erhöhtes inflammatorisches Risiko. Eine sorgfältige Aufklärung und engmaschige Überwachung dieser Patient/-innen ist jedoch unerlässlich. Zukunftsweisend könnten personalisierte Behandlungsstrategien sein, die eine Kombination aus lipidsenkender und entzündungshemmender Therapie verfolgen.
Abkürzungsverzeichnis
ACS Akutes Koronarsyndrom
ASCVD Atherosklerotische kardiovaskuläre Erkrankung (engl. Atherosclerotic Cardiovascular Disease)
Hs-CRP hochsensitives C-reaktives Protein
ICAM-1 Intercellular Adhesion Molecule 1
IL-1 Interleukin-1
IL-6 Interleukin-6
Lp-PLA2 Lipoprotein-assoziierte Phospholipase A2
MI Myokardinfarkt
oxLDL oxidiertes Low-Density-Lipoprotein
TNF- Tumornekrosefaktor-α
RIR Residuales inflammatorisches Risiko (engl. Residual Inflammatory Risk)
VCAM-1 Vascular Cell Adhesion Molecule 1
Copyright
Aerzteverlag medinfo AG
– Klinik für Kardiologie, Herzzentrum
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern
- Fakultät für Gesundheitswissenschaften und Medizin
Universität Luzern
Frohburgstrasse 3
6002 Luzern
Klinik für Kardiologie, Herzzentrum
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern
Funding: Die Autoren erhielten für diese Arbeit keine finanzielle Unterstützung.
Disclosures: MB hat Beratungs- und Vortragshonorare von Abbott Vascular, Abiomed/ J&J MedTech, Amgen, Astra Zeneca, Bayer, Biosensors, Cordis, Daichii, MedAlliance, Novartis, NovoNordisk, OM Pharma, SIS Medical und Vifor erhalten.
1. Ajoolabady A, Pratico D, Lin L, Mantzoros CS, Bahijri S, Tuomilehto J, et al. Inflammation in atherosclerosis: pathophysiology and mechanisms. Cell Death Dis. 2024;15(11):817. Epub 20241111. doi: 10.1038/s41419-024-07166-8. PubMed PMID: 39528464; PubMed Central PMCID: PMC11555284.
2. Zubiran R, Neufeld EB, Dasseux A, Remaley AT, Sorokin AV. Recent Advances in Targeted Management of Inflammation In Atherosclerosis: A Narrative Review. Cardiol Ther. 2024;13(3):465-91. Epub 20240720. doi: 10.1007/s40119-024-00376-3. PubMed PMID: 39031302; PubMed Central PMCID: PMC11333429.
3. Nielsen RV, Fuster V, Bundgaard H, Fuster JJ, Johri AM, Kofoed KF, et al. Personalized Intervention Based on Early Detection of Atherosclerosis: JACC State-of-the-Art Review. Journal of the American College of Cardiology. 2024;83(21):2112-27. doi: 10.1016/j.jacc.2024.02.053. PubMed PMID: 38777513.
4. Mensah GA, Arnold N, Prabhu SD, Ridker PM, Welty FK. Inflammation and Cardiovascular Disease: 2025 ACC Scientific Statement: A Report of the American College of Cardiology. Journal of the American College of Cardiology. 2025. Epub 20250929. doi: 10.1016/j.jacc.2025.08.047. PubMed PMID: 41020749.
5. Finocchiaro S, Mazzone PM, Ammirabile N, Bordonaro C, Cusmano C, Cutore L, et al. Anti-inflammatory pharmacotherapy in patients with cardiovascular disease. Eur Heart J Cardiovasc Pharmacother. 2025. Epub 20250819. doi: 10.1093/ehjcvp/pvaf058. PubMed PMID: 40828623.
6. Ridker PM, Everett BM, Thuren T, MacFadyen JG, Chang WH, Ballantyne C, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. The New England journal of medicine. 2017;377(12):1119-31. Epub 20170827. doi: 10.1056/NEJMoa1707914. PubMed PMID: 28845751.
7. Vrints C, Andreotti F, Koskinas KC, Rossello X, Adamo M, Ainslie J, et al. 2024 ESC Guidelines for the management of chronic coronary syndromes. European heart journal. 2024;45(36):3415-537. doi: 10.1093/eurheartj/ehae177. PubMed PMID: 39210710.
8. Madanchi M, Young M, Tersalvi G, Maria Cioffi G, Attinger-Toller A, Cuculi F, et al. The impact of colchicine on patients with acute and chronic coronary artery disease. European journal of internal medicine. 2024;125:1-9. Epub 20240118. doi: 10.1016/j.ejim.2024.01.004. PubMed PMID: 38238134.
9. d’Entremont MA, Poorthuis MHF, Fiolet ATL, Amarenco P, Boczar KE, Buysschaert I, et al. Colchicine for secondary prevention of vascular events: a meta-analysis of trials. European heart journal. 2025;46(26):2564-75. doi: 10.1093/eurheartj/ehaf210. PubMed PMID: 40314334.
10. Byrne RA, Rossello X, Coughlan JJ, Barbato E, Berry C, Chieffo A, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. European heart journal. 2023;44(38):3720-826. doi: 10.1093/eurheartj/ehad191. PubMed PMID: 37622654.
11. Ridker PM, Everett BM, Pradhan A, MacFadyen JG, Solomon DH, Zaharris E, et al. Low-Dose Methotrexate for the Prevention of Atherosclerotic Events. The New England journal of medicine. 2019;380(8):752-62. Epub 20181110. doi: 10.1056/NEJMoa1809798. PubMed PMID: 30415610; PubMed Central PMCID: PMC6587584.
12. Tardif JC, Kouz S, Waters DD, Bertrand OF, Diaz R, Maggioni AP, et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. The New England journal of medicine. 2019;381(26):2497-505. Epub 2019/11/17. doi: 10.1056/NEJMoa1912388. PubMed PMID: 31733140.
13. Nidorf SM, Fiolet ATL, Mosterd A, Eikelboom JW, Schut A, Opstal TSJ, et al. Colchicine in Patients with Chronic Coronary Disease. The New England journal of medicine. 2020;383(19):1838-47. Epub 20200831. doi: 10.1056/NEJMoa2021372. PubMed PMID: 32865380.
14. Jolly SS, d’Entremont MA, Lee SF, Mian R, Tyrwhitt J, Kedev S, et al. Colchicine in Acute Myocardial Infarction. The New England journal of medicine. 2025;392(7):633-42. Epub 20241117. doi: 10.1056/NEJMoa2405922. PubMed PMID: 39555823.
info@herz+gefäss
- Vol. 15
- Ausgabe 5
- Dezember 2025