Anamnese und Befunde
Ein 40-jähriger Patient stellte sich aufgrund seit mehreren Tagen bestehenden Fiebers bis 39.6 °C, vorwiegend gastrointestinaler Beschwerden und positiver Umgebungsanamnese auf der Notfallstation vor. Weder klinisch noch laborchemisch zeigten sich auffällige Befunde, sodass die Diagnose einer viralen Gastroenteritis gestellt und der Patient mit symptomatischer Therapie entlassen wurde. Am Folgetag wurde der Patient erneut vorstellig wegen eines akuten Harnverhaltes sowie zunehmender Verschlechterung des Allgemeinzustandes. In der klinischen Untersuchung konnten wiederum keine pathologischen Befunde erhoben werden, insbesondere war die perianale Sensibilität und der Sphinktertonus erhalten. Laborchemisch zeigten sich eine Hyponatriämie (128 mmol/l, Normalwert 136–145 mmol/l) und normwertige Entzündungsparameter. Nach Anlage eines Dauerkatheters erfolgte ein ambulantes Prozedere. Am nächsten Tag wurde der Patient vorstellig aufgrund lumbaler und paravertebral linksseitiger Rückenschmerzen, einer linksdominanten Beinschwäche sowie einer neu aufgetretenen Verwirrung.
In der klinischen Untersuchung zeigten sich folgende abnormen Befunde: Meningismus, linksbetonte Paraparese mit Hypästhesie und Hyperalgesie sub Th12 sowie Mastdarmstörung (fehlender Sphinktertonus) und qualitative Bewusstseinsstörung.
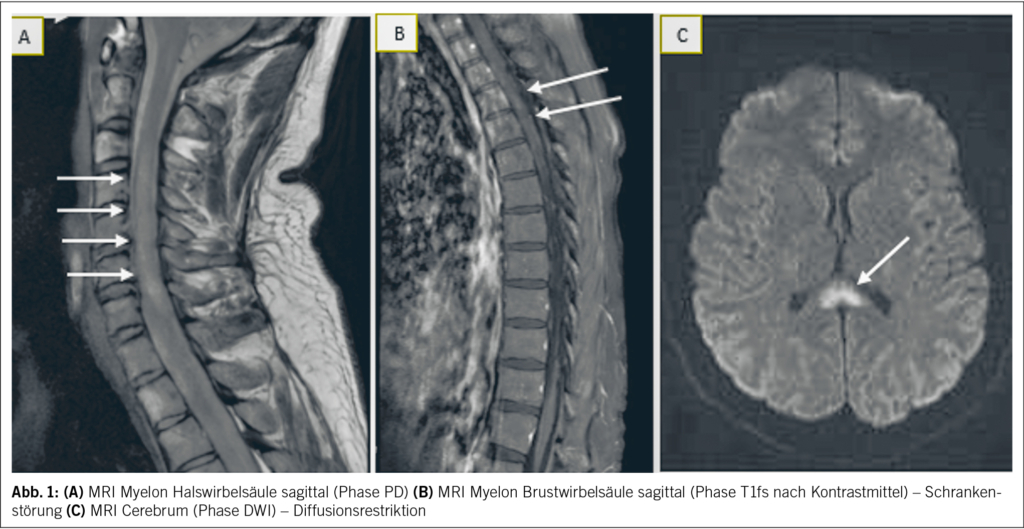
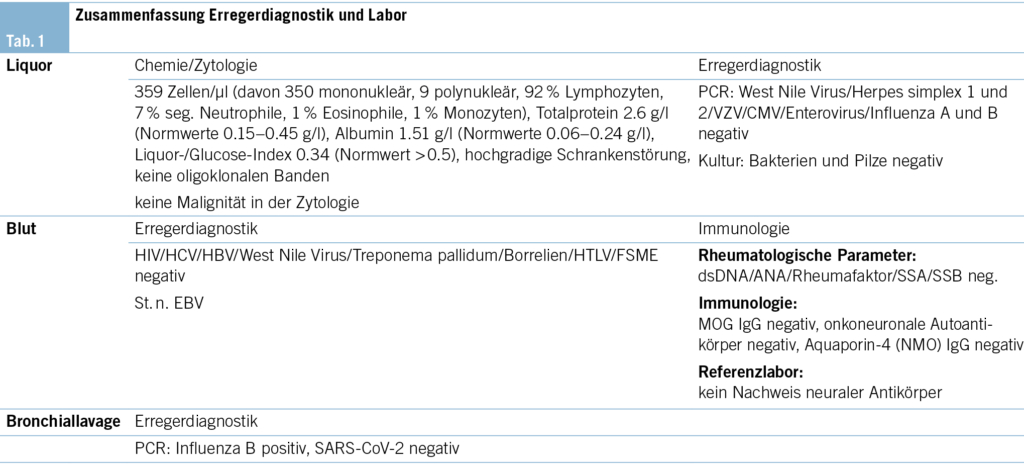
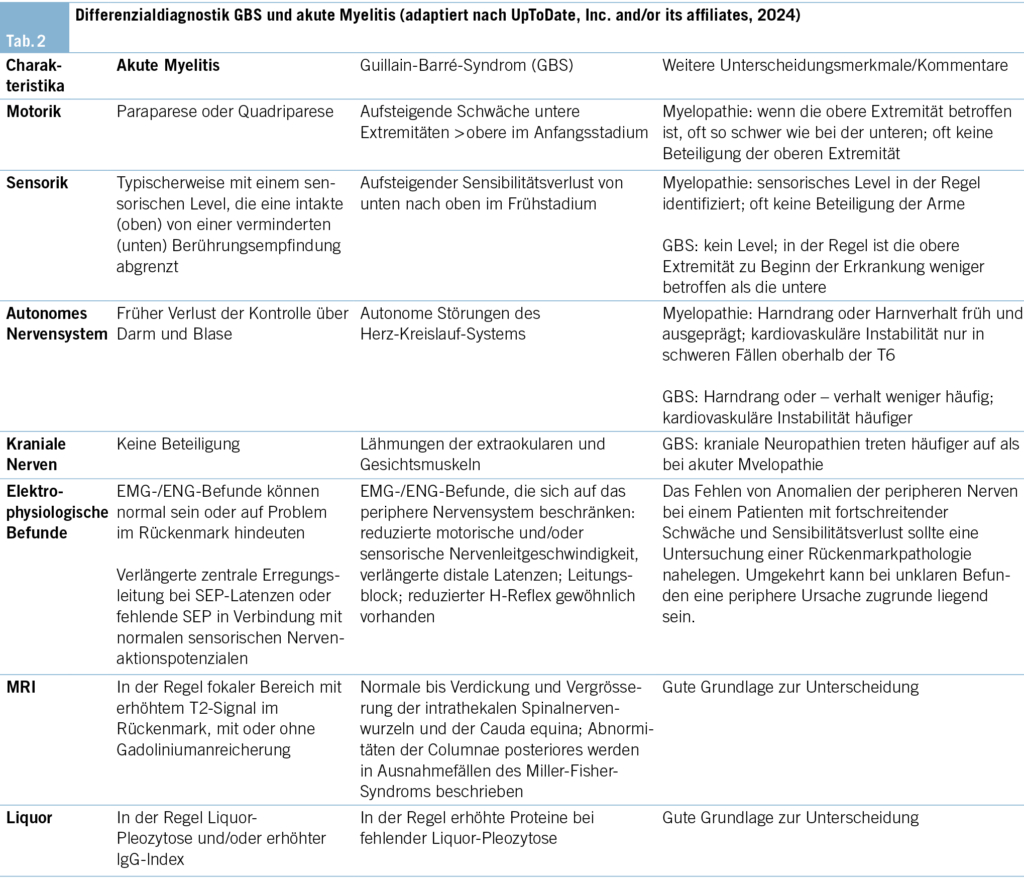
Die Blutuntersuchungen waren bis auf eine Hyponatriämie (130 mmol/l, Normalwert 136–145 mmol/l), Hypokaliämie (3.3 mmol/l, Normalwert 3.5–4.5 mmol/l) und ein minimal erhöhtes CRP (9 mg/l, Normalwert < 5 mg/l) unauffällig. Aufgrund der rasch aufsteigenden Tetraparese mit autonomen Symptomen im Sinne eines spinalen Notfalls mit zusätzlich qualitativer Bewusstseinsstörung war ein notfälliges MRI der spinalen Achse, des Schädels und in der Folge eine Lumbalpunktion indiziert. Während im MRI der Wirbelsäule eine langstreckige, unscharf begrenzte Signalstörung des zervikalen und thorakalen Myelons sowie des Conus medullaris mit assoziierter lineärer bis feinfleckiger Schrankenstörung imponierte, zeigte das cerebrale MRI eine hyperintense Signalstörung im Splenium des Corpus callosum mit assoziierter Diffusionsrestriktion (sog. CLOCC-Läsion) (Abb. 1). In der Lumbalpunktion zeigte sich ein entzündliches Liquorsyndrom mit ausgeprägter lymphozytärer Pleozytose. Das Krankheitsbild wurde syndromal als Enzephalomeningomyelitis eingeordnet.
Differenzialdiagnostische Überlegungen und Verlauf
Innerhalb zweier Tage nach stationärer Aufnahme kam es zu einer rasch aufsteigenden Querschnittsymptomatik mit Tetraplegie und Areflexie. Bei fehlendem Hustenstoss und kontinuierlicher Abnahme der bedside gemessenen Atemvolumina erfolgte eine Verlegung auf die Intensivstation zur Intubation. Es bestand eine schlaffe Tetraparese sub C4 mit sensiblem Niveau L1, die Hirnnerven waren nicht betroffen. Es erfolgte eine Diagnostik hinsichtlich infektiöser und nicht infektiöser Ursachen der ätiologisch offenen Enzephalomeningomyelitis.
Die bildgebenden Befunde erfüllen die Diagnosekriterien einer akuten longitudinalen transversen Myelitis (LETM) sowie einer milden Enzephalitis mit reversibler splenialer Läsion (MERS) (1).
MERS ist ein klinisch-radiologisches Syndrom, welches durch Enzephalopathie und transiente Läsionen im Splenium des Corpus callosum gekennzeichnet ist (2) – vergleiche Abb. 1C. Die LETM ist ein Subtyp der transversen Myelitis, bei welcher sich die Läsionen entlang des Rückenmarks über mindestens drei Level erstrecken – vergleiche Abb. 1A und B. Oft ist diese Erkrankung assoziiert mit Entitäten wie NMOSD (neuromyelitis optica spectrum disorder), MOGAD (myelin oligodendrocyte glycoprotein-associated disease) oder anderen autoimmunen/rheumatologischen Erkrankungen bzw. ADEM (acute disseminated encephalomyelitis) sowie Multipler Sklerose. MERS und LETM können assoziiert (para- bzw. postinfektiös) – aber nicht direkt ausgelöst – sein mit Infektionen durch Viren (Influenza, Enteroviren, Hepatitiden, Herpes simplex, VZV, HTLV, SARS-CoV-2, Röteln, Masern, Mumps, HIV, West Nile), atypische Bakterien (z. B. Borrelien, Treponema pallidum), Parasiten (z. B. Toxoplasma) und Pilze (z. B. Aspergillus fumigatus) (3, 4). Eine durch direkt pathogene nachweisbare Antikörper getriggerte Genese konnte nicht bewiesen werden (insb. MOG und AQ-4-AK negativ) (Tab. 1). Auch erschienen eine rheumatologische Grunderkrankung (Lupus erythematodes, Sjörgen-Syndrom, M. Behcet, Kollagenosen), Multiple Sklerose oder eine paraneoplastische Genese anhand der Anamnese (zuvor gesund) und Klinik (rasche Symptomentwicklung, gastrointestinale Beschwerden) unwahrscheinlich, weshalb auf entsprechende weiterführende Untersuchungen verzichtet wurde. Der Patient war nicht wissentlich immunsupprimiert, somit hielten wir opportunistische Erreger und insbesondere Pilzerkrankungen für unwahrscheinlich. Weitere klinisch wahrscheinliche Erreger wurden mittels PCR und Serologie nicht gefunden (Tab. 1). Initial wurde eine antiinfektive Therapie mittels Ceftriaxon und Aciclovir begonnen. Bei negativer infektiologischer Diagnostik wurde die Hypothese einer direkten infektiösen Genese verlassen und die Antiinfektiva gestoppt. Impfungen hatte der Patient keine erhalten. Aufgrund der klinischen Präsentation und der Infektanamnese wurde differenzialdiagnostisch an ein Guillain-Barré-Syndrom (GBS) gedacht. Dagegen sprach die ausgeprägte Pleozytose im Liquor (GBS: geringe Zellzahl, erhöhtes Protein im Sinne einer zytoalbuminären Dissoziation) sowie der positive Nachweis einer LETM im MRI der Wirbelsäule (GBS: unauffälliges Myelon oder Kontrastmittelaufnahme der Nervenwurzeln und der Cauda equina) (Tab. 2).
Metabolische (z. B. Vitamin B12, Kupfer, Vitamin E, Folsäure) bzw. toxische (im Rahmen Methotrexat, TNF-alpha-Blocker, Heroin) Myelopathien präsentieren sich zumeist mit einem schleichenden Verlauf (5). Anamnestisch nahm der Patient keine Medikamente oder andere Noxen zu sich. Im Blutbild zeigten sich keine Hinweise für eine Veränderung der Erythrozyten. Klinisch und anamnestisch bestand kein Hinweis auf eine Mangelernährung. Eine Kompression von aussen auf das Myelon und eine spinale Ischämie lag bildgebend nicht vor. Das neurologische Erscheinungsbild einer spinalen Ischämie wird weitgehend durch das betroffene Gefässgebiet bestimmt. Klinisch ergab sich kein Anhalt für ein Arteria-spinalis-anterior-Syndrom (rein motorische Symptomatik zu erwarten) und ein Brown-Séquard-Syndrom (keine dissoziierte Sensibilitätsstörung). Ebenso spricht der subakute Verlauf gegen eine ischämische Genese, hier wäre ein hochakutes Auftreten der Symptome zu erwarten (6).
Aufgrund des kontinuierlich steigenden Sauerstoffbedarfs und Nachweises einer Teilatelektase in der CT wurde eine Bronchoskopie und aufgrund massig vorhandenen putriden Sekrets eine Bronchiallavage durchgeführt.
Die initialen Symptome des Patienten liessen an eine virale Gastroenteritis denken. Trotz Ende der Grippesaison wurde aufgrund der positiven Umgebungsanamnese eine Testung auf Influenza durchgeführt. Es konnte Influenza B mittels PCR nachgewiesen werden, sodass nun von einer parainfektiösen Genese der Enzephalomeningomyelitis ausgegangen wurde. Ein entsprechender Virusnachweis im Liquor gelang bei parainfektiöser Genese erwartungsgemäss nicht.
Der Höhepunkt der Symptomatik war 10 Tage nach initialer Vorstellung und 16 Tage nach Symptombeginn erreicht. Wegen voraussehbarer längerer Beatmungspflicht wurde ein Tracheostoma sowie eine PEG-Sonde angelegt.
20 Tage nach Beginn der Infektsymptomatik war eine Rückkehr der Motorik in den oberen distalen Extremitäten zu beobachten, welche sich zunehmend nach proximal verbesserte. Die initiale enzephalopathische Komponente im Rahmen des MERS besserte sich rasch.
Nach Entwöhnung vom Respirator konnte der Patient nach 32 Tagen in eine Rehabilitationsklinik verlegt werden. Zu diesem Zeitpunkt war eine adäquate Kommunikation mit dem Patienten möglich. Hinsichtlich der Tetraplegie war der Patient motorisch weiter schwer beeinträchtigt (Muskelkraft obere Extremitäten M2–3, untere Extremitäten M0), während das sensible Niveau auf Höhe Th6 lag. Zudem persistierten eine ausgeprägte Dysphagie, welche die Entfernung der Trachealkanüle verunmöglichte, sowie Dysästhesien im Bereich der Beine.
Nach mehrwöchiger Neurorehabilitation zeigte der Patient signifikante Fortschritte. Aktuell liegt eine sensomotorisch inkomplette Paraplegie unterhalb von Th11 vor (Arme: M4–5, Beine: M0–1). Weiterhin bestehen neuropathische Schmerzen der Beine sowie Mastdarm- und Blasenentleerungsstörungen.
Diagnose und Therapie
Bei diesem Patienten kam es infolge einer Influenza-B-Infektion mit vorwiegend gastrointestinaler Symptomatik zu einer rasch aufsteigenden Tetraparese mit enzephalopathischen Symptomen. Wir gingen im Kontext der oben genannten Befunde von einer seltenen parainfektiösen Pathogenese der Myelitis im Rahmen der Influenza B aus.
Neben den klassischen respiratorischen und weniger häufigen gastrointestinalen Symptomen können Influenzaviren auch zu verschiedenen neurologischen Erkrankungen führen. Es sind direkt assoziierte neurologische Symptome wie bei der Influenza-assoziierten Enzephalopathie (IAE), die hauptsächlich bei Kindern beobachtet wird, möglich. Weiter kann es indirekt via immunologische Mechanismen zu neurologischen Manifestationen kommen, wie beispielsweise zum Guillain-Barré-Syndrom (GBS) oder wesentlich seltener zur milden Enzephalopathie mit reversibler splenialer Läsion (MERS) oder longitudinalen extensiven transversen Myelitis (LETM) (7). Influenzaviren wurden hierbei als ursächlich für diese Krankheitsbilder beschrieben, wenn auch das kombinierte Auftreten von MERS und LETM in diesem Kontext selten ist (8, 9).
Sowohl bei dem MERS als auch der LETM handelt es sich um eine immunologisch getriggerte Pathogenese. Beim MERS wird die isolierte Läsion im Splenium durch zytotoxische und intramyelinische Schwellung infolge einer Neuroinflammation vermutet, während beim LETM eine perivaskuläre Infiltration mit Monozyten und Lymphozyten zu Demyelinisierung und axonaler Schädigung führt. Klinisch treten beim MERS nach einer Phase mit Fieber als Prodromi am häufigsten Bewusstseinsstörungen, Kopfschmerzen und epileptische Anfälle auf, während bei der LETM motorische, sensorische und autonome Störungen im Vordergrund stehen. Zum Höhepunkt (Nadir zwischen 4 Stunden und 21 Tagen) der Erkrankung leidet etwa die Hälfte der Betroffenen an einer beinbetonten Paraplegie. Fast alle Erkrankten haben Blasenentleerungsstörungen. Die beschriebenen sensorischen Störungen sind typischerweise auf ein spezifisches Niveau begrenzt und umfassen Dysästhesien sowie neuropathische Schmerzen. Während es sich beim MERS in aller Regel um eine reversible Erkrankung handelt, weist die LETM eine signifikante Morbidität auf. Während ein Drittel der Erkrankten eine fast vollständige Erholung zeigt, bleibt bei einem Drittel eine moderate und bei einem weiteren Drittel eine schwere Einschränkung zurück. Die Ätiologie der LETM kann oft erst im Verlauf eruiert werden (10, 11). Oft findet sich bei der LETM kein auslösender Faktor (15–30 %) (12).
Therapeutisch wurde bereits bei Eintritt eine hoch dosierte Steroidtherapie mit Methylprednison (initial 500 mg 1 x bei unklarem Krankheitsmechanismus mit anschliessend 80 mg/Tag, bei definitiver Diagnosestellung am Tag 5 der Hospitalisation Erhöhung auf 1 g für 5 Tage, dann 6 Tage 125 mg und hiernach 1 mg/kgKG mit anschliessend veranschlagtem Tapering über ca. 2 Monate) begonnen. Zudem wurde im Kontext des schweren Krankheitsbildes und noch positiver Influenza-PCR Oseltamivir 75 mg 12-stündlich für 5 Tage verabreicht.
Bei der parainfektiösen LETM im Rahmen einer Influenzainfektion gibt es keine evidenzbasierten Therapiekonzepte. Hauptbestandteil der Therapie sind Kortikosteroide in hoher Dosierung sowie Oseltamivir. Ebenfalls wird der Einsatz von intravenösem Immunglobulin G oder Plasmapherese zusammen mit Cyclophosphamid berichtet. In Abwesenheit einer klaren Antikörper-vermittelten Pathologie und auch aufgrund des breiten immunsuppressiven Effektes erscheint eine hoch dosierte Steroidtherapie rational. Bei bekannter Ätiologie erfolgt die Therapie der Grunderkrankung (13, 14). Ein direkter Keimnachweis von Influenza im Liquor wurde bisher nicht beschrieben (15).
Elena Pletzer 1, Katia Boggian 2, Matthias Arnold 3, Claudia Schrag 4
1 Allgemeine Innere Medizin / Hausarztmedizin und Notfallmedizin, HOCH Health Ostschweiz, Kantonsspital St. Gallen, St. Gallen
2 Klinik für Infektiologie, Infektionsprävention und Reisemedizin, HOCH Health Ostschweiz, Kantonsspital St. Gallen, St. Gallen
3 Neurologie / Klinik Allgemeine Innere Medizin, Spital Nidwalden, Stans
4 Klinik für Intensivmedizin, HOCH Health Ostschweiz, Kantonsspital St. Gallen, St. Gallen
Author Contributions
Alle Autorinnen und Autoren haben das eingereichte Manuskript gelesen und sind für alle Aspekte des Werkes mitverantwortlich.
Verdankung
Wir bedanken uns bei Dr. Manuel Gubser, Netzwerk Radiologie, Kantonsspital St. Gallen.
Allgemeine Innere Medizin / Hausarztmedizin und Notfallmedizin
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
elena.pletzer@h-och.ch
Die Autorinnen und Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Transverse Myelitis Consortium Working Group. Proposed diagnostic criteria and nosology of acute transverse myelitis. Neurology. 2002: 499-505.
2. Park SE, Choi DS, Shin HS, Baek HJ, Choi HC, Kim JE, Choi HY, Park MJ. Splenial Lesions of the Corpus Callosum: Disease Spectrum and MRI Findings. Korean J Radiol. 2017: 710-721.
3. Greenberg BM, Frohman EM. Immune-mediated myelopathies. Continuum (Minneap Minn). 2015: 121-31.
4. Lyons JL. Myelopathy associated with microorganisms. Continuum (Minneap Minn) 2015; 21:100
5. Lopez Chiriboga S, Flanagan EP. Myelitis and Other Autoimmune Myelopathies. Continuum (Minneap Minn). 2021: 62-92.
6. Novy J, Carruzzo A, Maeder P, Bogousslavsky J. Spinal cord ischemia: clinical and imaging patterns, pathogenesis, and outcomes in 27 patients. Arch Neurol. 2006:1113-20.
7. Sellers SA, Hagan R, Hayden F, Fischer WA II. The hidden burden of influenza: A review of the extra-pulmonary complications of influenza infection. Influenza Other Respi Viruses. 2017; 11: 372-393.
8. Studahl M. Influenza virus and CNS manifestations. J Clin Virol. 2003: 225-32.
9. Geurs N, Hoffbauer K, Belmans A, De Cauwer H. Influenza B-induced longitudinally extensive transverse myelitis and bithalamic acute disseminated encephalomyelitis. Neurol Sci. 2024: 1299-1301.
10. Krishnan C, Kaplin AI, Pardo CA, Kerr DA, Keswani SC. Demyelinating disorders: update on transverse myelitis. Curr Neurol Neurosci Rep. 2006: 236-43.
11. Yuan J, Yang S, Wang S, Qin W, Yang L, Hu W. Mild encephalitis/encephalopathy with reversible splenial lesion (MERS) in adults-a case report and literature review. BMC Neurol. 2017: 103.
12 Pidcock FS, Krishnan C, Crawford TO, Salorio CF, Trovato M, Kerr DA. Acute transverse myelitis in childhood: center-based analysis of 47 cases. Neurology. 2007: 1474-80.
13. Greenberg BM. Treatment of acute transverse myelitis and its early complications. Continuum (Minneap Minn). 2011:733-43.
14. Murphy OC, Barreras P, Villabona-Rueda A, Mealy M, Pardo CA. Identification of specific causes of myelopathy in a large cohort of patients initially diagnosed with transverse myelitis. J Neurol Sci. 2022: 442:120425.
15. Srichawla BS. Mild Encephalopathy/Encephalitis With a Reversible Splenial Lesion (MERS) and Longitudinally Extensive Transverse Myelitis (LETM) in Influenza B: Neurotropic Mechanisms and Diagnostic Challenges. Cureus. 2022 Oct: e30681.