Einleitung
Die Therapie von Menschen mit kognitiven Störungen und Demenz-Syndromen ist komplex. Neben medikamentösen Optionen steht eine Vielzahl von nicht-medikamentösen Behandlungen zur Verfügung. Die Indikation der verschiedenen Therapieoptionen unterscheidet sich stark je nach individuellen Symptomen, zugrunde liegenden Pathologien, Alter, Stadium der Erkrankung und Verfügbarkeit. So kann es gerade für Nichtspezialisten schwierig sein, die richtige Kombination von Therapien zum richtigen Zeitpunkt für den individuellen Menschen mit Demenz (MmD) festzulegen. Zunehmend empfohlen wird deshalb der Einbezug von Dementia Care Managers (1).
Der Verein Swiss Memory Clinics (SMC) veröffentlicht in Ergänzung zu den im Rahmen der Nationalen Demenzstrategie entwickelten Empfehlungen zur Demenzabklärung im vorliegenden Dokument Empfehlungen zur Therapie der Demenz in der Schweiz. Die Empfehlungen beschränken sich auf in der Schweiz zugelassene und verfügbare Therapien.
Für die aktuelle Publikation hat die Autorengruppe Leitlinien anderer Staaten und insb. die kürzlich erschienene S3-Leitlinie berücksichtigt (1). Die therapiespezifischen Abschnitte wurden in der Regel von den entsprechenden Berufsverbänden erstellt. Positiver klinischer Erfahrung wurde explizit ein Stellenwert eingeräumt.
Die nachfolgenden Empfehlungen richten sich grundsätzlich an alle Berufsgruppen und Settings. Es handelt sich um die Kurzfassung der mit Unterstützung des BAG erstellten Langversion, die frei verfügbar ist (Nationale Plattform Demenz, https://www.bag.admin.ch/bag/de/home/strategie-und-politik/nationale-gesundheitsstrategien/demenz.html). Wie bereits bei den momentan in Aktualisierung befindlichen Empfehlungen zur Diagnostik (2) ist es uns auch hier ein Anliegen, insbesondere die Primärversorgung anzusprechen. Sofern nicht explizit anders angegeben, sind alle Geschlechter gemeint.
Allgemeine Therapieziele
Demenzen sind per Definition chronische Syndrome, denen unterschiedliche Erkrankungen zugrunde liegen. Die klinische und ätiologische Ebene sollte getrennt werden, jedoch sind Begriffe wie «Demenzerkrankungen» weiterhin verbreitet und werden deshalb auch hier verwendet. Insbesondere neurodegenerative Demenzen sind fortschreitend. Heute verfügbare Therapien der kognitiven Defizite können lediglich deren Fortschreiten verlangsamen. Die Erkrankungen bedeuten eine hohe Belastung für direkt Betroffene und deren Angehörige. Oft sind nicht die kognitiven Einschränkungen, sondern behaviorale und psychische Symptome der Demenz (BPSD) verantwortlich für den Übertritt in ein Alters- und Pflegeheim. Diese werden in separaten Empfehlungen fokussiert (3). Ebenfalls separat publiziert sind Empfehlungen für die Behandlung von MmD in Langzeitinstitutionen (BAG 2020).
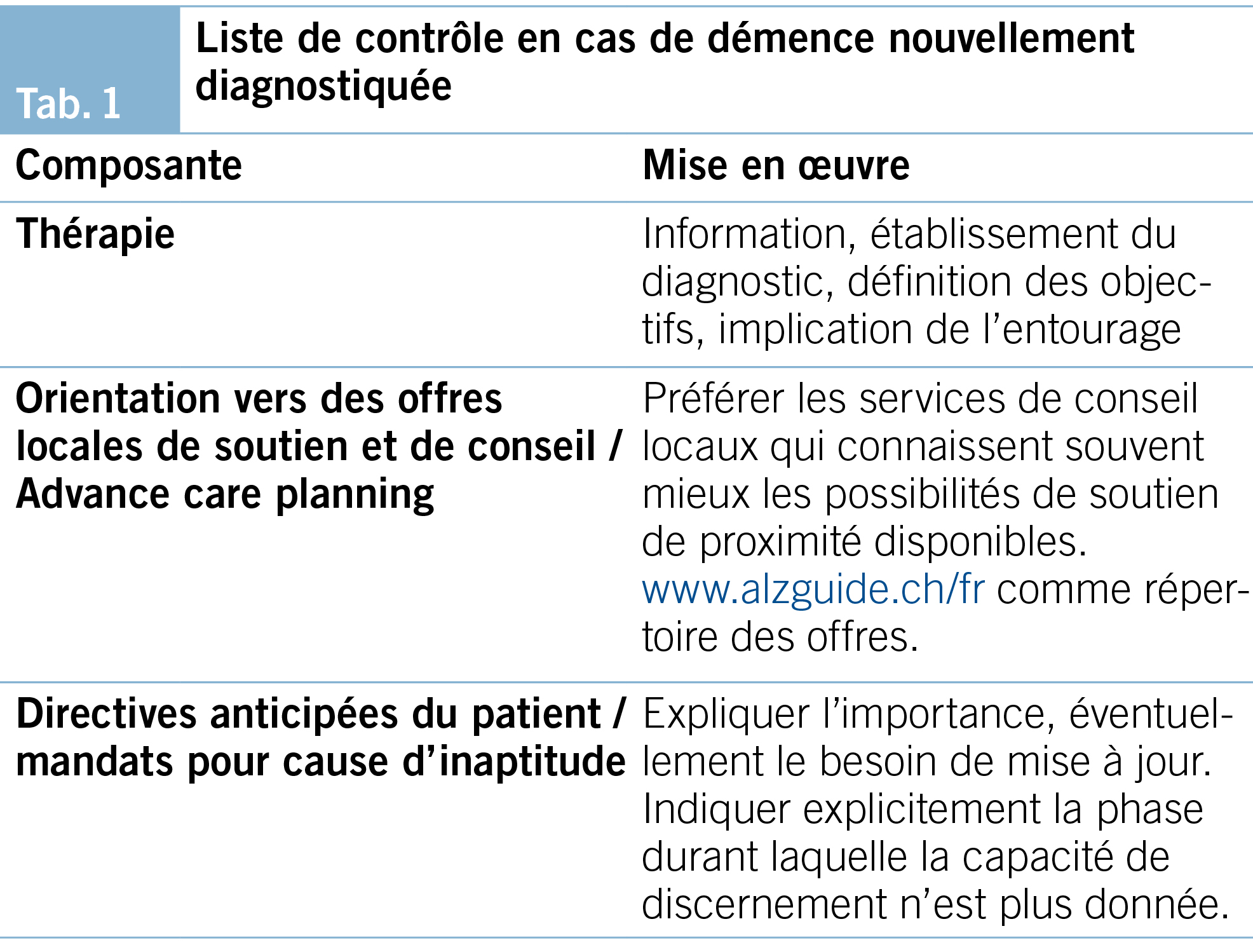
Die vorliegenden Empfehlungen behandeln die Verbesserung der Lebensqualität von MmD und ihren Angehörigen sowie den bestmöglichen Erhalt der Selbstständigkeit und der Stabilisierung der kognitiven Leistung. Tab. 1 zeigt wichtige Handlungskomponenten bei einer neu diagnostizierten Demenz.
Nicht-medikamentöse Therapie
Nicht-medikamentöse Interventionen zielen grossenteils darauf ab, in den bio-psycho-sozialen und spirituellen Dimensionen Momente des Wohlbefindens zu ermöglichen sowie Funktionen und Teilhabe eines MmD so lange als möglich aufrechtzuerhalten, während die Krankheit fortschreitet. Dadurch können weitere Einschränkungen reduziert oder verlangsamt und die Lebensqualität verbessert oder stabilisiert werden (4). Damit nicht-medikamentöse Therapien gelingen, brauchen Fachpersonen u.a. aus dem Bereich Gesundheit und Soziales, aber auch betreuende Angehörige Wissen und Fähigkeiten zu unten stehenden Konzepten und Interventionen. Schulungen sind deshalb zentral. Durch den notwendigen Einsatz qualifizierten Personals ist die Durchführung nicht-medikamentöser Massnahmen abhängig vom verfügbaren Personal. Die entsprechenden Lohnkosten müssen dabei ins Verhältnis gesetzt werden zu den Belastungen durch an sich vermeidbare Komplikationen (belastetes Umfeld, freiheitsbeschränkende Massnahmen) und Kosten, welche diese oft bei Personen im Umfeld der erkrankten Person sowie der Behandlung von Komplikationen (Spitalaufenthalte) in der Folge verursachen.
Vom Umfeld verlangt insbesondere die Kommunikation mit MmD viel Einfühlungsvermögen, Geduld, Kreativität und ein echtes Interesse. Neben aktivierenden Tätigkeiten soll auch immer die Möglichkeit für einen Rückzug angeboten werden.
Nicht-medikamentöse Massnahmen kommen für alle Stadien der Demenz infrage. Im Idealfall werden sie kontinuierlich angeboten und passen sich den verändernden Fähigkeiten der MmD im Krankheitsverlauf an.
Integrative Ansätze
In den folgenden Abschnitten wird eine grosse Bandbreite von nicht-medikamentösen Therapien vorgestellt. Die Auswahl sollte primär von den Bedürfnissen der Erkrankten abhängen. Zusätzlich spielt aber auch die Verfügbarkeit im jeweiligen Setting eine Rolle.
Da die nachfolgenden Therapien zumeist einzeln untersucht wurden, ist wenig über den zusätzlichen Nutzen von Kombinationen bekannt und damit auch nicht, ob gemeinsame oder unterschiedliche Wirkfaktoren relevant sind. Gemeinsam sind den Therapien die folgenden Aspekte:
– Hohe Individualisierung
– Interdisziplinarität und Interprofessionalität
– Einbezug von Umfeld und insb. Angehörigen
– Wertschätzung, Anerkennung von Emotionen
– Nonverbale Kommunikation
Die Evidenzlage für die einzelnen Verfahren ist sehr unterschiedlich. Abgegrenzt werden muss zudem die Zielsetzung. So ist eine Verbesserung der Kognition durch nicht-medikamentöse Ansätze am ehesten im Stadium der leichten bis mittleren Demenz erreichbar. Zahlreiche Interventionen, z. B. kognitive Stimulation, Reminiszenztherapie, Ergotherapie, Musik- und Tanztherapie, werden hingegen in der S3-Leitlinie (1) für alle Demenzstadien zur Behandlung depressiver Symptome empfohlen. Der Empfehlungsgrad reicht hierbei von «stark dafür» für Bewegungstherapie und Kognitive Verhaltenstherapie bis zu «schwach» bei Reminiszenz und Ergotherapie. Trotz etlicher vorhandener Studien sieht die S3-Leitlinie (1) keine Wirksamkeitsevidenz nicht-medikamentöser Verfahren gegen Angstsymptome.
Psychotherapie
Insbesondere zur Behandlung depressiver Symptome bei leichter Demenz und mild cognitive impairment (MCI) besteht gute Evidenz für die Wirksamkeit (1). Therapieziele sind neben Psychoedukation auch Ressourcenaktivierung, Stärkung der Bewältigungsstrategien und z. B. die Förderung der Selbstwirksamkeit. Der Einbezug bzw. die Beratung der Angehörigen ist auch für dieses Setting wesentlich. Empfohlen werden Anpassungen der Therapie gegenüber dem Vorgehen bei Personen ohne kognitive Defizite. Kürzeren und dafür häufigeren Therapieeinheiten sollte der Vorzug gegeben werden. Zudem sollten kognitive Elemente dem Leistungsvermögen angepasst werden.
Spezifische Pflegekonzepte
Pflegerische Konzepte beinhalten meist eine Kombination aus unterschiedlichen Interventionen und Ansätzen. Da die Pflege an sich keine Therapie ist, werden häufig therapeutische Elemente von angrenzenden Disziplinen miteinbezogen. So werden beispielsweise Aktivitäten im Alltag mit bewegungsstimulierenden Interventionen ergänzt oder musikalische Interventionen in die Tagesstruktur aufgenommen und erzielen dadurch ihre Effekte (z. B. Erhaltung oder Reaktivierung von Ressourcen, Förderung der Lebensqualität). Entsprechend werden die hier zusammengestellten Interventionen keineswegs exklusiv von Pflegekräften angeboten.
Multisensorische Interventionen
Aromapflege und Aromatherapie
Aromapflege und Aromatherapie werden in der Literatur oftmals synonym verwendet und umfassen die äusserliche Anwendung ätherischer Öle. Hinsichtlich Aromatherapie/-pflege gibt es keinen eindeutigen Wirksamkeitsnachweis in Bezug zur Schlafqualität beziehungsweise zur Verbesserung der Lebensqualität. Ein Review über 5 Studien findet keine Wirksamkeitsnachweise für den Einsatz bei Agitiertheit (1). Die Erfahrungen mit Aromatherapie/-pflege in der Pflegepraxis sind in jedem Stadium der Demenz oftmals positiv. Melissenöl scheint insgesamt das Produkt mit den besten Ergebnissen zu sein. Es ist notwendig, die MmD während des Einsatzes von Aromapflege genau zu beobachten, um bei allfälligen negativen Reaktionen die Intervention sofort abzubrechen. Beim erstmaligen Einsatz eines Produkts ist wegen möglicher allergischer Reaktion Vorsicht geboten und ggf. ein Allergietest durchzuführen.
Basale Stimulation
Basale Stimulation fördert die Wahrnehmung, z. B. durch sensorische Stimulation mittels Massage, aber auch multimodal mittels Bewegung und Sprache (Singen/Summen). Die Studienlage in Bezug auf den Nutzen von basaler Stimulation in der Pflege und Betreuung von MmD ist dünn. Bestehende Empfehlungen für die Pflege und Betreuung von MmD führen basale Stimulation jedoch auf (3).
Snoezelen
Bei der Snoezelen-Therapie werden unterschiedliche Sinne durch visuelle, akustische, olfaktorische, taktil-haptische, vestibuläre und/oder vibratorische Angebote im Alltag angeregt. Diese multisensorische Therapie kann in einem separaten Raum (Snoezelen-Raum) stattfinden. Basierend auf der vorhandenen Evidenz und den Erfahrungen in der Praxis kann die Snoezelen-Therapie für Menschen mit moderater bis schwerer Demenz empfohlen werden (5, 6). Die Effekte der Snoezelen-Therapie sind grösser, wenn die Person, welche die Therapie anbietet (Pflegende, Angehörige), in der Anwendung von multisensorischen Interventionen geschult ist (5).
Gedächtnistraining / Kognitive Stimulationstherapie
Das Spektrum der kognitiven Therapieansätze reicht von relativ unspezifisch aktivierenden Verfahren (kognitive Stimulation) bis hin zu auf einzelne kognitive Domänen konzentrierte (Funktions-)Trainings. Z. T. wird auch das Realitäts-Orientierungs-Training hinzugezählt. Viele Ansätze sind mit sozialer Interaktion verbunden und dürften allein deshalb hilfreich sein. Teilnehmende Personen schätzten ihre Lebensqualität z. T. als höher ein. Die Konfrontation mit den eigenen Defiziten kann aber auch negative Auswirkungen auf die psychische Verfassung haben.
Im Stadium der leichten bis mittelschweren Demenz wird in mehreren internationalen Guidelines (1, 6) sowie im Rahmen eines Cochrane Reviews (7) kognitive Stimulation empfohlen, welche neben einer Verbesserung der Kognition auch positive Effekte auf die Lebensqualität sowie auf die Kommunikation haben können, welche vergleichbar sind mit den im Rahmen etablierter medikamentöser Therapien erzielbaren Effekte. Die S3-Leitlinie macht eine schwache Empfehlung für die kognitive Stimulation zur Behandlung depressiver Symptome im Rahmen der Demenz. Von spezifischem Gedächtnistraining mit der Vermittlung von Strategien oder von psychotherapeutischen Verfahren zur Behandlung kognitiver Defizite wird im Stadium einer Demenz zur Vermeidung von Überforderung abgeraten.
Kognitive Rehabilitation
Kognitive Rehabilitation bezieht sich auf die individuelle Identifizierung funktionaler Ziele, die für die MmD relevant sind und die in der Zusammenarbeit mit der betroffenen Person und deren Angehörigen und Betreuenden erreicht werden sollen. Ziel ist, die Auswirkungen der vorhandenen Einschränkungen zu reduzieren.
Die kognitive Rehabilitation wird für das Stadium der leichten bis mittelschweren Demenz empfohlen (6) (NICE).
Physiotherapie
Die Literatur und Studienlage zeigen deutlich die Wirksamkeit von physiotherapeutischen Massnahmen bei Schmerzen und Bewegungseinschränkungen (8). Die S3- Leitlinie spricht sich stark für körperliches Training zur Verbesserung der Aktivitäten des täglichen Lebens aus (1).
Durch gezielte physiotherapeutische Untersuchungen der körperlichen Strukturen, Funktionen und der Aktivität im Verlauf der Erkrankung werden Defizite wie Schmerz, Sturzrisiko, Dysphagie schnell erkannt, und es können individuell optimal angepasste interprofessionelle Massnahmen geplant werden (9–11) und Training Manuals optimal eingesetzt werden (12). Hierdurch können auch gezielt Verhaltensprobleme reduziert werden (13).
Insbesondere im Stadium der fortgeschrittenen Demenz sollte abhängig vom Krankheitsverlauf circa 1 x jährlich ein Assessment zur Erfassung von Struktur (Schmerz, Bewegungseinschränkung), Funktion (Stabilität, Kraft, Gleichgewicht, kardio-pulmonaler Kapazität, Dysphagie) und motorisch-kognitiven Fähigkeiten erfolgen. Das Assessment sollte ein Abklärung des Sturzrisikos beinhalten.
Ergotherapie
Ergotherapie wird verstanden als Therapie zur Verbesserung und zum Erhalt von Alltagsfunktionen und Handlungsfähigkeit mit dem Ziel der Verbesserung von Teilhabe und Lebensqualität im individuellen Alltag und Lebenskontext. Als wirksame Interventionen gelten die Beratung und Umsetzung gesundheitsfördernder Aktivitäten, welche die Lebensqualität steigern, sowie das Training von alltagsrelevanten körperlichen, kognitiven, emotionalen und sozialen Fähigkeiten (14–16). Entsprechend der S3-Leitlinie wird Ergotherapie auch zur Behandlung depressiver Symptome empfohlen. Ergotherapie bezieht sich sowohl auf Betroffene als auch deren Angehörige und kann diese in den Bereichen Alltagsaktivitäten, Selbstversorgung, Mobilität, Haushaltsführung und Freizeit unterstützen (17) und dadurch eine Reduktion der physischen (16) und psychischen Belastung (18) von Angehörigen bewirken.
Aktivierungstherapie
Aktivierungstherapie findet im Einzel- oder Gruppensetting statt. In der Aktivierung kommen verschiedene Mittel (z. B. Musik, Bewegung oder Gedächtnistraining) und Methoden (z. B. Reminiszenzverfahren mit Biografiearbeit, Validation oder basale Stimulation) zum Einsatz (15), deren Wirksamkeit in Studien untersucht wurde.
Für aktivierungstherapeutische Ansätze bei MmD liegt moderate Evidenz vor (16, 17), diese jedoch für eine grosse Bandbreite von Outcomes und sowohl direkt für die MmD als auch für Angehörige. In den NICE-Guidelines wird darauf hingewiesen, dass verschiedene körperliche Aktivitäten im Alltag (Spazieren, Tanzen, Balance-Übungen etc.) einen positiven Einfluss auf die Kognition und die Ausführung von Alltagsaktivitäten haben können. Angebote im Freien scheinen sich positiv auf Stimmung, soziale Teilhabe und Schlaf auszuwirken (18).
Logopädie
Sprach-, Sprech- und Kommunikationsstörungen, die in allen Demenzformen auftreten, erschweren die soziale Teilhabe in einem hohen Mass. Insbesondere im MCI-Stadium und zu Beginn der Erkrankung ist eine logopädische Behandlung bei den sprachlich dominierten Varianten angezeigt. Es ist sinnvoll, die pflegenden Angehörigen frühzeitig in die logopädische Behandlung einzubeziehen (19).
Übungen sollten alltagsrelevant bzw. biografisch bedeutsam sein. Je nachdem, auf welcher Ebene sich die Sprachstörung hauptsächlich zeigt, liegt der Schwerpunkt der logopädischen Behandlung im Bereich der Artikulation, der Wörter, des Satzes oder der Diskursfähigkeit.
Das Lesen kann eine Ressource zur Aufrechterhaltung der Kommunikation darstellen, insbesondere für jene Personen mit einer Demenz vom Alzheimer Typ (20–22). Ebenso sind alternative Kommunikationsmittel wie Applikationen, Kommunikationsbücher oder multimodale Ansätze via Gesten und Schrift empfehlenswert. Die Prävalenz von Dysphagien bei fortgeschrittener Demenz liegt bei über 80 % (23, 24). Eine ausführliche klinisch-logopädische Schluckuntersuchung (23, 25) schliesst instrumentelle Verfahren zur Untersuchung des Schluckvorgangs ein. Bei fortgeschrittener Demenz ist dies allerdings oft nicht möglich. Man weicht dann auf eine strukturierte Essensbeobachtung aus. Methode der Wahl ist die funktionelle Dysphagietherapie. Hierbei wird das Schlucken, z. B. durch Änderungen der Kopfhaltung, aber auch Kostanpassungen, unterstützt.
Kunsttherapie
Musiktherapie
Nationale und internationale Leitlinien und Experten empfehlen konsistent den Einsatz von Musiktherapie (MT). Ein Cochrane Review (29) liefert Hinweise darauf, dass Stimmung, Verhaltenssymptome, Kommunikation und physische Funktionen positiv beeinflusst werden können. Die S3-Leitlinie sieht positive Effekte von Musik zur Behandlung depressiver Symptome und spricht eine starke Empfehlung für den personalisierten Einsatz bei Agitation aus. Eine Metaanalyse von Zhang et al. (2017) zeigt auf, dass musikbasierte Interventionen – kombiniert mit sozialer Interaktion – positive Auswirkungen auf Verhaltenssymptome und Ängstlichkeit haben können. Auch ein Verbesserungstrend hinsichtlich Depressionsanzeichen, kognitiver Funktion und Lebensqualität wird festgestellt. Eine Literaturübersicht stützt diese Erkenntnisse (28, 29) und zeigt in einer Metaanalyse positive Effekte auf Aufmerksamkeit, Sprache und autobiografische Erinnerung und beschreibt messbar stärkere Effekte bei durch qualifizierte Musiktherapeut/-innen durchgeführten Therapien. Depressionssymptome verbessern sich unter Gruppenmusiktherapie signifikant stärker als durch Singgruppenteilnahme (30).
Einen besonderen Stellenwert hat die Musik bei mittelgradiger und fortgeschrittener Demenz bei der Erzeugung positiver Emotionen, dem Auslösen von Erinnerungen und der Kontaktaufnahme durch Betreuungspersonen (31).
Die MT zeigt schon im MCI-Stadium positive Effekte auf die Lebensqualität, wobei aktive MT Vorrang hat vor rezeptiver MT und die Effekte im Einzelsetting grösser sind. Playlisten/Musiksammlungen zum Entspannen, Motivieren oder Unterstützen pflegerischer Massnahmen werden empfohlen (31, 32). Da häufigere MT die positiven Effekte zu verstärken scheint, wird eine kontinuierliche Behandlung mehrmals pro Woche empfohlen (33), wobei im Gruppensetting nicht mehr als 5–8 Patientinnen und Patienten teilnehmen sollten (34).
Weitere kunsttherapeutische Ansätze
Im 2018 erschienenen Cochrane Review mit Fokus auf der Maltherapie wird keine ausreichende Evidenz für die Kunsttherapie gesehen (35). In der aktualisierten S3-Leitlinie wird die Tanztherapie zur Behandlung depressiver Symptome bei MCI und Demenz empfohlen. Auf weitere kunsttherapeutische Ansätze wird dort nicht mehr explizit eingegangen, und es besteht die dringliche Notwendigkeit weiterführender Forschung.
Tiergestützte Therapie
Der Begriff «tiergestützte Interventionen» gilt als Überbegriff. Wie für die Fachperson braucht es auch für die eingesetzten Tiere eine fachgerechte, intensive Vorbereitung und für die Tiere auch eine spezielle Zertifizierung.
Generell werden tiergestützte Interventionen eingesetzt zur Förderung sozialer, emotionaler, physischer sowie kognitiver Kompetenzen (36). Zur Behandlung von Agitiertheit besteht aktuell keine Evidenz.
Beratungsangebote und Angehörigenarbeit bei Alzheimer und anderen Demenzformen
Beratung von Patient und Umfeld ist ein Kernelement der Therapie der Demenzerkrankungen und Voraussetzung für einen geeigneten Umgang mit der Erkrankung. Die einmalige Beratung, z. B. gleich bei der Übermittlung einer Diagnose, reicht dabei nicht aus. Oftmals kommen den Betroffenen die wesentlichen Fragen bzgl. ihrer Erkrankung und des Lebens mit der Erkrankung erst nach einer gewissen Zeit in den Sinn. Ein angeleitetes Vorgehen von Anfang an, das den Erkrankten und ihren Familienmitgliedern aufzeigt, welche Informationen relevant sind, welche Unterstützungsmöglichkeiten es gibt und wie sie trotz einer Demenzerkrankung ein erfülltes Leben führen können, ist entscheidend, da dies Orientierung über verfügbare Unterstützung und Hilfe bietet (37). Bestandteil von Angehörigenarbeit ist aber auch die Vermittlung von Skills im Umgang mit MmD, z. B. bei BPSD oder bzgl. der Kommunikation.
Die S3-Leitlinie empfiehlt bereits bei leichten psychischen Symptomen kognitive Verhaltenstherapie, Verhaltensaktivierung oder Multikomponenten-Intervention in Kombination mit Beratung.
Da die Beratungsansätze vielfältig und daher kaum vergleichbar sind, finden sich bis heute kaum qualifizierte Studien zur Wirkung von Beratung von MmD im engeren Sinne.
Case Management und Zugehende Beratung
Um einerseits psychologische Hindernisse aufgrund der noch immer gegebenen Stigmatisierung von Demenzerkrankungen zu vermeiden und andererseits die Erkrankten und ihre Angehörigen auch bei fortschreitender Erkrankung bedarfs- und bedürfnisgerecht begleiten zu können, bietet demenzspezifisches Case Management, z. B. auch in Form von «Zugehender Beratung», einen sinnvollen Ansatz (38, 39). In diese Richtung geht auch der international immer stärker geforderte Dementia Care Manager mit Evidenz zur Reduktion von Komplikationen und Verzögerung von Heimeintritten (40).
Beratungsstellen
In der Schweiz gibt es unterschiedliche Stellen, an die sich Angehörige wenden können: Memory Clinics, Haus- und Spezialärzte, Beratungsstellen, Bildungszentren sowie verschiedene Angebote zur Altersberatung der Gemeinden. Teilweise gehören diese zu national tätigen Organisationen wie Alzheimer Schweiz und Pro Senectute oder haben sich lokal entwickelt. Meist sind erste Beratungsgespräche kostenlos. Zudem können die zahlreich verfügbaren Online-ressourcen (z. B. www.alz.ch und https://alzguide.ch) als Ergänzung sinnvoll sein.
Peer support
Peer support durch andere pflegende Angehörige kann den psychosozialen Stress von betreuenden Angehörigen verringern und das Supportnetz eines MmD stärken.
Interventionelle Verfahren
Verschiedene interventionelle Verfahren wurden bei Demenz untersucht. Im Gegensatz zu medikamentösen Innovationen, welche im Rahmen eines Zulassungsverfahrens die Sicherheit und die Wirksamkeit beweisen müssen, sind die interventionellen Verfahren weniger stark reguliert. So sind im Schweizer Gesundheitsmarkt verschiedene Verfahren verfügbar, welche zwar CE-zertifiziert sind und damit als hinreichend sicher gelten, jedoch ihre Wirksamkeit bisher nicht in qualitativ ausreichenden und grossen Studien zeigen konnten. Dies ist besonders bedenklich, da einige Firmen bereits heute versuchen, ihre Produkte für die Behandlung von MmD zu vermarkten.
Repetitive transkranielle magnetische Stimulation (rTMS)
Die rTMS ist ein neuromodulatorisches Verfahren, welches durch Stimulation mit einer Magnetspule an der Kopfoberfläche ein elektrisches Feld in der Tiefe des Gehirns erzeugen kann. Insgesamt sind die verfügbaren Daten noch zu gering, um eine breite Anwendung bei Demenz ausserhalb von klinischen Studien empfehlen zu können.
Transkranielle Pulsstimulation
Mit der transkraniellen Pulsstimulation sollen von aussen durch die Schädeldecke tiefer liegende Hirnstrukturen erregt werden. Bisherige Studien haben zwar Effekte auf einige für die Alzheimer Demenz relevante Funktionen messen können (41), die Studien wurden aber ohne adäquate Kontrollgruppe durchgeführt. Eine Anwendung ausserhalb von klinischen Studien kann nicht empfohlen werden.
Transkranielle elektrische Stimulation
Die transkranielle elektrische Stimulation kann auf verschiedene Arten auf der Kopfoberfläche appliziert werden. Es liegen Daten aus randomisierten und sham-kontrollierten Studien vor, die eine Wirksamkeit auf Kernsymptome der Alzheimer Demenz wie die episodische Gedächtnisstörung nahelegen (42), wobei die Effekte auch über den eigentlichen Behandlungszeitraum hinaus messbar blieben (43). Doch auch bei dieser Methode sind die Studiendaten zum heutigen Zeitpunkt noch heterogen und vorläufig, so- dass ein Einsatz ausserhalb von klinischen Studien nicht empfohlen wird.
Tiefe Hirnstimulation
Die tiefe Hirnstimulation (deep brain stimulation, DBS) ist ein invasives Verfahren, bei dem Elektroden an unterschiedlichen Zielpunkten in der Tiefe des Gehirns platziert werden. Das Verfahren ist in der Behandlung von Menschen mit Parkinson-Erkrankung und anderen Bewegungsstörungen gut etabliert, kann aber zum heutigen Zeitpunkt ausserhalb von klinischen Studien für MmD nicht empfohlen werden.
Palliative Care, Advance Care Planning (ACP)
Demenz ist ein Syndrom, das meist Ausdruck einer unheilbaren, lebensverkürzenden Krankheit ist, die mit ihren Begleiterkrankungen schliesslich zum Tod führt, obgleich die Menschen jahrelang mit der Krankheit leben können. Eine adäquate Palliativversorgung hat die Verbesserung der Lebensqualität, den Funktionserhalt und die Maximierung des Wohlbefindens im ganzen Krankheitsverlauf zum Ziel und nimmt auch die Bedürfnisse der Angehörigen auf (44). Weil Kognition, Kommunikations- und Urteilsfähigkeit im Krankheitsverlauf abnehmen, ist eine frühzeitige Vorausplanung (ACP) mit dem MmD wichtig, um Präferenzen, Werte, Bedürfnisse und Vorstellungen für spätere Krankheitsphasen festzuhalten (45).
Medikamentöse und nicht-medikamentöse Behandlungsmassnahmen sind im palliativen Sinne anzuwenden.
Im Krankheitsverlauf erfordern gesundheitliche Störungen sorgfältige Entscheidungen bezüglich Behandlungsziel unter Berücksichtigung des ACP, um unnötige Hospitalisationen und Interventionen zu vermeiden (46).
Medikamentöse Therapie
Symptomatische medikamentöse Therapie
Alle bislang zugelassenen medikamentösen Therapieansätze sind symptomatisch wirksam. Sie richten sich also nicht direkt gegen die krankheitsauslösende Neurodegeneration oder die pathologischen Eiweissablagerungen bei der Alzheimer-Krankheit (Tau und Amyloid) im Gehirn. Orientierend lässt sich sagen, dass diese Medikamente die Punktzahl im Mini-Mental-Status bei MmD aufgrund einer Alzheimer-Krankheit um gut einen Punkt verbessern und es einige Wochen dauert, bis der Effekt maximal deutlich wird. Wichtiger sind oft die Verbesserungen von Alltagsfunktionen. Da die Medikamente bereits lange verfügbar sind, erfüllen die ursprünglichen Zulassungsstudien nicht mehr die heutigen Standards. Dies hat dazu geführt, dass einige Länder (z. B. Frankreich) ihre Erstattungsfähigkeit eingeschränkt haben. Für alle Substanzen wird eine langsame Eindosierung empfohlen. Insgesamt werden die Substanzen gut vertragen.
AChE-Inhibitoren
Alzheimer-Krankheit
Der Effekt der drei Acetylcholinesteraseinhibitoren (AChE-I) Donepezil, Rivastigmin und Galantamin ist moderat, bleibt aber auch bei längerem Einsatz signifikant, wie neuere Arbeiten mit Langzeitdaten zeigen (47). In dieser und weiteren Studien haben MmD unter AChE-I auch eine reduzierte Gesamtmortalität.
AChE-I stehen auf der Spezialitätenliste. Die Limitationen erfordern die wiederholte Durchführung des MMSE zur Unterstützung einer Nutzen-Risiko-Abwägung. Bei einem Wert unter 10 fordert die Limitatio zudem die Beendigung. Im Gegensatz dazu empfehlen die deutschsprachige S3- Leitlinie und die Daten der Domino-AD-Studie hingegen die Weiterführung (48), die aber begründet werden sollte (off-label). Im Stadium erheblicher Funktionseinschränkungen (z. B. Bettlägerigkeit und umfassender Pflegebedarf) sollte die Behandlung beendet werden.
Andere Formen der Demenzerkrankungen
Menschen in leichten bis mittleren Stadien einer Demenz bei Parkinson-Erkrankung oder aufgrund einer LBD sollte Donepezil oder Rivastigmin angeboten werden. Rivastigmin kann in dieser Indikation Verhaltenssymptome günstig beeinflussen (49). In der Schweiz besteht eine Zulassung von Rivastigmin-Kapseln für die Demenz bei ParkinsonErkrankung, in den weiteren Indikationen handelt es sich um eine Off-label-Behandlung.
Bei einer rein vaskulären Demenz empfiehlt die S3-Leitlinie Donepezil oder Galantamin in hoher Dosierung, aber auch Memantin zur Verbesserung der Kognition. Zudem ist zu berücksichtigen, dass es sich bei Demenzen bei Hoch- betagten in der Mehrzahl um Mischformen handelt. Bei Demenz aufgrund einer FTLD sind AChE-I ungeeignet.
Memantin
Alzheimer-Krankheit
Memantin ist zugelassen für die mittelgradig bis schwere Demenz aufgrund einer Alzheimer-Krankheit. Bei moderater Demenz sollte bei guter Verträglichkeit jedoch den AChE-I der Vorzug gegeben werden (NICE). Auch hier sollte bei guter Verträglichkeit und langsamer Aufdosierung mit der Höchstdosis von 20 mg behandelt werden. Die Limitatio verlangt zudem die wiederholte Durchführung des MMSE und einen Punktwert zwischen 3 und 19 Punkten.
Weitere Demenzformen
Für die Behandlung einer Demenz bei LBD gilt Memantin als 2. Wahl nach den AchE-I (siehe oben). Bei FTLD wird empfohlen, beide Substanzgruppen nicht einzusetzen. Memantin wirkt eher sedierend als AChE-I.
Ginkgo biloba
Alzheimer-Demenz und vaskuläre Demenz
Die deutschsprachige S3-Guideline bewertet Ginkgo biloba in einer Dosis von 240 mg täglich positiv in Bezug auf «Aktivitäten des täglichen Lebens» sowie u.a. für die kognitiven Fähigkeiten. Empfohlen wird der Einsatz bei leichter bis mittelgradiger AD oder vaskulärer Demenz mit nicht psychotischen Verhaltenssymptomen. Der Empfehlungsgrad für die Verbesserung der Kognition ist aber niedriger als jener für z. B. die AChE-Inhibitoren. Es stehen verschiedene Präparate zur Verfügung, die sich in ihrer chemischen Zusammensetzung leicht unterscheiden. Die meisten wissenschaftlichen Untersuchungen wurden mit dem Extrakt EGb 761 durchgeführt. Insgesamt kann bei leichter bis mittlerer Demenz aufgrund einer Alzheimer-Krankheit, aber auch bei einer vaskulären Demenz die Behandlung erwogen werden. Der Einsatz empfiehlt sich insbesondere für Menschen, die Phytotherapien favorisieren, oder für welche, bei denenAChE-I und Memantin nicht infrage kommen.
Subjektive kognitive Störung (SCD) und leichte kognitive Störung (MCI)
In der Schweiz ist die Zulassung dieser Substanzen breit gefasst («Einbussen in der mentalen Leistungsfähigkeit»). Damit sind Ginkgo-Präparate die einzigen Substanzen, die auch im MCI-Stadium eingesetzt werden können. Allerdings haben grosse randomisierte Studien keinen signifikanten Effekt auf die Entwicklung einer Demenz gezeigt (50, 51). Hingegen zeigen Daten aus Verschreibungsregistern, dass Menschen unter Ginkgo weniger häufig eine Demenz entwickeln (52). Die Diskrepanz könnte durch unterschiedliche Studiendesigns und Beobachtungszeiträume zu erklären sein. Zusammenfassend kann eine Behandlung mit Ginkgo in den Stadien SCD und MCI erwogen werden. Sie sollte aber immer mit einer ausführlichen Beratung zu demenzpräventiven Massnahmen (53) kombiniert werden.
Andere Demenzformen
Ein Wirksamkeitsnachweis für Parkinson-Demenz, LBD und FTLD liegt nicht vor.
Krankheitsmodifizierende Therapien
Im Zeitraum der Erstellung der vorliegenden Therapieempfehlungen wurden Zulassungsanträge für die neuen krankheitsmodifizierenden Therapien Lecanemab und Donanemab bei der Swissmedic eingereicht. Eine Entscheidung hierüber steht aus. Diese Medikamente haben in grossen Phase-III-Studien gezeigt, dass sie die Amyloidlast im Gehirn von Menschen mit frühen Stadien einer Alzheimer-Krankheit effektiv reduzieren können und auch moderate Effekte auf die Progredienz der klinischen Symptome aufweisen.
Da sich die vorliegenden Empfehlungen auf zugelassene bzw. in der Schweiz verfügbare Therapien beschränken, erfolgt an dieser Stelle (noch) keine weitere Bewertung dieser neuen Therapien. Wir verweisen auf separate Stellungnahmen, welche zu gegebener Zeit publiziert werden.
Kritische Überprüfung anderer medikamentöser Therapien
Genauso wichtig wie der Einsatz von Medikamenten zur Verbesserung der Kognition ist die Vermeidung von Medikamenten, welche die Kognition verschlechtern. PRISCUS (54) und START-STOPP (58) sind Zusammenstellungen von im Alter potenziell ungeeigneten Medikamenten (potentially inappropriate medications, PIMs).
Substanzbasierte Therapien/Nahrungsergänzungsmittel
Beim Einsatz von Nahrungsergänzungsmitteln bei Demenzerkrankungen gibt es verschiedene, möglicherweise wirksame Behandlungsansätze, die von einer Hirnversorgung mit spezifisch-neuroprotektiven Mikronährstoffen über energetische Verbesserung mittels Keto-Diät bis zur gezielt cerebralen Inflammationsbeeinflussung via Mikrobiomveränderung (Braunalgen) reichen. Angesichts des Pilotcharakters der dazu vorliegenden wissenschaftlichen Studien lassen sich zum heutigen Zeitpunkt keine allgemeinen Empfehlungen ableiten. Dies betrifft nicht die Behandlung von gezielt nachgewiesenen Mangelzuständen oder die allgemeinen Empfehlungen der Altersmedizin zu Vitamin D.
Ausblick
Fachkräftemangel und Kostendeckung
Trotz der neuesten Entwicklungen bei den Antikörper-basierten Therapien wird die Versorgung und Therapie der Demenzerkrankungen eine gesellschaftliche Herausforderung bleiben. Diese Herausforderungen spitzen sich aufgrund der erwarteten Verdoppelung der Fallzahlen bis 2050 und dem Fachkräftemangel erheblich zu. Es erscheint aktuell nicht realistisch, den Demenzbetroffenen flächendeckend die optimale Therapie zukommen zu lassen. Viele der in diesem Dokument gemachten Empfehlungen müssen aufgrund fehlender lokaler Angebote und deren Finanzierung angepasst werden. Erforderlich ist insbesondere aber eine gesellschaftliche Diskussion, was die Demenzversorgung kosten darf und wie integriert beispielsweise MmD sein sollen.
Wie sich neue Technologien wie Sozialroboter oder computerbasierte kognitive Technologien im Alltag (insbesondere im Schweizer Kontext) implementieren und über längere Zeit einsetzen lassen, ist noch ungenügend untersucht worden, und somit fällt die Empfehlungsstärke gering aus. Klar ist jedoch, dass neue Technologien zukünftig eine grössere Rolle spielen werden.
Danksagungen
Mit freundlicher Unterstützung der Nationalen Demenzplattform. Wir danken senesuisse, Verband wirtschaftlich unabhängiger Alters- und Pflegeeinrichtungen Schweiz, und LangzeitSchweiz, Schweizer Fachverband für Langzeitpflege und -betreuung, für ihre Teilnahme am Vernehmlassungsverfahren. Wir danken Reto Kressig für eine ergänzende Kommentierung. Wir danken Sandra Habegger für die Editierung des Textes. Es handelt sich hierbei um die 1. Auflage. der Therapieempfehlungen. Gerne nimmt die Geschäftsstelle SMC Anregungen für eine Neuauflage entgegen.
Abkürzungen
ACP Advance Care Planning
BPSD behaviorale und psychische Symptome der Demenz
FTLD Frontotemporale Lobärdegenerationen
LBD/LBK Demenz/Krankheit mit Lewy-Körperchen
MCI mild cognitive impairment (leichte kognitive Störung)
MmD Menschen mit Demenz
MT Musiktherapie
PIM potentially inappropriate medication
SCD subjective cognitive decline
(subjektive kognitive Beeinträchtigung)
SMC Swiss Memory Clinics
Historie
Manuskript eingereicht: 30.05.2024
Manuskript angenommen: 10.06.2024
Recommandations de Swiss Memory Clinics pour le traitement des troubles cognitifs
Introduction
Le traitement des personnes atteintes de troubles cognitifs et de syndromes démentiels est complexe. Outre les options médicamenteuses, il existe une multitude de traitements non médicamenteux. L’ indication des différentes options thérapeutiques varie fortement en fonction des symptômes individuels, des pathologies sous-jacentes, de l’ âge, du stade de la maladie et de la disponibilité. Il peut donc être difficile, surtout pour les non-spécialistes, de déterminer, pour chaque personne atteinte de démence (PAD), la bonne combinaison de thérapies au bon moment. C’ est pourquoi il est de plus en plus recommandé de faire appel à des Dementia Care Managers (1). L’ association Swiss Memory Clinics (SMC) publie dans le présent document des recommandations sur le traitement de la démence en Suisse, en complément des recommandations sur le diagnostic de la démence développées dans le cadre de la stratégie nationale en matière de démence. Les recommandations se limitent aux thérapies autorisées et disponibles en Suisse.
Pour la publication actuelle, le groupe d’ auteurs a également pris en compte les lignes directrices publiées dans d’ autres pays, en particulier la ligne directrice S3 (1). Généralement, les sections sur les thérapies spécifiques ont été rédigées par les associations professionnelles correspondantes. Une place a été explicitement accordée à l’ expérience clinique.
Les recommandations suivantes s’ adressent en principe à tous les groupes professionnels et à tous les settings. Il s’ agit d’ une version abrégée de la version longue élaborée avec le soutien de l’ OFSP, disponible gratuitement (Plateforme nationale démence (https://www.bag.admin.ch/bag/fr/home/strategie-und-politik/nationale-gesundheitsstrategien/demenz.html). Comme pour les recommandations en cours d’ actualisation concernant le diagnostic (2) nous tenons à souligner l’importance des soins primaires. Sauf indication contraire explicite, tous les sexes sont concernés.
Objectifs thérapeutiques généraux
Les démences sont par définition des syndromes chroniques sous-tendus par diverses maladies. Les niveaux cliniques et étiologiques doivent être distingués, mais des termes comme «pathologies démentielles» restent courants et seront donc utilisés ici. Par ailleurs, les démences neurodégénératives sont évolutives. Les traitements des déficits cognitifs actuellement disponibles ne peuvent que ralentir leur progression. Ces maladies représentent une lourde charge pour les personnes directement concernées et leurs proches. Souvent, ce ne sont pas les déficits cognitifs, mais les symptômes comportementaux et psychiques de la démence (SCPD) qui sont à l’ origine du passage en maison de retraite ou en établissement médico-social. Ceux-ci font l’ objet de recommandations séparées (3).
Les présentes recommandations traitent de l’ amélioration de la qualité de vie des PAD et de leurs proches, du maintien de l’ autonomie et de la stabilisation des performances cognitives (BAG 2020). Le Tab. 1 présente les principales composantes de la démarche dans le cas d’ une démence nouvellement diagnostiquée.
Thérapie non médicamenteuse
Les interventions non médicamenteuses visent en grande partie à permettre des moments de bien-être dans les dimensions bio-psycho-sociales et spirituelles, ainsi qu’ à maintenir, alors que la maladie progresse, les fonctions et la participation des PAD aussi longtemps que possible. Cela permet de réduire ou de ralentir les restrictions supplémentaires et d’ améliorer ou de stabiliser la qualité de vie (4). Pour que les thérapies non médicamenteuses soient efficaces, les professionnels de la santé et du travail social, entre autres, mais aussi les proches aidants ont besoin de connaissances et de compétences concernant les concepts et les interventions mentionnés ci-dessous. Les formations sont donc essentielles. En raison de la nécessité de recourir à du personnel qualifié, les mesures non médicamenteuses dépendent de la disponibilité de ce dernier. Les coûts salariaux correspondants doivent être mis en relation avec les charges liées aux complications évitables en soi (entourage chargé, mesures de restriction de la liberté) et les coûts du traitement des complications (séjours hospitaliers).
L’ entourage doit faire preuve d’ empathie, de patience, de créativité et d’ un réel intérêt pour communiquer avec les PAD. Outre les activités d’ activation, il faut toujours offrir la possibilité de se retirer.
Les mesures non médicamenteuses sont envisageables à tous les stades de la démence. Dans l’ idéal, elles sont proposées en continu et s’ adaptent à l’ évolution des capacités des PAD au cours de la maladie.
Approches intégratives
Les paragraphes suivants présentent un large éventail de thérapies non médicamenteuses. Le choix devrait dépendre en premier lieu des besoins des personnes concernées. De plus, la disponibilité dans le milieu concerné joue également un rôle.
Étant donné que la plupart des thérapies suivantes ont été étudiées séparément, on sait peu de choses sur les avantages supplémentaires des combinaisons et, par conséquent, sur la pertinence des facteurs communs ou distincts. Les aspects suivants sont communs aux thérapies :
– Haute personnalisation
– Interdisciplinarité et interprofessionnalité
– Implication de l’ entourage et des proches en particulier
– Valorisation, reconnaissance des émotions
– Communication non verbale
Le niveau de preuve pour chaque procédure est très différent. Il convient en outre de délimiter l’ objectif. Ainsi, l’ amélioration de la cognition par des approches non médicamenteuses est plus facilement réalisable au stade de démence légère à modérée. De nombreuses interventions, telles que la stimulation cognitive, la thérapie par réminiscence, l’ ergothérapie, la thérapie par la musique et la danse, sont en revanche décrites dans la lignes directrice S3 (1) pour tous les stades de la démence pour le traitement des symptômes dépressifs. Le degré de recommandation va de «élevé» pour la thérapie par le mouvement et la psychothérapie à «faible» pour la réminiscence et l’ ergothérapie. Malgré les nombreuses études existantes, la ligne directrice S3 (1) n’ apporte aucune preuve d’ efficacité des méthodes non médicamenteuses contre les symptômes d’ anxiété.
Psychothérapie
Il existe de bonnes preuves d’ efficacité de la psychothérapie, notamment pour le traitement des symptômes dépressifs dans les cas de démence légère et de Mild cognitive impairment (MCI). Les objectifs thérapeutiques sont la psychoéducation, l’ activation des ressources, le renforcement des stratégies d’ adaptation et la promotion de l’ efficacité personnelle. Il est également essentiel d’impliquer et conseiller les proches. Il est recommandé d’ adapter le traitement par rapport aux personnes sans déficit cognitif. La préférence devrait être donnée à des séances de thérapie plus courtes mais plus fréquentes. De plus, les éléments cognitifs devraient être adaptés aux capacités de la personne.
Concepts de soins spécifiques
Les concepts de soins infirmiers impliquent généralement une combinaison d’ interventions et d’ approches différentes. Les soins n’ étant pas une thérapie en soi, ils intègrent souvent des éléments thérapeutiques de disciplines voisines. Par exemple, les activités quotidiennes sont complétées par des interventions stimulant le mouvement, ou bien des interventions musicales sont intégrées dans la structure de la journée et produisent ainsi leurs effets (p. ex. maintien ou réactivation des ressources, promotion de la qualité de vie). Les interventions présentées ici ne sont donc pas exclusivement proposées par le personnel soignant.
Interventions multisensorielles
Soins aromatiques et aromathérapie
Les soins aromatiques et l’ aromathérapie sont souvent utilisés comme synonymes dans la littérature et comprennent l’ utilisation externe d’ huiles essentielles. Il n’ y a pas de preuve claire d’ efficacité en ce qui concerne la qualité du sommeil ou l’ amélioration de la qualité de vie. Une revue de 5 études ne trouve aucune preuve d’ efficacité de leur utilisation en cas d’ agitation (1). Les expériences en matière d’ aromathérapie / soins aromatiques dans la pratique des soins sont souvent positives, quel que soit le stade de la démence. L’ huile de mélisse semble être le produit qui donne globalement les meilleurs résultats. Il est nécessaire d’ observer attentivement les personnes atteintes de démence pendant l’ utilisation de l’ aromathérapie afin d’ interrompre immédiatement l’ intervention en cas d’ éventuelles réactions négatives. Lors de la première utilisation d’ un produit, la prudence est de mise en raison d’ une possible réaction allergique et un test d’ allergie doit être effectué si nécessaire.
Stimulation basale
La stimulation basale favorise la perception, par exemple par la stimulation sensorielle au moyen de massages, mais aussi de manière multimodale par le mouvement et la parole (chanter / fredonner). Les études sur l’ utilité de la stimulation basale dans les soins et l’ accompagnement des personnes atteintes de démence sont peu nombreuses. Les recommandations existantes pour les soins et l’ accompagnement des personnes atteintes de démence mentionnent la stimulation basale (3).
Snoezelen
La thérapie Snoezelen consiste à stimuler différents sens par des offres visuelles, acoustiques, olfactives, tactilo-haptiques, vestibulaires et / ou vibratoires au quotidien. Cette thérapie multisensorielle peut se dérouler dans un espace clos (salle Snoezelen), dans le cadre d’ un plan de traitement axé sur les tâches ou encore dans le cadre d’ une prise en charge 24h/24. Sur la base des preuves existantes et de l’ expérience pratique, la thérapie Snoezelen peut être recommandée pour les personnes atteintes de démence modérée à sévère (5, 6). Les effets de la thérapie Snoezelen sont plus importants lorsque la personne qui propose la thérapie (soignant, proche aidant) est formée à l’ utilisation d’ interventions multisensorielles (5).
Entraînement de la mémoire / Thérapie de stimulation cognitive
L’ éventail des approches de thérapie cognitive va de procédés d’ activation relativement peu spécifiques (stimulation cognitive) à des entraînements (fonctionnels) concentrés sur certains domaines cognitifs. De nombreuses approches sont liées à l’ interaction sociale et devraient être utiles pour cette seule raison. Les participants ont parfois estimé que leur qualité de vie était meilleure. Mais la confrontation avec ses propres déficits peut aussi avoir des effets négatifs sur l’ état psychique.
Au stade de démence légère à modérée, plusieurs lignes directrices internationales (1, 6) ainsi qu’une revue Cochrane (7) recommandent une stimulation cognitive qui, outre une amélioration de la cognition, peut également avoir des effets positifs sur la qualité de vie et la communication, comparables à ceux pouvant être obtenus dans le cadre de thérapies médicamenteuses établies. La ligne directrice S3 émet une recommandation faible pour la stimulation cognitive dans le traitement des symptômes dépressifs dans le cadre de la démence. L’ entraînement spécifique de la mémoire avec l’ enseignement de stratégies ou les méthodes psychothérapeutiques pour le traitement des déficits cognitifs sont déconseillés au stade de démence afin d’éviter une surcharge.
Réhabilitation cognitive
La réadaptation cognitive se réfère à l’ identification individuelle d’ objectifs fonctionnels pertinents pour la personne atteinte de démence et qui doivent être atteints en collaboration avec la personne concernée, ses proches et ses soignants. L’ objectif est de réduire les impacts des limitations existantes.
La réadaptation cognitive est recommandée pour les stades de démence légère à modérée (6) (NICE).
Physiothérapie
La littérature et les études montrent clairement l’ efficacité des mesures physiothérapeutiques en cas de douleurs et de limitations de mouvement (8). La ligne directrice S3 se prononce fortement en faveur de l’ entraînement physique pour améliorer les activités de la vie quotidienne (1).
Grâce à des examens physiothérapeutiques ciblés des structures corporelles, des fonctions et de l’ activité tout au long de l’ évolution de la maladie, les déficits tels que la douleur, le risque de chute, la dysphagie sont rapidement identifiés, permettant la planification de mesures interprofessionnelles individuellement adaptées (9–11) et une utilisation optimale des manuels d’ entraînement (12). Cela permet également de réduire de manière ciblée les problèmes de comportement (13).
Au stade de démence avancée, en fonction de l’ évolution de la maladie, il convient de procéder environ une fois par an à une évaluation structurelle (douleur, limitation des mouvements), fonctionnelle (stabilité, force, équilibre, capacité cardio-pulmonaire, dysphagie), des capacités cognitives et motrices, et du risque de chute.
Ergothérapie
L’ ergothérapie est considérée comme une thérapie visant à améliorer et à maintenir les fonctions quotidiennes et la capacité d’ action dans le but d’ améliorer la participation et la qualité de vie dans le quotidien et le cadre de vie individuel. Les interventions efficaces comprennent le conseil et la mise en œuvre d’ activités de promotion de la santé qui améliorent la qualité de vie, ainsi que l’ entraînement des capacités physiques, cognitives, émotionnelles et sociales pertinentes pour la vie quotidienne (14–16). La ligne directrice S3 recommande également l’ ergothérapie pour traiter les symptômes dépressifs. L’ ergothérapie s’ adresse à la fois aux personnes concernées et à leurs proches, et peut les soutenir dans les domaines des activités quotidiennes, des soins personnels, de la mobilité, des tâches ménagères et des loisirs (17), permettant ainsi de réduire la charge physique (16) et psychologiques (18) des proches.
Thérapie d’activation
La thérapie d’ activation se déroule en individuel ou en groupe. Divers moyens (p. ex. musique, mouvement ou entraînement de la mémoire) et méthodes (p. ex. processus de réminiscence avec travail biographique, validation ou stimulation basale) sont utilisés (19). Ces méthodes ont fait l’ objet d’ études sur leur efficacité.
Il existe des preuves modérées concernant les approches de thérapie d’ activation chez les PAD (15, 20), mais celles-ci couvrent un large éventail de résultats et s’ appliquent aussi bien directement pour les PAD que pour leurs proches. Les lignes directrices NICE indiquent que diverses activités physiques quotidiennes (marche, danse, exercices d’ équilibre, etc.) peuvent avoir une influence positive sur la cognition et l’ exécution des activités quotidiennes. Les activités en plein air semblent avoir un effet positif sur l’ humeur, la participation sociale et le sommeil (21).
Logopédie
Les troubles du langage et/ou de la parole ainsi que de la communication, qui peuvent apparaître dans différentes formes de démence, entravent la participation sociale dans une large mesure. En particulier au stade MCI et en début de maladie, un traitement logopédique est indiqué pour les variantes à dominante linguistique. Il est essentiel d’intégrer les proches-aidants dès le début de la prise en charge logopédique (22).
Les exercices doivent être pertinents pour la vie quotidienne ou avoir une signification pour le patient. Dépendant d’où se situe le trouble langagier, nous pouvons travailler au niveau de l’ articulation, des mots, de la phrase ou du discours.
La lecture peut être une ressource pour maintenir la communication, en particulier pour ceux qui souffrent d’ une démence de type Alzheimer (23–25). Il existe également des moyens de communication alternatifs tels que des carnets de communication, des applications ou encore la communication multimodale via le geste ou l’ écriture.
La prévalence des dysphagies dans la démence avancée est de plus de 80 % (26, 27). Un examen clinique et logopédique détaillé de la déglutition (26, 28) inclut des procédures instrumentales pour examiner le processus de déglutition. En cas de démence avancée, cela n’ est souvent pas possible. On se rabat alors sur une observation structurée de l’ alimentation. Sur le plan thérapeutique, la méthode de choix est la thérapie fonctionnelle de la dysphagie. La déglutition est soutenue, par exemple, par des modifications de la position de la tête, mais aussi par des adaptations de la nourriture.
Art-thérapie
Musicothérapie
Les lignes directrices nationales et internationales ainsi que les experts recommandent l’ utilisation de la musicothérapie (MT). Une revue Cochrane (29) fournit des indications selon lesquelles l’ humeur, les symptômes comportementaux, la communication et les fonctions physiques peuvent être influencés positivement.
La ligne directrice S3 considère que la musique a des effets positifs sur le traitement des symptômes dépressifs et recommandent fortement son utilisation personnalisée en cas d’ agitation. Une méta-analyse de Zhang et al. 2017 (30) montre que les interventions basées sur la musique – combinées à l’ interaction sociale – peuvent avoir des effets positifs sur les symptômes comportementaux et l’ anxiété. Une tendance à l’ amélioration des signes de dépression, de la fonction cognitive et de la qualité de vie est également constatée. Une revue de la littérature soutient ces conclusions (31, 32), démontrant dans une méta-analyse des effets positifs sur l’ attention, le langage et la mémoire autobiographique, et décrit des effets mesurables plus importants lors de thérapies menées par des musicothérapeutes qualifiés.
Les symptômes dépressifs diminuent de manière significativement plus importante avec la musicothérapie de groupe qu’ avec la participation à un groupe de chant (33).
Dans les cas de démence modérée et avancée, la musique joue un rôle particulier dans la génération d’ émotions positives, le déclenchement de souvenirs et la prise de contact par les soignants (Huber et al., 2021).
La MT montre des effets positifs sur la qualité de vie dès le stade MCI, avec une préférence pour la MT active par rapport à la MT réceptive, et des effets étant plus importants en individuel.
Des playlists/collections musicales pour se détendre, motiver ou soutenir les mesures de soins sont recommandées (34, 35). Comme une MT plus fréquente semble renforcer les effets positifs, un traitement continu plusieurs fois par semaine est recommandé (36), sachant qu’ en setting de groupe le nombre des participants devrait se limiter à un maximum de 5–8 patients (37).
Autres approches d’art-thérapie
Dans la revue Cochrane parue en 2018 et portant sur la thérapie par la peinture, aucune preuve suffisante de l’ efficacité de l’ art-thérapie n’ a été trouvée (38). Dans la ligne directrice S3 actualisée, la thérapie par la danse est recommandée pour le traitement des symptômes dépressifs en cas de MCI et de démence. Les autres approches d’ art-thérapie n’ y sont plus explicitement abordées et il est urgent de poursuivre la recherche dans ce domaine.
Thérapie assistée par l’ animal
Le terme «interventions assistées par l’ animal» est considéré comme un terme générique.
Comme pour le professionnel, les animaux utilisés nécessitent une préparation professionnelle et intensive, ainsi qu’ une certification spéciale.
En général, les interventions assistées par l’ animal sont utilisées pour promouvoir les compétences sociales, émotionnelles, physiques et cognitives (39).
Il n’ y a actuellement pas de preuve d’efficacité concernant le traitement de l’ agitation.
Offres de conseil et travail avec les proches en cas de maladie d’ Alzheimer et d’autres formes de démence
Le conseil au patient et à son entourage est un élément clé du traitement de la démence et une condition préalable à une gestion appropriée de la maladie. Un conseil unique, par exemple au moment de l’ annonce du diagnostic, n’ est pas suffisant. Souvent, les questions essentielles concernant la maladie et la vie avec la maladie ne viennent à l’ esprit des personnes concernées qu’ après un certain temps. Une approche guidée dès le début, qui montre aux personnes malades et à leur famille quelles sont les informations pertinentes, quelles sont les possibilités de soutien et comment mener une vie épanouie malgré la démence, est essentielle, car elle permet de s’ orienter vers le soutien et l’ aide disponibles (40). Le travail avec les proches comprend également l’ enseignement des compétences nécessaires pour l’interaction avec les PAD, comme p.ex. concernant la communication et les SCPD.
La ligne directrice S3 recommande dès la présence de symptômes psychologiques légers, une thérapie cognitive-comportementale, ou une activation comportementale, ou une intervention multimodale en combinaison avec du conseil.Étant donné que les approches de conseil sont variées et donc difficilement comparables, il existe à ce jour peu d’ études portant sur l’ effet du conseil aux PAD au sens strict.
Case management et suivi personnalisé
Afin d’ éviter d’ une part les obstacles psychologiques dus à la stigmatisation encore présente des pathologies démentielles, et d’ autre part d’ accompagner les malades et leurs proches de manière adaptée à leurs besoins et à l’ évolution de la maladie, la gestion de cas spécifique à la démence, par exemple sous la forme d’un «suivi personnalisé», offre une approche judicieuse (41, 42). Dans ce sens, le Dementia Care Manager est de plus en plus demandé au niveau international, avec des preuves d’une réduction des complications et du retard des entrées en institution (43).
Centres de consultation
En Suisse, il existe différentes structures vers lesquelles les proches peuvent se tourner : les memory clinics, les médecins généralistes et spécialistes, les centres de consultation, les centres de formation ainsi que divers services de conseil pour les personnes âgées offerts par les communes. Certains d’ entre eux appartiennent à des organisations actives au niveau national comme Alzheimer Suisse et Pro Senectute ou se sont développés au niveau local. La plupart du temps, les premières consultations sont gratuites. En outre, les nombreuses ressources en ligne disponibles (p. ex. Alzheimer Berne: Alzheimer Berne (alzheimer-schweiz.ch) et (https://alzguide.ch/fr) peuvent être utiles en complément.
Soutien par les pairs
Le soutien par les pairs d’ autres aidants familiaux peut réduire le stress psychosocial des aidants familiaux et renforcer le réseau de soutien des personnes atteintes de démence.
Procédures interventionnelles
Différentes procédures interventionnelles ont été étudiées dans le cadre de la démence. Contrairement aux innovations médicamenteuses, dont la sécurité et l’ efficacité doivent être prouvées dans le cadre d’ une procédure d’ autorisation, les méthodes interventionnelles sont moins réglementées. Ainsi, il existe sur le marché de la santé en Suisse différentes procédures qui sont, certes certifiées CE et donc considérées comme suffisamment sûres, mais qui n’ ont pas encore pu démontrer leur efficacité dans des études de qualité suffisante et de grande envergure. Cette situation est particulièrement préoccupante, car certaines entreprises tentent déjà de commercialiser leurs produits pour le traitement des PAD.
Stimulation magnétique transcrânienne répétitive (SMTr)
La SMTr est une méthode neuromodulatrice qui peut générer un champ électrique en profondeur dans le cerveau par stimulation avec une bobine magnétique à la surface de la tête. Dans l’ ensemble, les données disponibles sont encore trop limitées pour pouvoir recommander une large utilisation dans la démence en dehors des études cliniques.
Stimulation transcrânienne par impulsions
La stimulation transcrânienne par impulsions doit permettre d’ exciter des structures cérébrales profondes depuis l’ extérieur à travers la boîte crânienne. Jusqu’ à présent, des études ont certes pu mesurer des effets sur certaines fonctions importantes pour la démence de type Alzheimer (44) mais elles ont été menées sans groupe contrôle. Dans l’ ensemble, les données disponibles sont encore insuffisantes et l’ utilisation en dehors des études cliniques ne peut pas être recommandée.
Stimulation électrique transcrânienne
La stimulation électrique transcrânienne peut être appliquée de différentes manières à la surface de la tête. Des données issues d’ études randomisées et contrôlées par placebo suggèrent une efficacité sur les symptômes principaux de la démence de type Alzheimer, comme les troubles de la mémoire épisodique (45). Les effets sont restés mesurables au-delà de la période de traitement proprement dite (46). Cependant, les données des études sont encore hétérogènes et préliminaires, de sorte qu’une utilisation en dehors des études cliniques n’ est pas recommandée.
Stimulation cérébrale profonde
La stimulation cérébrale profonde (deep brain stimulation, DBS) est une procédure invasive au cours de laquelle des électrodes sont placées en différents points cibles en profondeur dans le cerveau. Cette méthode est bien établie dans le traitement des personnes atteintes de la maladie de Parkinson et d’ autres troubles du mouvement. Cependant, cette méthode ne peut pas être recommandée à l’ heure actuelle pour les PAD, en dehors des études cliniques.
Soins palliatifs, Advance Care Planning (ACP)
La démence est un syndrome qui est le plus souvent l’ expression d’ une maladie incurable, qui raccourcit la vie et qui, avec les maladies qui l’ accompagnent, conduit finalement au décès, bien que les personnes puissent vivre avec la maladie pendant des années. Des soins palliatifs adéquats visent à améliorer la qualité de vie, à préserver les fonctions et à maximiser le bien-être tout au long de la maladie, et prennent également en compte les besoins des proches (47). Étant donné que la cognition, la capacité de communication et de jugement diminuent au cours de la maladie, une planification anticipée précoce (ACP) avec la personne atteinte de démence est importante, afin de consigner les préférences, les valeurs, les besoins et les attentes pour les phases ultérieures de la maladie (48).
Les mesures de traitement médicamenteuses et non médicamenteuses doivent être appliquées dans un esprit palliatif.
Au cours de la maladie, les troubles de santé nécessitent des décisions minutieuses concernant l’ objectif du traitement en tenant compte de l’ ACP, afin d’ éviter des hospitalisations et des interventions inutiles (49)
Thérapie médicamenteuse
Traitements médicamenteux symptomatiques
Toutes les approches thérapeutiques médicamenteuses autorisées jusqu’ à présent ont un effet symptomatique. Ils ne ciblent donc pas directement la neurodégénérescence à l’ origine de la maladie ou les dépôts de protéines pathologiques de la maladie d’ Alzheimer (tau et amyloïde) dans le cerveau. En général, ces médicaments améliorent d’ un point le score du Mini-Mental Status chez les personnes atteintes de la maladie d’ Alzheimer et il faut plusieurs semaines pour que l’ effet maximal soit observé. L’ amélioration des fonctions quotidiennes est souvent plus importante. Comme les médicaments sont disponibles depuis longtemps, les études d’ autorisation initiales ne répondent plus aux normes actuelles. Cela a conduit certains pays (p. ex. la France) à restreindre leur remboursement.
Pour toutes les substances, il est recommandé de procéder à une titration lente. Dans l’ ensemble, les substances sont bien tolérées.
Inhibiteurs de l’ AChE
Maladie d’ Alzheimer
L’ effet des trois inhibiteurs de l’ acétylcholinestérase (AChE-I), Donepezil, Rivastigmine et Galantamine, est modéré, mais reste significatif même en cas d’ utilisation prolongée, comme le montrent des travaux récents avec des données à long terme (50). Dans cette étude et dans d’ autres, les personnes atteintes de démence sous AChE-I ont également une mortalité globale réduite.
Les AChE-I figurent sur la liste des spécialités. Les limitations exigent la réalisation répétée du MMSE pour une évaluation du rapport bénéfice/risque. En cas de valeur inférieure à 10, les limitations exigent ainsi leur arrêt. En revanche, la ligne directrice S3 allemande et les données de l’ étude Domino-AD recommandent leur poursuite (51), mais celle-ci doit être justifiée (off-label). Au stade de limitations fonctionnelles importantes (p. ex. alitement et besoin de soins importants), le traitement devrait être arrêté.
Autres formes de démence
Le Donépézil ou la Rivastigmine devraient être proposés aux personnes atteintes d’ une démence légère à modérée liée à la maladie de Parkinson ou à une DCL. Dans cette indication, la Rivastigmine peut avoir un effet favorable sur les symptômes comportementaux (52). En Suisse, la Rivastigmine en capsules est autorisée pour la démence liée à la maladie de Parkinson ; dans les autres indications, il s’ agit d’ un traitement off-label.
Dans le cas d’ une démence purement vasculaire, la ligne directrice S3 recommande le Donepezil ou la Galantamine à haute dose, ainsi que la Mémantine pour le traitement de la cognition. Il convient également de prendre en compte que les démences chez les personnes très âgées sont majoritairement des formes mixtes. Les AChE-I ne sont pas indiqués en cas de démence due à une Dégénérescence lobaire fronto-temporale (DLFT).
Mémantine
Maladie d’ Alzheimer
La mémantine est autorisée pour la démence modérée à sévère due à la maladie d’ Alzheimer. En cas de démence modérée, il convient toutefois de donner la préférence aux AChE-I s’ils sont bien tolérés (NICE). Ici aussi, en cas de bonne tolérance, le traitement doit être administré avec une augmentation progressive jusqu’ à la dose maximale de 20 mg. Les limitations exigent en outre la réalisation répétée du MMSE et un score compris entre 3 et 19 points.
Autres formes de démence
Pour le traitement de la DCL, la mémantine est considérée comme un traitement de 2e choix après les AchE-I (voir ci-dessus). En cas de DLFT, il est recommandé de ne pas utiliser les deux groupes de substances. La mémantine a un effet sédatif plus marqué que les AchE-I.
Ginkgo biloba
Démence de type Alzheimer et démence vasculaire
La ligne directrice S3 allemande évalue positivement le ginkgo biloba à une dose de 240 mg par jour en ce qui concerne les «activités de la vie quotidienne» ainsi que les capacités cognitives. Son utilisation est recommandée en cas de maladie d’Alzheimer légère à modérée ou de démence vasculaire avec des symptômes comportementaux non psychotiques. Le degré de recommandation pour l’ amélioration de la cognition est toutefois inférieur à celui des inhibiteurs de l’ AChE. Plusieurs préparations sont disponibles, dont la composition chimique diffère légèrement. La plupart des études scientifiques ont été menées avec l’ extrait Egb 761. Dans l’ ensemble, le traitement peut être envisagé en cas de démence légère à modérée due à une maladie d’ Alzheimer, mais aussi à une démence vasculaire. Ceci est particulièrement vrai pour les personnes qui favorisent les phytothérapies ou pour lesquelles les autres AChE-I et la mémantine ne sont pas envisageables.
Trouble cognitif subjectif (SCD) et trouble cognitif léger (MCI)
En Suisse, l’ autorisation de ces substances est large («pertes de capacités mentales»). Ainsi, les préparations à base de ginkgo sont les seules substances qui peuvent également être utilisées au stade MCI. Toutefois, de grandes études randomisées n’ ont pas montré d’ effet significatif sur le développement d’ une démence (53, 54). En revanche, les données des registres de prescription montrent que les personnes sous ginkgo sont moins susceptibles de développer une démence (55). Cette divergence s’ explique probablement par des différences méthodologiques et la durée d’ observation. En résumé, un traitement au ginkgo peut être envisagé au stade SCD et MCI. Il devrait cependant toujours être accompagné de conseils détaillés sur les mesures de prévention de la démence (56).
Autres formes de démence
Il n’ existe aucune preuve d’ efficacité pour la démence parkinsonienne, la DCL et la DLFT.
Thérapies modifiant la maladie
Au moment de l’ élaboration des présentes recommandations thérapeutiques, des demandes d’ autorisation de mise sur le marché ont été déposées auprès de Swissmedic pour de nouveaux traitements modifiant la maladie, le Lecanemab et le Donanemab. Une décision à ce sujet est en attente. Ces médicaments ont montré dans de grandes études de phase III qu’ ils pouvaient réduire efficacement la charge amyloïde dans le cerveau des personnes aux stades cliniques précoces de la maladie d’ Alzheimer et qu’ ils avaient également des effets modérés sur la progression des symptômes cliniques.
Comme les présentes recommandations se limitent aux thérapies autorisées ou disponibles en Suisse, nous ne procédons pas (encore) à une évaluation plus approfondie de ces nouvelles thérapies. Nous vous renvoyons à des prises de position séparées qui seront publiées en temps voulu.
Révision critique d’autres thérapies médicamenteuses
Il est tout aussi important d’ utiliser des médicaments pour améliorer la cognition que d’ éviter ceux qui la détériorent. PRISCUS (57) et START-STOPP (58) sont des compilations de médicaments potentiellement inappropriés pour les personnes âgées (PIM).
Thérapies à base de substances / Compléments alimentaires
L’ utilisation de compléments alimentaires dans le cadre de la démence fait l’ objet de différentes approches thérapeutiques potentiellement efficaces, qui vont de l’ approvisionnement du cerveau en micronutriments neuroprotecteurs spécifiques, à l’ influence ciblée sur l’ inflammation cérébrale via la modification du microbiome (algues brunes), en passant par l’ amélioration énergétique au moyen d’ un régime cétogène. Compte tenu du caractère préliminaire des études scientifiques disponibles, aucune recommandation générale ne peut être formulée à l’ heure actuelle. Cela ne concerne pas le traitement de carences avérées ni les recommandations générales de la médecine gériatrique concernant la vitamine D.
Perspectives
Pénurie de personnel qualifié et couverture des coûts
Malgré les derniers développements de thérapies à base d’anticorps, la prise en charge et le traitement des pathologies démentielles resteront un défi sociétal. Ces défis s’ intensifient considérablement en raison du doublement attendu du nombre de cas d’ ici 2050 et de la pénurie de personnel spécialisé. Il ne semble actuellement pas réaliste d’ offrir aux personnes atteintes de démence un traitement optimal de manière uniforme. Bon nombre des recommandations formulées dans ce document doivent être adaptées en raison du manque d’ offres locales et de leur financement. Il est notamment nécessaire d’ engager une discussion sociétale sur le coût de la prise en charge de la démence et sur le niveau d’ intégration souhaité pour les PAD. La manière dont les nouvelles technologies telles que les robots sociaux ou les technologies cognitives informatisées peuvent être mises en œuvre au quotidien et utilisées à long terme (en particulier dans le contexte suisse) n’ a pas encore été suffisamment étudiée, ce qui explique le faible niveau de recommandation. Il est toutefois clair que les nouvelles technologies joueront un rôle plus important à l’ avenir.
Remerciements
Nous remercions senesuisse, association suisse d’établissements économiquement indépendante pour personnes âgées, et Soins de longue durée Suisse, association suisse des professionnels de l’ accueil et des soins de longue durée, pour leur participation à la procédure de consultation. Nous remercions Reto Kressig pour ses commentaires complémentaires. Nous remercions Nadège Barro-Belaygues pour ses commentaires sur la version française des recommandations. Nous remercions Sandra Habegger pour l’ édition du texte. Il s’ agit de la 1ère édition des recommandations thérapeutiques. Le secrétariat de SMC reçoit volontiers des suggestions pour une nouvelle édition.
Abkürzungen
ACP Advance Care Planning
DCL/MCL Démence/maladie à corps de Lewy,
Démence/maladie à corps de Lewy
DLFT Dégénérescence lobaire fronto-temporale
MCI Mild cognitive impairment
MT Musicotherapie
PAD Personnes atteintes de démence
PIM Potentially inappropriate medication
SCD Subjective cognitive impairment
SCPD Symptômes comportementaux et psychiques de la démence
SMC Swiss Memory Clinics
Histoire
Manuscrit soumis: 30.05.2024
Manuscrit accepté: 10.06.2024
Universitätsklinik für Alterspsychiatrie und Psychotherapie
Murtenstrasse 21
3008 Bern
Schweiz
Société Professionnelle Suisse de Gériatrie (SPSG)
Swiss Memory Clinics (SMC)
Association Suisse des Neuropsychologues (ASNP)
Swiss Memory Clinics (SMC)
Centre de compétence en soins et santé
Genossenschaft Alterszentrum Kreuzlingen
Leitung Pflegeentwicklung
Genossenschaft Alterszentrum Kreuzlingen
Leitung Pflegeentwicklung
Physioswiss
GERONTOLOGIE CH Fachbereich Physiotherapie
Physioswiss
GERONTOLOGIE CH Fachbereich Physiotherapie
Ergotherapie-Verband Schweiz (EVS)
Ergotherapie-Verband Schweiz (EVS)
Konferenz der Schweizerischen Berufsverbände der Logopädinnen und Logopäden (K/SBL)
Zentrum für medizinische Bildung Bern (medi)
Schweizerischer Verband der Aktivierungsfachpersonen (SVAT)
Schweizerischer Verband der Aktivierungsfachpersonen (SVAT)
Zentrum für medizinische Bildung Bern (medi)
Swiss Memory Clinics (SMC)
Schweizerische Gesellschaft für Alterspsychiatrie (SGAP)
Department of Adult Psychiatry and Psychotherapy
University of Zürich
Lenggstrasse 31
CH-8032 Zürich
Alzheimer Schweiz
Konferenz der Schweizerischen Berufsverbände der Logopädinnen und Logopäden (K/SBL)
Schweizerische Arbeitsgemeinschaft für Logopädie
Swiss Memory Clinics (SMC)
Schweizerische Neurologische Gesellschaft (SNG)
Die Autorinnen und Autoren dieser Publikation haben alle relevanten Informationen über mögliche Interessenskonflikte offengelegt. Sollten Sie weitere Informationen zu diesem Thema wünschen, wenden Sie sich bitte an die Geschäftsstelle unter: info@swissmemoryclinics.ch.
Les auteurs de cette publication ont déclaré toutes les informations pertinentes concernant d‘éventuels conflits d‘intérêts. Si vous souhaitez obtenir de plus amples informations sur ce sujet, veuillez contacter le secrétariat à l‘adresse suivante: info@swissmemoryclinics.ch
1. DGPPN. S3-Leitlinie Demenzen [Internet]. 2023. Verfügbar unter: https://register.awmf.org/de/leitlinien/detail/038-013
2. Bürge M, Bieri G, Brühlmeier M, Colombo F, Demonet JF, Felbecker A, u. a. Recommendations of Swiss Memory Clinics for the Diagnosis of Dementia. Praxis (Bern 1994). 2018;107(8):435–51.
3. Savaskan E, Bopp-Kistler I, Buerge M, Fischlin R. Recommendations für diagnosis and therapy of behavioral and psychological symptoms in dementia (BPSD). 2024;(in Vorbereitung).
4. Tesky VA, Schall A, Pantel J. [Non-pharmacological interventions for people with dementia]. Inn Med (Heidelb). Februar 2023;64(2):139–46.
5. Cusic E, Hoppe M, Sultenfuss M, Jacobs K, Holler H, Obembe A. Multisensory Environments for Outcomes of Occupational Engagement in Dementia: A Systematic Review. Physical & Occupational Therapy In Geriatrics. 3. Juli 2022;40(3):275–94.
6. Duff C. Dementia: assessment, management and support for people living with dementia and their carers – NICE Guideline [Internet]. 2018. Verfügbar unter: NICE (National Institute for Health and Care Excellence). (2018). Dementia: assessment, management and support for people living with dementia and their carers – NICE guideline.
7. Woods B, O’Philbin L, Farrell EM, Spector AE, Orrell M. Reminiscence therapy for dementia. Cochrane Database Syst Rev. 1. März 2018;3(3):CD001120.
8. Achterberg W, Lautenbacher S, Husebo B, Erdal A, Herr K. [Pain in dementia]. Schmerz. April 2021;35(2):130–8.
9. Cui MY, Lin Y, Sheng JY, Zhang X, Cui RJ. Exercise Intervention Associated with Cognitive Improvement in Alzheimer’s Disease. Neural Plast. 2018;2018:9234105.
10. Hobson N, Dupuis SL, Giangregorio LM, Middleton LE. Perceived Facilitators and Barriers to Exercise Among Older Adults With Mild Cognitive Impairment and Early Dementia. J Aging Phys Act. 24. April 2020;28(2):208–18.
11. van der Wardt V, Hancox J, Pollock K, Logan P, Vedhara K, Harwood RH. Physical activity engagement strategies in people with mild cognitive impairment or dementia – a focus group study. Aging Ment Health. August 2020;24(8):1326–33.
12. Bruderer-Hofstetter M, Tomic S, Deininger R, Eijqoudt E. ZHAW Zürcher Hochschule für Angewandte Wissenschaften. 2022 [zitiert 20. November 2023]. Entwicklung und Evaluation einer Trainingsapplikation für Personen mit leichter kognitiver Beeinträchtigung. Verfügbar unter: https://www.zhaw.ch/de/forschung/forschungsdatenbank/projektdetail/projektid/6156/
13. Law CK, Lam FM, Chung RC, Pang MY. Physical exercise attenuates cognitive decline and reduces behavioural problems in people with mild cognitive impairment and dementia: a systematic review. J Physiother. Januar 2020;66(1):9–18.
14. Chu CH, Puts M, Brooks D, Parry M, McGilton KS. A Feasibility Study of a Multifaceted Walking Intervention to Maintain the Functional Mobility, Activities of Daily Living, and Quality of Life of Nursing Home Residents With Dementia. Rehabil Nurs. 2020;45(4):204–17.
15. Bennett S, Laver K, Voigt-Radloff S, Letts L, Clemson L, Graff M, u. a. Occupational therapy for people with dementia and their family carers provided at home: a systematic review and meta-analysis. BMJ Open. 11. November 2019;9(11):e026308.
16. Korczak D, Habermann C, Braz S. Wirksamkeit von Ergotherapie bei mittlerer bis schwerer Demenz [Internet]. 2013. Verfügbar unter: https://portal.dimdi.de/de/hta/hta_berichte/hta343_bericht_de.pdf
17. Flotho W, Sibold C. HED-I Häusliche Ergotherapie bei Demenz Interventionsprogramm für Menschen mit leichter bis mittlerer Demenz und ihre Angehörigen im häuslichen Umfeld [Internet]. 2021. Verfügbar unter: https://www.k2-verlag.ch/media/pdf/874610_Leseprobe_HEDI_2_Auflage_2021.pdf
18. Abrahams R, Liu KPY, Bissett M, Fahey P, Cheung KSL, Bye R, u. a. Effectiveness of interventions for co-residing family caregivers of people with dementia: Systematic review and meta-analysis. Aust Occup Ther J. Juni 2018;65(3):208–24.
19. Röker M, Ballmer T, Gantschnig B. Projekt „Evidenz Aktivierung“ – Bericht zur Befragung [Internet]. 2022. Verfügbar unter: https://svat.ch/wp-content/uploads/Kurzbericht_Befragung_Projekt-Evidenz.pdf
20. Sikkes SAM, Tang Y, Jutten RJ, Wesselman LMP, Turkstra LS, Brodaty H, u. a. Toward a theory-based specification of non-pharmacological treatments in aging and dementia: Focused reviews and methodological recommendations. Alzheimers Dement. 2020;17(2):255–70.
21. Ng L, Oliver E, Laver K. Beyond garden design: A review of outdoor occupation in hospital and residential care settings for people with dementia. Aust Occup Ther J. Februar 2023;70(1):97–118.
22. Volkmer A, Spector A, Meitanis V, Warren JD, Beeke S. Effects of functional communication interventions for people with primary progressive aphasia and their caregivers: a systematic review. Aging Ment Health. September 2020;24(9):1381–93.
23. Hickey E, Bourgeois M. Dementia From Diagnosis to Management – A Functional Approach. 2009.
24. Steiner J. Sprachtherapie bei Demenz Aufgabengebiet und ressourcenorientierte Praxis. 2010.
25. Steiner J. Demenz verstehen und logopädisch behandeln. 2018;
26. Eibl K, Simon C, Tilz C, Kriegel W. Sprachtherapie in Neurologie, Geriatrie und Akutrehabilitation. In 2019. S. 483–541.
27. Jonas HE, Javorszky SM. Ernährung bei fortgeschrittener Demenz – Möglichkeiten und Grenzen logopädischer Dysphagietherapie. 2022;(LOGOS. Die Fachzeitschrift für akademische Sprachtherapie und Logopädie, Prolog, 2022, Jg. 30 H. 2, S. 115-12).
28. DGN, DGD. S1-Leitlinie Neurogene Dysphagie [Internet]. 2020. Verfügbar unter: https://register.awmf.org/de/leitlinien/detail/030-111
29. Gassner L, Geretsegger M, Mayer-Ferbas J. Effectiveness of music therapy for autism spectrum disorder, dementia, depression, insomnia and schizophrenia: update of systematic reviews. Eur J Public Health. 1. Februar 2022;32(1):27–34.
30. Zhang Y, Cai J, An L, Hui F, Ren T, Ma H, u. a. Does music therapy enhance behavioral and cognitive function in elderly dementia patients? A systematic review and meta-analysis. Ageing Res Rev. Mai 2017;35:1–11.
31. Fusar-Poli L, Bieleninik Ł, Brondino N, Chen XJ, Gold C. The effect of music therapy on cognitive functions in patients with dementia: a systematic review and meta-analysis. Aging Ment Health. September 2018;22(9):1097–106.
32. Popa LC, Manea MC, Velcea D, Șalapa I, Manea M, Ciobanu AM. Impact of Alzheimer’s Dementia on Caregivers and Quality Improvement through Art and Music Therapy. Healthcare. Juni 2021;9(6):698.
33. Werner J, Wosch T, Gold C. Effectiveness of group music therapy versus recreational group singing for depressive symptoms of elderly nursing home residents: pragmatic trial. Aging Ment Health. Februar 2017;21(2):147–55.
34. Clare A, Camic P, Crutch S. Using Music to Develop a Multisensory Communicative Environment for People with Late-Stage Dementia | The Gerontologist | Oxford Academic [Internet]. 2020 [zitiert 21. November 2023]. Verfügbar unter: https://academic.oup.com/gerontologist/article/60/6/1115/5669944
35. Huber A, Oppikofer S, Meister L, Langensteiner F, Meier N, Seifert A. Music & Memory: The Impact of Individualized Music Listening on Depression, Agitation, and Positive Emotions in Persons with Dementia. Activities, Adaptation & Aging. 2. Januar 2021;45(1):70–84.
36. Moreno-Morales C, Calero R, Moreno-Morales P, Pintado C. Music Therapy in the Treatment of Dementia: A Systematic Review and Meta-Analysis. Front Med (Lausanne). 2020;7:160.
37. Baker FA, Bloska J, Braat S, Bukowska A, Clark I, Hsu MH, u. a. HOMESIDE: home-based family caregiver-delivered music and reading interventions for people living with dementia: protocol of a randomised controlled trial. BMJ Open. 19. November 2019;9(11):e031332.
38. Deshmukh S, Holmes J, cardno A. Art therapy for people with dementia [Internet]. 2018. Verfügbar unter: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011073.pub2/epdf/full
39. Klimova B, Toman J, Kuca K. Effectiveness of the dog therapy for patients with dementia – a systematic review. BMC Psychiatry. 6. September 2019;19(1):276.
40. Aminzadeh F, Byszewski A, Molnar FJ, Eisner M. Emotional impact of dementia diagnosis: exploring persons with dementia and caregivers’ perspectives. Aging Ment Health. Mai 2007;11(3):281–90.
41. Imhof DRM, Imhof DL. Zugehende Beratung der Alzheimer Zürich. 2020;
42. Becker S. Case Management bei Demenz: Mehr als «nice to have» Case Management, 18( 2), pp. 80-84 [Internet]. 2021. Verfügbar unter: https://www.rekopflege.de/wp-content/uploads/2021/06/CM-2-2021-Interview-Kraujuttis.pdf
43. IQWiG. Strukturierte Aufklärung über die Erstdiagnose Evidenzbericht zur S3-Leitlinie Demenz [Internet]. 2021. Verfügbar unter: https://www.iqwig.de/download/v20-03e_strukturierte-aufklaerung-ueber-die-erstdiagnose_evidenzbericht_v1-0.pdf
44. Beisteiner R, Matt E, Fan C, Baldysiak H, Schönfeld M, Philippi Novak T, u. a. Transcranial Pulse Stimulation with Ultrasound in Alzheimer’s Disease-A New Navigated Focal Brain Therapy. Adv Sci (Weinh). 2019;7(3):1902583.