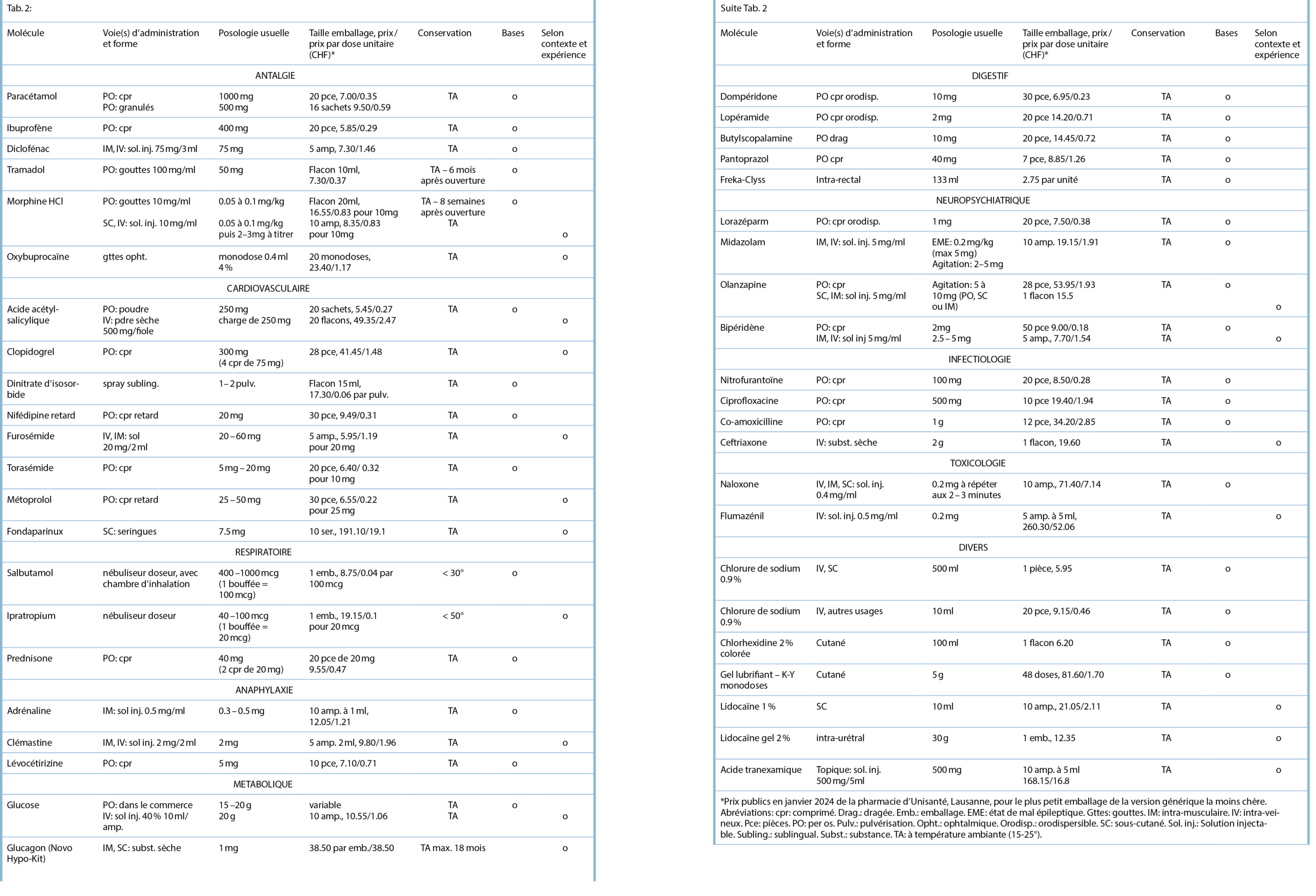
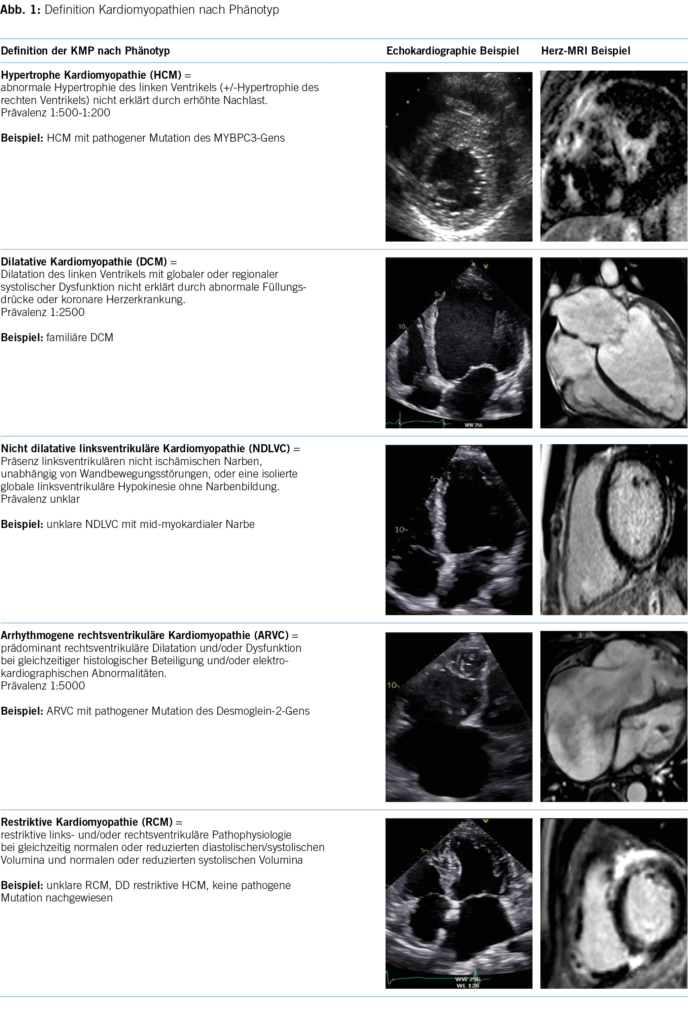
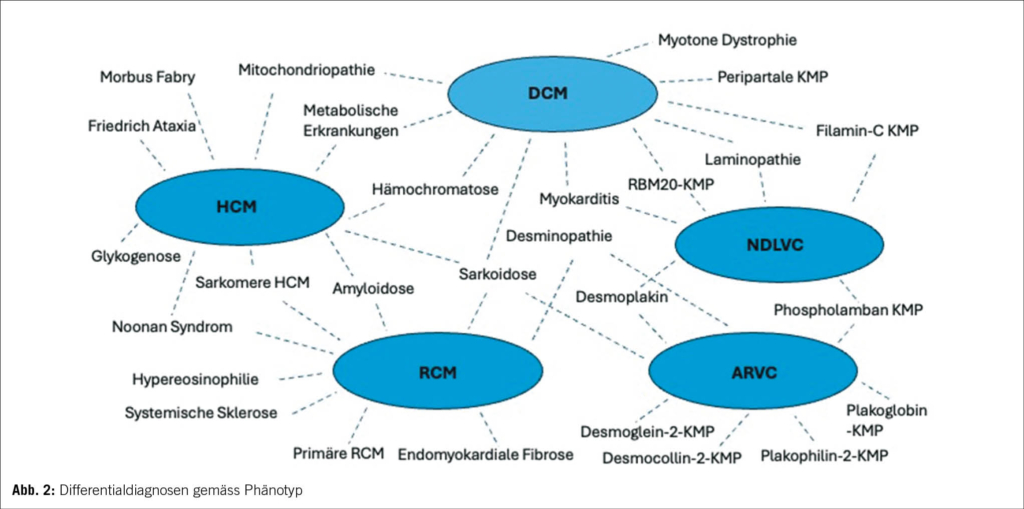
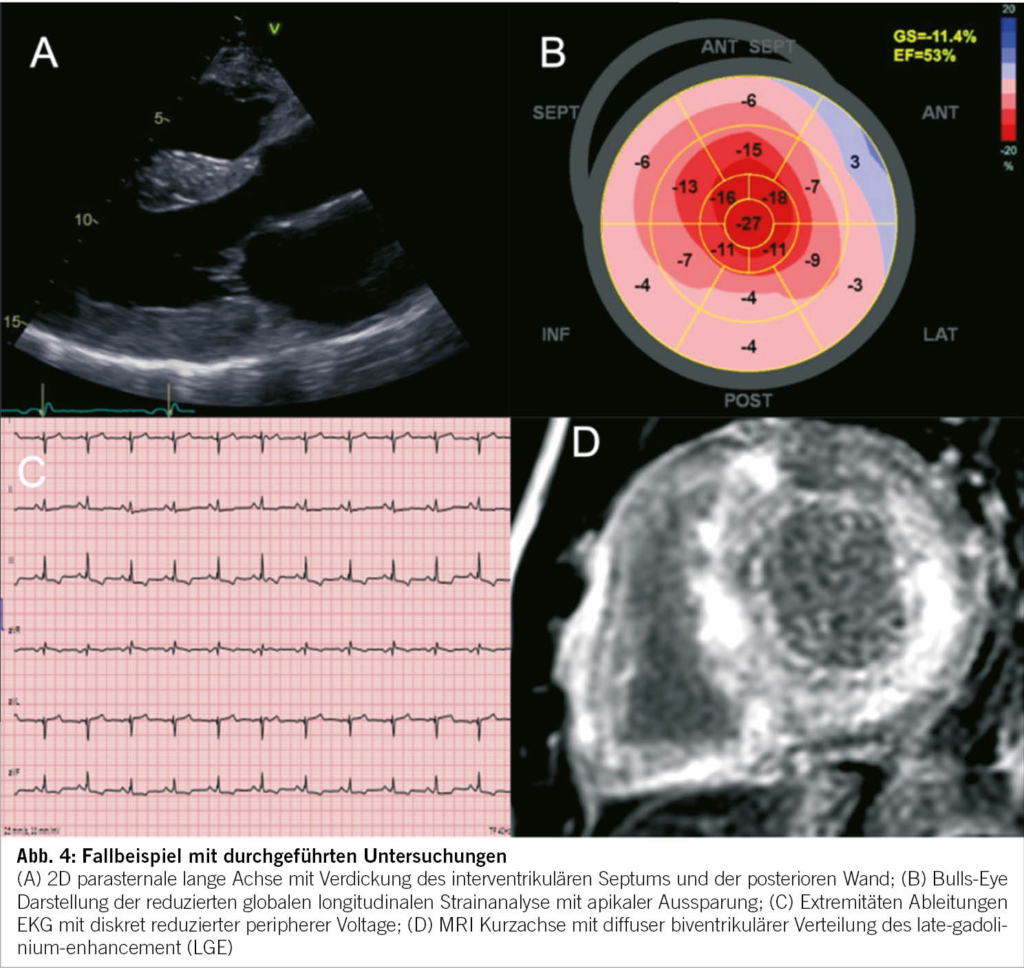
Anamnese und Befunde
Ein 29-jähriger Patient stellte sich, nach hausärztlicher Zuweisung, mit Verdacht auf akute Appendizitis auf unserer Notfallstation vor. Er klagte über spontan aufgetretene, starke abdominale Schmerzen (7/10 auf der numerischen Schmerzskala; NRS), welche vom rechten Unterbauch auszugehen schienen und welche vor wenigen Stunden begonnen hatten. Übelkeit und Erbrechen wurden verneint. Die Stuhlanamnese war in Bezug auf Frequenz, Konsistenz sowie Farbe unauffällig, der letzte Stuhlgang erfolgte ein paar Stunden vor Eintritt. Auf Nachfrage gab der Patient an, vor einer Woche während zweier Tage an Diarrhö gelitten zu haben. Im engen Umfeld gab es keine akut erkrankten Personen, insbesondere nicht mit gastrointestinalen Symptomen. Ein kürzlicher Auslandsaufenthalt wurde verneint. Beim Patienten waren keine Vorerkrankungen bekannt. Es bestand eine Hymenopterengiftallergie, ansonsten lagen keine Allergien vor. Abdominelle Voroperationen, wesentliche abdominelle Infekte sowie abdominelle oder pelvine Traumata wurden verneint.
Im Status zeigte sich ein afebriler, kardiopulmonal kompensierter Patient mit normalem Ernährungszustand. Die Darmgeräusche waren spärlich, insbesondere im rechten unteren Quadranten. Das Abdomen war insgesamt weich, im linken/mittleren unteren Quadranten fand sich eine lokale Druckdolenz ohne Peritonismus. Es lagen keine Druckdolenzen im McBurney- und Lanz-Punkt vor, das Psoas-Zeichen war ebenfalls negativ. In der durchgeführten Sonographie zeigte sich eine angedeutete Pendelperistaltik sowie erweiterte Dünndarmschlingen im linken Unterbauch. Die Appendix konnte nicht dargestellt werden. Laborchemisch ergaben sich keine pathologischen Befunde, insbesondere keine Entzündungszeichen und normale Laktatwerte.
Differenzialdiagnostische Überlegungen
Mit einem Alvarado-Score von 0 Punkten, unauffälligen Laborwerten und keiner Druckdolenz im rechten Unterbauch war eine Appendizitis sehr unwahrscheinlich. Obwohl eine infektiöse Ursache der Beschwerden nicht sicher ausgeschlossen werden konnte (CAVE: unauffällige Laborwerte in den ersten Stunden sind möglich), passte die rasch entstandene und ausgeprägte Schmerzsymptomatik nicht dazu. Basierend auf dem sonographischen Befund, der Hinweise auf eine mechanische Obstruktion zeigte, wurde, trotz fehlender Voroperationen, ein Ileus als Ursache der Beschwerden in Erwägung gezogen. Nicht dazu passend war jedoch das Fehlen von Übelkeit und/oder Erbrechen. Eine mesenteriale Ischämie wurde in Betracht gezogen, allerdings aufgrund des Alters und fehlender Komorbiditäten als sehr unwahrscheinlich eingestuft.
Weitere Abklärungsschritte
Aufgrund der anhaltenden ausgeprägten Schmerzproblematik mit NRS 7/10, trotz Verabreichung einer intravenösen basisanalgetischen Therapie mit Paracetamol/Metamizol und kumulativ 16 mg Morphin i.v. («pain out of proportion»), wurde die Indikation zur computertomographischen Diagnostik gestellt.
Diagnose und Verlauf
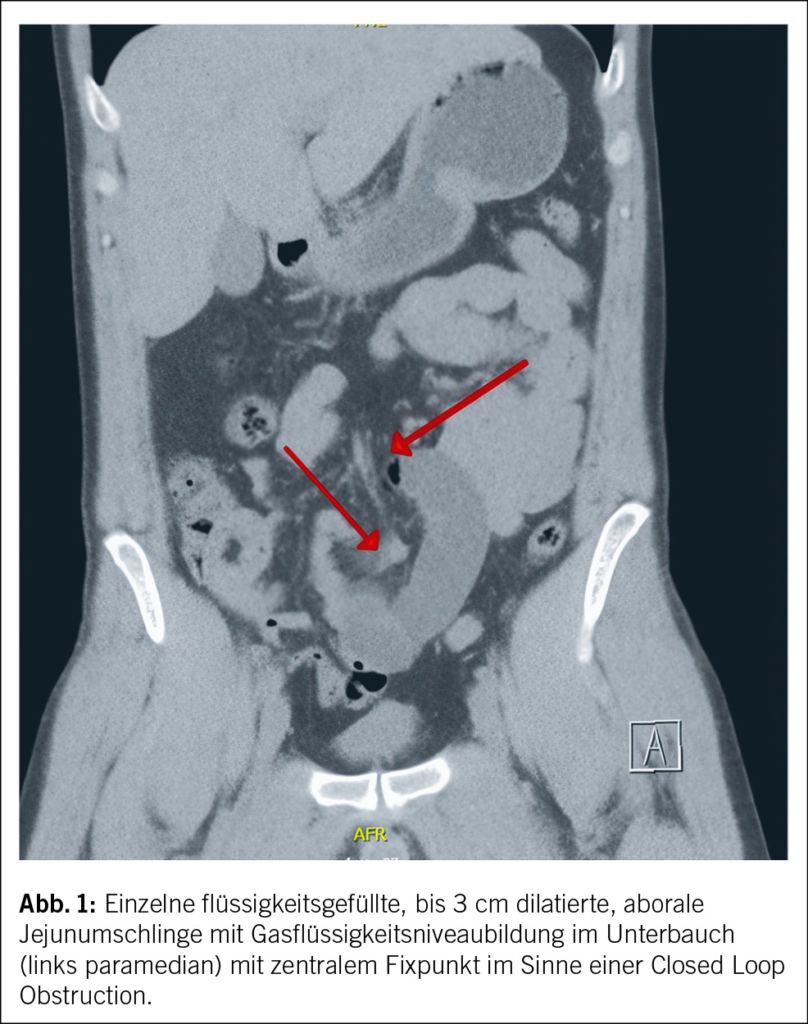
In der durchgeführten Computertomographie (CT) fand sich das Bild einer Closed Loop Obstruction (CLO) des distalen Ileums im mittleren Unterbauch (links paramedian), bei sonst normalkalibrigem, reizlosem Intestinum ohne Passagestörung (Abb. 1). Intraoperativ, ca. 70 cm ab Ileozökalklappe, fand sich eine Omentumbride, welche problemlos gelöst werden konnte, die vollständige Dünndarmrevision zeigte keine nekrotischen Anteile (Abb. 2). Es zeigte sich ein problemloser postoperativer Verlauf. Der Patient konnte das Spital am 2. post-operativen Tag in gutem Allgemeinzustand und funktionierender Darmpassage verlassen.
Kommentar
Die häufigste Ursache für eine CLO ist eine postoperative Bride, in seltenen Fällen, wie in unserem Fall beschrieben, kann es jedoch auch bei nicht abdominell voroperierten Patienten zu einer CLO kommen. Die Trias mit stärksten Schmerzen, ein klinischer Befund, der nicht zum Schmerz passt («pain out of proportion»), und das Vorhandensein einer abdominellen Narbe wurden als Hinweis für eine CLO beschrieben (1). Goldstandard in der Diagnostik stellt aktuell die CT mit einer Sensitivität von 90–96 % und einer Spezifität von 96 % dar (2). Bei jungen Personen muss, aufgrund der Strahlenexposition, die Indikation einer computertomographischen Untersuchung allerdings kritisch evaluiert werden. Aufgrund der guten diagnostischen Performance des Ultraschalls (3) wird von der europäischen Gesellschaft für Ultraschall (EFSUMB) die Anwendung des Ultraschalls (US) empfohlen, um eine Darmobstruktion zu detektieren (4). Die CT wird bei nicht konklusiver Abdomensonographie als nächster Schritt empfohlen (5) bzw. bei positivem US-Befund, um die Ursache des Ileus zu eruieren, die Perfusion des Darms zu prüfen und schlussendlich die OP-Indikation zu überprüfen. In unserem Fall lag zwar kein akutes Abdomen vor, aber aufgrund des fehlenden Ansprechens auf die intravenöse analgetische Therapie mit ausgeschöpfter basisanalgetischer Therapie und einer verabreichten Morphindosis von insgesamt 16 mg wurde der Entscheid zur CT-Untersuchung gefällt. Normale Laborwerte schliessen das Vorhandensein eines Ileus nicht aus, liegen jedoch erhöhte Entzündungswerte und/oder ein erhöhtes Laktat bzw. eine metabolische Azidose vor, dann können dies bereits Zeichen der Darmischämie und -nekrosen sein. Es ist deshalb empfohlen, diese zu bestimmen (1, 6) sowie auch die Elektrolyte. Eine Elektrolytverschiebung muss korrigiert werden.
Beim Dünndarmileus sollte, gemäss den Bologna-Leitlinien 2017, zunächst nach einer Adhäsionsursache gesucht werden und eine Ischämie/Strangulation ausgeschlossen werden, bevor ein konservativer Therapieversuch angestrebt werden kann. Neben den klinischen Zeichen wie dem Peritonismus spielt die CT eine wichtige Rolle sowohl zur Abklärung ggf. anderer Ursachen als Adhäsionen als auch zur Beurteilung der Darmperfusion. Bei negativer Verlaufskontrolle im konservativen Prozedere (kein Nachweis von KM im Kolon nach 24–36 h), anhaltender Obstruktion > 72 h oder Auftreten von Ischämie-/Peritonitiszeichen erfolgt die chirurgische Exploration. Liegen bereits initial direkte oder indirekte Ischämie-/Strangulationszeichen, insbesondere auch Zeichen einer CLO, vor, erfolgt das chirurgische Vorgehen unmittelbar (7).
Intraoperativ zeigte sich in unserem Fall eine Omentumbride, vom Omentum zum Meso hinziehend, mit einem dilatierten Dünndarmkonvolut, was zur Kompression des Dünndarms an einer zweiten Stelle führte und somit zur Beeinträchtigung der vaskulären Versorgung; zum Operationszeitpunkt zeigten sich glücklicherweise jedoch noch keine ischämischen Zeichen. Aufgrund dieser Konstellation wäre ein konservativer Versuch in unserem Fall auch retrospektiv wenig sinnvoll gewesen. Interessant jedoch bezüglich der aktuell gegebenen OP-Indikation bei einer CLO ist sicherlich eine kleine Serie aus Israel mit 18 nicht voroperierten Patienten mit CLO, in welcher bei 6 Patienten (33 %) während der diagnostischen Laparoskopie/Laparotomie keine Intervention notwendig war (nicht therapeutische Exploration) (8). Es stellt sich hier die Frage, ob es sich bei diesen Patienten tatsächlich um eine CLO oder um einen «normalen» mechanischen Ileus gehandelt haben könnte. In zwei weiteren systematischen Reviewarbeiten über Darmobstruktion bei nicht voroperierten Patienten wurden die Patienten mit CLO jeweils ausgeschlossen (9, 10). Ob eine CLO in bestimmten Fällen konservativ behandelt werden kann, bleibt eine offene Frage für die Zukunft.
Key Messages
• Eine CLO kann auch bei abdominell nicht voroperierten Patienten auftreten.
• Klinisch zeigen sich stärkste abdominelle Schmerzen, eventuell nicht passend zur klinischen Präsentation.
• Die Sonographie kann als Rule-In-Strategie angewendet werden, insbesondere bei jungen Patienten; die Diagnostik erfolgt grundsätzlich mittels CT.
• Die Therapie ist chirurgisch.
Sabine Fischbacher 1, Larissa C. Vines 2, Bruno Minotti 3
1 Notfallzentrum, HOCH Health Ostschweiz, Kantonsspital St. Gallen, St. Gallen
2 Klinik für Allgemein-, Viszeral-, Endokrin- und Transplantationschirurgie, HOCH Health Ostschweiz, Kantonsspital St. Gallen, St. Gallen
3 Notfallzentrum, Universitätsspital Basel, Basel
Interessenkonflikte
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
DOI: https://doi.org/10.23785/PRAXIS.2025.05.009
Abkürzungen
NRS Numerical (Pain) Rating Scale
CLO Closed Loop Obstruction
CT Computertomographie
Notfallzentrum
Universitätsspital Basel
Petersgraben 2
4031 Basel
Literatur
1. Tong JWV, Lingam P, Shelat VG. Adhesive small bowel obstruction – an update. Acute Med Surg. 2020;7(1):e587.
2. Mbengue A, Ndiaye A, Soko TO, Sahnoun M, Fall A, Diouf CT, et al. Closed loop obstruction: pictorial essay. Diagn Interv Imaging. 2015;96(2):213-20.
3. Gottlieb M, Peksa GD, Pandurangadu AV, Nakitende D, Takhar S, Seethala RR. Utilization of ultrasound for the evaluation of small bowel obstruction: A systematic review and meta-analysis. Am J Emerg Med. 2018;36(2):234-42.
4. Hollerweger A, Maconi G, Ripolles T, Nylund K, Higginson A, Serra C, et al. Gastrointestinal Ultrasound (GIUS) in Intestinal Emergencies – An EFSUMB Position Paper. Ultraschall Med. 2020;41(6):646-57.
5. Sinz S, Schmied B, Ukegjini K. Diagnostik und Behandlung des akuten Abdomens. Swiss Med Forum. 2021;21(4748):803-9.
6. Rosano N, Gallo L, Mercogliano G, Quassone P, Picascia O, Catalano M, et al. Ultrasound of Small Bowel Obstruction: A Pictorial Review. Diagnostics (Basel). 2021;11(4).
7. Ten Broek RPG, Krielen P, Di Saverio S, Coccolini F, Biffl WL, Ansaloni L, et al. Bologna guidelines for diagnosis and management of adhesive small bowel obstruction (ASBO): 2017 update of the evidence-based guidelines from the world society of emergency surgery ASBO working group. World J Emerg Surg. 2018;13:24.
8. Blich O, Nesher G, Tankel J, Boaz E, Dagan A, Reissman P, et al. Small Bowel Obstruction in Patients without Prior Abdominal Surgery: To Operate or Not? World J Surg. 2022;46(12):2919-26.
9. Hew N, Ng ZQ, Wijesuriya R. Non-operative management of small bowel obstruction in virgin abdomen: a systematic review. Surg Today. 2021;51(10):1558-67.
10. Yang TWW, Prabhakaran S, Bell S, Chin M, Carne P, Warrier SK, et al. Non-operative management for small bowel obstruction in a virgin abdomen: a systematic review. ANZ J Surg. 2021;91(5):802-9.