Zusammenfassung: Die Herzinsuffizienz stellt das Endstadium der meisten Herzerkrankungen dar und ist mit weltweit über 64 Millionen Betroffenen als globale Pandemie anzusehen. Es wird erwartet, dass die Prävalenz weiter steigen wird. Entscheidend sind die Prävention und Behandlung von kardiovaskulären Erkrankungen, sowie die frühe Erkennung von Patienten, die an einer Herzinsuffizienz leiden. Je nach Ausmass der Reduktion der linksventrikulären Ejektionsfraktion (LVEF) stehen unterschiedliche Therapien zur Verfügung. Eine optimale Behandlung verhindert unnötige Hospitalisationen, vermindert die Mortalität und verbessert die Lebensqualität. Im folgenden Artikel gehen wir auf die Diagnostik bei Herzinsuffizienz ein und erläutern die vielfältigen Behandlungsoptionen bei Herzinsuffizienz mit eingeschränkter LVEF (HFrEF, HFmrEF).
Heart failure with reduced left ventricular ejection fraction (HFrEF, HFmrEF)
Abstract: Heart failure is the final stage of most heart diseases and, with over 64 million people affected worldwide, is considered a global pandemic. The prevalence is expected to continue to rise. The prevention and treatment of cardiovascular diseases and the early detection of patients suffering from heart failure are essential. Different therapies are available depending on the extent of the reduction in left ventricular ejection fraction (LVEF). Optimal treatment prevents unnecessary admissions to hospital, reduces mortality and improves quality of life. In the following article, we discuss the diagnosis of heart failure and explain the various treatment options for heart failure with reduced LVEF (HFrEF, HFmrEF).
Die Herzinsuffizienz umschreibt ein klinisches Syndrom mit Symptomen und/oder Zeichen der pulmonalen oder systemischen Stauung, die durch eine strukturelle und/oder funktionelle kardiale Anomalie verursacht werden (1). Basierend auf der linksventrikulären Ejektionsfraktion (EF) wird die Herzinsuffizienz in drei Kategorien eingeteilt: 1) Herzinsuffizienz mit reduzierter (HFrEF, EF≤40%), 2) leicht reduzierter (HFmrEF, EF 41-49%) und 3) erhaltener EF (HFpEF, EF≥50%). Als neue Entität wird zudem die Herzinsuffizienz mit verbesserter («improved») EF (HFimpEF) durch ein Therapieansprechen mit Anstieg der EF ≥10% auf >40% definiert (1). Im Folgenden geben wir eine Übersicht über die verschiedenen evidenzbasierten Therapiemöglichkeiten der HFrEF und HFmrEF zusammen mit praktischen Handlungsempfehlungen zur optimalen Betreuung dieser zunehmenden Patientenpopulation mit hoher Mortalität und Morbidität. Die HFpEF und deren Behandlungsoptionen werden in einem weiteren Artikel in dieser Ausgabe beleuchtet.
Epidemiologie/Prognose
Mit weltweit über 64.3 Millionen Betroffenen stellt die Herzinsuffizienz eine globale Pandemie dar (2). Es wird erwartet, dass die Prävalenz aufgrund der älter werdenden Bevölkerung und des verbreiteten Einsatzes lebensverlängernder, evidenzbasierter Therapien weiter steigen wird, obwohl kardiovaskuläre Erkrankungen insgesamt früher erkannt und behandelt werden. Die Prävalenz ist zudem altersabhängig und steigt von etwa 1% bei <55-Jährigen auf >10% bei über 70-Jährigen an (3). Es wird geschätzt, dass hiervon rund 60% an einer HFrEF, 24% an einer HFmrEF und 16% an einer HFpEF leiden (3).
Die Prognose der Herzinsuffizienz ist stark variabel und hängt in erster Linie von der klinischen Präsentation und dem Alter ab. So wird die 1-Jahres-Mortalität im europäischen Langzeitregister auf 23.6% für die akute Herzinsuffizienz versus 6.4% für die chronische Herzinsuffizienz geschätzt, wobei die Mortalität bei ≥75-Jährigen deutlich ansteigt (4). Patienten mit HFrEF haben eine höhere 1-Jahres-Mortalität als Patienten mit einer HFmrEF und HFpEF (8.8% vs.7.6% vs. 6.3%). Noch deutlicher wirkt sich der Phänotyp auf die Hospitalisationsrate nach 1 Jahr aus (HFrEF 14.6%, HFmrEF 8.7% und HFpEF 9.7%) (4).
Diagnostik
Für die Diagnose der chronischen Herzinsuffizienz werden sowohl Symptome oder klinische Zeichen als auch eine bildmorphologisch objektivierbare kardiale Dysfunktion benötigt. Klinisch manifestiert sich die Herzinsuffizienz typischerweise durch Leistungsintoleranz mit Anstrengungsdyspnoe, Fatigue, Orthopnoe sowie paroxysmale nächtliche Dyspnoe. Charakteristische Zeichen sind Knöchel- oder Beinödeme, Halsvenenstauung oder ein 3. Herzton – letzterer ist relativ spezifisch, aber wenig sensitiv. Risikofaktoren wie ein stattgehabter Herzinfarkt, chronische koronare Herzerkrankung, arterielle Hypertonie, Diabetes mellitus, chronische Nierenerkrankung, Alkoholabusus, kardiotoxische Chemotherapie und eine positive Familienanamnese erhöhen die diagnostische Vortestwahrscheinlichkeit (5). Im Ruhe-EKG können Vorhofflimmern, Q-Zacken, Hypertrophiezeichen oder QRS-Verbreiterung ebenfalls auf das Vorliegen einer Herzinsuffizienz hinweisen, ein unauffälliges EKG macht diese hingegen unwahrscheinlich (5).
Leider sind weder Symptome noch klinische Zeichen spezifisch für eine Herzinsuffizienz, sodass bei klinischem Verdacht eine weitere Differenzierung mittels natriuretischer Peptide (NT-proBNP oder BNP) hilfreich ist (5). Insbesondere Patienten mit vorbekannten Lungenerkrankungen (COPD, Asthma etc.) zeigen oft ähnliche, klinisch schwer zu differenzierende Symptome, sodass die Diagnose der Herzinsuffizienz oft verzögert oder gar nicht gestellt wird. Natriuretische Peptide (NP) werden bei erhöhtem myokardialen Wandstress produziert. Sie sind somit nicht nur Biomarker der linksventrikulären systolischen Funktion, vielmehr können weitere strukturelle und funktionelle kardiale Anomalien einschließlich einer diastolischen Dysfunktion, rechtsventrikulären Dysfunktion, Herzklappenfehlfunktion, erhöhtem Lungendruck und Vorhofarrhythmien die NP erhöhen (6).
Da die LV-Füllungsdrücke wie auch die Nierenfunktion altersabhängig sind, werden bei zunehmendem Alter sowie bei Niereninsuffizienz (eGFR < 60ml/min/1.73m2) höhere NP erwartet. Falsch tiefe Werte werden bei Adipositas (BMI ≥30 kg/m2) beobachtet (6, 7). Die natriuretischen Peptide dienen bei sehr tiefen Werten (NT-proBNP <125pg/ml, BNP <35pg/ml) altersunabhängig zum Ausschluss einer Herzinsuffizienz und in höherer Konzentration zur Risikostratifizierung und Prognostizierung (7). Sofern sich die Verdachtsdiagnose der Herzinsuffizienz erhärtet, muss in einem nächsten Schritt der Phänotyp mittels Echokardiografie definiert und die Ätiologie weiter geklärt werden.
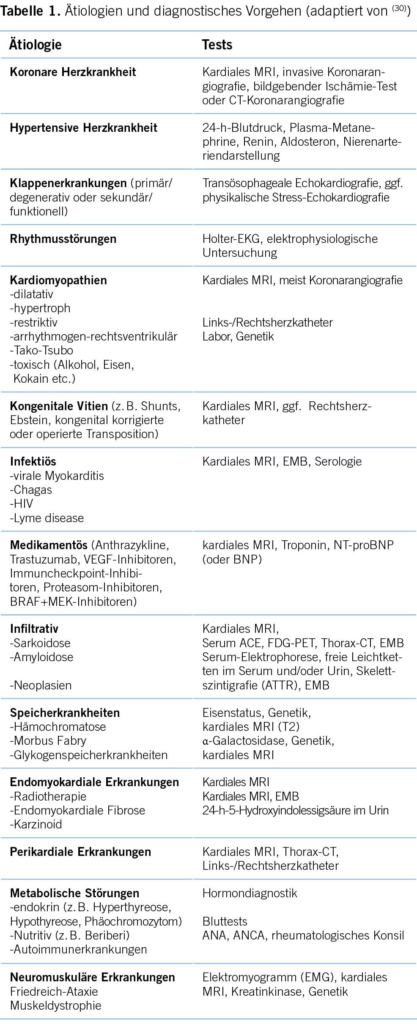
Da eine Herzinsuffizienz das Endstadium der meisten Herzerkrankungen darstellt, sind entsprechend viele Differentialdiagnosen zu berücksichtigen (Tabelle 1). Die häufigsten Ursachen wie eine koronare Herzerkrankung, arterielle Hypertonie, Klappenvitien oder Arrhythmien können bereits mit einfachen Massnahmen wie einer detaillierten Anamnese, körperlichen Untersuchung (inkl. Blutdruckmessungen), einem EKG und einer transthorakalen Echokardiografie eingegrenzt werden. Eine weitere Bildgebung mittels Magnetresonanztomografie ist in vielen Fällen sinnvoll. Verschiedene Ursachen einer Herzinsuffizienz wie eine Myokarditis, Sarkoidose, Amyloidose, Kardiomyopathien und weitere seltenere Entitäten können dadurch differenziert werden (5). Weiter hilft das MRT, bei ungenügender Echoschallqualität die EF genau zu bestimmen, und es kann das Ausmass der Fibrose zur Risikostratifizierung herangezogen werden (5). Abhängig vom kardiovaskulären Risikoprofil und der Vortestwahrscheinlichkeit kann eine koronare Genese mittels Koronarangiografie oder mittels Herz-CT gesucht werden. Besonders bei Kardiomyopathien, die nach eingehender Abklärung unklar bleiben, sollte eine genetische Ursache gesucht werden, welche in Abhängigkeit der Genmutation prognostische und somit therapeutische Implikationen, insbesondere auf die Primärprophylaxe des plötzlichen Herztodes, haben kann (5).
Therapie
Allgemeine Empfehlungen
Bei jeder Neudiagnose einer HFrEF sollten gezielte Aufklärungsgespräche zur Verbesserung des Krankheitsverständnisses, des natürlichen Krankheitsverlaufes und zur Besprechung der therapeutischen Möglichkeiten erfolgen. Eine gute Aufklärung und aktives Miteinbeziehen des Patienten und seiner Angehörigen erhöhen die Therapieadhärenz, was schliesslich die Mortalitäts- und Hospitalisationsrate positiv beeinflusst (8).
Eine wichtige Rolle kommt dabei dem Selbstmanagement zu, wonach der Patient in Abhängigkeit der Gewichtsmessungen seine Diuretika und Flüssigkeitszufuhr anpasst. Wichtig ist eine frühe Erkennung von Warnzeichen, bei welchen ein Arztbesuch nötig wird (z. B. zunehmendes Gewicht von >2 kg innert 2-3 Tagen, progrediente Beinödeme, Atemnot etc.). Im Alltag ist auf Nikotinkonsum sowie exzessiven Salz- oder regelmässigen Alkoholkonsum zu verzichten. Eine ausgewogene Ernährung und regelmässige körperliche Aktivität erhöhen die Lebensqualität, und bei stabilem Verlauf sind auch längere Reisen (inkl. Flüge) oder Höhenaufenthalte bis 2500 m bedenkenlos möglich. Selbst kurze Aufenthalte in höheren Lagen werden erfahrungsgemäss in der Regel gut toleriert. Eine Pneumokokken-, COVID- und jährliche Grippe-Impfung wird allen Herzinsuffizienzpatienten empfohlen (5).
Medikamentöse Therapie
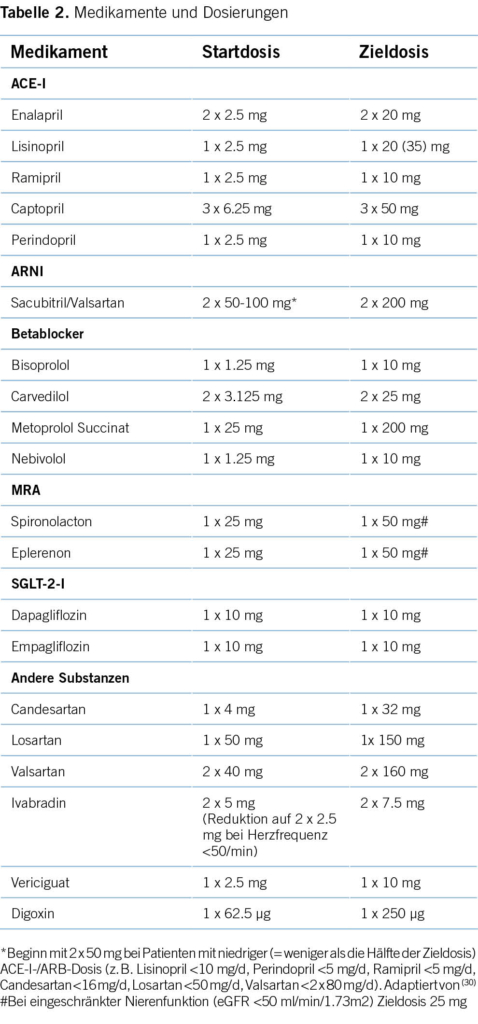
Die medikamentöse Therapie ist der Grundstein einer erfolgreichen Herzinsuffizienzbehandlung mit dem Ziel, die Mortalität und Hospitalisationsrate zu reduzieren sowie die Lebensqualität zu verbessern. Das bei Herzinsuffizienz verminderte Schlagvolumen führt zu langfristig ungünstigen Kompensationsmechanismen wie die sympatho-adrenerge Stimulation und Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS). Dies verbessert kurzfristig die Herzleistung, führt aber zu einer Negativspirale mit weiterer myokardialer Zellschädigung. Die Pharmakotherapie der Herzinsuffizienz ist darauf ausgerichtet, diese maladaptiven Prozesse positiv zu modulieren und basiert auf den 4 Substanzgruppen Angiotensin-II-Rezeptor-Neprilysin-Inhibitoren (ARNI), Betablocker (BB), Mineralokortikoid-Rezeptor-Antagonisten (MRA) und Sodium-Glucose Co-transporter-2 Inhibitoren (SGLT2-I). Auf die sogenannten «fantastischen Vier» wird im Folgenden näher eingegangen. Die gängigen Therapeutika mit Start- und Zieldosierung sind in Tabelle 2 aufgelistet.
Sobald die Diagnose der HFrEF gestellt ist, sollten diese Medikamente rasch begonnen und zügig auftitriert werden (5, 9). Bei schlechter Verträglichkeit (z. B. Hypotonie) wird ein niedrig dosierter Einsatz aller vier Substanzklassen anstelle einzelner hoch dosierter Medikamente bevorzugt (5). Wichtig für eine erfolgreiche Etablierung und Aufdosierung der Vierfachtherapie ist die aktive Einbindung und Kommunikation zwischen Patient, Angehörigen, Hausarzt sowie betreuendem Kardiologen. Eine Unterstützung durch speziell ausgebildete Pflegefachkräfte ist wertvoll und wird von Betroffenen geschätzt.
Diuretika
Alle Patienten mit Symptomen oder Zeichen einer Hypervolämie werden bevorzugt mit Schleifendiuretika behandelt. Zur Vermeidung einer Diuretikaresistenz sollte bei akuter Dekompensation eine rasche und aggressive Behandlung erfolgen (10). Bei milder Hypervolämie kann die Rekompensation mittels Verdoppelung oder allenfalls Vervierfachung der bestehenden Diuretikadosis ambulant angestrebt werden. Bei Diuretika-naiven Patienten empfiehlt sich ein Beginn mit Torasemid 10 mg 1-2 x/Tag. Furosemid per os wird aufgrund der niedrigeren Bioverfügbarkeit, Potenz und kürzeren Wirkdauer seltener verwendet. Bei fehlendem Ansprechen oder initial bereits ausgeprägter Symptomatik ist eine Hospitalisation unausweichlich, da die Absorption oraler Diuretika durch die intestinale Stauung deutlich reduziert und eine intravenöse Therapie mit Furosemid notwendig ist. Generell empfiehlt sich, die Schleifendiuretika während einer Dekompensation mindestens 2 x/Tag zu geben, um einen konstanten Medikamentenspiegel zu gewährleisten und einen «Rebound-Effekt» zu vermeiden (5). Bei fortgeschrittener Niereninsuffizienz ist die Halbwertszeit allerdings deutlich verlängert, sodass eine einmalige Gabe zu einem ausreichend hohen und länger anhaltenden Medikamentenspiegel führt (10).
Nach Rekompensation und Ausbau der Herzinsuffizienztherapie sinkt der Diuretikabedarf durch die verbesserte Hämodynamik und die diuretische Wirkung von MRA, Sacubitril/Valsartan und SLGT2-Inhibitoren (5).
ACE-Hemmer, Angiotensin-II-Rezeptor-Antagonisten und Angiotensin-II-Rezeptor-Neprilysin-Inhibitoren (ARNI)
ACE-Hemmer (ACE-I) waren die erste Substanzklasse, welche eine erwiesene Reduktion der Mortalität und Morbidität sowie eine Symptomverbesserung bei der HFrEF erzielte. Im Mittel reduzierten ACE-I in den wegweisenden Studien die Mortalität um 16-44%, sodass jeder HFrEF-Patient in Abwesenheit von Kontraindikationen (Angioödem, bilaterale Nierenarterienstenose, Schwangerschaft, Allergie) mit der maximal tolerablen Dosis behandelt werden sollte (5). Im PARADIGM-HF-Trial konnte mit Angiotensin-II-Rezeptor-Neprilysin-Inhibitoren (Sacubitril/Valsartan, Entresto®) eine 20%ige Reduktion der Todes- und Hospitalisationsrate und eine Symptomverbesserung im Vergleich zum ACE-I Enalapril beobachtet werden (11). Subanalysen der PARADIGM-HF-Studie zeigten zusätzliche Vorteile gegenüber ACE-I. Neben einer Verbesserung der Lebensqualität sowie eines langfristig positiven Einflusses auf die Nierenfunktion treten auch seltener schwere Hyperkaliämien auf (11). Zudem senkt die Therapie mit ARNI die Häufigkeit des plötzlichen Herztodes, insbesondere auch bei sogenannten «stabilen» Patienten mit nur geringer Symptomatik (NYHA II) (11, 12). Im Unterschied zu anderen internationalen Richtlinien (13, 14) empfiehlt die Europäische Gesellschaft für Kardiologie (ESC) weiterhin, zuerst mit einem ACE-I zu beginnen und erst im Verlauf bei persistierender Symptomatik auf Valsartan/Sacubitril umzustellen. Sobald die halbe Zieldosis erreicht ist, kann der ACE-I bei normotensiven Patienten auf 2 x 100 mg Valsartan/Sacubitril umgestellt und schrittweise nach 2-4 Wochen aufdosiert werden (5). Zur Vermeidung eines Angioödems ist bei Therapieumstellung eine minimale Auswaschphase von 36 h empfohlen. Bei suffizienter Blutdruckreserve ist im stationären Setting ein direkter Therapiestart mit ARNI sicher und ohne gehäufte unerwünschte Arzneimittelwirkungen durchführbar (15, 16).
Betablocker
Zusätzlich zur Behandlung mit einem ACE-I und Diuretikum verringern Betablocker die Mortalität um rund 35% und reduzieren Herzinsuffizienzsymptome (17-19). Sie werden daher bei allen klinisch und hämodynamisch stabilen, euvolämen Patienten in tiefer Dosierung gestartet und bis zur Maximaldosis oder Zielherzfrequenz von 55-60/min aufdosiert. Relevante Kontraindikationen sind ein schweres Asthma bronchiale, eine kritische Beinischämie und relevante Bradyarrhythmien (Sick-Sinus-Syndrom, höhergradige AV-Blockierungen). Bei langsamer Auftitrierung sind symptomatische Bradykardien selten. Tritt in den Heimmessungen eine Ruhefrequenz <50/min oder Bradykardie-assoziierte Symptome wie ausgeprägte Müdigkeit, Unwohlsein oder Schwindel auf, sollte die Dosis reduziert werden. Gleichzeitig ist ein Ruhe-EKG sinnvoll, um einen höhergradigen AV-Block auszuschliessen.
Generell werden vorwiegend kardioselektive Betablocker (Bisoprolol, Metoprolol, Nebivolol) eingesetzt, bei gleichzeitigem Vorliegen einer arteriellen Hypertonie ist Carvedilol als zusätzlicher Alpha-1-Antagonist eine attraktive Therapiealternative. Eine erektile Dysfunktion ist eine seltene, dosisabhängige Nebenwirkung und tritt weniger häufig unter Nebivolol oder Bisoprolol auf (20). Das Wissen über die mögliche unerwünschte Wirkung führt zu einem häufigeren Auftreten (Nocebo-Effekt), weshalb die Thematik zurückhaltend erläutert werden sollte. Bei Vorliegen eines Asthmas oder einer COPD war der Einsatz von Bisoprolol mit den besten FEV1-Werten in retrospektiven Studien assoziiert (20). Durch eine nicht selektive Beta-2-Blockade können Symptome einer pAVK exazerbieren. Nebivolol wird aufgrund seiner NO-freisetzender, vasodilatierenden Wirkung bei pAVK bevorzugt (20).
Mineralokortikoid-Rezeptor-Antagonisten
Mineralokortikoid-Rezeptor-Antagonisten (MRA) reduzieren zusätzlich zu ACE-I und Betablockern die Mortalität, Hospitalisationsrate und Symptomatik (5). Sie sind wegen der renalen Akkumulation und kalium-retinierender Wirkung bei schwerer Nierenfunktionsstörung (eGFR <30ml/min/1.73m2) kontraindiziert. Bei Patienten mit eingeschränkter Nierenfunktion wird mit tiefer Dosierung gestartet und in Abhängigkeit der Elektrolyt- und Nierenwerte aufdosiert. Bei ansteigendem Kalium >5.5 mmol/l oder einer Abnahme der eGFR <30ml/min/1.73m2 wird nach Ausschluss einer übermässigen Diuretisierung und/oder Stopp nephrotoxischer Substanzen die Dosis halbiert und ab einem Kalium >6.0mmol/l das Medikament gestoppt. Da sowohl ACE-Hemmer und MRA wichtige Grundsteine der Herzinsuffizienztherapie sind, ist bei chronischer Neigung zur Hyperkaliämie eine langfristige Strategie zur Elektrolytkontrolle essenziell. Neben einer kaliumarmen Ernährung und Verzicht auf nephrotoxische oder kaliumsparende Medikamente (z. B. Amilorid, Comilorid) werden bei Neigung zur Hypervolämie Schleifendiuretika und/oder Thiazide eingesetzt. Alternativ bieten sich Austauschharze wie Resonium oder Patiromer an, wobei letzteres deutlich weniger gastrointestinale Nebenwirkungen hervorruft und in randomisierten Studien bei HFrEF zu höher tolerablen ACE-I/MRA-Dosierungen führte (21, 22). MRA sind zudem starke CYP3A4-Inhibitoren und daher vorsichtig mit Medikamenten wie Ketokonazol, Clarithromycin etc. zu kombinieren. Durch die zusätzliche Bindung an Steroid- und Androgenrezeptoren führt insbesondere Aldactone häufiger zu einer Gynäkomastie, was unter dem etwas selektiv wirkenden Eplerenon deutlich seltener auftritt.
SGLT2-Inhibitoren
In der DAPA-HF- und der EMPEROR-Reduced-Studie wurde der Effekt von Dapagliflozin respektive Empagliflozin versus Placebo bei symptomatischen Patienten (NYHA II-IV) mit einer LVEF<40% untersucht und eine ca. 25%ige Reduktion von kardiovaskulären Todesfällen und Hospitalisationen sowie eine verbesserte Lebensqualität und Leistungsfähigkeit beobachtet (23, 24). Der Effekt besteht schon früh nach Behandlungsbeginn und ist unabhängig davon, ob ein Diabetes Typ 2 vorliegt oder nicht.
Wie bei ACE-Hemmern fällt in den ersten Wochen nach Therapiebeginn die eGFR um bis zu 30% ab. Dies ist auf eine Reduktion der ungünstigen Hyperfiltration im Glomerulum zurückzuführen, wirkt sich jedoch langfristig nephroprotektiv aus. Bei fortgeschrittener Niereninsuffizienz können SGLT-2-I bis zu einer eGFR von 20ml/min/1.73m2 sicher eingeleitet und bis zum Beginn einer Dialyse oder einer Nierentransplantation fortgesetzt werden (25).
Selten tritt als schwere Nebenwirkung eine lebensbedrohliche diabetische Ketoazidose auf. Weil dies bei Diabetes mellitus Typ 1 gehäuft auftritt, werden SGLT-2-I bei dieser Patientengruppe nicht eingesetzt. Bei Verdacht und entsprechender Symptomatik (Übelkeit, Erbrechen, Bauchschmerzen, Durst, Atembeschwerden, Erschöpfung, Verwirrung) müssen daher auch bei normoglykämen Patienten Ketonkörper gesucht werden. Zur Prävention einer Ketoazidose werden SGLT-2-I bei kritisch kranken Patienten, schweren Infektionen, Volumendepletion oder vor grossen Operationen pausiert. Ausserdem müssen die Patienten auf einen gemässigten Alkoholkonsum sowie das Vermeiden einer ketogenen Diät hingewiesen werden.
Als weitere Nebenwirkung werden urogenitale Infektionen durch die Glucosurie begünstigt. Bei unkomplizierten Infektionen kann der SGLT2-Inhibitor unter entsprechender antibiotischer oder antimykotischer Therapie weitergeführt werden. Bei komplizierten Harnwegsinfekten (inkl. Sepsis) oder rezidivierenden urogenitalen Infektionen (≥3) sollten die SGLT2-Inhibitoren abgesetzt werden. Sofern die zugrunde liegende Ätiologie identifiziert und behandelt wurde, ist eine Wiederaufnahme nach einem infektionsfreien Jahr möglich (25).
Ältere Patienten zeigen häufiger eine atypische Symptomatik und sind anfälliger für Dehydratationen, Hypotonien und Hypoglykämien, weshalb bei ihnen besonders auf unerwünschte Wirkungen geachtet werden sollte.
Reihenfolge der Initiierung der Vierfachtherapie
Die optimale Einleitung der Vierfachtherapie beruht derzeit auf Expertenmeinungen, wobei wissenschaftliche Evidenz und entsprechende Empfehlungen in den ESC-Leitlinien fehlen. Vermutlich ist die Reihenfolge der Medikamentenwahl weit weniger entscheidend, als dass versucht wird, alle Substanzklassen rasch zu starten. Bei niedrigem Blutdruck kann ein Beginn mit SGLT2-I und MRA sinnvoll sein, bei schlechter Nierenfunktion empfiehlt sich, zuerst Betablocker und SGLT2-I einzusetzen. Liegt eine Hypervolämie vor, lohnt es sich, mit SGLT2-I, MRA und ARNI vor Einsatz des Betablockers zu beginnen. Im ambulanten Setting werden nach Erstdiagnose einer HFrEF alle vier Substanzklassen in niedriger Dosis innerhalb von 2-4 Wochen gestartet und über weitere 2-4 Wochen in kleinen Schritten bis zur Zieldosis aufdosiert (s. Tabelle 2). Bei Patienten mit vorbestehender Hypotonie oder Niereninsuffizienz ist zur Vermeidung von Nebenwirkungen oft ein langsameres Vorgehen notwendig. Während der Einführungsphase sind engmaschige hausärztliche Kontrollen der Laborparameter (v. a. Kreatinin und Kalium) sowie Beurteilung der Volämie notwendig. Häufig sinkt nach Etablierung dieser Vierfachtherapie der Diuretikabedarf durch die Verbesserung der Hämodynamik und additive diuretische Wirkung von MRA, SGLT-2-I und ARNI. Nach Spitalaustritt sollte bei einem weiteren Gewichtsverlust, klinischen Zeichen der Hypovolämie oder Kreatininanstieg ohne Zeichen einer erneuten Dekompensation die Diuretikadosis rasch reduziert werden, was im besten Fall durch den gut informierten Patienten in Eigenregie erfolgt.
Vericiguat
Vericiguat ist ein Stimulator der löslichen Guanylatcyclase, welche die Synthese von intrazellulärem zyklischen Guanosinmonophosphat (cGMP) katalysiert. cGMP ist ein wichtiges Signalmolekül und verbessert die Herzkontraktilität, den Gefässtonus und das kardiale Remodelling. Im VICTORIA-Trial reduzierte Vericiguat bei Herzinsuffizienzpatienten mit kürzlich klinischer Verschlechterung (intravenöse Diuretika oder Hospitalisation in den letzten 3-6 Monaten) und einer LVEF <45%, das Risiko einer Rehospitalisation um 10% (26). Es zeigte sich kein wesentlicher Effekt auf die Mortalität, was hauptsächlich durch die kränkere Studienpopulation mit entsprechend höherem NT-proBNP erklärt wurde. Aufgrund vordefinierter Subgruppenanalysen und Post-hoc-Studien ist Vericiguat bei einem NT-proBNP >5000 pg/ml mit Vorsicht einzusetzen und potenziell gefährlich bei Patienten mit einem NT-proBNP >8000 pg/ml (26, 27). Im Gegensatz zu den anderen Herzinsuffizienz-Medikamenten darf Vericiguat auch bei fortgeschrittener Niereninsuffizienz (bis eGFR ≥ 15ml/min/1.73m2) gestartet werden. Zwar ist die am häufigsten beschriebene Nebenwirkung die Hypotonie (16.4%), allerdings war im VICTORIA-Trial die Blutdruckdifferenz im Vergleich zu Placebo nur 1 bis 2 mmHg tiefer und auch die Rate an symptomatischen Hypotonien mit 1.2% nur marginal erhöht (26). Somit eignet sich das Medikament insbesondere für Patienten, welche die gängigen HFrEF-Medikamente aufgrund einer fortgeschrittenen Niereninsuffizienz oder Hypotonie nicht tolerieren. Eine weitere mögliche Indikation besteht bei Verschlechterung der Herzinsuffizienz trotz optimaler Vierfachtherapie, sofern das NT-proBNP nicht exzessiv erhöht ist (5).
Rehabilitation
Es gibt konsistente Evidenz dafür, dass körperliches Training die Leistungstoleranz und die Lebensqualität von Patienten mit Herzinsuffizienz verbessert (5). Klinische Studien und Meta-analysen bei Menschen mit HFrEF zeigen zudem, dass eine kardiale Rehabilitation die Zahl der Krankenhausaufenthalte reduziert, Unsicherheiten bestehen über die Auswirkungen auf die Mortalität (5). Nebst moderatem Ausdauertraining kann auch ein hochintensives Intervalltraining den maximalen Sauerstoffverbrauch (VO2max) verbessern. Es ist daher immens wichtig, Patienten zum regelmässigen körperlichen Training zu animieren und bei chronisch fortgeschrittener Erkrankung, nach einer akuten Verschlechterung oder einer Hospitalisation aktiv in ein Rehabilitationsprogramm einzubinden (5).
Devices/Interventionen
Neben der klassischen medikamentösen Therapie der Herzinsuffizienz bestehen diverse weitere Therapiemöglichkeiten mit Devices oder Interventionen. Eine detaillierte Übersicht folgt in dieser Ausgabe der «Therapeutischen Umschau». Bleibt die LVEF unter leitlinienkonformer Therapie <35%, ist eine Versorgung mit einem implantierbaren Defibrillator zur Verminderung des plötzlichen Herztods zu diskutieren und bei zusätzlich breitem QRS (>130ms) eine kardiale Resynchronisationstherapie (CRT) zu evaluieren (5). Besteht eine schwere sekundäre Mitralklappeninsuffizienz, sind chirurgische wie auch interventionelle Therapiestrategien zu erwägen (5).
Fortgeschrittene Herzinsuffizienz/Palliation
Viele Patienten entwickeln trotz weitreichender therapeutischer Massnahmen eine progrediente Herzinsuffizienz mit zunehmender Symptomatik (NYHA III-IV) und häufigen Hospitalisationen. In diesem Stadium der Erkrankung ist mit einer 1-Jahres-Mortalität zwischen 25 und 75% zu rechnen (5). Es ist daher wichtig, betroffene Patienten über die Prognose und die weiteren begrenzten therapeutischen Möglichkeiten (Herztransplantation, Herzunterstützungssysteme, Palliation) zu informieren. Spätestens zu diesem Zeitpunkt sollte mit den Patienten ein ausführliches Gespräch über die Gestaltung der letzten Lebensphase geführt werden und gegebenenfalls auch ein Palliative Care Team involviert werden.
Medikamentöse Behandlung der HFmrEF
Patienten mit einer HFmrEF haben klinische Merkmale, welche der HFrEF ähnlicher sind als der HFpEF. Die Mortalität ist hingegen tiefer als bei der HFrEF (28). Patienten mit HFmrEF sind öfter jünger, männlich und haben häufiger eine koronare Herzerkrankung, wohingegen Vorhofflimmern und nicht kardiale Komorbiditäten bei der HFpEF häufiger sind (28).
Es existieren bisher nur wenige prospektive, randomisierte, kontrollierte Studien, die explizit Patienten mit HFmrEF untersucht haben. So besteht die beste Evidenz derzeit für die SGLT-2-Inhibitoren, welche bei allen HFmrEF-Patienten eingesetzt werden sollten (29). Für alle andere Substanzklassen (ACE-I, ARNI, Betablocker, MRA) besteht eine Klasse-IIb-Empfehlung («kann erwogen werden»), welche sich primär auf Subgruppenanalysen stützt (5). Eine medikamentöse Therapie mit einer Vierfachtherapie sollte bei Patienten, welche eine Verbesserung der EF auf >40% erfahren haben (HFimpEF), unverändert fortgeführt werden. Bisher gibt es für diese Patientenpopulation keine spezifischen Studien. Hingegen zeigte eine Studie bei Patienten mit dilatativer Kardiomyopathie und Verbesserung der EF auf >50% einen negativen Effekt, wenn die Medikation schrittweise gestoppt wird (31).
Fazit
Die Betreuung von Patienten mit Herzinsuffizienz ist oft komplex und zeitaufwendig. Mittlerweile stehen zur Behandlung der Herzinsuffizienz mit eingeschränkter LVEF diverse Therapieoptionen zur Verfügung. Allgemein ist eine gute Prävention und Behandlung von kardiovaskulären Erkrankungen sowie die frühe Erkennung von Patienten, die an einer Herzinsuffizienz leiden essenziell – möglichst, bevor eine Hospitalisation notwendig wird. Durch eine rasche Einführung und Aufdosierung der Vierfachtherapie bei HFrEF können Episoden mit akuter Verschlechterung verhindert sowie die Lebensqualität und das Überleben verbessert werden. Hierdurch lassen sich unnötige Hospitalisationen sowie Konsultationen in der Hausarztpraxis vermeiden. Dies ist umso wichtiger aufgrund der in den nächsten Jahren zu erwartenden starken Zunahme der Prävalenz. Eine gute Zusammenarbeit zwischen Spezialisten und Grundversorgern mit Einbezug von Angehörigen und spezialisierten Pflegefachkräften trägt zum Behandlungserfolg bei. Weitere medikamentöse und nicht medikamentöse Therapien sind in Entwicklung und werden hoffentlich die Versorgung dieser vulnerablen Patientenpopulation weiter verbessern.
Herzzentrum, Luzerner Kantonsspital
Spitalstrasse 16
6000 Luzern
Literatur:
1. Bozkurt B, Coats AJS, Tsutsui H, et al. Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure: Endorsed by the Canadian Heart Failure Society, Heart Failure Association of India, Cardiac Society of Australia and New Zealand, and Chinese Heart Failure Association. Eur J Heart Fail. 2021;23(3):352-80.
2. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018;392(10159):1789-858.
3. Chioncel O, Lainscak M, Seferovic PM, et al. Epidemiology and one-year outcomes in patients with chronic heart failure and preserved, mid-range and reduced ejection fraction: an analysis of the ESC Heart Failure Long-Term Registry. Eur J Heart Fail. 2017;19(12):1574-85.
4. Savarese G, Becher PM, Lund LH, et al. Global burden of heart failure: a comprehensive and updated review of epidemiology. Cardiovasc Res. 2023;118(17):3272-87.
5. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022;24(1):4-131.
6. Mueller C, McDonald K, de Boer RA, et al. Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations. Eur J Heart Fail. 2019;21(6):715-31.
7. Bayes-Genis A, Docherty KF, Petrie MC, et al. Practical algorithms for early diagnosis of heart failure and heart stress using NT-proBNP: A clinical consensus statement from the Heart Failure Association of the ESC. Eur J Heart Fail. 2023;25(11):1891-8.
8. Unverzagt S, Meyer G, Mittmann S, et al. Improving Treatment Adherence in Heart Failure. Dtsch Arztebl Int. 2016;113(25):423-30.
9. Mebazaa A, Davison B, Chioncel O, et al. Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial. Lancet. 2022;400(10367):1938-52.
10. Mullens W, Damman K, Harjola VP, et al. The use of diuretics in heart failure with congestion – a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2019;21(2):137-55.
11. Desai AS, McMurray JJ, Packer M, et al. Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J. 2015;36(30):1990-7.
12. Packer M. What causes sudden death in patients with chronic heart failure and a reduced ejection fraction? Eur Heart J. 2020;41(18):1757-63.
13. Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145(18):e895-e1032.
14. McDonald M, Virani S, Chan M, et al. CCS/CHFS Heart Failure Guidelines Update: Defining a New Pharmacologic Standard of Care for Heart Failure With Reduced Ejection Fraction. Can J Cardiol. 2021;37(4):531-46.
15. Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure. N Engl J Med. 2019;380(6):539-48.
16. Wachter R, Senni M, Belohlavek J, et al. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail. 2019;21(8):998-1007.
17. Packer M, Fowler MB, Roecker EB, et al. Effect of carvedilol on the morbidity of patients with severe chronic heart failure: results of the carvedilol prospective randomized cumulative survival (COPERNICUS) study. Circulation. 2002;106(17):2194-9.
18. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999;353(9169):2w001-7.
19. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet. 1999;353(9146):9-13.
20. Paolillo S, Dell‘Aversana S, Esposito I, et al. The use of ß-blockers in patients with heart failure and comorbidities: Doubts, certainties and unsolved issues. Eur J Intern Med. 2021;88:9-14.
21. Murphy D, Banerjee D. Hyperkalaemia in Heart Failure: Consequences for Outcome and Sequencing of Therapy. Curr Heart Fail Rep. 2022;19(4):191-9.
22. Butler J, Anker SD, Lund LH, et al. Patiromer for the management of hyperkalemia in heart failure with reduced ejection fraction: the DIAMOND trial. Eur Heart J. 2022;43(41):4362-73.
23. Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-24.
24. McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019;381(21):1995-2008.
25. Liew A, Lydia A, Matawaran BJ, et al. Practical considerations for the use of SGLT-2 inhibitors in the Asia-Pacific countries-An expert consensus statement. Nephrology (Carlton). 2023;28(8):415-24.
26. Armstrong PW, Pieske B, Anstrom KJ, et al. Vericiguat in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2020;382(20):1883-93.
27. Ezekowitz JA, O‘Connor CM, Troughton RW, et al. N-Terminal Pro-B-Type Natriuretic Peptide and Clinical Outcomes: Vericiguat Heart Failure With Reduced Ejection Fraction Study. JACC Heart Fail. 2020;8(11):931-9.
28. Koh AS, Tay WT, Teng THK, et al. A comprehensive population-based characterization of heart failure with mid-range ejection fraction. Eur J Heart Fail. 2017;19(12):1624-34.
29. McDonagh TA, Metra M, Adamo M, et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2023;44(37):3627-39.
30. Swiss Heart Failure Working Group of the Swiss Society of Cardiology. SHFW Pocket-Card: Diagnose und Management der chronischen Herzinsuffizienz. https://www.heartfailure.ch/de/
31. Halliday BP, Wassall R, Amrit S, et al. Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. Lancet 393, 61–73 (2019).