Die Frozen Shoulder (FS) ist eine in der Praxis häufig vorkommende Pathologie. Die Erkrankung geht häufig mit einer Vielzahl an Komorbiditäten einher und ist durch starke Schmerzen und einen deutliche Bewegungseinschränkung der betroffenen Schulter charakterisiert. Eine aufgehobene passive Aussenrotation bei adduziertem Arm ohne Hinweise auf eine andere Pathologie, die den Befund erklären kann, wie zum Beispiel eine Omarthrose oder eine nicht entdeckte hintere Luxation, ist pathognomonisch. Der Krankheitsverlauf erstreckt sich in der Regel über ein bis zwei Jahre und ist in den meisten Fällen selbstlimitierend. In den allermeisten Fällen kann das Krankheitsbild konservativ behandelt werden.
Einführung
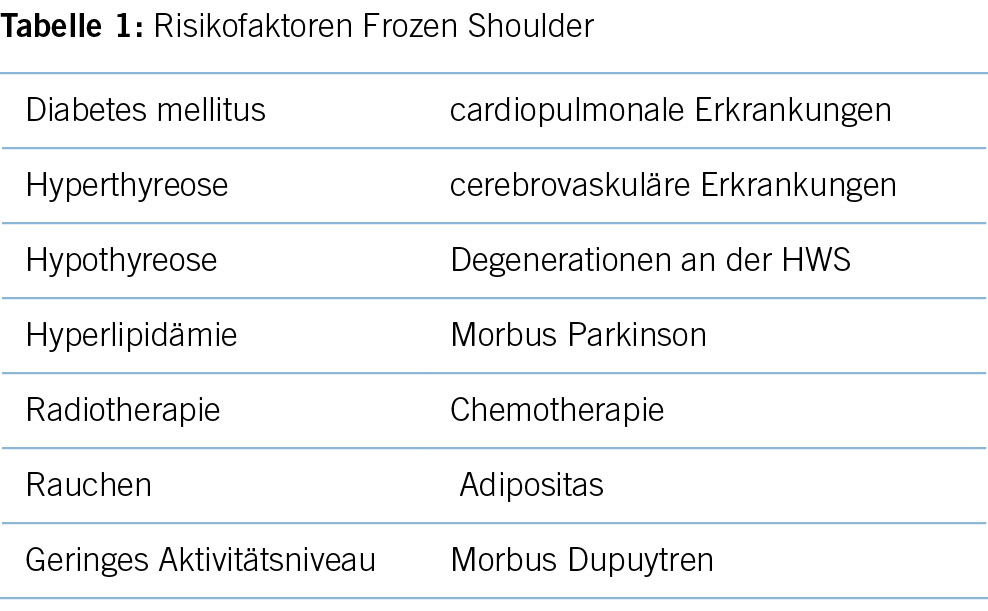
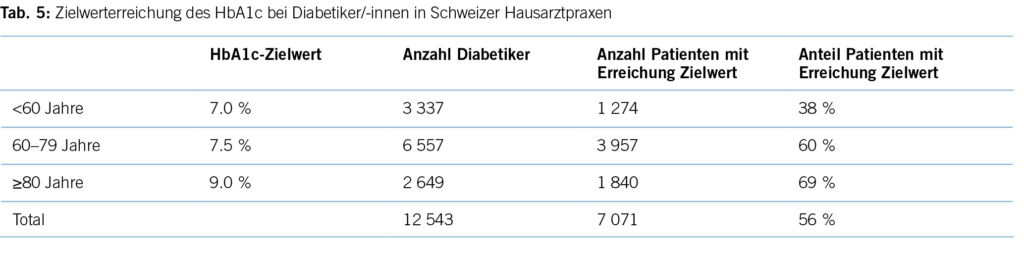
Die Frozen Shoulder (FS), auch Capsulitis adhaesiva oder eher historisch Periarthropathia Humeri, ist eine häufige, meist äusserst schmerzhafte Pathologie der Schulter, welche auch in der Hausarztpraxis regelmässig gesehen wird (1). Ein Grossteil der Fälle kann problemlos in der hausärztlichen Praxis behandelt werden und erfordert keine Zuweisung zum Spezialisten. Die Lebenszeitprävalenz wird in der Literatur mit 2-5% angegeben (2), wobei Frauen häufiger betroffen sind als Männer. Ebenso zeigt sich, dass der adominante Arm häufiger betroffen ist (3). Circa 20-30% der Patienten entwickeln dieselben Beschwerden im Verlauf auch auf der Gegenseite (4). Das Krankheitsbild ist mit oftmals starken, insbesondere auch nächtlichen Schmerzen sowie einer limitierenden körperlichen Einschränkung assoziiert und kann alle Facetten des alltäglichen Lebens betreffen (2). Die nächtlichen Schmerzen können dazu führen, dass die Patienten häufig tage- oder wochenlang nicht richtig durchschlafen, was zu einer chronischen Müdigkeit, sogar auch zum Entwickeln einer Depression führen kann. Das Krankheitsbild der FS kann mit einer Vielzahl an Komorbiditäten in Verbindung gebracht werden, insbesondere beim Diabetes mellitus zeigt sich eine Inzidenz von beinahe 60%. Auch eine Hyper- oder Hypothyreose kann mit einer FS assoziiert sein. Weitere Komorbiditäten sind in Tabelle 1 abgebildet. Eine oder mehrere dieser Komorbiditäten können in über 80% der FS-Patienten gefunden werden, in 35% der Patienten können sogar drei oder mehr der aufgezählten Komorbiditäten gefunden werden (2). Zudem bestehen weitere Risikofaktoren (weibliches Geschlecht im mittleren Alter, Nikotinabusus, Adipositas und verminderte körperliche Aktivität, auch psychologische Aspekte werden in Betracht gezogen) (5,6).
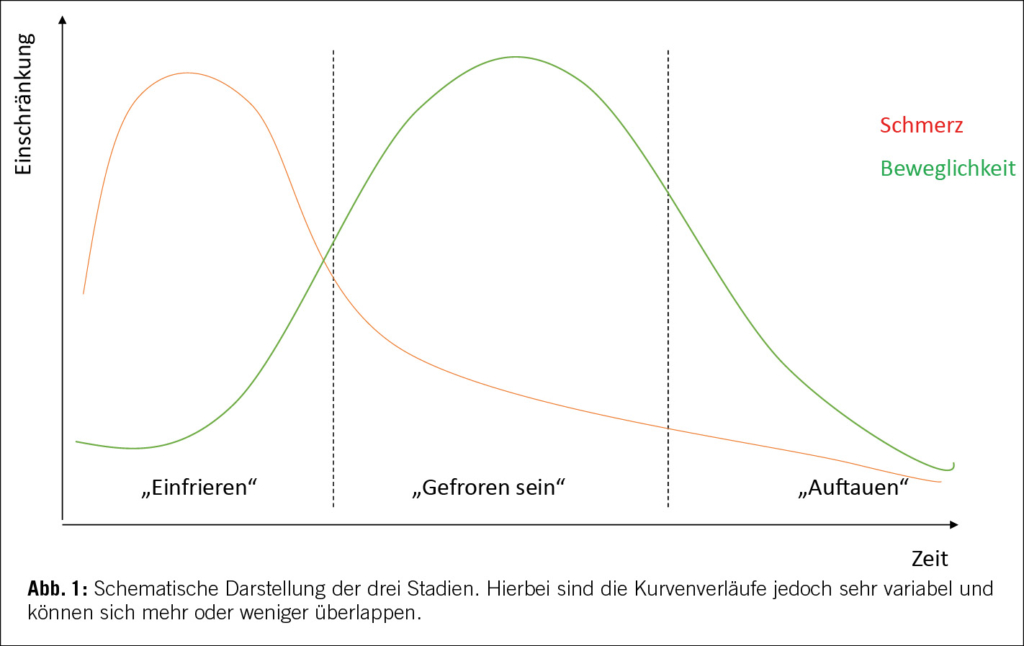
Aufgrund aktueller Erkenntnisse ist die Erkrankung in den meisten Fällen eine selbstlimitierende Pathologie mit einem Krankheitsverlauf von durchschnittlich 12-24 Monaten. Die Beschwerden können jedoch auch deutlich länger anhalten. In der Literatur gibt es Untersuchungen, welche persistierende Symptome (Schmerz und Steifigkeit) bei 20-50% der Patienten nach 5 Jahren nach Symptombeginn noch immer beschreiben (7,8). In den beschriebenen Kohorten kam es bei bis zu 20% der Patienten zu einer bilateralen Symptomatik, jedoch nicht zu einem Rezidiv nach abgeklungener Symptomatik. Die Erkrankung kann typischerweise in drei Stadien (3) eingeteilt werden, welche allesamt in unterschiedlicher Ausprägung durchlaufen werden. Im ersten Stadium kommt es zum «Einfrieren» der Schulter, diese Phase ist durch starke Schmerzen ohne eigentliche Bewegungseinschränkung geprägt. Im zweiten Stadium besteht die Bewegungseinschränkung der Schulter, der Schmerz kann nachlassen, kann jedoch auch noch weiter vorhanden sein, dieses Stadium wird auch als das «Gefroren sein» bezeichnet. Schliesslich kommt das «Auftauen», das dritte Stadium, spätestens hier ist der Schmerz regredient, es kommt zu einer Verbesserung der Beweglichkeit, nahe der ursprünglichen Bewegungsausmasse (Abb. 1).
Obschon es sich um eine sehr häufige Schulterpathologie handelt, gibt es in vielen Reviews keine einheitlichen Definitionen. Deswegen wurden Versuche unternommen, unter etablierten Schulterchirurgen einen Consensus zu finden, so zum Bespiel die Kollegen der American Shoulder and Ellbow Surgeons (ASES) (9), (Tab. 2).
Pathophysiologie
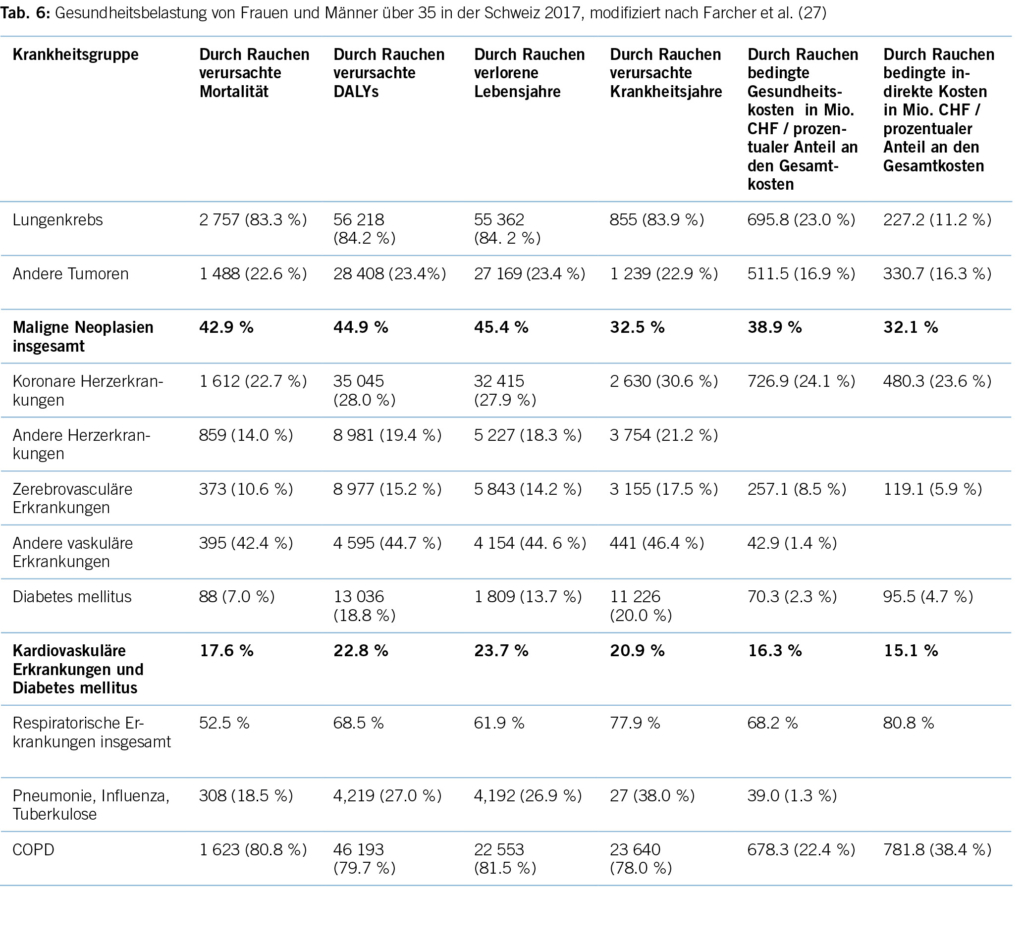
Die FS ist weiterhin eine der am schlechtesten verstandenen Schulterpathologien (9), auch wenn mittlerweile einige pathophysiologischen Vorgänge beschrieben wurden. Physiologisch oder normalerweise besteht die Gelenkkapsel aus einem hohen Anteil an Kollagen Typ I Fasern und elastischen Fasern. In das Gewebe sind Fibroblasten eingebettet, welche Proteine produzieren, um die stabilisierende, aber auch flexible Struktur zu gewährleisten (2). Bei der FS kommt es zu einer Fibrosierung und somit zur Veränderung der Kollagenstruktur sowie einer Verdickung der Synovia. Diese Veränderungen gehen mit einer Neoangionese und einer Neoinnervation einher. Es resultiert ein vermindertes Gelenkvolumen und eine erhöhte Steifigkeit des Gewebes (10,11). Parallel zur Klinik zeigen sich diese drei Stadien bei der arthroskopischen und histologischen Betrachtung. Im ersten Stadium zeigt sich eine vermehrte Inflammation der Synovialis sowie eine Hypervaskularität der Synovialis mit Einwanderung von Entzündungszellen bei noch normalem Kapselgewebe in der Biopsie. Im zweiten Stadium zeigt sich weiterhin arthroskopisch eine Synovialitis mit zunehmender Kontraktur der Kapsel, und in der Histologie zeigt sich das Bild einer hypertrophen, hypervaskularisierten Synovialitis mit Narbenbildung. Arthroskopisch zeigt sich im dritten Stadium nur noch geringe Synovitis mit Aufhebung des axillären Recessus und Fibrose. Bei der mikroskopischen Betrachtung kann ein dichtes hyperzelluläres, kollagenreiches Gewebe gesehen werden, in der genaueren Betrachtung zeigt sich ein Verlust der Kollagen Typ I Fasern und vermehrt Kollagen Typ III Fasern, welche ein desorganisiertes Muster aufweisen. Die Kollegen um Millar (2) haben eine detaillierte Übersicht über die komplexen, bisher bekannten pathophysiologischen Abläufe zusammengetragen.
Diagnostik
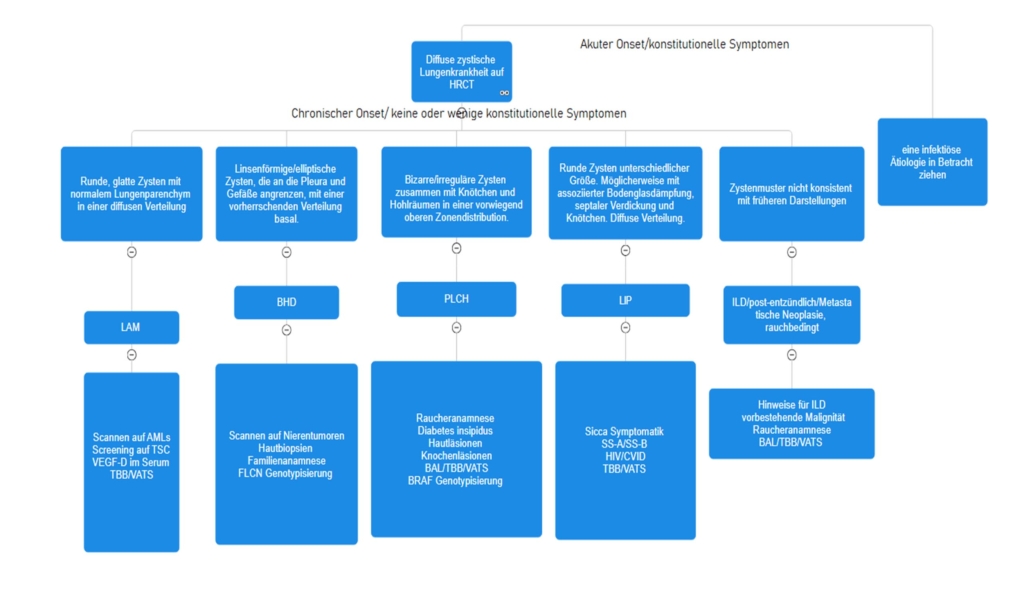
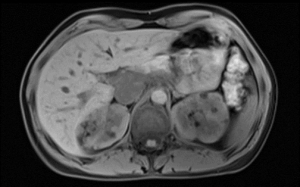
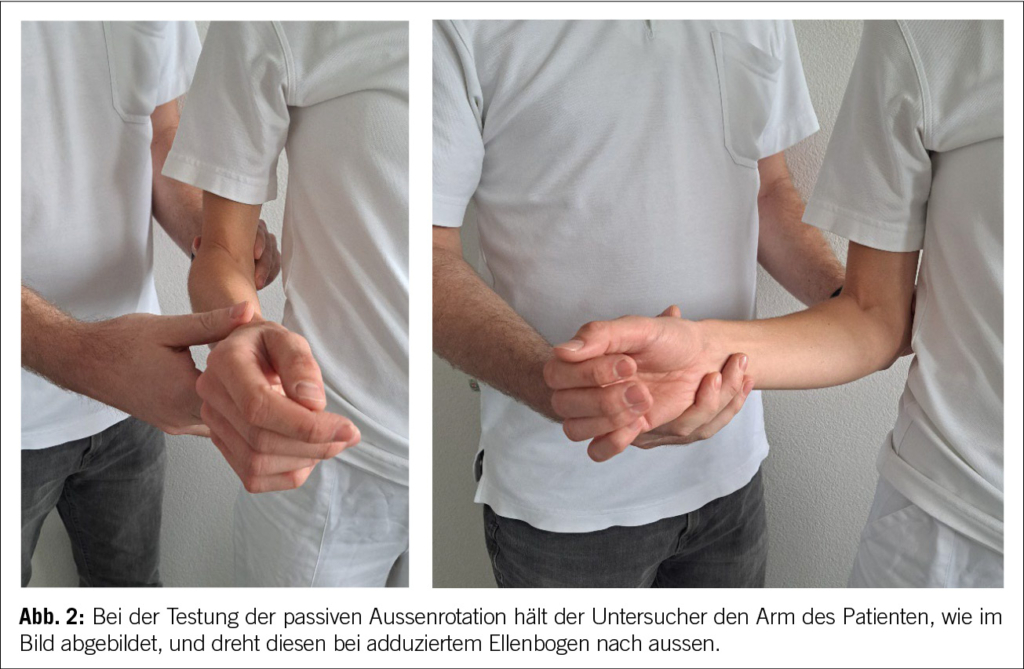
Die Verdachtsdiagnose der FS kann bereits häufig schon durch eine gründliche Anamnese (Nacht- und Ruheschmerzen) und eine gute klinische Untersuchung gestellt werden (12). Klinisch zeigt sich eine deutlich eingeschränkte, eventuell sogar völlig aufgehobene aktive und passive Aussenrotation der betroffenen Schulter, ohne Krepitationen (13). Insbesondere die passive Aussenrotation (Abb. 2) sollte immer untersucht werden. Dies in Adduktion und im Vergleich zur «gesunden» Seite. Häufig wird die Diagnose über Monate verpasst, da keine gründliche klinische Untersuchung durchgeführt wird. Im weiteren Krankheitsverlauf können auch andere Bewegungsdimensionen aktiv wie auch passiv eingeschränkt sein. Die Kraft ist im schmerzfreien Bereich nicht eingeschränkt (14). Wichtig zu unterscheiden ist, ob der harte Anschlag einer aktiven Muskelkontraktion des Patienten oder einem echten mechanischen Hindernis entspricht. Hierfür wird der Patient am besten in unterschiedlichen Positionen untersucht, Aussenrotation bei anliegendem Arm, Aussenrotation bei 90° abduziertem Arm, stehend oder liegend, hier wird die Scapula durch die Unterlage stabilisiert (14). Die einzigen Pathologien, die eine Einschränkung der AR bei einer nicht operierten Schulter verursachen, sind die fortgeschrittene Omarthrose und eine verpasste hintere Luxation. Deshalb wird eine konventionelle Bildgebung in zwei Ebenen (AP/Neer) empfohlen. Insbesondere bei jüngeren Patienten mit unauffälligem Röntgenbild kann zum weiteren Ausschluss einer weiteren Pathologie eine Ultraschalluntersuchung durch einen geübten Sonographeur oder eine Arthro-Magnetresonanztomographie (Arthro-MRI) durchgeführt werden (15). Diese Untersuchungen bringen bezüglich der FS keinen diagnostischen Mehrwert. Bei Vorliegen einer FS kann in diesen Untersuchungen eine Verdickung der Kapsel, des Rotatorenintervalls und des Coracohumeralen Ligaments wie auch ein aufgehobener axillärer Recessus nachgewiesen werden (2).
Therapeutische Optionen
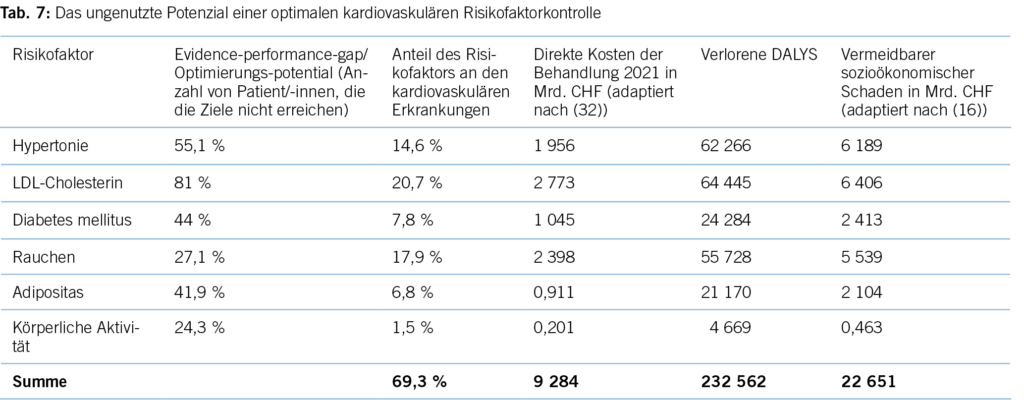
Bei anhin gibt es keine gut definierten evidenzbasierten Behandlungsstrategien, was auch der unzureichend bekannten Pathogenese des Krankheitsbildes geschuldet ist. Mitunter am wichtigsten ist eine gute Aufklärung über den natürlichen Verlauf der Erkrankung sowie Begleitung im Verlauf deren Stadien. Rangan et al. konnten zeigen, dass eine gute Patientenedukation und Angstreduktion eine subjektive Verbesserung der Symptome mit sich bringen kann (16). Bisher sind die Behandlungsmöglichkeiten hauptsächlich symptomatischer Natur. Sie stützen sich darauf, die Schmerzen zu kontrollieren sowie die Einschränkung der Beweglichkeit zu minimieren respektive diese zu verbessern. Es stehen konservative wie auch operative Therapiemöglichkeiten zur Verfügung. Primär sollen jedoch die konservativen Therapieoptionen verfolgt werden, erst wenn diese fehlschlagen, sollten auch operative Massnahmen evaluiert werden. Initial ist eine gute Analgesie für die Patienten wichtig. Wenn die Komorbiditäten es erlauben, sollten NSAR eingesetzt werden, auch in Kombination mit Paracetamol und Metamizol. Gelegentlich werden auch Opiate nötig. Zur Verbesserung der Beweglichkeit kann eine Bewegungstherapie beitragen, welche selbständig durch den Patienten oder unter physiotherapeutischer Supervision stattfindet. Wichtig ist hier, dass insbesondere in der schmerzhaften Phase nicht noch weitere Schmerzen generiert werden (17). Versuche mit extrakorporalen Stosswellen haben einen möglichen Benefit bezüglich der Schmerzen zeigen können, jedoch ist die Evidenz hierfür nicht ausreichend, um dies abschliessend beurteilen zu können (2). Bei persistierenden Schmerzen haben Corticosteroide einen guten Effekt zeigen können (18). Diese können sowohl oral wie auch intraartikulär appliziert werden (19). Beide Darreichungsformen zeigen eine Verbesserung des Schmerzes und der passiven Beweglichkeit. Bei einer intraartikulären Applikation besteht prinzipiell das Risiko einer septischen Arthritis, während bei einer oralen Stosstherapie (Stufenschema nach Habermeyer) vermehrt systemische Nebenwirkungen auftreten. In der Literatur zeigt sich ein Vorteil der Infiltration gegenüber der oralen Gabe (18,20). Auch bei einer intraartikulären Infiltration sollte bei Diabetikern der Blutzucker über die ersten Tage engmaschig kontrolliert werden. Zudem zeigte sich, dass eine gute physiotherapeutische Behandlung einer oralen Steroidgabe gar überlegen ist. In den letzten Jahren wurde auch eine positive Wirkung von Calcitonin Nasenspray postuliert. Es zeigte sich ein positiver Effekt sowohl auf die Schmerzen als auch auf die Beweglichkeit. Hinweise hierfür konnten auch im Labor anhand von ex vivo gezüchteten synovialen Fibroblasten nachgewiesen werden (21,22). Allerdings übernimmt in aller Regel die Krankenkasse die Kosten für den Calcitonin Nasenspray nicht, und diese müssen vom Patienten selber getragen werden. Neuere Studien untersuchen auch den Nutzen von Platelet-Rich-Plasma (PRP) als mögliche Alternative zu Steroiden. Hier zeigten sich in den Kohorten positive Effekte längerfristig gegenüber den Steroiden, kurzzeitig zeigten diese jedoch einen besseren Effekt (23,24). Allerdings sind hierzu noch weitere Studien mit grösseren Patientenzahlen nötig. Auch diese Behandlung wird nicht durch die Grundversicherung vergütet, und die Patienten müssen die Kosten, welche je nach Hersteller unterschiedlich sind, selber übernehmen. Weitere therapeutische Optionen, wie zum Beispiel der Nervenblock des Nervus suprascapularis, Botox-Injektionen oder auch Collagenasebehandlungen, konnten einen gewissen Effekt zeigen, allerdings existiert hierfür noch eine sehr dünne Datenlage (2). Diese Behandlungen bedürfen sicherlich noch weiterer Untersuchungen und Studien, um deren Effektivität zu beurteilen. Sie können in Einzelfällen und bei therapierefraktären Situationen gegebenenfalls bereits angewendet werden. Nach Ausschöpfen der konservativen Therapieoptionen und bei persistierenden Beschwerden kann die FS operativ angegangen werden. Ziel einer operativen Therapie ist das Lösen der verdickten, fibrotischen Gelenkkapsel und der kontrakten Ligamente, um eine Verbesserung der Beweglichkeit, aber auch eine Schmerzreduktion zu erzielen. Dabei wird arthroskopisch eine Kapsulotomie, meist mit einer Resektion des verdickten Intervalls zusammen mit einer Arthrolyse durchgeführt. Entscheidend für den Erfolg ist die postoperative Analgesie idealerweise unter einer Scalenusblockade für etwa fünf Tage, bis ein voller Bewegungsumfang erreicht wird. In der Literatur wird kontrovers darüber diskutiert, wann der richtige Zeitpunkt hierfür gekommen ist. Es gibt Autoren, welche eine rasche operative Herangehensweise befürworten, andere sehen diese lediglich als Option bei erfolgloser konservativer Therapie über zwölf Monate (2,3,10,25). Kollegen in England haben die Resultate und entstehende Kosten zwischen Physiotherapie, Mobilisation unter Narkose und Mobilisation unter Narkose mit Arthroskopie untersucht. Hierbei zeigte sich, dass keine der drei Gruppen ein deutlich besseres Outcome im Vergleich zu den anderen Gruppen aufweisen konnte. Die operativen Möglichkeiten können eine schnellere Reduktion der Schmerzen und eine raschere Verbesserung der Beweglichkeit bringen, jedoch sollten diese dennoch erst nach Fehlschlagen der nicht operativen Behandlungsmöglichkeiten in Betracht gezogen werden (13).
Schlussfolgerung
Zusammenfassend handelt es sich bei der Frozen Shoulder um ein weiterhin noch nicht gut verstandenes Krankheitsbild, daraus resultieren keine standardisierten und auf breiter Evidenz abgestützten Behandlungsalgorithmen. Entscheidend ist jedoch die frühe Diagnosestellung und damit Einleitung geeigneter therapeutischer Massnahmen, insbesondere auch das Vermeiden von anhaltenden Schmerzreizen. Es werden viele Interventionen und Behandlungsansätze beschrieben, welche durchaus Erfolg versprechend sind. Zum aktuellen Zeitpunkt zeigen jedoch Steroidinjektionen und NSAR im ersten Stadium, Physiotherapie in den Stadien zwei bis drei die besten Resultate. Von Beginn an ist eine gute Kommunikation und Begleitung des Patienten essenziell.
Kantonsspital Baden
Im Ergel 1
5404 Baden
david.windischbauer@ksb.ch
Es bestehen keine Interessenskonflikte.
Historie:
Manuskript eingereicht: 02.10.2023
Nach Revision angenommen: 22.11.2023
1. Neviaser JS. ADHESIVE CAPSULITIS OF THE SHOULDER – A Study of the Pathological Findings in Periarthritis of the Shoulder SHOULDER, 1945; http://journals.lww.com/jbjsjournal, Letzter Zugriff 01.10.2023
2. Millar NL, Meakins A, Struyf F et al. Frozen shoulder. Nat Rev Dis Primers. 2022 Dec 1;8(1).
3. Neviaser AS, Hannafin JA. Adhesive capsulitis: A review of current treatment. Vol. 38, American Journal of Sports Medicine. 2010. p. 2346–56.
4. Binder AI, Bulgen DY, Hazleman BL, Roberts S. Frozen shoulder: A long-term prospective study. Ann Rheum Dis. 1984;43(3):361–4.
5. Niehaus R, Urbanschitz L, Schumann J et al. Non-adherence to pain medication increases risk of postoperative frozen shoulder. Int J Prev Med. 2021 Jan 1;12(1).
6. Gil JA, Goodman AD, Mulcahey MK. Psychological Factors Affecting Outcomes After Elective Shoulder Surgery. Journal of the American Academy of Orthopaedic Surgeons. 2018 Mar 1;26(5):E98–104.
7. Kim DH, Kim YS, Kim BS, Sung DH, Song KS, Cho CH. Is frozen shoulder completely resolved at 2 years after the onset of disease? Journal of Orthopaedic Science. 2020 Mar 1;25(2):224–8.
8. Hand C, Clipsham K, Rees JL, Carr AJ. Long-term outcome of frozen shoulder. J Shoulder Elbow Surg. 2008 Mar;17(2):231–6.
9. Zuckerman JD, Rokito A. Frozen shoulder: A consensus definition. J Shoulder Elbow Surg. 2011 Mar;20(2):322–5.
10. Neviaser AS, Neviaser RJ. Adhesive Capsulitis of the Shoulder. 2011.
11. Ryan V, Brown H, Minns Lowe CJ, Lewis JS. The pathophysiology associated with primary (idiopathic) frozen shoulder: A systematic review. BMC Musculoskelet Disord. 2016 Aug 15;17(1).
12. Rangan A, Gibson J, Brownson P, Thomas M, Rees J, Kulkarni R. Frozen Shoulder. Shoulder Elbow. 2015 Oct 1;7(4):299–307.
13. Rangan A, Brealey SD, Keding A, Corbacho B, Northgraves M, Kottam L, et al. Management of adults with primary frozen shoulder in secondary care (UK FROST): a multicentre, pragmatic, three-arm, superiority randomised clinical trial. Vol. 396, www.thelancet.com. 2020. Available from: www.thelancet.com
14. Itoi E, Arce G, Bain GI et al. Shoulder Stiffness: Current Concepts and Concerns. Vol. 32, Arthroscopy – Journal of Arthroscopic and Related Surgery. W.B. Saunders; 2016. p. 1402–14.
15. Cho CH, Lee YH, Kim DH, Lim YJ, Baek CS, Kim DH. Definition, diagnosis, treatment, and prognosis of frozen shoulder: A consensus survey of shoulder specialists. CiOS Clinics in Orthopedic Surgery. 2020;12(1):60–7.
16. Jones S, Hanchard N, Hamilton S, Rangan A. A qualitative study of patients’ perceptions and priorities when living with primary frozen shoulder. Available from: http://dx.doi.org/10.1136/
17. Chan HBY, Pua PY, How CH. Physical therapy in the management of frozen shoulder. Singapore Med J. 2017 Dec 1;58(12):685–9.
18. Lorbach O, Anagnostakos K, Scherf C, Seil R, Kohn D, Pape D. Nonoperative management of adhesive capsulitis of the shoulder: Oral cortisone application versus intra-articular cortisone injections. J Shoulder Elbow Surg. 2010 Mar;19(2):172–9.
19. Çelik D, Yasacı Z, Erşen A. Oral corticosteroids vs. exercises on treatment of frozen shoulder: a randomized, single-blinded study. J Shoulder Elbow Surg. 2023 Jun 1;32(6):1127–34.
20. Wang W, Shi M, Zhou C et al. Effectiveness of corticosteroid injections in adhesive capsulitis of shoulder. Vol. 96, Medicine (United States). Lippincott Williams and Wilkins; 2017.
21. Rouhani A, Mardani-Kivi M, Bazavar M et al. Calcitonin effects on shoulder adhesive capsulitis. European Journal of Orthopaedic Surgery and Traumatology. 2016 Aug 1;26(6):575–80.
22. Yang R, Deng H, Hou J et al. Investigation of salmon calcitonin in regulating fibrosis-related molecule production and cell-substrate adhesion in frozen shoulder synovial/capsular fibroblasts. Journal of Orthopaedic Research. 2020 Jun 1;38(6):1375–85.
23. Yu S, Hu R, Feng H, Huang D. Efficacy of platelet-rich plasma injection in the treatment of frozen shoulder: A systematic review and meta-analysis. J Back Musculoskelet Rehabil. 2023;36(3):551–64.
24. Gupta GK, Shekhar S, Haque ZU, Halder S, Manjhi AK, Rai A. Comparison of the Efficacy of Platelet-Rich Plasma (PRP) and Local Corticosteroid Injection in Periarthritis Shoulder: A Prospective, Randomized, Open, Blinded End-Point (PROBE) Study. Cureus. 2022 Sep 17;
25. Neviaser RJ, Neviaser TJ. The Frozen Shoulder Diagnosis and Management. Clin Orthop Relat Res. 1987. Oct;(223)59-64.