Einleitung
Der vorliegende Artikel befasst sich mit Ängsten und Befürchtungen von Menschen am Lebensende.1 Zunächst werden die Begriffe Angst und Furcht definiert und ihre Prävalenz am Lebensende dargestellt. Anschliessend werden die wichtigsten Angststörungen besprochen, und es wird auf die klinische Diagnostik von Angst und Furcht eingegangen. Wichtige Differenzialdiagnosen werden zusammenfassend dargestellt. Schliesslich werden pharmakologische, psychotherapeutische und andere nicht pharmakologische Behandlungen von Angst und Furcht am Lebensende besprochen.
Wenn sie unbehandelt bleiben, können Ängste und Befürchtungen zu erheblichen Beeinträchtigungen der körperlichen und psychosozialen Funktionen sowie zu einer verminderten Lebensqualität führen (3). Angststörungen korrelieren zudem beispielsweise mit erhöhtem Alkoholkonsum, Beziehungsproblemen, arbeitsbezogenen Problemen und Suizid (4–5).
Definition von Angst und Furcht
Angst und Furcht sind gleichzeitig sehr ähnliche, aber unterschiedliche Zustände (6). Furcht ist eine unangenehme emotionale Reaktion, die durch die Erwartung einer Gefahr ausgelöst wird (6) und Personen dazu motiviert, eine Bedrohung zu vermeiden. Im Gegensatz dazu wird Angst durch verallgemeinerte, unspezifische Bedrohungen des «Selbst» ausgelöst und geht mit Hypervigilanz einher (6). Anders formuliert ist Angst eine verallgemeinerte Reaktion auf eine unbekannte Bedrohung oder einen inneren Konflikt, während Furcht sich auf eine bekannte äussere Gefahr bezieht (7). Die evolutionäre Funktion sowohl von Angst als auch von Furcht bestand darin, vor einer Gefahr zu warnen oder auf die Notwendigkeit der Bewältigung eines Stressors hinzuweisen (8).
In der Palliative Care reicht das Spektrum von der Furcht vor dem Sterbeprozess im Zusammenhang mit einer fortschreitenden und/oder lebensbedrohlichen Erkrankung (z.B. Angst vor unaushaltbaren Schmerzen) bis hin zur Todesangst in Bezug auf das Unvorhersehbare. Der Tod wird in existenziellen Ansätzen der Psychotherapie auch als eines der «vier letzten Dinge» respektive der vier ultimativen Grundprobleme der menschlichen Existenz (engl. ultimate concerns – neben Freiheit, Isolation und Sinnlosigkeit) beschrieben (9), die man nicht einfach wegreden, wegerklären oder wegtherapieren kann, sondern gefühlt, durchlebt und ausgehalten werden müssen (10).
Pathologische Angst ist eine übermässige Reaktion auf externe Stressoren und/oder eine Reaktion auf nicht identifizierte interne Stressoren, die oft nicht vorübergehend, sondern dauerhaft ist und zu beeinträchtigter Bewältigung wie Vermeidung oder Rückzug führt (z.B. (11)). Die Symptome pathologischer Angst sind körperlicher (z.B. Tachykardie, Tachypnoe, Schwitzen, Durchfall, Schwindel), emotionaler (z.B. Nervosität, Angstgefühl, Gefühl des drohenden Untergangs), verhaltensbezogener (Vermeidung, Zwänge, psychomotorische Unruhe) und kognitiver Natur (z.B. Sorgen, Befürchtungen, Unsicherheit).
Prävalenz von Angststörungen
Angststörungen sind die häufigsten psychischen Erkrankungen in der Allgemeinbevölkerung, wobei je nach Studie zwischen 30 und 40 % aller Menschen irgendwann in ihrem Leben an einer Angststörung leiden (12). Die Prävalenz von Angstzuständen am Lebensende ist hoch: 70 % der Krebspatienten im fortgeschrittenen Stadium berichten über mässige bis schwere Angstzustände und bis zu 25 % der Patienten erfüllen die Kriterien für eine Angststörung (13–14). Oft gibt es jedoch keine Vorgeschichte einer diagnostizierten Angststörung, und es scheint so zu sein, dass nur ein kleiner Prozentsatz der Menschen vor einer Krebsdiagnose oder -behandlung Angstsymptome hat (15). Die spezifischen Angststörungen am Lebensende sind vielfältig, wobei häufige Störungen und Risikofaktoren in Tabelle 1 aufgeführt sind.
Arten von Angststörungen
Es existieren unterschiedliche Arten von Angststörungen. Zu den häufigsten Angststörungen, die am Lebensende auftreten, gehören Anpassungsstörungen mit Angst, Panikstörungen, posttraumatische Belastungsstörungen und generalisierte Angststörungen.
Nach dem Diagnostic and Statistical Manual of Mental Disorders (19) ist eine generalisierte Angststörung ein Zustand übermässiger Angst und Sorge (ängstliche Erwartung), der an mehr als sechs Tagen über mindestens sechs Monate hinweg auftritt und sich auf eine Reihe von Ereignissen oder Aktivitäten bezieht (z.B. Arbeits- oder Schulleistungen).
Eine Panikattacke ist das plötzliche Auftreten intensiver Angst, Besorgnis, Furcht, Schrecken oder eines Gefühls des drohenden Unheils, das in der Regel mit Symptomen wie Kurzatmigkeit, Herzklopfen, Brustschmerzen, einem Gefühl des Erstickens und der Angst, «verrückt zu werden» oder die Kontrolle zu verlieren, einhergeht, oft unerwartet «aus heiterem Himmel» und ohne erkennbaren Auslöser oder Hinweis (19). Panikattacken sind zeitlich begrenzt und dauern in der Regel 15 bis 20 Minuten. Eine Panikstörung wird diagnostiziert, wenn mehrere Panikattacken auftreten oder die Angst vor einer weiteren Attacke das psychosoziale Funktionieren erheblich einschränkt (19).
Eine Anpassungsstörung ist charakterisiert durch eine psychische Reaktion auf einen identifizierbaren Stressor, die zur Entwicklung klinisch signifikanter emotionaler Verhaltenssymptome führt, die jedoch für die Diagnose einer Angststörung nicht ausreicht (19). Viele Personen mit schweren medizinischen Erkrankungen können Schwierigkeiten haben, sich mental auf ihre Diagnose, Prognose oder auf Behandlungsmethoden einzustellen, was zu Angstsymptomen führt, die nicht das Niveau einer diagnostizierbaren Angststörung erreichen, aber dennoch Aufmerksamkeit durch Fachpersonen und möglicherweise eine Intervention erfordern.
Einige Menschen können im Zusammenhang mit ihrer Diagnose oder Behandlung eine Übererregung (engl. hyperarousal) entwickeln und Symptome einer posttraumatischen Belastungsstörung (PTBS) aufweisen oder sogar die Kriterien für die Diagnose erfüllen, d.h., sie erleben ein traumatisches Ereignis erneut mit Symptomen wie Übererregung, Albträumen, intrusiven Gedächtnisinhalten, Wiedererleben von Ereignissen, Hypervigilanz und Vermeidung von Erinnerungen an das traumatische Ereignis (19).
Angststörungen haben erhebliche Auswirkungen auf kranke Menschen am Lebensende, sowohl in Bezug auf das Erleben von Symptomen als auch auf ihre medizinische Versorgung. Angstpatienten berichten beispielsweise oft über ein geringeres Vertrauen in medizinische Fachpersonen, beeinträchtigte Interaktionen mit Fachpersonen, mehr Zweifel an Behandlungen und eine schlechtere körperliche Leistungsfähigkeit (18). Oft ist es schwierig, Angstzustände von anderen psychischen Störungen wie Depressionen oder medizinischen Symptomen der Grunderkrankung oder deren Behandlung zu unterscheiden. Gängige Symptome einer Depression wie Appetitlosigkeit, verminderte Libido, Reizbarkeit, Isolation und Schlaflosigkeit können auch Teil von Angstzuständen sein (20). Weitere körperliche Symptome, die mit Krankheiten in Verbindung stehen, sind bei Angstzuständen zudem häufig anzutreffen, darunter Herzklopfen, Dyspnoe und Hyperventilation, Magen-Darm-Beschwerden, Schwitzen, Kopfschmerzen, Muskelverspannungen, Benommenheit oder Schwindel und Müdigkeit (13, 21).
Angst und Furcht erkennen
Angstzustände werden oft immer noch entweder gar nicht oder nur unzureichend diagnostiziert. Das Erkennen von Angstzuständen kann schwierig sein, da Patientinnen und Patienten oft eine komplexe Mischung aus körperlichen und psychischen Symptomen präsentieren (20). Bei Patienten mit einer fortgeschrittenen, lebensbedrohlichen Krankheit und Angstsymptomen kann die Verunsicherung mit körperlichen, psychischen, sozialen, existenziellen, das Lebensende oder den Verlust bezogenen Problemen zusammenhängen (20). Darüber hinaus geht die Angst vor unkontrollierbaren Symptomen oder zunehmender Abhängigkeit manchmal einher mit einem verstärkten Wunsch nach einem frühzeitigen Tod (engl. hastened death) (22). Bei diesen Menschen stehen die somatischen Symptome der Angst oftmals im Vordergrund, sodass die Angststörung nicht primär als solche erkannt wird. Psychiatrische Fachpersonen können Palliative-Care-Teams dabei unterstützen, solche Symptome und deren Ursachen zu verstehen, oder helfen, eine allfällig zugrunde liegende Angststörung zu diagnostizieren und zu behandeln.
Angst und Furcht diagnostizieren
Interdisziplinäre Teams können dazu beitragen, die Beurteilung zu erleichtern. Eine ausführliche Anamnese und gezielte körperliche Untersuchung plus Laboruntersuchung bilden den Goldstandard bei der Diagnostik. Nicht nur die Informationen der Betroffenen, sondern auch Angaben ihrer Verwandten und Freunde können von unschätzbarem Wert sein. Eine solche Informationssammlung braucht Zeit, weshalb es bedeutsam ist, dass man wichtige Fragen stellt. Einige Ärztinnen und Ärzte verwenden Screening-Instrumente, wie zum Beispiel die Hospital Anxiety and Depression Scale (HADS), das am häufigsten untersuchte und auch in deutscher Sprache validierte Instrument (23–24); (deutsche Version siehe (25)), obwohl sich die meisten Fachpersonen auf gezielte Interviewfragen und erfahrene interdisziplinäre Teammitglieder verlassen, um wichtige Patienteninformationen zu erhalten.
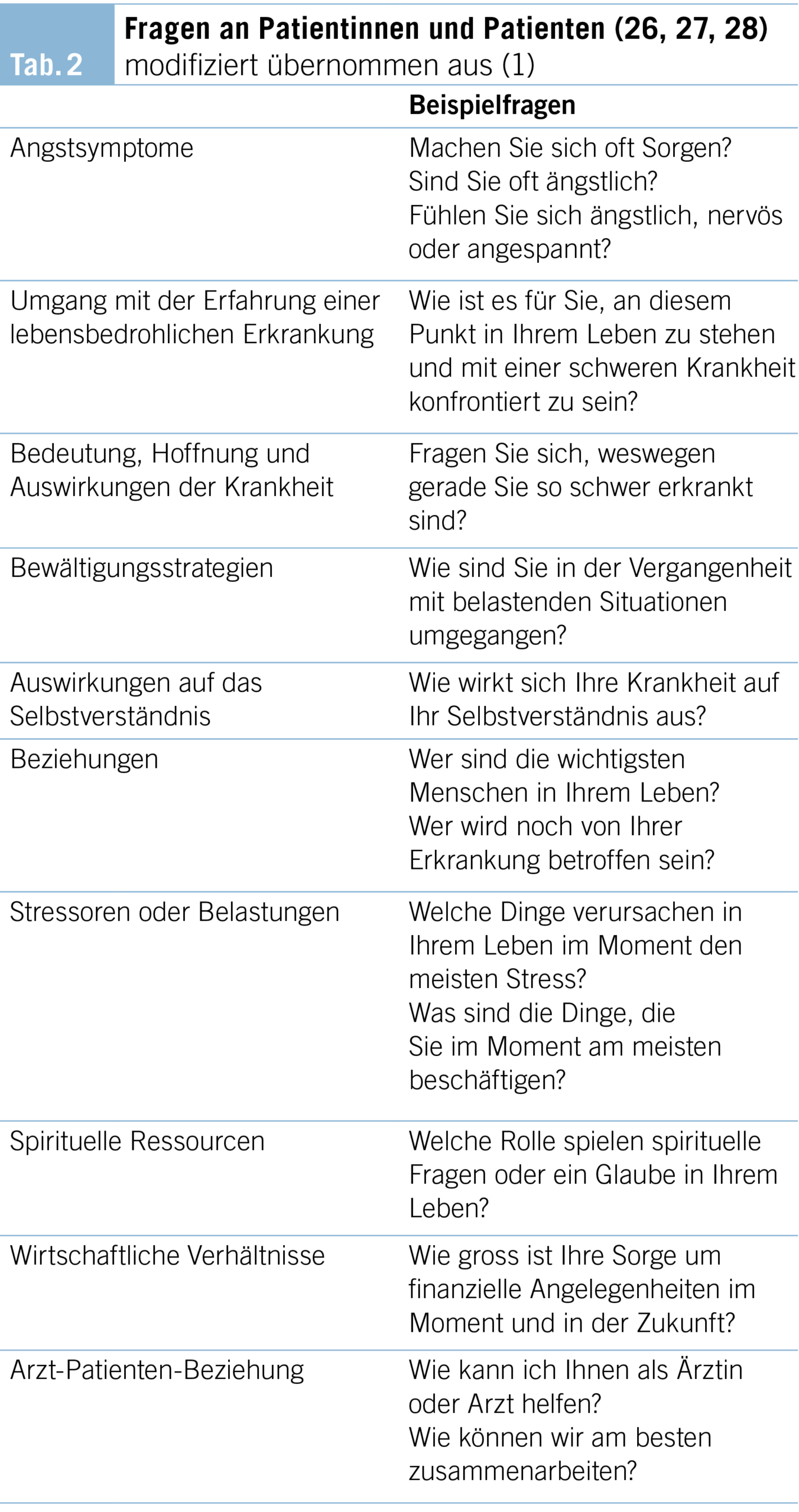
Tabelle 2 enthält Fragen, die – in einem ruhigen Setting gestellt – als Unterstützung für Gespräche dienen und Fachpersonen bei der Beurteilung von Ängsten und Befürchtungen sowie anderen damit verbundenen Themen unterstützen können.
Bei Betroffenen mit positivem Angstscreening müssen normale Ängste und Sorgen von pathologischen Ängsten unterschieden werden (13). Es sollte ein ausführliches Gespräch folgen, bei dem die Diagnosekriterien für Angststörungen und andere psychische Störungen geprüft werden und eine Überweisung an eine psychiatrische Fachperson erfolgt, falls diagnostische Klarheit erforderlich ist. Wichtig ist, dass eine Angststörung erst dann diagnostiziert werden sollte, wenn somatische Ursachen der Angst ausgeschlossen sind (Tab. 1).
Nach Schlüsselwörtern suchen
Obwohl Menschen mit schweren Erkrankungen häufig Angst und Furcht empfinden (13, 28), äussern viele Betroffene ihre Symptome gegenüber Fachpersonen nicht direkt und artikulieren ihre Erfahrungen nicht in Form leicht identifizierbarer Diagnosekriterien. Daher sollten Kliniker auf Schlüsselwörter achten, die oft auf zugrunde liegende Ängste und Befürchtungen hinweisen. Anderson und Kollegen (29) haben 415 Gespräche zwischen Patientinnen und Patienten mit Krebserkrankungen im fortgeschrittenen Stadium und Onkologen aufgezeichnet und festgestellt, dass Angst und Furcht die am häufigsten geäusserten Gefühle in diesen Gesprächen waren. Die Erkrankten benutzten dabei am häufigsten die Wörter «besorgt», «verängstigt», «betroffen» und «nervös», um ihre Erfahrung von Angst oder Furcht auszudrücken. Sich dieser Schlüsselwörter bewusst zu sein und darauf zu achten, ob sie in Gesprächen mit kranken Menschen vorkommen, kann dem Arzt helfen, das Vorhandensein von Ängsten zu erkennen.
Es ist zudem wichtig, die zwischenmenschlichen Verhaltensmuster von Menschen zu beachten, die wegen einer schweren Krankheit behandelt werden. Betroffene mit Angstzuständen können teilweise verwirrt und unfähig erscheinen, Informationen zu verarbeiten. Diese Menschen stellen möglicherweise immer wieder dieselben Fragen, haben Aufmerksamkeits- oder Gedächtnisprobleme oder zeigen Schwierigkeiten bei der Entscheidungsfindung, was bei ihnen selbst, ihren Angehörigen und beim Behandlungsteam zu Frustrationen führen kann. Menschen mit Angstzuständen können auch widersprüchliche Aussagen machen oder sogar misstrauisch erscheinen (26). Wie Betroffene auf das Behandlungsteam wirken und welche Reaktionen sie bei den sie betreuenden Fachpersonen auslösen, kann hinweisend sein für die zugrunde liegende Störung. Natürlich müssen bei den oben beschriebenen Verhaltensauffälligkeiten auch andere Differenzialdiagnosen, wie z.B. ein Delirium, erwogen werden.
Risikofaktoren und Ursachen von Angstzuständen
Angstsymptome können entweder im Rahmen somatischer Erkrankungen oder primärer Angststörungen oder auch anderer psychischer Störungen auftreten (13, 16–18), was die Unterscheidung noch schwieriger macht. Es lohnt sich, somatische Ursachen sorgfältig auszuschliessen, wenn keine persönliche oder familiäre Vorgeschichte von Angststörungen vorliegt und/oder wenn die Person auf frühere anxiolytische Behandlungen nicht angesprochen hat. Häufige Risikofaktoren und Ursachen von Angstzuständen am Lebensende finden sich in Tabelle 1.
Bei ernster Erkrankung können körperliche Beschwerden (oder somatische Symptome) Angst und Furcht auslösen. Zum Beispiel können Krebserkrankungen mit Veränderungen des Körperbildes einhergehen, die zu Angstsymptomen oder -störungen führen können. Bei Betroffenen mit Erkrankungen mit einem gewissen Rezidivrisiko werden ebenfalls oft Ängste ausgelöst, da diese Menschen sich immer wieder fragen, wann der «Krebs zurückkehren wird» oder ob der «Krebs wieder da ist» (30).
Das Symptom der Dyspnoe verdient besondere Aufmerksamkeit, da Atemnot Unbehagen, Angst und Beklemmung auslösen kann (31). Die Erfahrung von Atemnot löst nachweislich Angst und Furcht aus, selbst bei gesunden Probanden, die sich vollkommen bewusst sind, dass sie sich nicht in unmittelbarer Gefahr befinden (32). Das Symptom der Atemnot ist für Betroffene äusserst belastend. Daher ist es unabdingbar, die Auswirkungen der Atemnot auf die erkrankten Menschen regelmässig zu prüfen und entsprechende Massnahmen einzuleiten (31).
Behandlung von Angstzuständen bei Menschen am Lebensende
Wenn sie gezielt behandelt wird, bessert sich Angst oder Furcht bei den meisten Erkrankten; nur bei wenigen Menschen gelingt es jedoch, die Symptome vollständig zum Verschwinden zu bringen. Dies gilt insbesondere im Zusammenhang mit fortschreitenden, lebenslimitierenden Erkrankungen, was die Bedeutung einer kontinuierlichen Evaluation und Anpassung der Therapie unterstreicht (33). Fachpersonen können mit nicht pharmakologischen oder pharmakologischen Massnahmen arbeiten, wobei häufig eine Kombination am wirksamsten ist (26–27).
Auf die Grundhaltung kommt es an
Bei der Behandlung von schwer kranken ängstlichen Menschen kann die Bedeutung der Grundhaltung gar nicht hoch genug eingeschätzt werden. Der Zugang zu den Betroffenen mit Empathie und Respekt ist die Grundlage einer wirksamen Behandlung und Betreuung (34). Die Grundhaltung der Arztpersonen stärkt auch das Selbstwertgefühl und die Resilienz der Patientinnen und Patienten und mildert so deren Angstzustände. In einer Studie wurden die spezifischen Auswirkungen eines empathischen, patientenzentrierten Behandlungsansatzes bei Erkrankten mit fortgeschrittenem Dickdarmkrebs untersucht (35): Die patientenzentrierte Behandlung beinhaltete häufige Treffen mit der Arztperson, die Möglichkeit für die Betroffenen, an Behandlungsentscheidungen mitzuwirken (Shared Decision Making), umfassende Informationen über Diagnose und Prognose sowie nach Bedarf psychologische Unterstützung für die Erkrankten und deren Angehörige. Es wurde festgestellt, dass diese Art von engagiertem und personalisiertem Ansatz nicht nur die Lebensqualität verbessert, sondern auch Ängste verringert.
Psychotherapie und andere nicht pharmakologische Interventionen
Da es nur wenige spezifische Daten zur Wirksamkeit einer spezifischen Pharmakotherapie für Angst und Furcht am Lebensende gibt, werden Psychotherapie und psychosoziale Interventionen gegen Angst oft bevorzugt (36). Eine Psychotherapie kann für Personen mit leichten bis mittelschweren Angstsymptomen besonders hilfreich sein, wenn diese zuvor schon erfolgreich psychotherapeutisch behandelt wurden, unzureichend auf eine Pharmakotherapie ansprechen oder eine Abneigung gegen Medikamente haben sowie keine kognitiven Beeinträchtigungen aufweisen (17).
Eine Psychotherapie kann unter anderem das Gefühl der Selbstwirksamkeit und die Bewältigungsmöglichkeiten von Betroffenen verbessern und bietet gleichzeitig den Vorteil, dass eine Polypharmazie vermieden wird. Infrage kommen Einzel- oder Gruppenpsychotherapien, wobei es insbesondere auch um Beratung bezüglich Ernährung, Bewegung und Schlaf geht. Zu den evidenzbasierten Psychotherapien, die zur Behandlung von Angst und Furcht eingesetzt werden, gehören supportive Psychotherapie, kognitive Verhaltenstherapie und interpersonelle Therapie (26, 37); allerdings muss die Wirksamkeit dieser Behandlungen bei Menschen mit schweren Erkrankungen am Lebensende noch besser untersucht werden.
Für die Behandlung schwer kranker Menschen am Lebensende wurden spezifische Psychotherapieansätze entwickelt (38). Dazu gehören Managing Cancer and Living Meaningfully (CALM) (39), Dignity Therapy (40–41), Meaning-Centered Therapy (42) und Mindfulness-Based Supportive Therapy (MBST) (43). Der Vorteil dieser Behandlungen liegt in der gezielten Anwendbarkeit für schwer kranke Patientinnen und Patienten. CALM hat sich als vorteilhaft bei Todesangst erwiesen (39); in der Meaning-Centered Group Therapy zeigten die Erkrankten einen signifikanten Rückgang von Angst und dem Wunsch nach einem beschleunigten Tod (44); die Dignity Therapy führte zu einem signifikanten und nachhaltigen Rückgang der Angstsymptome (45).
Je näher der Zeitpunkt des Sterbens rückt, desto enger werden die Ziele der Psychotherapie und desto eher wird auch dabei ein palliativer Ansatz verfolgt (38), um das psychische und physische Wohlbefinden zu maximieren, indem Patientinnen und Patienten sowie ihre Familien im Rahmen der emotionalen und praktischen Vorbereitung auf den Tod unterstützt werden (17). Die Abbruchquoten von Psychotherapie am Lebensende sind hoch, weshalb die Häufigkeit und Dauer der geplanten Therapie sorgfältig abgewogen werden sollten (46).
Neben Psychotherapie können zahlreiche weitere nicht pharmakologische Interventionen eingesetzt werden, um Angst und Furcht von Menschen mit schweren Erkrankungen zu verringern. Zu den möglichen ergänzenden Therapien gehören Musiktherapie (47), Entspannungstraining (31), Achtsamkeitsmeditation (48) oder Kunsttherapie (49). Musiktherapie scheint vielversprechend zu sein, wenn es darum geht, Ängste abzubauen und die Lebensqualität von Patienten in der Palliative Care zu verbessern (47). Entspannungstraining ist weitverbreitet, zumal es oft relativ kostengünstig angeboten werden kann und langfristige Auswirkungen hat, wenn das Training über einen längeren Zeitraum hinweg konsequent praktiziert wird (31).
Auch körperliche Betätigung kann sich als nützlich erweisen, selbst bei Schwerkranken. Bewegung kann Sorgen und Ängste verringern und gleichzeitig das allgemeine Befinden verbessern. Bewegung kann auch dazu dienen, ein Gefühl von Autonomie, Selbstwirksamkeit, Kontrolle oder Erfolg zu vermitteln. Bettlägerige Erkrankte können ebenso von Bewegungen profitieren, selbst wenn es sich dabei oftmals nur um passive Bewegungsabläufe handelt.
Es lohnt sich auch, sich gemeinsam mit den Betroffenen anzuschauen, ob eine Reduktion des Konsums von Kaffee und Alkohol einen Einfluss auf das Symptom der Angst hat. Dies kann dazu beitragen festzustellen, ob eine Verringerung des Konsums dieser Substanzen die begleitenden Ängste verringern könnte.
Ein Schlafhygieneprotokoll kann hilfreich sein, um Schlafstörungen zu erfassen, die wiederum Auswirkungen auf die Angstsymptomatik haben können. Schliesslich kann eine Psychoedukation über den allgemeinen Verlauf einer schweren Krankheit und darüber, was in den einzelnen Stadien zu erwarten ist, das Ausmass der Angst und Sorge der Patientinnen und Patienten weiter verringern (27).
Pharmakologische Interventionen
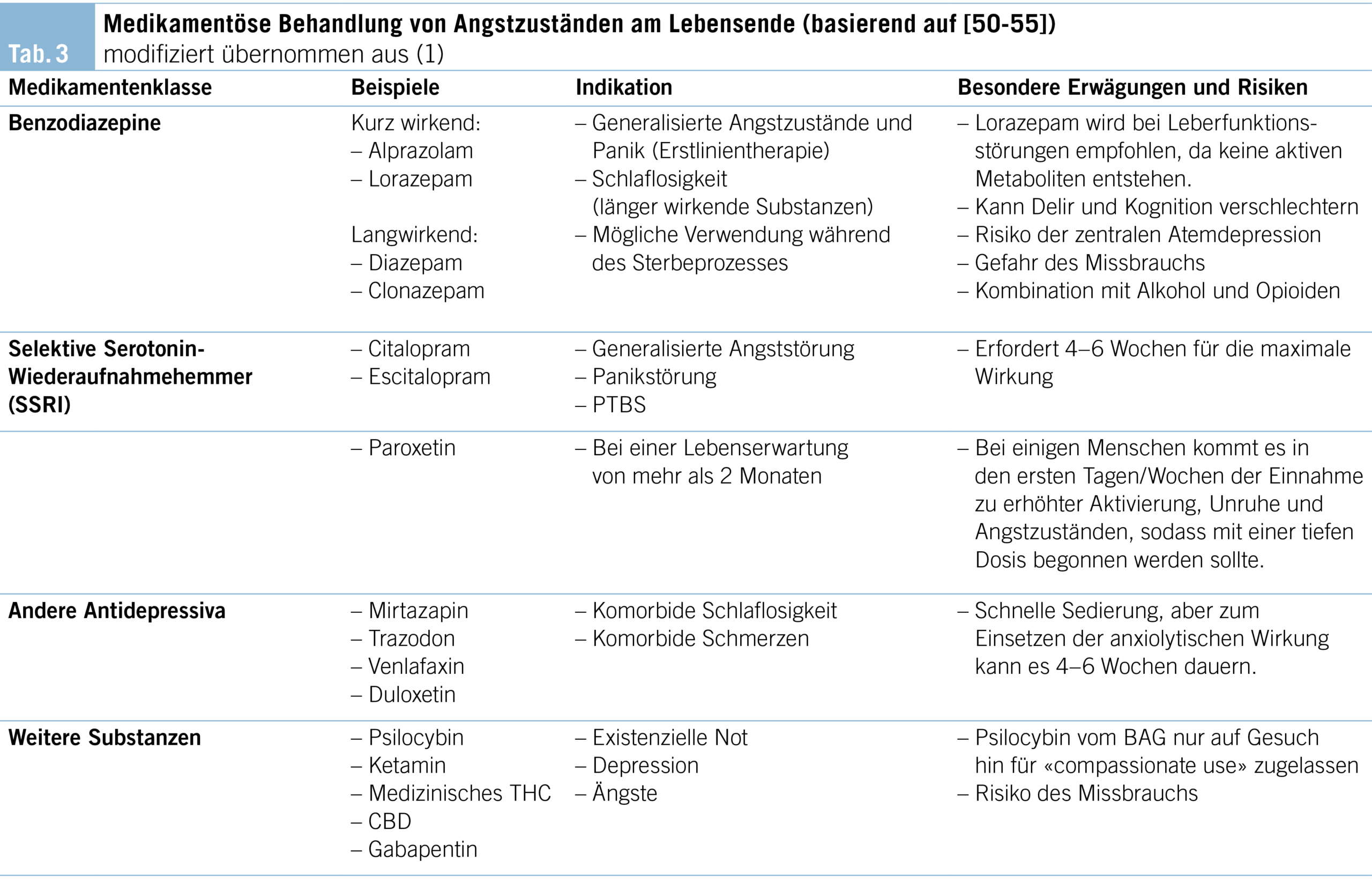
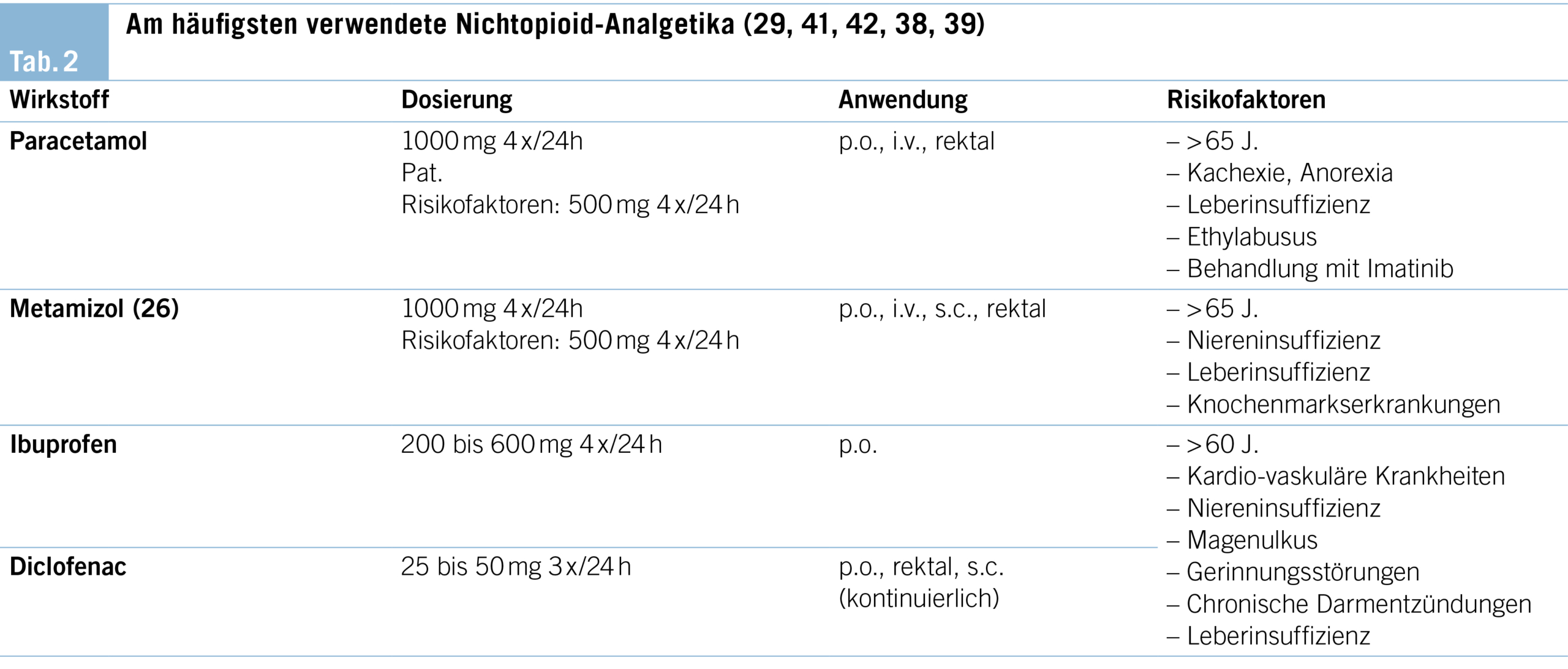
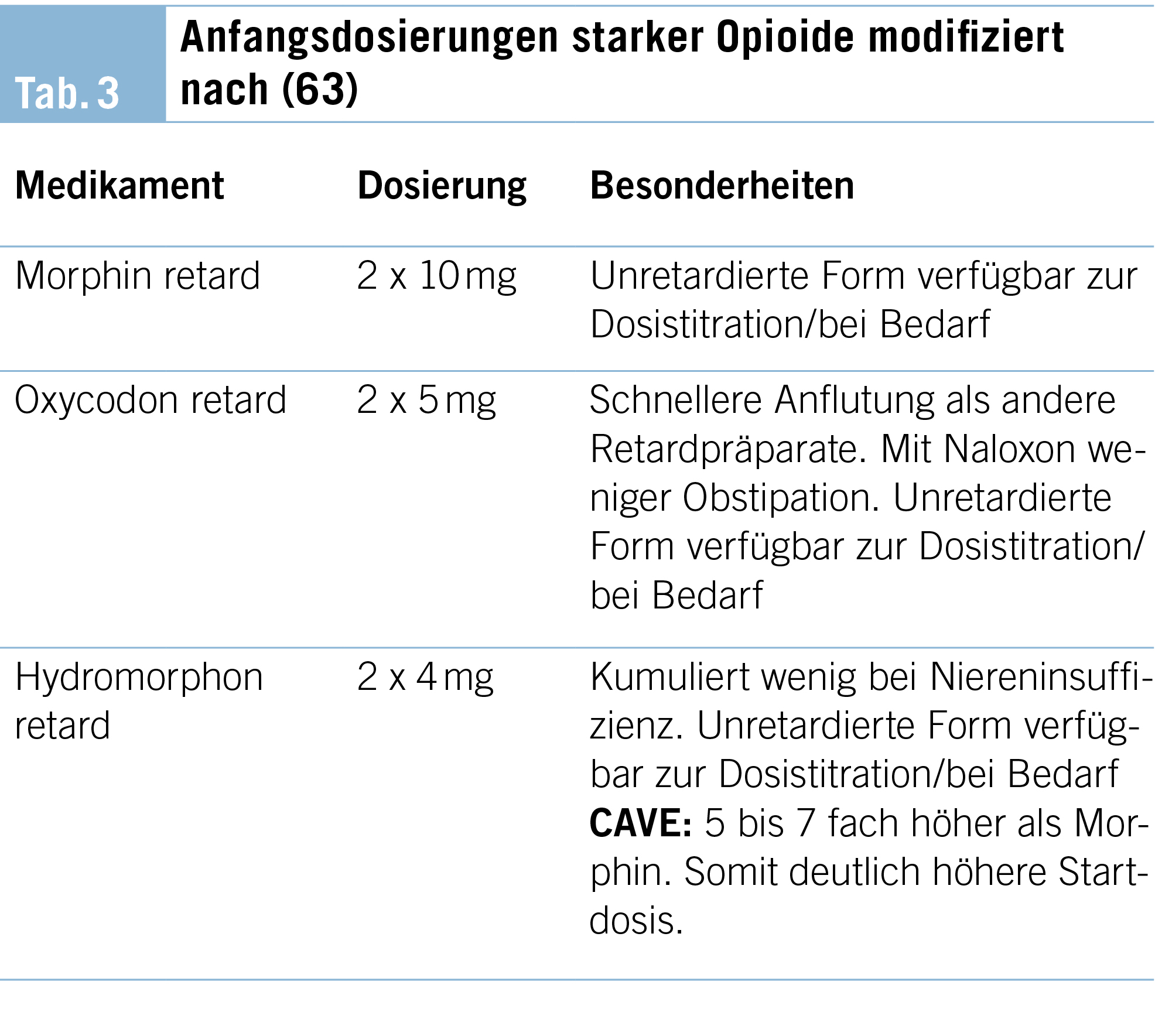
Die Behandlung von Angstzuständen ist in der Regel am wirksamsten, wenn psychotherapeutische und pharmakologische Ansätze kombiniert werden. Einen Überblick über die medikamentöse Behandlung von Angstzuständen am Lebensende einschliesslich differenzierter Indikationen und Risiken gibt Tabelle 3. Die Dosierung und die Verabreichungswege einiger der gängigsten Medikamente für Menschen mit schweren Erkrankungen und Angstzuständen sind in Tabelle 4 aufgeführt.
Wie in allen Bereichen der Palliative Care müssen die Funktionseinschränkungen der Betroffenen, ihre Lebenserwartung und die im Vordergrund stehenden Symptome berücksichtigt werden, um die optimale Behandlung der Angstzustände zu ermitteln.
Bisher gibt es keine sorgfältig durchgeführten und aussagekräftigen Studien, die es erlauben würden, bestimmte Pharmaka spezifisch bei Angstzuständen in der Palliative Care zu empfehlen (36). Daher basieren aktuelle Empfehlungen auf Studien, in denen die Behandlung von Angstzuständen bei anderen Erkrankungen (z.B. bei Tumorerkrankungen) untersucht wurde, allerdings nicht in palliativen Situationen (13, 16, 18). Begrenzt veröffentlichte Literatur und Expertenmeinungen positionieren Benzodiazepine und selektive Serotonin-Wiederaufnahmehemmer (SSRI) als Erstlinienbehandlung von Angstsymptomen bei progressiven und/oder lebensbedrohlichen Erkrankungen sowie Krebs (2, 24, 36).
Selektive Serotonin-Wiederaufnahme- hemmer (SSRI)
Wie bei depressiven Störungen gibt es für SSRI auch eine Evidenzbasis für Angstzustände im Allgemeinen. Zudem sind sie generell gut verträglich. Daher gelten sie heute als Mittel der Wahl bei der Behandlung chronischer Angstzustände. Allerdings ist der Nutzen von Antidepressiva einschliesslich SSRI zur Behandlung von Angstzuständen bei Menschen am Lebensende oft begrenzt, da es in der Regel 4–6 Wochen dauert, bis sie ihre maximale Wirkung entfalten (56). Bei diesen Erkrankten müssen Ärztinnen und Ärzte abwägen zwischen der Notwendigkeit, die Symptome kurzfristig zu lindern, und der Wahl einer Medikamentenklasse, die erst nach mehreren Wochen ihre Wirkung entfaltet. Bei schweren Angstzuständen können SSRI und Benzodiazepine zusammen gestartet werden, wobei die Benzodiazepine ausgeschlichen werden, sobald die SSRI ihre therapeutische Wirkung entfaltet haben.
Paroxetin (10–50 mg täglich) wird im Vergleich zu einigen anderen SSRI häufig zur Behandlung chronischer Angstzustände eingesetzt, da es eher sedierend und beruhigend wirkt. Andere SSRI, die in dieser Gruppe häufig eingesetzt werden, sind Citalopram (10–60 mg täglich) und Escitalopram (5–20 mg täglich). Eine weitere Möglichkeit sind selektive Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRI) wie Venlafaxin (35–300 mg täglich). Sedierende Antidepressiva wie Trazodon oder Mirtazapin können Menschen mit anhaltenden Angstzuständen und Schlaflosigkeit helfen.
Benzodiazepine
Benzodiazepine haben viele Indikationen in der Onkologie und Palliative Care. Sie zeigen einen raschen Wirkungseintritt und Wirksamkeit bei generalisierten Angstzuständen, Panik und Schlaflosigkeit sowie einen potenziellen Nutzen bei Übelkeit und Dyspnoe (2, 24). Während das Risiko einer Abhängigkeit am Lebensende keine grosse Rolle spielt, sollte das Risiko für kognitive und motorische Nebenwirkungen ernst genommen werden, z.B. Sedierung, Stürze, Verwirrung und Aufmerksamkeitsdefizite (2, 20). Wie bei Medikamenten mit anticholinerger Wirkung besteht zudem das Risiko, dass Benzodiazepine ein Delirium auslösen respektive Symptome eines bestehenden Deliriums oder einer Demenz verschlimmern (23). Weitere Risiken von Benzodiazepinen bestehen darin, dass andere Medikamente mit dämpfender Wirkung auf das zentrale Nervensystem diese Wirkung von Benzodiazepinen verstärken können. Zudem können einige Benzodiazepine bei Erkrankten mit Leberfunktionsstörungen akkumulieren (z.B. Diazepam).
In den meisten Fällen werden Benzodiazepine auf der Grundlage der Halbwertszeit ausgewählt. Je länger die Halbwertszeit, desto nachhaltiger ist die Wirkung des Medikaments (z.B. Clonazepam (t1/2 = 30–40 Stunden; 0.5–2 mg p.o. täglich bis 2x täglich nach Bedarf). Medikamente mit einer Halbwertszeit von mehr als ein oder zwei Tagen wie Clonazepam oder Diazepam können akku
mulieren, was zu zunehmenden Nebenwirkungen und Toxizität führt; sie gehen jedoch weniger oft mit Entzugssymptomen einher.
Kürzer wirkende Benzodiazepine (z.B. Lorazepam, t1/2 = 12 Stunden; 0.25–2 mg p.o., s.l. 6x täglich nach Bedarf; Alprazolam t1/2 = 11.2 Stunden) können öfter verabreicht werden und sind nicht nur bei Angst- und Panikattacken nützlich, sondern können auch antizipatorisch Übelkeit lindern. Benzodiazepine mit sehr kurzen Halbwertszeiten (z.B. Oxazepam t1/2 = 2.8–8.6 Stunden; Midazolam t1/2 = 0.8–1 Stunde) sind für die Behandlung der meisten Angstzustände am Lebensende nicht geeignet, da sie nur für kurze Zeit wirken und mit einem höheren Risiko von Rebound-Angst- und Entzugssymptomen einhergehen.
Betroffene mit eingeschränkter Leberfunktion sollen mit Lorazepam, Oxazepam oder Temazepam behandelt werden, da diese Medikamente durch Konjugation metabolisiert werden und keine aktiven Metaboliten haben.
Manchmal können Angstsymptome auch durch andere Prozesse ausgelöst werden, etwa durch ein Delirium oder Dyspnoe. In diesen Fällen kann die Angst durch spezifische Behandlungen angegangen werden, z.B. durch die Behebung der Ursache eines Deliriums, die Behandlung der Symptome eines Deliriums mit einem Antipsychotikum oder durch den Einsatz von Opioiden zur Behandlung von Dyspnoe.
Andere Medikamente
Häufig bergen Standard-Anxiolytika entweder ein erhebliches Risiko für unerwünschte Wirkungen bei Menschen mit fortgeschrittener, lebensbedrohlicher Krankheit oder wirken nicht schnell genug. Gabapentin (100 mg, 1x stündlich nach Bedarf bis zu einer Tageshöchstdosis von 3600 mg täglich) und Trazodon (25 mg, 1x täglich vor dem Schlafengehen nach Bedarf bei Angst oder Unruhe, und 25–100 mg vor dem Schlafengehen bei Schlaflosigkeit) sind oft wirksame Alternativen und bergen ein geringeres Risiko für unerwünschte Wirkungen.
Trotz des nach wie vor relativen Mangels an evidenzbasierten Medikamenten zur Behandlung von Angstzuständen in der Palliative Care zeigten einige Substanzen wie Ketamin, Psilocybin und medizinisches THC/CBD ermutigende Ergebnisse in einigen kleineren Studien zur Behandlung von Angstzuständen am Lebensende (2, 52–53, 55).
Leiter Abteilung Klinische Ethik
Spitalstrasse 22
4031 Basel
Schweiz
manuel.trachsel@usb.ch
Cedars-Sinai Cancer and Department of Psychiatry and Behavioral Neurosciences,
Cedars-Sinai Health System,
Los Angeles,
USA
Department of Psychiatry
University of Manitoba
CancerCare Manitoba
Winnipeg
Canada
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Trachsel M, Chochinov MH, Irwin, SA. Anxiety and fear in patients with serious illness facing the end of life. In: Goldstein NE, Woodrell CD, Morrison RS, editors. Evidence-Based Practice of Palliative Medicine, 2nd Edition. Elsevier; 2024.
2. Irwin SA, Fairman N, Samsel C, Hirst J, Webb JA, Trachsel M. Psychological and psychiatric aspects of palliative and end-of-life care: Synergies between psycho-oncology and palliative care. In: Breitbart WS, Butow P, Jacobsen P, Lam, W, Lazenby M, Loscalzo M, editors. Psycho-Oncology. 4th edition. Oxford: Oxford University Press; 2021.
3. Hui D, Bruera E. Integrating palliative care into the trajectory of cancer care. Nat Rev Clin Oncol. 2016;13(3):159–171.
4. Bauer MS, Altshuler L, Evans DR, Beresford T, Williford WO, Hauger R, et al. Prevalence and distinct correlates of anxiety, substance, and combined comorbidity in a multi-site public sector sample with bipolar disorder. J Affect Disord. 2005;85(3):301–15.
5. Conway KP, Compton W, Stinson FS, Grant BF. Lifetime comorbidity of DSM-IV mood and anxiety disorders and specific drug use disorders: results from the National Epidemiologic Survey on Alcohol and Related Conditions. J Clin Psychiatry. 2006;67(2):247–257.
6. MacLeod AD. Fear in palliative care. Prog Palliat Care. 2017;25(6):273–278.
7. Steimer T. The biology of fear- and anxiety-related behaviors. Dialogues Clin Neurosci. 2002;4(3):231–249.
8. Beck ATEGGRL. Anxiety disorders and phobias: a cognitive perspective. Cambridge, MA: Basic Books; 2005.
9. Yalom ID. Existential psychotherapy. New York: Basic Books; 1980.
10. Schneider KJ, Krug OT. Theories of psychotherapy. Existential-humanistic therapy. American Psychological Association: 2010.
11. Alici Y, Levin TT. Anxiety Disorders. In: Holland C, Breitbart WS, Jacobsen PB, Lederberg MS, Loscalzo MJ, McCorkle R, editors Psychooncology. 2nd edition New York: Oxford University Press.
12. Bandelow B, Michaelis S. Epidemiology of anxiety disorders in the 21st century. Dialogues Clin Neurosci. 2015;17(3):327–335.
13. Ford JA. The complexity of assessment and treatment for anxiety in patients with a terminal illness. J Hosp Pall Nurs. 2016;18:131–138.
14. Wilson KG, Chochinov HM, Skirko MG, et al. Depression and anxiety disorders in palliative cancer care. J Pain Symptom Manage. 2007;33(2):118–129.
15. Shalev AY, Schreiber S, Galai T, Melmed RN. Post-traumatic stress disorder following medical events. Br J Clin Psychol. 1993;32(2):247–253.
16. Kolva E, Rosenfeld B, Pessin H, Breitbart W, Brescia R. Anxiety in terminally ill cancer patients. J Pain Symptom Manage. 2011;42(5):691–701.
17. Roth AJ, Massie MJ. Anxiety and its management in advanced cancer. Curr Opin Support Palliat Care. 2007;1(1):50–56.
18. Spencer R, Nilsson M, Wright A, Pirl W, Prigerson H. Anxiety disorders in advanced cancer patients: correlates and predictors of end-of-life outcomes. Cancer. 2010;116(7):1810–1819.
19. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th edition. Arlington, VE: American Psychiatric Publishing; 2013.
20. Roth AJ, Massie MJ. Anxiety in Palliative Care. In: Chochinov HM, Breitbart W, editors. Handbook of psychiatry in palliative medicine. 2nd edition. New York: Oxford University Press; 2012. 69–80.
21. Delgado-Guay M, Parsons HA, Li Z, Palmer JL, Bruera E. Symptom distress in advanced cancer patients with anxiety and depression in the palliative care setting. Support Care Cancer. 2009;17(5):573–579.
22. Balaguer A, Monforte-Royo C, Porta-Sales J, et al. An International Consensus Definition of the Wish to Hasten Death and Its Related Factors [published correction appears in PLoS One. 2018 Apr 26;13(4):e0196754].
23. Mitchell AJ, Meader N, Symonds P. Diagnostic validity of the Hospital Anxiety and Depression Scale (HADS) in cancer and palliative settings: a meta-analysis. J Affect Disord. 2010;126(3):335–348
24. Traeger L, Greer JA, Fernandez-Robles C, Temel JS, Pirl WF. Evidence-based treatment of anxiety in patients with cancer. J Clin Oncol. 2012;30(11):1197-1205.
25. Herrmann-Lingen C, Buss U, Snaith RP. Hospital Anxiety and Depression Scale – Deutsche Version. 4. Auflage. Bern: Huber; 2018.
26. Block SD. Psychological issues in end-of-life care. J Palliat Med. 2006;9(3):751-772.
27. Emanuel LL, Ferris FD, von Gunten, CF, Von Roenn J. EPEC-O: Education in palliative and end-of-life care for oncology, Module 3c: Symptoms-Anxiety. Chicago, IL: The EPEC Project; 2005.
28. Fava GA, Porcelli P, Rafanelli C, Mangelli L, Grandi S. The spectrum of anxiety disorders in the medically ill. J Clin Psychiatry. 2010;71(7):910-914.
29. Anderson WG, Alexander SC, Rodriguez KL, et al. „What concerns me is…“ Expression of emotion by advanced cancer patients during outpatient visits. Support Care Cancer. 2008;16(7):803-811.
30. Goldstein NE, Genden E, Morrison RS. Palliative care for patients with head and neck cancer: „I would like a quick return to a normal lifestyle“. JAMA. 2008;299(15):1818-1825.
31. Gilman SA, Banzett RB. Physiologic changes and clinical correlates of advanced dyspnea. Curr Opin Support Palliat Care. 2009;3(2):93-97.
32. Banzett RB, Pedersen SH, Schwartzstein RM, Lansing RW. The affective dimension of laboratory dyspnea: air hunger is more unpleasant than work/effort. Am J Respir Crit Care Med. 2008;177(12):1384-1390.
33. Gorman JM. Treatment of generalized anxiety disorder. J Clin Psychiatry. 2002;63 Suppl 8:17-23.
34. Chochinov HM. Dignity and the essence of medicine: the A, B, C, and D of dignity conserving care. BMJ. 2007;335(7612):184-187.
35. Popa-Velea O, Cernat B, Tambu A. Influence of personalized therapeutic approach on quality of life and psychiatric comorbidity in patients with advanced colonic cancer requiring palliative care. J Med Life. 2010;3(3):343-347.
36. Salt S, Mulvaney CA, Preston NJ. Drug therapy for symptoms associated with anxiety in adult palliative care patients. Cochrane Database Syst Rev. 2017;5(5):CD004596.
37. Ayers CR, Sorrell JT, Thorp SR, Wetherell JL. Evidence-based psychological treatments for late-life anxiety. Psychol Aging. 2007;22(1):8-17.
38. Gramm J, Trachsel M, Berthold D. Psychotherapeutic work in palliative care. Verhaltenstherapie. 2022;32(1):44–53
39. Lo C, Hales S, Jung J, et al. Managing Cancer And Living Meaningfully (CALM): phase 2 trial of a brief individual psychotherapy for patients with advanced cancer. Palliat Med. 2014;28(3):234-242.
40. Chochinov HM. Dignity-conserving care–a new model for palliative care: helping the patient feel valued. JAMA. 2002;287(17):2253-2260.
41. Chochinov HM, Hack T, Hassard T, Kristjanson LJ, McClement S, Harlos M. Dignity therapy: a novel psychotherapeutic intervention for patients near the end of life. J Clin Oncol. 2005;23(24):5520-5525.
42. Breitbart W, Poppito S, Rosenfeld B, et al. Pilot randomized controlled trial of individual meaning-centered psychotherapy for patients with advanced cancer. J Clin Oncol. 2012;30(12):1304-1309.
43. Beng TS, Chin LE, Guan NC, et al. Mindfulness-based supportive therapy (MBST): proposing a palliative psychotherapy from a conceptual perspective to address suffering in palliative care. Am J Hosp Palliat Care. 2015;32(2):144-160.
44. Breitbart W, Rosenfeld B, Pessin H, Applebaum A, Kulikowski J, Lichtenthal WG. Meaning-centered group psychotherapy: an effective intervention for improving psychological well-being in patients with advanced cancer. J Clin Oncol. 2015;33(7):749-754.
45. Julião M, Barbosa A, Oliveira F, Nunes B, Vaz Carneiro A. Efficacy of dignity therapy for depression and anxiety in terminally ill patients: early results of a randomized controlled trial. Palliat Support Care. 2013;11(6):481-489.
46. Moorey S, Cort E, Kapari M, et al. A cluster randomized controlled trial of cognitive behaviour therapy for common mental disorders in patients with advanced cancer. Psychol Med. 2009;39(5):713-723.
47. Hilliard RE. Music Therapy in Hospice and Palliative Care: a Review of the Empirical Data. Evid Based Complement Alternat Med. 2005;2(2):173-178.
48. Jain S, Shapiro SL, Swanick S, et al. A randomized controlled trial of mindfulness meditation versus relaxation training: effects on distress, positive states of mind, rumination, and distraction. Ann Behav Med. 2007;33(1):11-21.
49. Barraclough J. ABC of palliative care. Depression, anxiety, and confusion. BMJ. 1997;315(7119):1365-1368.
50. Daud ML. Drug management of terminal symptoms in advanced cancer patients. Curr Opin Support Palliat Care. 2007;1(3):202-206.
51. Grob CS, Danforth AL, Chopra GS, et al. Pilot study of psilocybin treatment for anxiety in patients with advanced-stage cancer. Arch Gen Psychiatry. 2011;68(1):71-78.
52. Irwin SA, Iglewicz A. Oral ketamine for the rapid treatment of depression and anxiety in patients receiving hospice care. J Palliat Med. 2010;13(7):903-908.
53. Irwin SA, Iglewicz A, Nelesen RA, et al. Daily oral ketamine for the treatment of depression and anxiety in patients receiving hospice care: a 28-day open-label proof-of-concept trial. J Palliat Med. 2013;16(8):958-965.
54. Irwin SA, Hirst J, Fairman N, Prommer E. Ketamine for the management of depression in palliative care: An update on the science. J Pain Symptom Manage. 2013;4w5(2):371-371.
55. Ross S, Bossis A, Guss J, et al. Rapid and sustained symptom reduction following psilocybin treatment for anxiety and depression in patients with life-threatening cancer: a randomized controlled trial. J Psychopharmacol. 2016;30(12):1165-1180.
56. Rayner L, Price A, Evans A, Valsraj K, Hotopf M, Higginson IJ. Antidepressants for the treatment of depression in palliative care: systematic review and meta-analysis. Palliat Med. 2011;25(1):36-51.