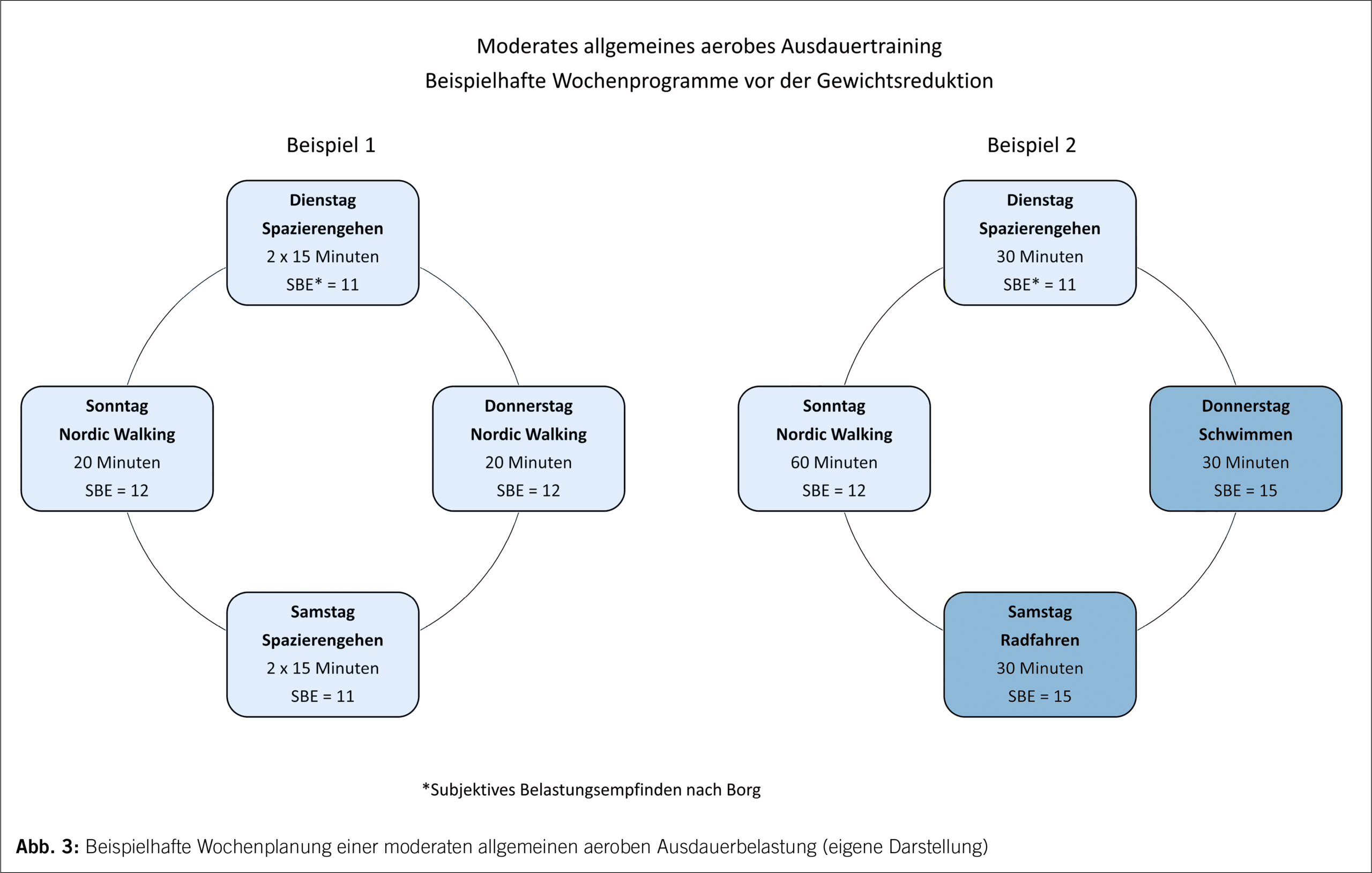
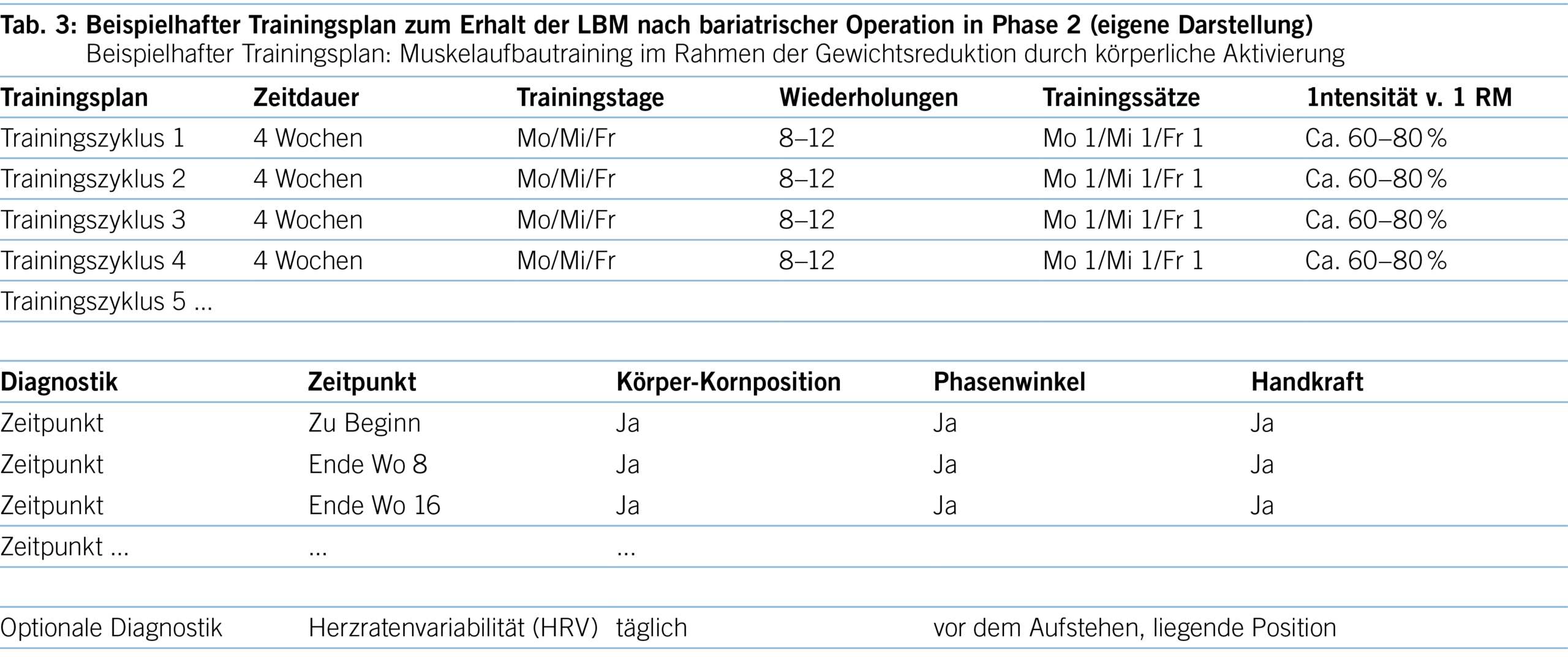
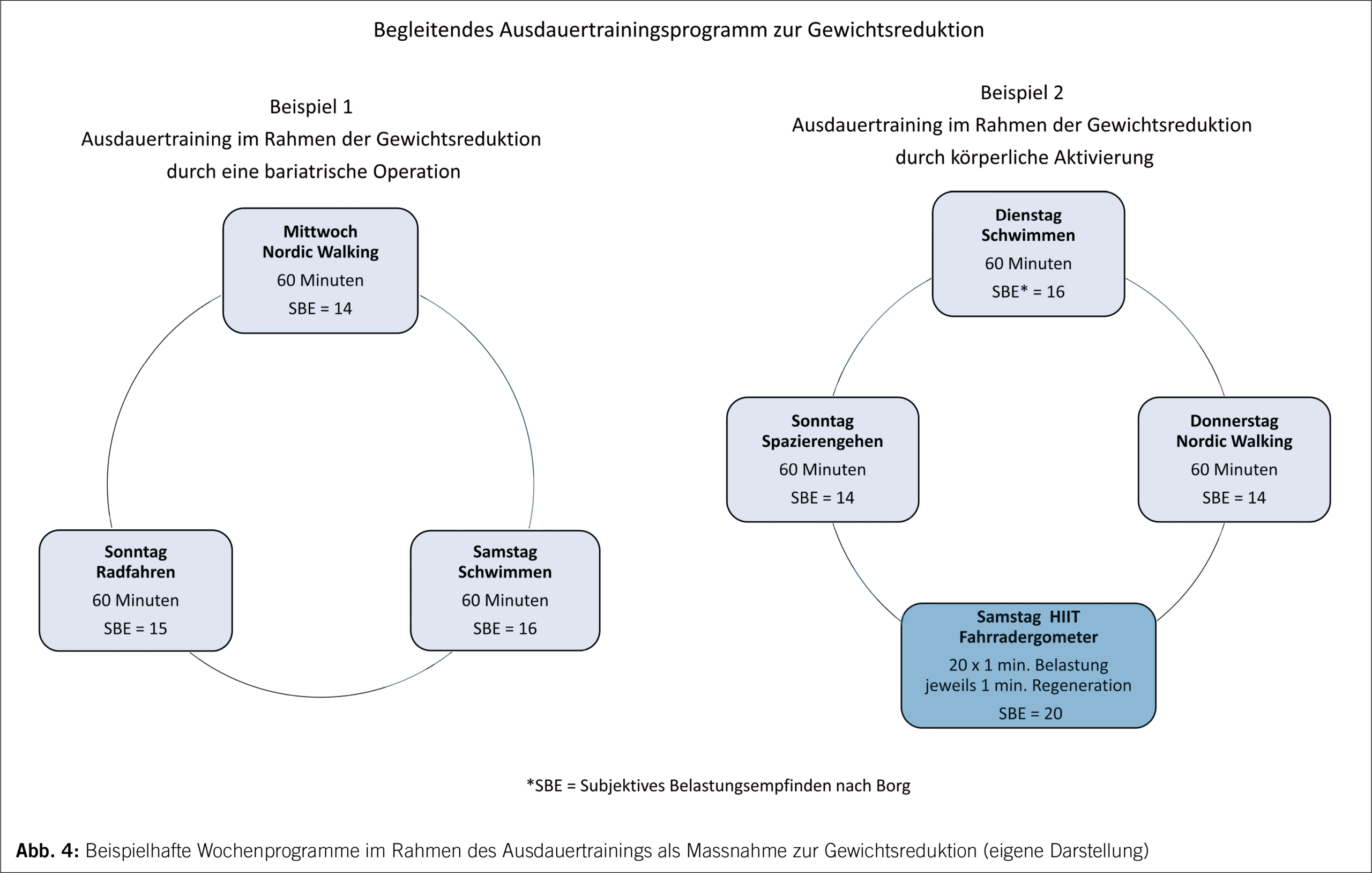
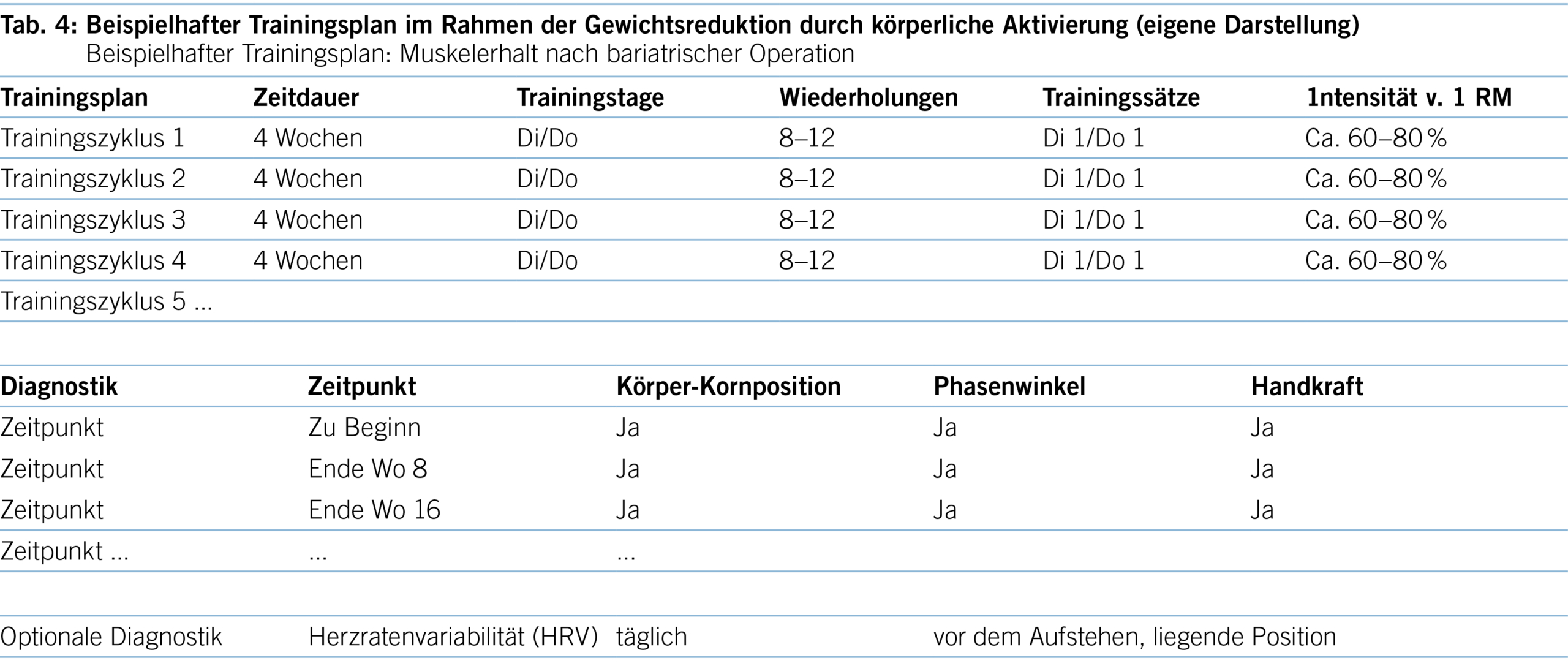
Einleitung
Das Thema Tod und Sterben begleitet uns in der Betreuung und Begleitung schwer kranker Patient/-innen und bewegt uns – bewusst oder unbewusst. Dennoch spricht man im klinischen Kontext kaum darüber. Für viele Patient/-innen ist es schwierig, über das eigene Ableben nachzudenken, mit Patient/-innen wird die Thematisierung des Lebensendes wenn möglich vermieden. Auch für Angehörige ist es schwierig, mit ihren Liebsten über den Tod zu sprechen. Mit Berufskolleg/-innen wird selten über die Bedeutung des Sterbens und des Todes für Patient/-innen und deren Angehörige sowie für die eigene berufliche Tätigkeit reflektiert. Lieber versucht man, über weitere Therapieoptionen nachzudenken aus Sorge, die Konfrontation mit dem Lebensende könnte die therapeutische Beziehung zu stark belasten (2). In den zeitlich eng getakteten Tagesabläufen tendiert man, dieses Thema aus Sorge vor Reaktionen und möglichen emotionalen Ausbrüchen der Patient/-innen zu meiden. Eine mangelnde Schulung und Erfahrung in der Gesprächsführung kann es ebenfalls erschweren, sich gegenüber dem Sterben und dem Tod im Gespräch mit Patient/-innen zu öffnen (3). Letztlich dient die Vermeidung von Endlichkeit, Sterben und Tod dem Selbstschutz vor starken Gefühlen und dem schmerzhaften Abschiednehmen von unseren Patient/-innen (4).
Die Auseinandersetzung mit dem Lebensende ist für schwer kranke Menschen in existenzieller Hinsicht schwierig. Viele scheuen sich, das nahende Lebensende und Ängste in Zusammenhang mit dem Sterben und dem Tod offen mit ihrem Arzt/Ärztin anzusprechen aus Furcht vor einem Abbruch der medizinischen Behandlung oder therapeutischen Beziehung (5). Viele kranke Menschen entwickeln aufgrund des Verschweigens des sich aufdrängenden und unausweichlichen Lebensendes diffuse Ängste, existenziellen Distress sowie Verleugnung (Denial) (6). Diese Angstbewältigung kann zu zwei diametral verschiedenen Phänomenen führen: einerseits zum Wunsch nach einem raschen Versterben, andererseits zur Entscheidung für aggressive und belastende Therapien am Lebensende, welche in der Folge mit hoher Symptomlast und eingeschränkter Lebensqualität einhergeht (7, 8). Beide Verhaltensweisen sind Ausdruck eines verzweifelten (dysfunktionalen) Bewältigungsversuchs. Auch pflegende Angehörige finden sich häufig in einem Zwiespalt zwischen Fürsorge und Sorge um die kranke Person und der Überforderung mit eigenen Gefühlen wieder. Sie sprechen kaum über ihr Erleben, ihre Sorgen und Ängste in Bezug auf das nahende Lebensende der geliebten Person (3). Die fehlende Auseinandersetzung mit dem Tod und Sterben im Verlaufe einer komplexen medizinischen Behandlung kann dazu führen, dass auch Angehörige auf die Fortführung aggressiver Therapien am Lebensende drängen und das Gespräch über das nahende Lebensende erschwert wird (9).
Obwohl das Sterben Kernbestandteil des menschlichen Lebens ist, macht es uns Angst. Die Angst vor dem Tod ist universell und beschäftigt jede Person mit seiner latenten Präsenz und Bedrohung auf unterschiedliche Weise (10). Unterschiedliche wissenschaftliche Gebiete, darunter die Medizin, die Theologie, die Philosophie, die Rechts-, Natur- und Sozialwissenschaften, aber auch die Literatur, die Kunst und die Musik haben versucht, den Tod verständlich zu machen (11). Die Arbeit mit unseren Patient/-innen zeigt uns allerdings auf, dass es häufig nicht der Tod, sondern das Sterben ist, wovor sich die Menschen fürchten.
In diesem Artikel gehen wir unter Beleuchtung unterschiedlicher Perspektiven der Frage nach, warum wir uns vor dem Sterben und dem Tod fürchten, ob und wie man das Sterben lernen kann und wie eine Auseinandersetzung mit der Endlichkeit des Lebens gelingen kann. Wir verfolgen die These, dass die Auseinandersetzung mit der eigenen Sterblichkeit und der Vergänglichkeit einerseits unser Gesundheitsbewusstsein stärkt und die Verantwortung gegenüber dem Leben und die Fürsorge für sich selbst wie auch für andere fördert. Zudem kann die Anerkennung der eigenen Vulnerabilität sowie die Offenheit für die Unbeständigkeit des Lebens die Empathie gegenüber unseren Patient/-innen entscheidend vertiefen, wodurch sich die Beziehungsqualität, die Patientenzufriedenheit sowie die Lebensqualität verbessern. Dieser Artikel soll unsere Berufskolleg/-innen zur Selbstreflexion anregen und ermutigen, sich Gedanken über die eigene Endlichkeit und Vergänglichkeit zu machen, in der Hoffnung, sich in der Arbeit mit Patient/-innen und auch im privaten Leben gegenüber der Unbeständigkeit des Lebens zu öffnen und dadurch den Blick verstärkt auf das Wesentliche im Leben richten zu können.
Krankheit, Sterben und Tod
Krankheit, Sterben und Tod sind integrale Bestandteile des Lebens und betreffen nicht nur das hohe Alter, sondern auch Eltern mit kleinen Kindern, junge Erwachsene, Jugendliche oder Kinder. Das Erleben einer schweren Krankheit ist geprägt von Ängsten, Kontrollverlust, Verlust der körperlichen und psychischen Integrität, Schmerzen, Abhängigkeit, Autonomieverlust, Phasen der Zustandsverschlechterung, Krisenbewältigung, Fragen nach Sinn und Sinnlosigkeit des Daseins, Wunsch nach Weiterleben oder Resignation und kann einen tiefen Leidensdruck auslösen (12). Das Sterben hingegen beschreibt das Erlöschen der körperlichen Lebensvorgänge, den Prozess, den ein Organismus bis zum Eintreten des Todes durchläuft. Der Tod dagegen ist ein Zustand, das finale Ereignis, welches jedem Organismus ein unwiderrufliches Ende setzt (13).
Obwohl wir alle ein gewisses Grundverständnis von Tod und Sterben haben, bleibt unser Verständnis für die psychischen, spirituellen und transzendenten Erfahrungen während des Sterbeprozesses und nach dem Tod oft begrenzt. Sterben und Tod bleiben trotz allen Wissens über organische Zerfallsprozesse ein unbegreifliches Rätsel. Das Einzige, was man mit Bestimmtheit wissen kann, ist die Tatsache, dass der Tod irgendwann eintreten wird (14, S. 47). In einem evolutionsbiologischen Sinne hat der Tod zwei polar einander entgegengesetzte und dennoch aufeinander bezogene Funktionen, die sich nicht konfligieren, sondern ergänzen: Werden und Vergehen, Leid und Segen stehen sich gegenüber. Und wird der Tod gefürchtet, so kann er dennoch als erlösend erlebt oder sehnsüchtig erwartet werden (15).
Subjektiv betrachtet gibt es den Tod des anderen und den Tod, der uns betrifft. Der Tod des anderen wird häufig als schmerzhaft und bedrohlich wahrgenommen, denn er nimmt, was geschätzt oder geliebt wird (16). Wie bereits Mascha Kaléko bemerkte, muss es einem nicht bangen vor dem eigenen Tod, sondern nur vor dem Tod derer, die einem nahe sind (17). Was in der Umkehr bedeutet, dass viele sterbende Personen in Sorge um ihre Angehörigen sind. Im Gegensatz dazu bleibt der eigene Tod unvorstellbar und lehrt uns, vielleicht gerade deswegen, das Fürchten vor dem Nichts (18). Gleichzeitig widerspiegelt die Erfahrung des Todes anderer Menschen und die damit verbundene (oft unbewusste) Konfrontation mit der eigenen Sterblichkeit eine existenzielle Grenzerfahrung (19). Gedanken an den Tod erzeugen in uns Bilder, Vorstellungen und Gefühle, die von persönlichen und kulturellen Lebenserfahrungen geprägt sind. Ob wir ihn fürchten, uns gegen ihn auflehnen, ihn erwarten oder gar herbeisehnen, ob wir ihn als Gegner oder Begleiter des Lebens betrachten – die Wahrnehmungen über den Tod und das Sterben sind vielfältig (20, S. 248 –255).
Auch in der modernen Welt spielt die Frage der menschlichen Existenz und der zeitlichen Dimensionen des Lebens eine wichtige Rolle (11, S. 45). Geburt, Fortpflanzung, Reproduktionsmöglichkeiten und Möglichkeiten der Hightechmedizin, Krankheit, Alter, Tod und Sterben konfrontieren uns dabei immer wieder mit den Grenzen des Lebens und der Frage, wie man die begrenzte Lebenszeit erfüllend und sinnvoll nutzen kann und wo die Grenzen sind (21). Die kontrovers verlaufende Diskussion über medizinische Möglichkeiten zur persönlichen Entfaltung und Erfüllung der Lebenszeit, aber auch die Versöhnung von existenziell unerfüllten Lebenswünschen am Lebensende, also dem «ungelebten Leben», widerspiegelt im Wesentlichen die Frage, was eigentlich einen Menschen, ein sinnvolles Leben und damit zusammenhängend ein würdevolles Sterben ausmacht (21).
Leben und Tod im 21. Jahrhundert – der verdrängte Tod
Die Lebenswelt und Lebensgestaltung von Menschen der (post-)modernen westlichen Gesellschaft des 21. Jahrhunderts ist durch die Idee der Selbstverwirklichung und ein unersättliches Streben nach Freiheit, Autonomie und Selbstbestimmung gekennzeichnet. Das Bestreben nach Selbstoptimierung sowie der Wunsch, gesünder, schöner, stärker, resilienter und vor allem länger zu leben (engl. longevity), beeinflussen unser Selbstverständnis von Körper und Geist sowie die Art und Weise, wie wir unsere sozialen Beziehungen pflegen (22). Körper und Psyche werden zum Instrument der Selbstoptimierung, welches die Funktion hat, die Angst vor der eigenen Endlichkeit zu verdrängen und den Glauben an die eigene Unsterblichkeit zu stärken (16, S. 9). Seit Kurzem wissen wir, wie man den Alterungsprozess partiell verlangsamen kann (23). Tatsächlich ist es Forschern gelungen, durch die Veränderung eines einzelnen Genes in Labormäusen die Lebensdauer um 20 % zu verlängern (24). Es stellt sich nun die Frage, was dies für den Menschen bedeutet und welche sozialen Konsequenzen daraus folgen, wenn wir in der Lage sind, die Lebensdauer von Menschen durch genetische Veränderungen zu manipulieren. Interessanterweise stellt Selbstoptimierung kein Phänomen des 21. Jahrhunderts dar. Der stetige Drang nach Wissen und Selbstverwirklichung sowie der Traum vom ewigen Leben lassen sich seit jeher in der Menschheitsgeschichte beobachten (25, S. 26).
Die hoch entwickelte moderne Medizin erschwert mit ihrem Heilungsversprechen, dass wir uns eigenverantwortlich nicht nur mit Fragen von Krankheit und Gesundheit, sondern auch mit denen des Todes und Sterbens auseinandersetzen. Obwohl wir alle bewusst oder unbewusst um die Unausweichlichkeit des Todes wissen, tendieren wir dazu, den Tod auszublenden und diesen aus unserem Leben zu verdrängen. In der modernen Welt wünscht sich der Mensch ein grösstmögliches Mass an Autonomie und Selbstbestimmung sowohl über sein Leben als auch über seinen Tod und die Art und Weise, wie er stirbt (26). Diese zentralen Anliegen prägen unser Verständnis, wie das Lebensende verlaufen sollte – mit maximaler Selbstbestimmung und bestmöglicher Lebensqualität bis zum Tod. Die Gründung von Sterbehilfeorganisationen in der Schweiz hat sich als ein wichtiges Instrument zur Förderung dieser zentralen Anliegen erwiesen, ebenso wie das Recht, den Zeitpunkt des Todes selbst bestimmen zu dürfen (27, S. 16 ff.).
Obwohl Fortschritte in der Medizin sowie die Institutionalisierung und Medikalisierung des Lebensendes das Sterben einfacher und kontrollierbarer gemacht haben, ist uns durch diese Entwicklung der tiefere Sinn für das Sterben abhandengekommen. Das Lebensende wird vorwiegend als medizinisches Problem betrachtet, als ein Versagen der Hightechmedizin. Gleichzeitig entfernen wir uns zunehmend von traditionellen gesellschaftlichen und/oder religiösen Grundwerten, wodurch das Verständnis darüber, was es bedeutet, Mensch zu sein, in Vergessenheit gerät (28).
Der Übergang von Leben zu Tod findet oft im Krankenhaus oder in Pflegeeinrichtungen statt und ist weitgehend aus der unmittelbaren Verantwortung von Familien sowie der dörflichen oder kirchlichen Gemeinschaften gelöst und dem verwaltenden Staat und spezialisierten Berufen wie der Palliative Care übertragen worden (29). Noch nie starben Menschen so hygienisch wie heute, jedoch auch noch nie unter sozialen Bedingungen, welche die emotionale Einsamkeit der Sterbenden und ihrer Angehörigen in so hohem Masse fördern (16, S. 85). Rituale, Traditionen und auch die Sprache sind uns im Umgang mit Sterben, Tod, Verlust und Trauer teilweise verloren gegangen (16, S. 10, S. 29 ff.). Die Fähigkeit, die richtigen Worte mit Sterbenden und später mit den Angehörigen und Hinterbliebenen zu finden, wird nicht ausreichend geschult. Die Sterbebegleitung und die nachfolgende Trauerphase der Angehörigen finden zu grossen Teilen im Verborgenen statt. Das schweizerische Arbeitsrecht gewährt Personen nach dem Tod eines engen Familienangehörigen drei Tage Trauerzeit.1 Danach wird erwartet, dass die trauernde Person wieder arbeitsfähig ist . Dies verdeutlicht das Fehlen einer angemessenen Anerkennung der Belastung durch einen schweren Verlust sowie das Fehlen einer Trauerkultur.
Auch Arbeitgeber sind im Umgang mit schwerer Krankheit, Tod und Sterben sowie der Trauer von Angestellten häufig überfordert und wissen nicht, wie sie Angestellte in solchen Situation angemessen unterstützen können (30, 31). Die Förderung der Trauerkultur ist wichtig. Sie gibt praktische Handlungsanweisungen im Umgang mit Verstorbenen (Leichenpflege, Bestattung), für die soziale Ausgestaltung des krisenhaften Ereignisses (Unterstützung und Schutz durch die Gesellschaft) sowie bei der Bewältigung der psychischen Auswirkungen des Verlusts (Trauerarbeit) (32).
Fragen zur Förderung der Selbst‑reflexion und Kultur der Endlichkeit und Vergänglichkeit
Die Auseinandersetzung mit der Endlichkeit und der Vergänglichkeit in der Arbeit mit Patient/-innen ist sehr anspruchsvoll. Sie erfordert neben einer hohen sozialen Kompetenz eine vertiefte Selbstreflexion, Kenntnisse von Kommunikationstechniken sowie eine fundierte Schulung und Sensibilisierung bezüglich Fragen hinsichtlich Leben, Sterben, Tod, Verlust und Trauer. Diese Kenntnisse können erlernt werden, werden aber in der medizinischen und pflegerischen Aus-, Weiter- und Fortbildung nach wie vor zu wenig berücksichtigt.
Im Folgenden legen wir verschiedene Fragen vor, die zur Selbstreflexion anregen sollen und dazu beitragen können, eine Kultur der freundlichen Offenheit gegenüber der menschlichen Endlichkeit im klinischen Alltag als auch in der persönlichen Lebensgestaltung zu entwickeln. Diese Fragen dienen nicht nur als Leitfaden für die Kommunikationspraxis im medizinisch begleiteten Sterbeprozess, sondern sollen auch dazu anregen, dass jede/-r Einzelne sowie die Gesellschaft im Allgemeinen sich gegenüber Themen der Endlichkeit öffnen können.
Wie gelingt eine tiefgründige Auseinandersetzung mit der eigenen Endlichkeit?
Die Reflexion eigener Ängste vor dem Tod und dem Sterben sowie die Anerkennung der eigenen Vulnerabilität sind wichtige Voraussetzungen, um empathisch auf die Ängste, Gefühle, Verunsicherungen und Bedürfnisse der Patient/-innen einzugehen. Dazu gehört die Auseinandersetzung mit eigenen Krankheits- oder Verlusterfahrungen sowie das Verständnis dafür, wie diese Erfahrungen die eigene psychische Gesundheit beeinflussen können. Die Anerkennung, dass das Leben nicht selbstverständlich und die Kontrolle über das Leben sehr beschränkt ist, richtet unsere Aufmerksamkeit auf das, was im Leben von Bedeutung ist. Sich immer wieder einmal die Zeit nehmen, innezuhalten, sich zu besinnen, auf das eigene Innenleben zu schauen und zu spüren, was jetzt gerade wichtig ist, ist eine wichtige Fähigkeit zur Unterstützung der Regeneration und Stärkung der Resilienz (33). Im Umgang mit schwerer Erkrankung empfiehlt es sich ebenfalls, immer wieder einmal die Frage zu stellen, was der Tod uns über das Leben lehrt. In Tabelle 1 sind Zitate aus der Lebens- und Praxiserfahrung von Palliativmediziner/-innen aus der Schweiz aufgeführt, welche die Selbstreflexion im Umgang mit der eigenen Endlichkeit anregen sollen.
Auch die von Harvey Chochinov entwickelte Dignity Therapy kann die Auseinandersetzung mit der eigenen Biografie und Selbstreflexion fördern. Die Dignity Therapy wurde ursprünglich für Patient/-innen mit einer schweren fortgeschrittenen Erkrankung zur Linderung von existenziellem Leiden entwickelt. Durch Erzählen von Erinnerungen und bedeutungsvollen Momenten soll die Wertschätzung für das eigene Leben erhöht, die Sinnfindung unterstützt und die Bedeutung der eigenen Lebensgeschichte erkannt werden (34). Die Dignity Therapy kann aber in jeder Lebensphase ein wertvolles Instrument zur Förderung der Auseinandersetzung mit der eigenen Endlichkeit und Vergänglichkeit darstellen, indem man sich besinnt, was man erreicht hat, auf was man besonders stolz ist, wann man sich am Lebendigsten fühlt und was man gern weitergeben möchte.
Vulnerabilität + Solidarität = Social Care
(Fürsorge gegenüber Patient/-innen wie sich selbst)
In der Behandlung und Begleitung von schwer kranken Menschen und ihren Angehörigen sind Gesundheitsfachpersonen stets angehalten, sich empathisch gegenüber den Ängsten, Nöten und Sorgen der Patient/-innen zu öffnen, wodurch sich das Risiko für die Entwicklung von stressbezogenen Krankheiten wie moralischen Distress, Burn-out oder Depression erhöht (35). Die Anerkennung der eigenen Grenzen sowie die Realisation, dass das Leben gegen gewisse Schicksalsschläge nicht abzuschirmen ist und ausserberufliche Ereignisse wie die Geburt eines Kindes, eine schwere Erkrankung, die Pflege eines kranken Angehörigen oder der plötzliche Verlust einer nahestehenden Person auch das eigene Leben betreffen und die Arbeits- und Beziehungsfähigkeit beeinflussen und/oder beeinträchtigen können, zeigt auf, wie wichtig die Aufrechterhaltung der eigenen Selbstfürsorge in der Arbeit mit kranken Menschen ist.
Die narrative Medizin ist ein wichtiges Instrument der Selbstfürsorge und ermöglicht Ärzten/Ärztinnen und Pflegefachkräften, in der komplexen Bedeutung ihrer Tätigkeit sowohl sich selbst als auch andere wiederzufinden und zu verorten. Sie stellt weniger die Krankheit als biologischen Prozess, sondern vielmehr die Krankheitserfahrung in den Vordergrund. Dabei wird der Tatsache Sorge getragen, dass wichtige Lebensereignisse, Übergänge von Gesundheit zu Krankheit, der Wechsel von Leben, Sterben und Tod oder die Erfahrung von Verlust und Trauer Rituale notwendig machen, um die entstandenen Lebenszäsuren zu verarbeiten und ihnen Sinn und Bedeutung zu geben. Die narrative Medizin versucht, das individuelle Erleben und die Gefühle von Gesundheitsfachpersonen zu erfassen, indem sie über Erzählungen, Essays, Bilder, Gedichte oder Geschichten die Selbstreflexion anregt und einen Zugang zum eigenen Erleben schafft. Sie öffnet einen Kanal, in dem man sich in der kompletten menschlichen Verwundbarkeit und der Ehrlichkeit unseres Seins in einem geschützten Rahmen begegnen kann. Die Selbstreflexion wirkt entschleunigend, stressreduzierend und schafft neue Einblicke und Erkenntnisse. Durch die narrative Medizin wird die Selbstfürsorge gefördert, die Resilienz gestärkt und die Fürsorge gegenüber unseren Patient/-innen vertieft (36, 37).
In der Behandlung von Menschen mit schweren Erkrankungen ist es wichtig, auf die eigene Gesundheit zu achten und sich immer wieder einmal zu fragen: «Wie geht es mir? Wie müde oder erschöpft bin ich? Achte ich auf meine Bedürfnisse, nehme ich mir regelmässig Auszeiten, und trete ich in einen fachlichen Austausch?» Die Teilnahme an Balint-Gruppen, Super- oder Intervision sind weitere wichtige Gefässe zur Förderung der Selbstreflexion und zur Stärkung der Resilienz.
Wie können philosophische Betrachtungen den Umgang mit der Endlichkeit und der Vergänglichkeit fördern?
Die Existenzphilosophie untersuchte die Gründe, weshalb wir uns vor dem Tod fürchten, was genau am Tod beängstigend ist und welche Bedeutung es für das Leben hat, sich mit dem Tod auseinanderzusetzen, wobei diese Diskussionen kontrovers verliefen (14, 38). Philosophische Reflexionen können die Entwicklung eines sinnvollen Verhältnisses zu verschiedenen Aspekten des Lebens unterstützen, darunter das Verständnis von Zeit und Zeitlichkeit, Freiheit, Individualität, Selbstverwirklichung, Verantwortung und Selbstfürsorge sowie die Art und Weise, wie wir unsere sozialen Beziehungen pflegen (14, 15). Heidegger betont die Wichtigkeit der Selbstverwirklichung und die Herausforderung, dem Leben Sinn und Bedeutung zu geben (39, S. 141). Er unterstreicht auch die Bedeutung, den Tod bewusst in die Lebensgestaltung zu integrieren, da er dem Leben einen Horizont gibt und ein Zeit- und Grenzbewusstsein vermittelt (14, S. 86). Tugendhat sieht in der Todesangst eher eine Furcht vor dem Sterben. Er war überzeugt, dass es die Nähe zum Tod ist, welche uns auf die Bedeutung des Lebens aufmerksam macht. Die Todesfurcht sei Ausdruck der Erkenntnis, eine Chance verpasst zu haben, dem Leben Sinn und Bedeutung zu geben und den Tod als guten Abschied zu verstehen (15, S. 44 ff.). Sartre hingegen betrachtet die Vorstellung des eigenen Todes als absurd und behindernd für die eigene Selbstverwirklichung (40, S. 23). Rosenzweig betont die Bedeutung der Liebe und der Beziehungen, um die Angst vor dem Tod zu überwinden, und verdeutlicht, dass Selbstverwirklichung nicht ohne Beziehung zu anderen Menschen erreicht werden kann (41). Kierkegaard wiederum sieht die unbeschränkten Möglichkeiten des Lebens als Ursache für menschliche Verzweiflung, da sie die Suche nach dem Sinn erschweren (18, S. 144 ff.). Tatsächlich ist das Leben nicht immer nur gut, wie von den Existenzphilosophen postuliert (38), sondern kann leidvoll erlebt werden. Manchmal ist es so unerträglich und der Leidensdruck so hoch, dass man sich den Tod herbeisehnt (15). Hamlets berühmte Frage «To be or not to be» stellt die existenzielle Ambivalenz des Lebens dar, in dem sowohl Freude als auch Leid existieren.
Die frühzeitige Auseinandersetzung mit der eigenen Endlichkeit und Vergänglichkeit kann helfen, dem Leben einen tieferen Sinn und Bedeutung zu verleihen, indem der Blick auf das gerichtet werden kann, was wirklich von Bedeutung ist. Erst die bewusste Integration des Todes ins Leben ermöglicht ein gelingendes Leben. Die Beschäftigung mit dem Tod und die Anerkennung, dass Sterben und Tod Kernbestandteile des menschlichen Lebens sind, macht uns für das Lebend offener, lebendiger und kreativer (42).
Was bedeutet es, ein erfülltes Leben zu führen?
Die Auseinandersetzung und Bewältigung der Todesangst sind eine wichtige Entwicklungsaufgabe, die uns von der Kindheit an begleitet, in der Adoleszenz eintritt, uns später in der Lebensmitte erneut einholt und schliesslich im hohen Alter wieder begegnet (43, 44). Die Angst vor dem Tod in einer milden Ausprägung ist universell und gehört zur menschlichen Existenz. Sie widerspiegelt unser Bewusstsein für unsere Vulnerabilität, unsere soziale Angewiesenheit und das Wissen um unsere existenzielle Begrenztheit (45). Die Realisation, dass die Lebenszeit begrenzt ist, bewegt uns dazu, über unsere Entwicklungsaufgaben, den Lebenszyklus und unsere Lebensziele nachzudenken sowie darüber, was für das Leben von Sinn und Bedeutung ist. Das Stufenmodell von Erikson gliedert die psychosoziale Entwicklung in acht Stufen. Jede Stufe stellt eine Krise oder einen Konflikt dar, die oder den jeder Mensch für sich lösen muss, um eine gefestigte Persönlichkeit entwickeln zu können (46). Auch wenn dieses Stufenmodell immer wieder kritisiert wurde, zeigt es, dass wir uns im Verlaufe unseres Lebens unter Berücksichtigung der begrenzt verfügbaren Lebenszeit immer wieder mit Ängsten (Krisen) auseinandersetzen müssen.
Wenn es uns gelingt, diese zu überwinden, entstehen persönliche Reife und Weiterentwicklung (44). Eriksons Modell veranschaulicht ebenfalls, dass wir unser Verhalten unserem Alter und insbesondere unseren Entwicklungsaufgaben hingehend auszurichten haben. Sind wir uns des Lebenszyklus und der damit einhergehenden Aufgaben, Verantwortungen und Herausforderungen, aber auch Grenzen und Einschränkungen bewusst, lässt sich vermutlich auch ein besserer Umgang mit dem Tod und dem Sterben finden. Häufig reagiert der Mensch jedoch mit Abwehr und Verleugnung auf die Begrenztheit der eigenen Existenz. Im Schutze der Illusion, etwas Besonderes zu sein, fühlen sich viele Menschen unverletzbar und glauben, Krankheit und Leid blieben ihnen erspart (42). Diese neurotische Abwehr der Todesangst, die im Grunde genommen eine Lebensangst zum Ausdruck bringt (43, S. 117), kann in einem Teufelskreis enden und nicht nur die persönliche Entwicklung blockieren, sondern auch die Autonomie und Selbstverantwortung sowie die Beziehungs-, Liebes- und Genussfähigkeit einschränken (10). Um diesen existenziellen Ängsten zu begegnen, verwendet Irvin D. Yalom eine Art Gleichung. Er postuliert, je mehr ungelebtes Leben in uns steckt und je mehr wir bedauern, was wir nicht gelebt haben, desto mehr fürchten wir den Tod.
Die Auseinandersetzung mit dem Tod und der Begrenztheit des Lebens soll diesen Konflikt lösen und letzten Endes dazu beitragen, ein erfüllteres Leben zu führen. In der existenziellen Psychotherapie geht es nun darum, einen kreativen Umgang mit der Todesangst zu finden und dem Tod einen Platz im psychischen Raum zu geben, damit der Mensch trotz des Wissens um die Sterblichkeit ein persönlich erfülltes und sinnvolles Leben gestalten kann. Ein tägliches Bewusstsein dafür, dass das Leben kurz ist, soll helfen, authentisch und reflektiert zu leben und nichts anzuhäufen, was man am Lebensende bereuen würde (42, 47). Die Überwindung der Ängste vor dem Sterben kann als treibende Kraft zur persönlichen Entwicklung und sinnvollen Lebensgestaltung genutzt werden (43, S. 133).
Irvin D. Yalom ist zudem der Überzeugung, dass die verbleibende Lebenszeit sehr wichtig ist. Das Erlebte kann zwar nicht ungeschehen gemacht werden, die verbleibende Lebenszeit dagegen wird umso wichtiger und kann von jedem neu gestaltet werden. Der Blick darauf, was uns am Lebensende glücklich macht, soll als Massstab dafür dienen, die verbleibende Lebenszeit sinnvoll zu gestalten (42, 47).
Wie kann man Menschen (am Lebensende) helfen, Sinnfragen zu begegnen und ein würdevolles Sterben zu erreichen?
Spirituelle oder religiöse Rituale sowie transzendente Erfahrungen können am Lebensende wichtige Ressourcen im Umgang mit Sinnfragen, Ängsten oder existenziellen Nöten sein und auf das Lebensende und den Abschied vorbereiten, indem sie Trost vermitteln und die Verbundenheit zu Angehörigen stärken (48). Mit «spirituell» sind sinnstiftende Erfahrungen, Einstellungen und Rituale gemeint, die eine Person mit der Bedeutung des eigenen Lebens verbindet und können religiöser und nicht religiöser Natur sein (49). Religion und Spiritualität haben kulturübergreifend eine wichtige Aufgabe: Sie sollten die Angst vor dem Sterben und dem Tod lindern. Denn wenn der Tod nicht das Ende, sondern den Anfang markiert, gibt es keinen Grund, ihn zu fürchten. Schwindet jedoch dieser Glaube, nimmt die Angst zu (50).
Während die Ars moriendi im Mittelalter die Menschen aus Sorge um das Schicksal der Seele im Jenseits zu moralisch gutem Handeln anhielt (51), widerspiegeln moderne Interpretationen dieser Sterbekunst eine Lebensethik, die uns unter Einbezug der menschlichen Endlichkeit und Vergänglichkeit zur existenziellen Auseinandersetzung im Hier und Jetzt und zur persönlichen Entwicklung und Selbstverwirklichung ermutigt (52, S. 4–6). Es geht also weniger um die Vorbereitung der Seele auf einen heilsamen Tod als vielmehr darum, in der letzten Lebensphase nicht allein zu sein. Carlo Leget betont in seiner These zu einem erfüllten Leben und guten Sterben die Wichtigkeit, sich frühzeitig über die Dimensionen eines erfüllten Lebens und die damit zusammenhängenden Entscheidungen am Lebensende Gedanken zu machen. Dabei verweist er auf fünf existenzielle Themen, die einen individuellen Reflexionsprozess anregen und den Umgang mit der Endlichkeit und der Vergänglichkeit fördern sollen. Er ermutigt jeden Menschen, sich mit Fragen hinsichtlich eigener Autonomie, Position zu Leid und Schmerz, Abschied, unerledigter Dinge und Chance auf Erfüllung im Hier und Jetzt sowie innerer Wert- und Glaubensvorstellungen auseinanderzusetzen, damit dem Lebensende mit persönlicher Reife und mit innerem Frieden und Versöhnung entgegengeblickt werden kann (53). Die Offenheit gegenüber medizinischen, philosophischen und spirituellen Perspektiven ermöglicht diesen existenziellen Themen nicht nur am Lebensende, sondern im Leben generell mit Aufmerksamkeit und Wertschätzung zu begegnen (54).
Durch die weltanschauliche Diversifizierung unserer Gesellschaft sind die Haltungen gegenüber dem Sterben und Tod beziehungsweise die damit verbundenen Überzeugungen in einem komplexen Wandel. In säkular geprägten Gesellschaften sind viele Menschen weniger um ihre Existenz nach dem Tod in Sorge, sondern vielmehr um den Weg zum Lebensende. Was bedeutet nun Lebensende, Sterben, Tod und Trauer, wenn der Glaube an ein Weiterleben im Jenseits schwindet? Religion und Spiritualität sind in schweren Lebenssituationen für etwa die Hälfte der Schweizer Bevölkerung nach wie vor bedeutsam (55). Gesundheitsfachpersonen sollten in der Lage sein, offen, wertschätzend und empathisch auf existenzielle, spirituelle und transzendente Bedürfnisse und Erfahrungen einzugehen (56).
Besonders angesichts einer unheilbaren Erkrankung, infausten Prognose, terminalen Situation oder eines Krankheitsprogresses können Spiritualität oder Glaube wieder an Bedeutung gewinnen und die Entscheidungsfindung hinsichtlich lebenserhaltender Therapien beeinflussen. Kestenbaum et al. empfehlen Patient/-innen, nach spirituellen Bedürfnissen und Belastungen zu fragen sowie zu eruieren, welche spirituellen oder religiösen Überzeugungen wichtig sind, um Patient/-innen in der Entscheidungsfindung unterstützen zu können (57). Hierzu eignen sich die revidierte Version der Edmonton Symptom Assessment Scale (ESAS) («Erleben Sie spirituelles Leid oder Schmerzen?») (58) oder das FICA Spiritual Assessment Tool (59). Spirituelle und transzendente Erfahrungen, wie sie nicht selten in Todesnähe auftreten, können ferner einen wichtigen Faktor in der Auseinandersetzung mit Sinnfragen angesichts der eigenen Endlichkeit darstellen (48). Ein nützliches Instrument zur Erfassung von spirituellen Ressourcen und Belastungen am Lebensende ist der von Peng-Keller entwickelte «Spiritual Distress and Resources Questionnaire (SDRQ) (49). Der Leitfaden kann Gesundheitsfachpersonen helfen, spirituelle Aspekte oder Themen in Bezug auf die verbleibende Lebenszeit und bedeutsame Beziehungen anzusprechen.
Wie können Patient/-innen und ihre Angehörigen auf den Tod vorbereitet werden?
Gespräche über das Lebensende, Sterben und Tod in der Begleitung von Patient/-innen mit einer schweren unheilbaren Erkrankung und ihren Angehörigen sind eine zentrale Aufgabe der Palliative Care und helfen, die Patient/-innen und ihre Angehörigen auf das Lebensende und den Tod vorzubereiten. Dabei ist eine vertrauensvolle, verlässliche Beziehung zum/-r fallführenden Arzt/Ärztin sowie regelmässig stattfindende Gespräche für die Aufrechterhaltung der Kontinuität massgeblich. Der Einbezug der Palliative Care ist besonders in der letzten Lebensphase von Bedeutung, soll jedoch bereits im Verlauf einer chronischen oder schweren unheilbaren Erkrankung und parallel zu kurativen Behandlungsmassnahmen eingesetzt werden (13). Die Palliative Care hat zum Ziel, eine Kultur des Sterbens in unserer Gesellschaft zu etablieren und das Sterben auf eine selbstbestimmte und menschenwürdige Weise zu gestalten.
Cicely Saunders, Mitbegründerin der Palliative Care und Hospizbewegung, beschrieb in ihrem Model «Total Pain», dass das menschliche Leiden eine körperliche, eine psychische/emotionale, eine soziale, eine spirituelle und existenzielle Ebene hat, die sich gegenseitig überschneiden und beeinflussen (60). Aufgabe der Palliative Care ist es nun, dem menschlichen Leiden auf diesen Ebenen unter Einbezug von multiprofessionellen Diensten zu begegnen, um es zu lindern und die Lebensqualität zu verbessern. Dazu gehört neben der Krankheitsverarbeitung auch die Unterstützung bei der Entscheidungsfindung und bei ethisch-rechtlichen Fragestellungen sowie die Organisation und der Aufbau eines Betreuungsnetzes mit spezialisierten Diensten für zu Hause (z.B. palliative Spitex, Mahlzeitendienst, psychiatrisches Home Care Treatment etc.). Offene Fragen wie «Was haben Sie von Ihrer Krankheit verstanden? Gibt es etwas, das Sie wissen möchten? Was bereitet Ihnen Sorgen, wenn Sie an die nahe Zukunft denken? Was ist Ihnen besonders wichtig, wenn sich Ihr Gesundheitszustand verschlechtern würde? Gibt es etwas, was ich wissen muss, um Sie bestmöglich zu begleiten? Wie kann man Ihre Angehörigen unterstützen?» sind entscheidend, um Patient/-innen mit einer schweren fortgeschrittenen Erkrankung entsprechend ihren Wünschen, Bedürfnissen und Behandlungspräferenzen zu begleiten und zu unterstützen (61). Letztlich gibt es Menschen, die bis zum Lebensende nicht bereit sind, über Sterben und Tod zu sprechen. Auch das gilt es, zu akzeptieren und Wege zu finden, diese Personen wie auch ihre Angehörigen dennoch empathisch und würdevoll begleiten zu können (62).
Wie gelingt es mir, die Resilienz von schwer kranken Menschen zu stärken?
Die Erfahrung einer schweren unheilbaren Erkrankung sowie die Konfrontation mit dem nahenden Lebensende und die damit zusammenhängende Ungewissheit und eingeschränkten Zukunftsperspektiven können Ängste, dramatische Sinnkrisen und den Wunsch nach einem raschen Versterben auslösen (8). In der Auseinandersetzung mit dem Lebensende spielt Hoffnung eine bedeutende Rolle und wirkt als wichtiger Schutzfaktor zur Stärkung der Resilienz im Umgang mit vielfältigen Einschränkungen (63). Hoffnung steht als Gegenbegriff zu Verzweiflung und kann Lebenskraft mobilisieren. Sie verkörpert einen starken Handlungsantrieb, richtet Menschen in ihrem Leid und Verzweiflung auf, stärkt ihre Willenskraft und ihr Selbstwertgefühl. Im Hoffen wirkt immer ein Wunschgedanke. Über die Hoffnung erschliessen sich Menschen neue Existenz- und Handlungsmöglichkeiten, die über den Tod hinaus wirken können, und bewahren dadurch die Handlungsfähigkeit, Autonomie und Selbstbestimmung (64). Was bedeutet es für uns Menschen zu hoffen? Wie hoffen Menschen, wenn sie sich ihrem Lebensende nähern? Was bedeutet Hoffnung für Angehörige? Wie können Gesundheitsfachpersonen mit der Hoffnung von Patient/-innen oder der Hoffnung der Angehörigen interagieren, um ihre Würde, Identität, Autonomie und Selbstbestimmung zu stärken und aufrechtzuerhalten? Die Erzählung (narrative Konstruktion) als komplexer Prozess der Sinnbildung hat eine wichtige Bewältigungsfunktion und spielt in der Aufrechterhaltung der Hoffnung und Resilienz eine wichtige Rolle. Die Selbsterzählung ermöglicht die Verarbeitung der schweren Erkrankung und kann helfen, die lebensgeschichtliche Ruptur langsam in die eigene Lebensgeschichte zu integrieren und eine neue stabilisierende Identität zu formen. Dabei kann besonders die Konzentration der positiven, bestärkenden Erfahrungen in der Biografie helfen, dem Funktions-, Kontroll- und Sinnverlust zu begegnen und dadurch die verletzte Würde wiederherzustellen (65). Die Aufrechterhaltung der Hoffnung und die Stärkung der Sinn- und Bedeutungsfindung am Lebensende durch palliative Fürsorge und stützende Gespräche können dazu beitragen, die Resilienz von schwer kranken Patient/-innen und ihren Angehörigen zu stärken. Ein besonderes Merkmal der Hoffnung ist, dass sie auch dann weiter bestehen kann, wenn sich Erwartungen und Wünsche nicht erfüllt haben, z.B. die Symptomlast nicht gebessert oder die Schwere der Erkrankung nicht gemildert werden kann. Das Wissen um die begrenzte Lebenszeit und andererseits die Hoffnung auf viele gute Tage oder auch ein Wunder stellen keinen Widerspruch dar. Diese Dualität im Denken (engl. double awareness) – auf das Beste hoffen und auf das Schlimmste vorbereitet sein – widerspiegelt einen wichtigen Grundsatz der Palliative Care. Auch wenn die Hoffnung auf Heilung schwindet, kann Hoffnung weiter bestehen bleiben und als wichtige Ressource zur Stärkung der Resilienz angesichts des nahenden Lebensendes verwendet werden. Fragen wie «Was gibt Ihnen in schwierigen Zeiten Kraft weiterzumachen? Woraus schöpfen Sie Hoffnung, Kraft und Trost?» oder «Was hoffen Sie angesichts der verbleibenden Lebenszeit noch erleben zu dürfen?» können helfen, die Hoffnung auf eine resilienzstärkende Ressource auszurichten (66). Dies gelingt durch eine vertrauensvolle Arzt-Patienten-Beziehung, welche sich durch Empathie, Vertrauen, beidseitige Offenheit und die Bereitschaft über den Tod und das Sterben zu sprechen, auszeichnet (62). Die Aufgabe der Palliative Care besteht folglich nicht nur in der Symptomlinderung, sondern auch in der Förderung der Kommunikation mit Angehörigen, der Stärkung der zwischenmenschlichen Beziehungen sowie der Unterstützung des persönlichen und spirituellen Wachstums, das aus dem Erleben von existenziellem Leiden und Konfrontation mit dem Lebensende entstehen kann.
Wie unterstütze ich trauernde Menschen, trauernde Angehörige?
Die Trauer ist eine häufige und natürliche Reaktion auf antizipierte oder erlebte Verlusterfahrungen und hat in der Auseinandersetzung mit der eigenen Endlichkeit und Vergänglichkeit eine wichtige psychische Aufgabe. Sie fördert die Akzeptanz von unwiederbringlichen Veränderungen, von unerfüllten Lebensträumen und/oder Verlusten von wichtigen Bindungen und trägt nach erfolgter Trauerarbeit zur psychischen Entwicklung bei. Scheitern wir an dieser psychischen Arbeit, bleiben wir an innere Objekte aus der Vergangenheit gebunden, die frustriert erlebt werden. Das Resultat ist anhaltende Trauer, depressive Verstimmung, Ängste sowie ein fehlendes Gefühl von Sinn und Bedeutung im Leben (67). Sinnzentrierte Interventionen (z.B. Dignity Therapy (34)) können die Thematisierung von Lebensendthemen unterstützen und Patient/-innen und ihren Angehörigen helfen, Verluste zu akzeptieren und Sinn- und Bedeutungsfindung sowie die Aufrechterhaltung der Würde zu stärken. Auch wenn die Klärung von komplexen medizinischen Situationen und Therapiemöglichkeiten am Lebensende und das Auffangen der emotionalen Reaktionen von Patient/-innen und ihren Angehörigen Zeit und Energie kostet, können diese Gespräche sehr wertvoll sein, eine vertrauensvolle Arzt-Patienten-Beziehung aufzubauen und pathologische Formen der Trauer abzuwehren. Dieses Fundament hilft später, Gespräche sehr gezielt und fokussiert auf die wichtigsten Punkte zu lenken (68). Nach dem Tod einer nahestehenden Person können psychotherapeutische Gespräche helfen, Schmerzen zum Ausdruck zu bringen, den Verlust zu verarbeiten und die Trauer zu bewältigen. Die alleinige Anwesenheit eines wachsam zuhörenden, akzeptierenden und nicht wertenden Gegenübers kann dabei tröstend wirken. Auch Abschiedsgespräche mit dem fallführenden Arzt/Ärztin können trauernden Angehörigen helfen, die Trauerarbeit zu initiieren und bieten gleichzeitig Beistand, Orientierung und Halt. Dauert die Trauer nach einem schweren Verlust mehr als sechs Monate an, sollte eine anhaltende Trauerstörung evaluiert und eine Gesprächspsychotherapie gegebenenfalls kombiniert mit einer Psychopharmakotherapie aufgegleist werden (69).
Diskussion
Selbstreflexion und Selbstfürsorge
Ob man das Sterben lernen kann, ist besser in der Umkehr der Frage zu beantworten, nämlich was lehrt uns der Tod über das Leben oder was lehrt uns das Leben generell? Denn der Tod wie die Geburt ist integraler Bestandteil des Lebens. Kliniker/-innen oder Gesundheitsfachpersonen verfügen über ein Bewusstsein der Sterblichkeit und die Erfahrung, andere Menschen sterben zu sehen. Man hat gewisse Kenntnisse über das menschliche Leiden bei schwerer Erkrankung und weiss von der Belastung durch existenzielle Ängste, Einsamkeit, Versagen, Hilflosigkeit, Verzweiflung oder Trauer am Lebensende von sterbenden Personen sowie ihren Angehörigen und kennt die klinischen Vorboten des Todes. Gleichzeitig hat der Tod der Patient/-innen einen bedeutenden Einfluss auf das Denken, Fühlen und Handeln von Gesundheitsfachpersonen. Die Erfahrung des Todes ist unweigerlich eine Konfrontation mit der eigenen Endlichkeit, die Unbehagen auslösen kann. Jede Person entscheidet für sich, wie viel Nähe zum eigenen Tod ausgehalten und welche kreativen Lösungen gefunden werden können, um mit dieser Urangst umzugehen.
Das Thema Sterben und Tod aus einer gesundheitswissenschaftlichen Perspektive zu thematisieren, ist insofern relevant, weil durch die Akzeptanz der Endlichkeit nicht nur das Leben, sondern das «Er-Leben» des Lebens und damit auch das, was das Leben formt, nämlich die Bewältigung von Entwicklungsaufgaben, Gesundheit und Krankheit sowie Selbstachtung und die Fürsorge und Beziehung zueinander, in unser Blickfeld rückt. Jede/-r ist also zu einem sorgfältigen Umgang mit seiner begrenzten Lebenszeit angehalten sowohl in Bezug auf die Verwirklichung eigener Lebensprojekte als auch im Umgang mit ihren/seinen Beziehungen (14, S. 287). Die Auseinandersetzung mit der eigenen Endlichkeit kann zu einer verstärkten Eigenverantwortung gegenüber dem eigenen wie auch dem Leben der anderen führen und dazu anhalten, das Leben auf möglichst befriedigende, selbstbestimmte und gesundheitsbewusste Weise zu leben und zu gestalten (11, S. 13–17). Aus den Reflexionen und Zitaten von Palliativmediziner/-innen wird verständlich, dass es gerade der Tod ist, der uns herausfordert, Sinn überhaupt erst zu suchen und in unserem Tun zu verwirklichen.
Umgang mit kranken Menschen und ihren Angehörigen
Die Perspektive ändert sich, wenn man sich plötzlich mit dem Lebensende konfrontiert sieht. Die Konfrontation mit dem Lebensende und der Verlust der körperlichen und seelischen Integrität, der Verlust von Sinn- und Bedeutung im Leben, der Verlust der eigenen Autonomie und Selbstständigkeit sowie die zunehmende Abhängigkeit können einen hohen Leidensdruck verursachen und den Wunsch nach einem raschen Versterben verstärken (34). Pflegende Angehörige dagegen haben häufig noch nie das Sterben eines nahen Menschen erlebt und haben oftmals unrealistische Vorstellungen bezüglich des Sterbeprozesses (13). Gerade im letzten Lebensabschnitt sowie im Hinblick auf die Trauerphase bedürfen schwer kranke Menschen und ihre Angehörigen einer fürsorglichen Begleitung und Unterstützung durch Fachdienste wie der Palliative Care, der Ethikberatung, der Psychoonkologie und der Seelsorge.
Wie ändert sich nun das Erleben von Zeit und Zeitlichkeit des Lebens, wenn der Tod akzeptiert und nicht verdrängt wird? Die klinische Erfahrung mit unseren Patient/-innen lehrt uns, dass die Konfrontation mit einer schweren unheilbaren Erkrankung und der eigenen Endlichkeit das Bewusstsein für die verbleibende, plötzlich wertvoll erscheinende Lebenszeit entscheidend beeinflussen kann (14, S. 49 ff.). Auf wundersame Weise kann die Nähe zum Tod durch eine schwere Erkrankung, eine Nahtoderfahrung oder der Verlust eines nahestehenden Menschen zu tiefgreifenden Veränderungen führen (10, 43). Erst das Erleben des mit dem Sterben verbundenen Leidens ermöglicht das Erleben unserer Urängste: die Angst vor der Einsamkeit, die Angst vor dem Leid und vor dem völligen Kontrollverlust (26). Durch Erfahrung unserer Vulnerabilität, existenziellen Begrenztheit und sozialer Angewiesenheit lässt sich unser Blick auf das richten, was uns wirklich wichtig ist im Leben. Dadurch lässt sich auch eine andere Perspektive auf das Sterben finden, was das Erleben von Transzendenz fördern kann (70). Durch die Erfahrung von schwerer Krankheit, Sterben, Tod, Verlust und Trauer werden Gespräche über den Sinn und die Bedeutung des vorangegangenen Lebens, der Erkrankung und des nahenden Lebensendes möglich. Die Erfahrung der Begrenztheit unseres Daseins bildet einen zentralen Bezugspunkt, wobei die Auseinandersetzung damit zu einer besseren Verortung des Selbst und zu einem tieferen Verständnis der eigenen Identität führt (21).
Fazit
Über den Tod sprechen ist wichtig. Nur so werden wir uns unserer Unvollkommenheit und beschränkten Möglichkeiten bewusst. Die Auseinandersetzung mit der Angst vor dem Tod und dem Sterben ist eine wichtige Entwicklungsaufgabe. Sie erfordert unter Berücksichtigung der begrenzt verfügbaren Lebenszeit eine fortwährende Bewältigung im Verlaufe unseres Lebens, damit diese nicht blockiert, sondern als treibende Kraft zur persönlichen Entwicklung und sinnvollen Lebensgestaltung genutzt werden kann. Die Öffnung gegenüber der eigenen Endlichkeit führt zu einer verstärkten Eigenverantwortung für das eigene Leben und das der anderen und zu einer selbstbestimmten, gesundheitsbewussten und zufriedenen Lebensgestaltung. Die Offenheit gegenüber unserer eigenen Endlichkeit und Vergänglichkeit befähigt uns, mit unseren Patient/-innen über den Tod zu sprechen und sie und ihre Angehörigen empathisch und verlässlich bis zum Lebensende hin zu begleiten. Dadurch gelingt es auch schwer kranken Patient/-innen und ihren Angehörigen, sich auf das Wesentliche zu konzentrieren und Therapieentscheidungen zu treffen, die ihr Leiden lindern und die Lebensqualität verbessern.
Danksagung
Die Autorinnen und Autoren danken Professor Dr. med. Dr. phil. Ralf Jox für seine Reflexionen über Leben, Sterben und Tod.
Historie
Manuskript eingereicht: 08.04.2024
Angenommen nach Revision: 01.07.2024
Klinik für Radio-Onkologie, Kompetenzzentrum Palliative Care,
Universitätsspital Zürich
annina.seiler@usz.ch
Klinik für Radio-Onkologie
Kompetenzzentrum Palliative Care
Universitätsspital Zürich und Universität Zürich
Klinik für Radio-Onkologie, Kompetenzzentrum Palliative Care, Universitätsspital Zürich und Universität Zürich
Klinik für Radio-Onkologie, Kompetenzzentrum Palliative Care, Universitätsspital Zürich und Universität Zürich
Chefarzt
Universitäres Zentrum für Palliative Care
Inselspital Bern, SWAN Haus
Freiburgstrasse 38
3010 Bern
Palliativzentrum, Universität Basel, Schweiz
Abteilung für Palliative Care, Departement Theragnostik, Universitätsspital Basel, Basel
Clinica di Cure Palliative e di Supporto, Ente Ospedaliero Cantonale, Lugano e Bellinzona
Zentrum für Palliative Care, Kantonsspital Winterthur
Gemeinschaftspraxis Psychotherapie Bellevue, Zürich
Professur für Spiritual Care, Theologische und Religionswissenschaftliche Fakultät, Universität Zürich
Klinik für Radio-Onkologie, Kompetenzzentrum Palliative Care, Universitätsspital Zürich und Universität Zürich
Die Autorinnen und Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Bhagavad Gita: A new translation (S. Mitchell, Trans.). New York: Three Rivers Press; 2006.
2. Roberts TG, Jr., Goulart BH, Squitieri L, Stallings SC, Halpern EF, Chabner BA, et al. Trends in the risks and benefits to patients with cancer participating in phase 1 clinical trials. Jama. 2004;292(17):2130-40.
3. Lindtner-Rudolph H, Bardenheuer HJ. 13. Sprache am Lebensende: Chancen und Risiken ärztlicher Gesprächsführung in der Palliativemedizin. In: Albert B, Thomas S-F, editors. Handbuch Sprache in der Medizin. Berlin, München, Boston: De Gruyter; 2015. p. 333-47.
4. Salis Gross C. Der ansteckende Tod: eine ethnologische Studie zum Sterben im Altersheim. Frankfurt; Main: Campus Verlag; 2001.
5. Meerwein F. Das ärztliche Gespräch. Bern: Huber; 1986.
6. Pape E, Seiler A, von Känel R. Umgang mit Denial bei Tumorerkrankungen. Primary and Hospital Care: Allgemeine Innere Medizin. 2020;20.
7. Sinclair S, Chochinov H. Communicating with patients about Existential and Spiritual Issues: SACR-D work. Progress in Palliative Care. 2012;20:72-8.
8. Rodin G, Zimmermann C, Rydall A, Jones J, Shepherd FA, Moore M, et al. The desire for hastened death in patients with metastatic cancer. J Pain Symptom Manage. 2007;33(6):661-75.
9. Brownlee S, Chalkidou K, Doust J, Elshaug AG, Glasziou P, Heath I, et al. Evidence for overuse of medical services around the world. The Lancet. 2017;390(10090):156-68.
10. Fuchs T. Leiden an der Sterblichkeit. Formen neurotischer Todesverleugnung. Zeitschrift für Klinische Psychologie, Psychiatrie und Psychotherapie 2003;1(51):41 − 50.
11. Schnabel P-E. Mit Tod und Sterben leben lernen. Ein Konzept zur Föderung von Überlebenskompetenz und Gesundheit. Weinheim & Basel: Beltz Juventa; 2013.
12. Chochinov H, McClement S, Hack T, McKeen N, Rach A, Gagnon P, et al. The Patient Dignity Inventory: Applications in the Oncology Setting. Journal of palliative medicine. 2012;15:998-1005.
13. Schweizer Akademie der Medizinischen Wissenschaften (SAMW). Umgang mit Sterben und Tod. Basel: Gremper AG; 2019.
14. Birkenstock E. Heisst philosophieren sterben lernen? München: Alber; 1997.
15. Tugendhat E. 1.2 Über den Tod oder: Warum fürchten wir, bald zu sterben? In: Schmitt E, Eckart WU, editors. Handbuch Sterben und Menschenwürde De Gruyter; 2012. p. 31-50.
16. Elias N. Über die Einsamkeit der Sterbenden in unseren Tagen. Humana conditio. Frankfurt am Main: Suhrkamp; 2021, Erstausgabe 1982.
17. Kaléko M. Verse für Zeitgenossen. In: Zoch-Westphal G, editor.: Rowohlt Taschenbuch Verlag; 1980. p. 9.
18. Kierkegaard S. Die Krankheit zum Tode. Ges. Werke. Düsseldorf/Köln: Diederichs; 1954.
19. Langthaler R, Hofer M. Existenzerhellung – Grenzbewusstsein – Sinn der Geschichte : dem Andenken an Karl Jaspers (1883-1969). Wien; Hamburg: Wiener Jahrbuch für Philosophie; 2020.
20. Freud S. Psychologie des Unbewußten. Conditio humana. Ergebnisse aus den Wissenschaften vom Menschen. Studienausgabe. Bd. 3 ed. Frankfurt am Main: S. Fischer; 1975.
21. Schweda M. Ethisches Spannungsfeld: Begrenzte und erfüllte Lebenszeit. In: Riedel A, Lehmeyer S, editors. Ethik im Gesundheitswesen. Berlin, Heidelberg: Springer Berlin Heidelberg; 2022. p. 701-15.
22. Balandis O, Straub J. Selbstoptimierung und Enhancement. Journal für Psychologie. 2018;26(1):131-55.
23. Yang JH, Petty CA, Dixon-McDougall T, Lopez MV, Tyshkovskiy A, Maybury-Lewis S, et al. Chemically induced reprogramming to reverse cellular aging. Aging (Albany NY). 2023;15(13):5966-89.
24. Johnson AA, English BW, Shokhirev MN, Sinclair DA, Cuellar TL. Human age reversal: Fact or fiction? Aging Cell. 2022;21(8):e13664.
25. Fenner D. Selbstoptimierung und Enhancement. Ein ethischer Grundriss. Tübingen: Narr Francke Attempto Verlag GmbH & Co KG; 2019.
26. Caruso IA, Rubner A. Notizen zu einer Diskussion über den Tod. J Psychologie und Gesellschaftskritik. 1988;12:45-57.
27. Zimmermann M, Felder S, Streckeisen U, Tag B. Das Lebensende in der Schweiz. Basel: Schwabe; 2019.
28. Straub J, Sabisch-Fechtelpeter K, Sieben A. Homo modificans, Homo modificatus. Ein Vorwort zu aktuellen „Optimierungen des Menschen”. In: Sieben A, Sabisch-Fechtelpeter K, Straub J, editors. Menschen machen Die hellen und die dunklen Seiten humanwissenschaftlicher Optimierungsprogramme. Bielefeld transcript Verlag; 2012. p. 9-26.
29. Borasio GD. Über das Sterben. Was wir wissen. Was wir tun können. Wie wir uns darauf einstellen. München: Deutscher Taschenbuch Verlag GmbH & Co; 2014.
30. Sutor P. Trauer am Arbeitsplatz. Sprachlosigkeit überwinden – Fürsorgepflicht wahrnehmen – Trauerkultur entwicklen. Ostfildern: Patmos Verlag der Schwabenverlag AG; 2020.
31. Bundesgesetz über die Verbesserung der Vereinbarkeit von Erwerbstätigkeit und Angehörigenpflege [Internet]. 2021 [cited 07.03.2024]. Available from: https://www.bsv.admin.ch/bsv/de/home/sozialversicherungen/eo-msv/grundlagen-und-gesetze/betreuung-beeintraechtigte-kinder/faq-betreuende-angehoerige.html.
32. Sunderbrink B. Trauer – kulturhistorisch. In: Wittwer H, Schäfer, D., & Frewer, A. , editor. Handbuch Sterben und Tod Geschichte – Theorie – Ethik. 2. Auflage. Berlin: J.B. Metzler Verlag © Springer-Verlag GmbH; 2020. p. 241-5.
33. Frankl V. Zeiten der Besinnung. Gleichnisse. Zusammengestellt, ergänzt und kommentiert von Elisabeth Lukas München, Salzburg: Benevento Publishing; 2023.
34. Chochinov HM, Hack T, Hassard T, Kristjanson LJ, McClement S, Harlos M. Dignity therapy: a novel psychotherapeutic intervention for patients near the end of life. J Clin Oncol. 2005;23(24):5520-5.
35. Seiler A, Milliken A, Leiter RE, Blum D, Slavich GM. The Psychoneuroimmunological Model of Moral Distress and Health in Healthcare Workers: Toward Individual and System-Level Solutions. Compr Psychoneuroendocrinol. 2024;17:100226.
36. Charon R. Narrative MedicineA Model for Empathy, Reflection, Profession, and Trust. JAMA. 2001;286(15):1897-902.
37. Charon R. Narrative medicine in the international education of physicians. Presse Med. 2013;42(1):3-5.
38. Nagel T. Death. In: Mortal questions. Cambridge University Press. 2012:1-10.
39. Heidegger M. Sein und Zeit. Tübingen: Max Niemeyer Verlag; 1927.
40. Sartre J-P. L’être et le néant. Paris: Gallimard; 1943.
41. Rosenzweig F. Der Stern der Erlösung. Frankfurt: Surhkamp; 1988.
42. Yalom ID. Existenzielle Psychotherapie. Bergisch-Gladbach: EHP; 1980.
43. Grieser J. Der Tod und das Leben. Vergänglichkeit als Chance zur Entwicklung von Lebendigkeit. Giessen: Psychosozial Verlag; 2018.
44. Grieser J. Die Bewältigung des Todes in der psychischen Entwicklung (Coping with death in mental development). Forum der Psychoanalyse. 2019;35.
45. Riemann F. Grundformen der Angst. München: Ernst Reinhardt GmbH Verlag; 1961.
46. Erikson EH. Identity: youth and crisis. Oxford, England: Norton & Co.; 1968.
47. Yalom ID. Staring at the sun: Overcoming the terror of death. The Humanistic Psychologist. 2008;36(3-4):283-97.
48. Seiler A, Pelz S, Wolfensberger F, Hertler C, Schettle M, Schlögl M, et al. [End-of-Life Dreams and Visions]. Praxis (Bern 1994). 2023;112(5-6):297-303.
49. Peng-Keller S, Moergeli H, Hasenfratz K, Naef R, Rettke H, Hefti R, et al. Including the Spiritual Dimension in Multimodal Pain Therapy. Development and Validation of the Spiritual Distress and Resources Questionnaire (SDRQ). Journal of Pain and Symptom Management. 2021;62(4):747-56.
50. Luhmann N. Funktion der Religion. Frankfurt am Main: Suhrkamp; 1986.
51. Hilt A. Die Praxis der ars moriendi oder die Erfahrung, leben zu lernen und sterben zu können. Philosophische Rundschau. 2008;55(4):307-31.
52. Seneca LA. Epistulae morales 77. In: Giebel M, editor. Epistulae morales ad Lucilium Briefe an Lucilius über Ethik: Reclam; 2014. p. 19.
53. Leget C. Der innere Raum. Wie wir erfüllt leben und gut sterben können. Ostfildern: Patmos Verlag; 2021.
54. Peng-Keller S. Interprofessionelle und spezialisierte Spiritual Care. In: Anja Mehnert-Theuerkauf AL-L, Annina Seiler, Josef Jenewein, editor. Psychoonkologie in der palliativen Versorgung – Ein Praxishandbuch. Stuttgart: Kohlhammer; 2022. p. 197-209.
55. Religion [Internet]. Sektion Demografie und Migration. 2024 [cited 08.04.2024]. Available from: https://www.bfs.admin.ch/bfs/de/home/statistiken/bevoelkerung/sprachen-religionen/religionen.html.
56. Peng-Keller S. Sinnereignisse in der Todesnähe. Traum- und Wachvisionen Sterbender und Nahtoderfahrugen im Horizont von Spiritual Care. Berlin/Boston: De Gruyter; 2017.
57. Kestenbaum A, Fitchett G, Galchutt P, Labuschagne D, Varner-Perez SE, Torke AM, et al. Top Ten Tips Palliative Care Clinicians Should Know About Spirituality in Serious Illness. J Palliat Med. 2022;25(2):312-8.
58. Delgado-Guay MO, Chisholm G, Williams J, Frisbee-Hume S, Ferguson AO, Bruera E. Frequency, intensity, and correlates of spiritual pain in advanced cancer patients assessed in a supportive/palliative care clinic. Palliat Support Care. 2016;14(4):341-8.
59. Borneman T, Ferrell B, Puchalski CM. Evaluation of the FICA Tool for Spiritual Assessment. J Pain Symptom Manage. 2010;40(2):163-73.
60. Clark D. An annotated bibliography of the publications of Cicely Saunders–1: 1958–67. Palliative Medicine. 1998;12(3):181-93.
61. Why Doctors Need to Talk about Death. New England Journal of Medicine. 2024;390(7):e15.
62. Grieser J. Über den Tod sprechen [Talking about death]. Forum Der Psychoanalyse. 2023;39(2):189–203.
63. Peng-Keller S. Umgang mit Hoffnung. In: Bally K, et al., editor. Handbuch Palliativmedizin. 4., aktualisierte und ergänzte Auflage. Bern: Hogrefe; 2021. p. 291-7.
64. Leiter RE. The power of hope. Cell. 2023;186(8):1518-22.
65. Seiler A, Hertler C, Schettle M, Amann M, Jenewein J, Blum D. Die Würde generierende Kraft der Erzählung am Lebensende am Beispiel der Dignity Therapie. palliativech. 2022;4:13-7.
66. Anandarajah G, Hight E. Spirituality and medical practice: using the HOPE questions as a practical tool for spiritual assessment. Am Fam Physician. 2001;63(1):81-9.
67. Auchter T. Trauer. Giessen: Psychosozial-Verlag; 2019.
68. Götze H, Seiler A. Psychische Belastungen der Partner und Angehörigen. In: Mehnert-Theuerkauf/Lehmann-Laue/Seiler/Jenewein, editor. Psychoonkologie in der palliativen Versorgung – Ein Praxishandbuch: Verlag W. Kohlhammer; 2022. p. 102 – 23.
69. Rosner R. 7 Anhaltende Trauerstörung. 2018 2018/10/12. In: Praxisbuch Psychotraumatologie [Internet]. Stuttgart: Georg Thieme Verlag KG. 1. Auflage. Available from: http://www.thieme-connect.de/products/ebooks/lookinside/10.1055/b-0038-163415.
70. Jung CG. Seele und Tod. In: Jung CG, editor. Schriften zu Spiritualität und Transzendenz. Ostfildern: Patmos; 1934. p. 229–39.