Ein Rektumprolaps ist meist eine Erkrankung des älteren Menschens und tritt gehäuft bei Frauen auf. Den Kolleginnen und Kollegen in der Hausarztpraxis kommt bei der Erkennung und Einleitung der Therapie eine tragende Rolle zu. Viel Leid und pflegerischer Aufwand können durch eine adäquate Therapie vermindert und gelindert werden. Um den Rektumprolaps zu beheben, kann eine perineale Operation, immer häufiger aber eine minimalinvasive transabdominale Netzrektopexie, durchgeführt werden. Die Operation kann schonend bis ins hohe Patientenalter durchgeführt und angestrebt werden. Heutzutage obliegt die endgültige Behandlung einem Beckenbodenzentrum, das interdisziplinär die Expertise zur vollumfänglichen Diagnostik und Therapie vorweisen kann.
Was ist ein Rektumprolaps?
Der Rektumprolaps entspricht einem Vorfall sämtlicher Wandschichten durch das Darmlumen und bei Fortschreiten der Erkrankung bis durch den Analkanal nach aussen. Man unterteilt den Rektumprolaps in drei Schweregrade (Tabelle 1).
Am Anfang der Erkrankung des Rektumprolapses steht die sogenannte Intussuszeption (auch innerer Rektumprolaps genannt). Als solcher wird eine innere Ausstülpung der Rektumwand bezeichnet, die nicht zu einer Protrusion durch den Anus führt. Bei diesen Personen stehen Symptome einer Entleerungsstörung im Vordergrund, die unter den Begriff «Obstructed Defecation Syndrome» (ODS) fallen.
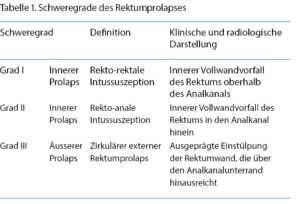
Vom Rektumprolaps Grad III soll ein reiner Mukosaprolaps bzw. Hämorrhoiden Grad III/IV (Analprolaps) unterschieden werden. Beim Hämorrhoidalprolaps handelt es sich um einen Vorfall der Hämorrhoidalpolster und des Anoderms, der durch die radiäre Fältelung einfach zu erkennen ist. Beim Rektumprolaps sind hingegen alle Darmwandschichten betroffen, was klinisch durch die zirkuläre Anordnung der Schleimhautfalten am prolabierenden Darmanteil charakterisiert ist (Abb. 1 und 2).
Welche Symptome kann der externe Rektumprolaps verursachen?
Zu den Symptomen zählen ein störendes Fremdkörpergefühl, je nach Ausprägung nur bei der Defäkation oder später dauerhaft. Entweder kommt es zu einer spontanen Reposition am Ende des Stuhlgangs oder es ist erforderlich, den Prolaps manuell zu reponieren. Mit der Zeit kann eine manuelle Reposition durch die Grössenzunahme deutlich erschwert sein. Eine Inkarzeration des Prolapses ist ein seltener Notfall und kann durch Schleimhautödem und Ischämie bis zu einer Nekrose kompliziert werden. Kann der Prolaps vor dem Auftreten von irreversiblen Veränderungen mit konservativen Möglichkeiten nicht verbessert werden, wird eine dringende chirurgische Korrektur erforderlich. Weitere häufige Symptome sind schleimiger Ausfluss und Stuhlschmieren bis zur kompletten Stuhlinkontinenz. Die Entwicklung einer Stuhlinkontinenz bei Rektumprolaps ist hierbei multifaktoriell bedingt: mechanische Dehnung der Schliessmuskeln, pudendale Neuropathie, chronische Stimulation des rektoanalen Hemmreflexes und beeinträchtigte rektoanale Motilität führen zu einem niedrigen analen Ruhedruck [1]. Bei Vorliegen von Schleimhautverletzungen durch mechanische Reizung können leichte Kontaktblutungen entstehen, die meistens selbstlimitierend sind, aber Betroffene sowie das soziale Umfeld stark beunruhigen. Weichteilinfekte sind äusserst selten und entstehen meistens als Folge von ungenügender oder erschwerter Hygiene.
Was ist ein obstruktives Defäkationssyndrom (ODS) und welche Ursachen hat es?
Unter einem obstruktiven Defäkationssydrom versteht man einen klinischen Zustand gekennzeichnet durch Schwierigkeiten bei der Stuhlentleerung und das Gefühl einer unvollständigen Entleerung des Darms. Dies kann zu übermässiger Anstrengung, Abhängigkeit von Abführmitteln und/oder Einläufen, erfolglosen Stuhlentleerungen mit längeren Aufenthalten auf der Toilette und wiederholtem Aufsuchen der Toilette führen [2]. Nicht selten neigen die PatientInnen dazu, die Stuhlentleerung durch vaginale oder rektale Manipulation oder durch Dammdruck zu unterstützen. Grundsätzlich kann ein ODS durch mechanische und funktionelle Ursachen verursacht werden. Zu den strukturellen, mechanischen Ursachen gehören die ventrale Rektozele und die Intussuszeption, aber auch extraintestinale Ursachen wie die Enterozele, die Beckenbodensenkung sowie der Gebärmutter-oder Scheidenprolaps [3]. Primär funktionelle Ursache wie z.B. ein Anismus (rektoanale Dyssynergie) müssen ausgeschlossen werden.
Welche Faktoren begünstigen die Entstehung eines Rektumprolapses?
Eine Reihe von Faktoren können mit dem Rektumprolaps in Verbindung gebracht werden (Tabelle 2), und in der Mehrheit der Fälle ist die Krankheit multifaktorieller Genese.
In der jüngeren Patientengruppe tritt der Rektumprolaps gehäuft bei schwerer Obstipation und anhaltendem Pressen auf. Bei Älteren entwickelt sich der Rektumprolaps in Zusammenhang mit einer Schwäche des Beckenbodens und wird oft von weiteren Krankheiten des Beckenbodens begleitet. Die Schwächung des Beckenbodens ist häufig mit dem weiblichen Geschlecht und mehrfachen Geburten vergesellschaftet.
Diagnostik des Rektumprolapses
Anamnese und Untersuchung
Eine gründliche und detaillierte Anamnese ist von entscheidender Bedeutung, denn oft scheuen sich die Betroffenen, über Symptome einer proktologischen Erkrankung oder Beckenbodenschwäche zu berichten. Neben Stuhlgewohnheiten sollte nach Juckreiz und Brennen perianal, Schmerzen während und nach der Defäkation sowie Blutabgang ab ano gefragt werden, um sich ein umfassendes Bild der Beschwerden machen zu können. Patientinnen und Patienten, die für Defäkationsbeschwerden in der proktologischen Sprechstunde abgeklärt werden, sollten anhand von validierten Fragebögen befragt werden. Messinstrumente wie z.B. der «Cleveland Constipation»-Score, Vaizey und Wexner-Score oder der ODS-Score ermöglichen eine standardisierte, objektive Beurteilung der Initialsituation und vor allem den Verlauf während und nach der Therapie. Die proktologische Anamnese sollte durch die Erhebung von gynäkologischen und urologischen Symptomen ergänzt werden.
Durch eine gute und strukturierte Anamnese kann in den meisten Fällen bereits eine Verdachtsdiagnose gestellt werden, die durch eine fokussierte proktologische Untersuchung bestätigt werden kann. Bei der Inspektion können Folgen einer erschwerten analen Hygiene und Inkontinenz wie z.B. Ekzem, Kratzspuren oder Rhagaden festgestellt werden. Bei der digital-rektalen Untersuchung kann eine vordere Rektozele und deren Schweregrad bestätigt werden. Des Weiteren sollte die Schliessmuskelfunktion geprüft werden. Die fehlende Sphinkterrelaxation beim Pressversuch kann auf einen Anismus hinweisen (rektoanale Dyssynergie). Wenn der Prolaps bei der Inspektion nicht sichtbar ist oder beim Pressversuch nicht ausgelöst werden kann, sollten die Betroffenen versuchen, am besten auf einer Toilette, den Prolaps zu reproduzieren.
Patientinnen mit Störungen des vorderen Kompartiments und Patienten mit Harninkontinenz können von einer urodynamischen und urogynäkologischen Untersuchung profitieren, um einen kombinierten chirurgischen Eingriff zu ermöglichen.
Weiterführende Diagnostik
Im Allgemeinen ist eine flexible Endoskopie ratsam, um eine Neoplasie oder andere Läsionen als Ursache des Prolapses und/oder der Entleerungsstörung auszuschliessen. Eine Ulzeration der anterolateralen Rektumwand hinweisend auf ein solitäres Rektum-Ulkus-Syndrom sollte biopsiert und der Befund einer ausgedehnten Divertikelkrankheit sollte bei einer entsprechenden Klinik bei der Planung der chirurgischen Behandlung berücksichtigt werden.
Neben der dynamischen Barium-Röntgenuntersuchung, die in der physiologischen Toilettenposition durchgeführt wird, wird heutzutage zunehmend eine Magnetresonanz-Defäkografie in Rückenlage angeboten. Diese Untersuchung ermöglicht eine umfassende Beurteilung sämtlicher Kompartimente des Beckenbodens und der Beckenbodenmuskulatur. Die Befunde der dynamischen Defäkografie sollen immer in Zusammenhang mit der Anamnese und der klinischen Untersuchung interpretiert werden, da abnormale Befunde in bis zu 67 % der Normalbevölkerung beschrieben wurden [4].
Die anorektale Manometrie hat bei der Abklärung eines Prolapses eher eine untergeordnete Rolle und dient vor allem dem Ausschluss eines möglichen Anismus und der Beurteilung der Schliessmuskelfunktion bei Stuhlinkontinenz.
Bei Patientinnen und Patienten mit ODS, bei denen der Verdacht auf eine Begleiterkrankung besteht, können zusätzliche Untersuchungen angefordert werden, wie zum Beispiel die Kolontransitzeit (Hinton-Test) bei Patientinnen und Patienten mit Verstopfung, oder eine Elektromyografie, die aber in der klinischen Praxis eher eine untergeordnete Rolle spielt.
Therapie und Indikationsstellung
Konservative Therapie
Die konservative Therapie nimmt bei einem ODS einen grossen Stellenwert ein und sollte in erster Linie auch bei Vorliegen einer niedriggradigen Intussuszeption oder anderen strukturellen Anomalien, deren klinische Signifikanz unklar ist, stets versucht werden. Als erstes sollte immer eine Stuhlregulierung erfolgen. Zudem sollten die Patientinnen und Patienten zu Lifestyle-Veränderungen (diätetische Massnahmen, Defäkationsschulung, Bewegung) beraten werden. Beckenbodenmuskeltraining kann durch Biofeedback ergänzt werden und ist eine weitere Therapiealternative, die vor allem bei Frauen mit Harninkontinenz und Prolapserkrankungen untersucht wurde, aber im Allgemeinen bei Krankheiten des Beckenbodens mit Defäkationsstörungen eingesetzt werden kann. Je nach Schweregrad der Symptome und der bildgebenden Befunde müssen etwa 42 % der Patienten mit ODS operativ behandelt werden [5].
Die Behandlung des externen Rektumprolapses bei erwachsenen Patienten erfolgt hingegen im Wesentlichen chirurgisch. Auch betagte gebrechliche Patientinnen und Patienten mit erhöhtem perioperativem Risiko können von den modernen, schonenden chirurgischen Techniken profitieren, die auch ohne Vollnarkose durchgeführt werden können. Die konservative Therapie des Rektumprolapses ist Personen vorbehalten, die sich nach ausführlicher Besprechung und Aufklärung durch Spezialistinnen und Spezialisten gegen eine Operation entscheiden oder bei denen, z.B. aufgrund eines fortgeschrittenen Leidens oder eines hohen Grades an Abhängigkeit, eine Verbesserung der Lebensqualität nicht zu erwarten ist. In diesen Fällen steht die Verbesserung der Stuhlkontinenz und der Schutz der perianalen Haut im Vordergrund.
Operative Therapie
Ziel der operativen Behandlung der Intussuszeption und des Rektumprolapses ist die Wiederherstellung der «normalen» Anatomie, die Verbesserung des Defäkations-und des Kontinenzverhaltens und die Vermeidung neuer Darmstörungen [1]. Die Rationale für die verschiedenen verfügbaren chirurgischen Techniken ergibt sich aus einigen anatomischen Merkmalen, die konstante Befunde bei Personen mit Prolapserkrankungen sind: Invagination bzw. Prolaps sämtlicher Wandschichten, ein tiefer Douglas-Raum, mangelhafte Fixierung des Rektums am Sakrum, ein verlängertes Colon sigmoideum und eine allgemeine Schwäche des Beckenbodens mitsamt der Schliessmuskeln.
Die Verfahren lassen sich in abdominale und perineale Eingriffe unterteilen. Die Entscheidung, welche Operation für welche Person am besten geeignet ist, hängt in der Regel von dem Alter und den Komorbiditäten der Patientin/ des Patienten, der Präferenz und Erfahrung des Chirurgen sowie der Entleerungsstörung ab. Im Folgenden werden wir die Verfahren vorstellen, die in der Praxis üblich sind und am häufigsten in der Literatur erwähnt werden.
Perineale Operationsverfahren
Perineale Eingriffe werden meistens älteren und komorbiden Personen vorbehalten, die keine Kandidaten für abdominale Verfahren sind, da diese auch unter Regionalanästhesie (Spinal-oder Sattelblock) durchführbar sind. In der Literatur sind diese Operationsmethoden durch eine niedrige Morbiditätsrate im Vergleich zu abdominalen Techniken, dagegen durch eine höhere Rezidivrate gekennzeichnet [6].
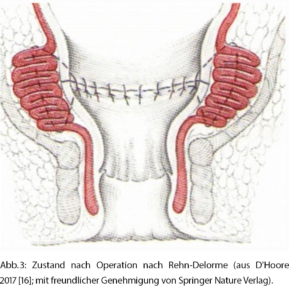
Bei der Rehn-Delorme-Technik wird die Mucosa des prolabierten Rektums inzidiert und von der Muscularis propria entfernt. Durch longitudinale Nähte wird die Rektumwand plikiert und gekürzt. Die Schleimhautmanschette wird dann über die geraffte Rektumwand adaptiert (Abb. 3). Vorteile dieser Technik sind das Vermeiden einer Anastomose und die Augmentation des Sphinkterkomplexes, was häufig zu einer Verbesserung der Stuhlinkontinenz führt. Die Prolapsrezidivrate nach einer Rehn-Delorme-Operation beträgt aber 20–40 % [7].
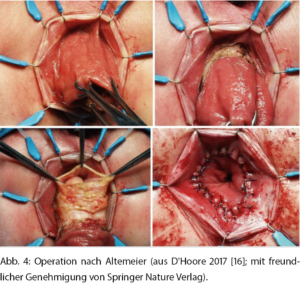
Die Operation nach Altemeier beinhaltet eine Resektion des überschüssigen Darms und eine koloanale Resektion (sog. perineale Rektosigmoidektomie) (Abb. 4). Diese Technik, die in Nordamerika vermehrt eingesetzt wird, eignet sich besser zur Behandlung längerer Rektumprolapse und ist auch in dem seltenen Fall eines inkarzerierten Rektumprolapses mit Wandnekrose indiziert.
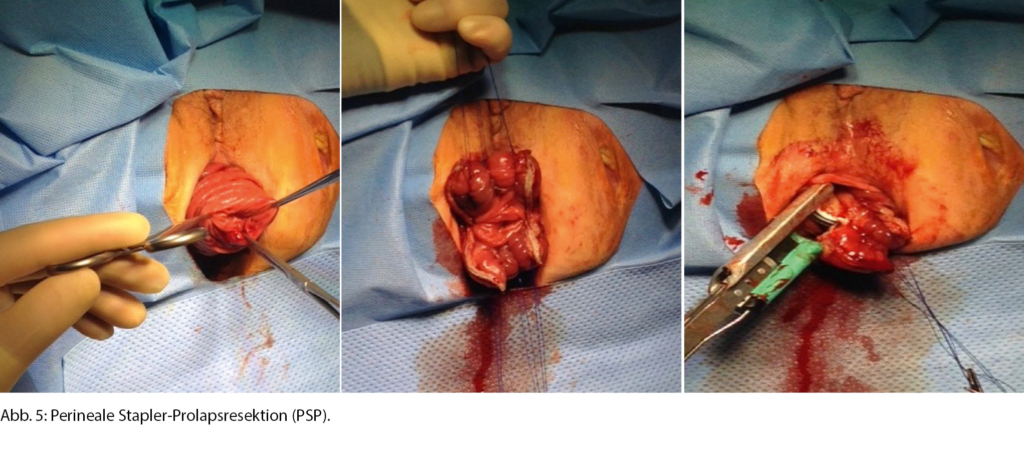
Hervorzuheben aus unserer Sicht ist hierbei das Perineale Stapler-Prolapsresektion(PSP)-Verfahren. Bei dieser Technik wird der Rektumprolaps nach aussen gestülpt und anschliessend mit Spezialstaplern abgetragen und gleichzeitig verbunden (Abb. 5). Diese Technik ähnelt der Altemeier-Resektion und gilt als sicheres, schnelles und einfaches Verfahren für Hochrisikopatientinnen und -patienten [8].
Abdominale Verfahren
Abdominale Verfahren werden heutzutage aufgrund der niedrigen Rezidivrate und besseren funktionellen Resultate zunehmend eingesetzt. Nach einer systematischen Cochrane-
Metaanalyse scheinen abdominale Zugänge zu einer geringeren Rezidivrate bei Prolapsen zu führen. Stuhlinkontinenz ist nach abdominalen Zugängen weniger häufig, da die Reservoirfunktion des Enddarms erhalten wird [9].
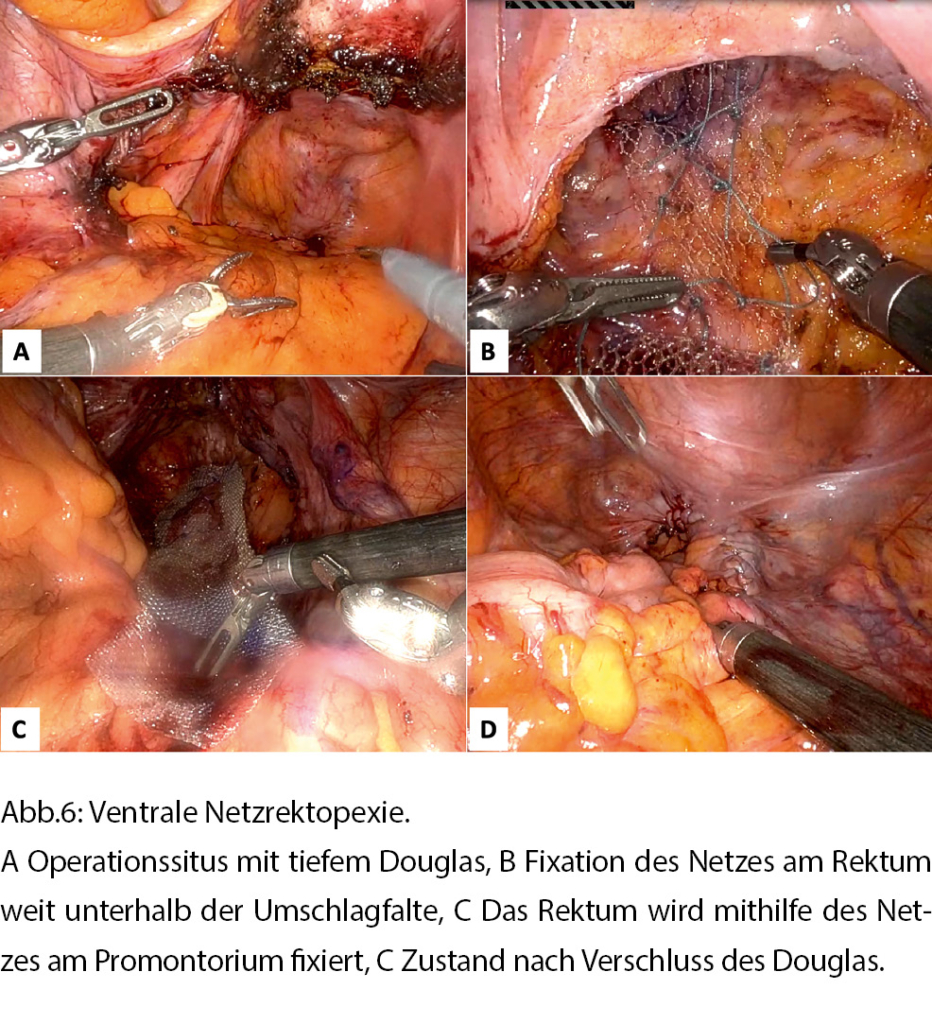
Die Verfahren unterscheiden sich hauptsächlich durch die Methode der Fixierung während der Rektopexie (Naht oder Netz), die Platzierung des Netzes (anterior, posterior, das Rektum vollständig oder teilweise umschliessend), das Ausmass der rektalen Mobilisierung und in der Durchführung einer Darmresektion. Auch das Material des Netzes, das für die Rektopexie verwendet wird, kann variieren, und in den letzten Jahren hat die Verwendung von biologischen Netzen oder vollständig resorbierbarem Material aufgrund der möglichen Komplikationen durch Kunststoffnetze zugenommen. Die minimal-invasive ventrale Netzrektopexie nach D’Hoore hat sich in Europa weit verbreitet und ist zum Verfahren der Wahl zur Korrektur des Rektumprolapses geworden [10, 11]. Bei dieser Technik wird das Rektum mithilfe eines Netzes, das anterior am Rektum weit unterhalb der Umschlagfalte sowie am Promontorium fixiert wird, gestreckt (Abb. 6). Der Hauptvorteil des ventralen Zugangs ist die sparsame Mobilisation des Rektums und die Schonung der Innervation, was zu einer Verbesserung der Darmfunktion bezüglich Verstopfung und Stuhlinkontinenz führt.
Eine grosse multizentrische Serie zu diesem Verfahren mit 919 Personen, wovon ca. ⅓ mit einem externen Prolaps, zeigte eine 10-Jahres-Rezidivrate von ca. 8 %. Sowohl die Inkontinenz als auch die Symptome eines ODS waren postoperativ signifikant reduziert [12].
Die Resektionsrektopexie (nach Frykman-Goldberg) wird insbesondere für Personen mit Sigma elongatum und «slow transit constipation» angeboten. Eine prospektive Kohortenstudie konnte allerdings nach laparoskopischer Resektionsrektopexie keine Verbesserung der Transitzeit beweisen. Diese Arbeit stellt die Rolle der Resektion bei der Behandlung des Rektumprolapses in Frage und unterstützt weniger invasive chirurgische Verfahren wie die ventrale Netzrektopexie [13].
Die posteriore Nahtrektopexie ist eine weit verbreitete Technik, die vor allem dann zum Einsatz kommt, wenn Operierende oder Behandelte vorziehen, auf ein Netz zu verzichten. Das Rektum wird zunächst bis zum Beckenboden mobilisiert und dann mit nicht resorbierbaren Nähten an der präsakralen Faszie und dem sakralen Promontorium fixiert.
In einer randomisierten Studie hat sich allerdings gezeigt, dass das funktionelle Ergebnis nach einer ventralen Netzrektopexie bei Personen mit vollständigem Rektumprolaps signifikant besser ist als bei denjenigen mit einer posterioren Nahtrektopexie [14].
Ob die abdominalen Verfahren nur jungen, fitten Personen vorbehalten werden sollten, wird in den letzten Jahren aufgrund der ernüchternden Ergebnisse bezüglich Rezidivrate von perinealen Verfahren und sehr tiefen Komplikationsraten von minimal-invasiven Techniken zunehmend in Frage gestellt [15].
Im Artikel verwendete Abkürzungen
ODS Obstructive Defecation Syndrome (obstruktives Defäkationssydrom)
PSP Perineale Stapler-Prolapsresektion
Klinik für Allgemein- und Viszeralchirurgie, Bauchzentrum
Interdisziplinäre Beckenbodensprechstunde
Kantonsspital Baselland
Rheinstrasse 26
4410 Liestal
raffaele.galli@ksbl.ch
Historie
Manuskript akzeptiert: 30.01.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
ORCID
Raffaele Galli
https://orcid.org/0000-0003-4644-307X
1. Bordeianou L, Paquette I, Johnson E, et al. Clinical Practice Guidelines for the Treatment of Rectal Prolapse. Dis Colon Rectum. 2017;60(11):1121–1131.
2. Santoro G.A, Di Falco G. Update in the evaluation of outlet obstruction. Benign Anorectal Diseases; diagnosis with endoanal and endorectal ultrasound and new treatment options. Springer Verlag; 2006:205–258.
3. D’Hoore A, Penninckx F. Obstructed defecation. Colorectal Disease. 2003;5:280–287.
4. Freimanis MG, Wald A, Caruana B, Bauman DH. Evacuation proctography in normal volunteers. Invest Radiol. 1991;26(6): 581–585.
5. Kapoor DS, Sultan AH, Thakar R, et al. Management of complex pelvic floor disorders in a multidisciplinary pelvic floor clinic. Colorectal Disease 2008;10(2):118–123.
6. Smedberg J, Graf W, Pekkari K, Hjern F. Comparison of four surgical approaches for rectal prolapse: multicentre randomized clinical trial. BJS Open. 2022;6;6(1):zrab140.
7. Watts AM, Thompson MR. Evaluation of Delorme’s procedure as a treatment for full-thickness rectal prolapse. Br J Surg. 2000;87(2):218–222.
8. Hummel B, Hardt J, Bischofberger S, et al. New kid on the block: perineal stapled prolapse resection (PSP) is it worthwhile in the long-term? Langenbecks Arch Surg. 2016;401(4): 519–29.
9. Tou S, Brown SR, Nelson RL. Surgery for complete (full-thickness) rectal prolapse in adults. Cochrane Database Syst Rev. 2015;2015(11):CD001758.
10. D’Hoore A, Cadoni R, Penninckx F. Long-term outcome of laparoscopic ventral rectopexy for total rectal prolapse. Br J Surg. 2004;91(11):1500–1505.
11. Reche F, Faucheron JL. Laparoscopic ventral rectopexy is the gold standard treatment for rectal prolapse. Tech Coloproctol. 2015;19(10):565–6.
12. Consten EC, van Iersel JJ, Verheijen PM, et al. Long-term outcome after laparoscopic ventral mesh rectopexy: an observational study of 919 consecutive patients. Ann Surg. 2015; 262(5):742–747.
13. El Muhtaseb MS, Bartolo DC, Zayiae D, Salem T. Colonic transit before and after resection rectopexy for full-thickness rectal prolapse. Tech Coloproctol. 2014;18(3):273–276.
14. Hidaka J, Elfeki H, Duelund-Jakobsen Laurberg S, Lundby L. Functional outcome after laparoscopic posterior sutured rectopexy versus ventral mesh rectopexy for rectal prolapse: six-year follow-up of a double-blind, randomised single-centre study. EClinicalMedicine 2019.
15. Wijffels N, Cunningham C, Dixon A, Greenslade G, Lindsey I. Laparoscopic ventral rectopexy for external rectal prolapse is safe and effective in the elderly. Does this make perineal procedures obsolete? Colorectal Dis. 2011;13(5):561–566.
16. D’Hoore A. Rectal Prolapse, Intussusception, Solitary Rectal Ulcer. In: Herold A, Lehur PA, Matzel K, O’Connell P. (eds) Coloproctology. European Manual of Medicine. Springer Verlag: 2007.