Einführung
Die Behandlung der Osteoporose hat sich in den letzten Jahren stark verändert, insbesondere durch die Verfügbarkeit neuer osteoanaboler Substanzen (Abaloparatid, Romosozumab) und zahlreicher Generika von Teriparatid. Zudem haben neue Behandlungssequenzen, die Differenzierung der Erstlinientherapie gemäss dem Frakturrisiko (mässig, hoch oder sehr hoch) und das Konzept der therapeutischen Zielgrösse – basierend auf der Knochenmineraldichte (BMD) – Eingang in den klinischen Alltag gefunden. Die Zeiten, in denen alle Patienten routinemässig auf unbestimmte Zeit mit Bisphosphonaten behandelt wurden, sind also definitiv vorbei. Diese Änderungen haben jedoch eine Komplexität eingeführt, die für Ärzte, die nicht auf Osteoporose spezialisiert sind, manchmal entmutigend ist und zu einem Zögern, eine Osteoporosebehandlung einzuleiten, führen kann. Auch die Angst vor Nebenwirkungen bestimmter Behandlungen, wie z. B. der Osteonekrose des Kiefers, die bei der Behandlung von Osteoporose äusserst selten vorkommt (1/10 000 Behandlungsjahre), hält Patienten und Ärzte davon ab, diese Krankheit richtig zu behandeln. Das Ergebnis ist, dass trotz nachgewiesener frakturreduzierender Wirkung (1) nur etwa eine von fünf Frauen, die an Osteoporose leiden, in der Schweiz behandelt wird. Noch bedauerlicher ist, dass nur eine Minderheit der fast 100 000 Brüche, die jährlich in der Schweiz auftreten, zur Diagnose und Behandlung einer Osteoporose führt, auch wenn die Entwicklung eines nationalen Netzwerks von Fracture Liaison Services (FLS) unter der Schirmherrschaft der Schweizerischen Vereinigung gegen Osteoporose (SVGO/ASCO) hierfür langsam Abhilfe schafft.
Präventive Massnahmen wie die Beachtung einer genügenden Kalziumzufuhr bzw. eine bedarfsgerechte Kalzium-/Vitamin-D-Supplementation bilden die Grundlage jeder Osteoporosebehandlung und sind für eine optimale Wirkung medikamentöser Behandlungen wichtig.
In diesem Übersichtsartikel sollen die Wirkmechanismen und die klinische Wirksamkeit antiresorptiv und osteoanabol wirkender Präparate zusammengefasst und deren Stellenwert in der Osteoporosetherapie diskutiert werden.
Medikamentöse Therapieoptionen
Antiresorptiv-wirkende Therapien
Menopausale Hormontherapie
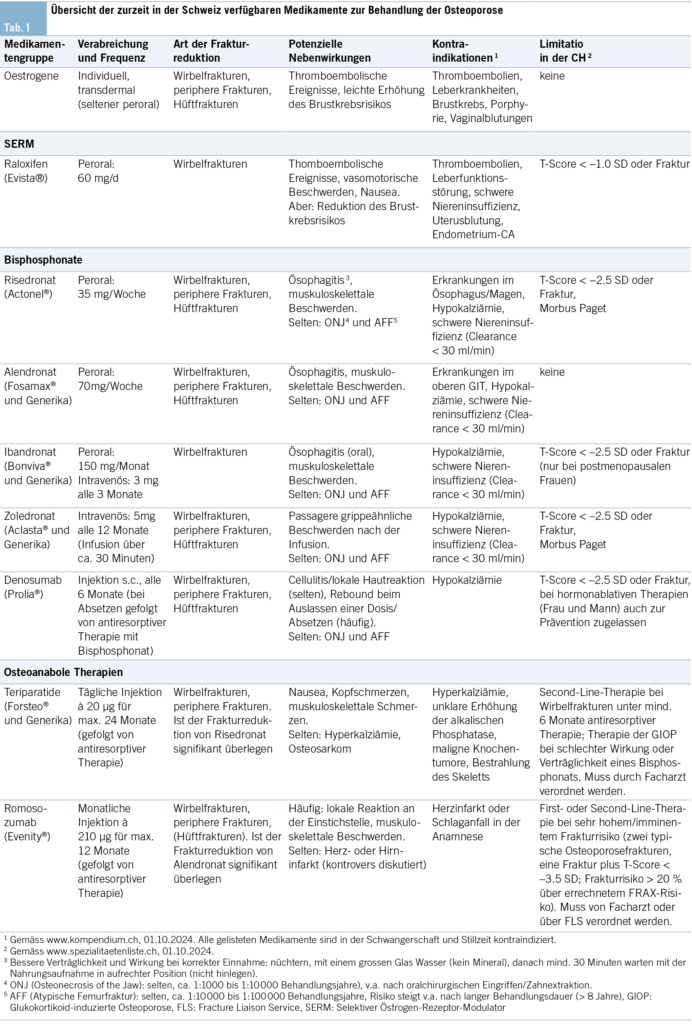
Zu den antiresorptiven Therapien zählen Medikamente, die die Knochenresorption, also den durch Osteoklasten vermittelten Knochenabbau, verhindern (Tab 1). Die postmenopausale Hormontherapie (Östrogene mit/ohne Progesteron), die oft als milde antiresorptive Therapie gewertet wird, geriet in den letzten Jahren zu Unrecht in Vergessenheit, obwohl sie auch bei Frauen einer Normalpopulation ohne erhöhtes Frakturrisiko das Risiko für Wirbel-, periphere und Hüftfrakturen signifikant um 25–35 % senkt (2). Die Hauptindikation der postmenopausalen Hormontherapie ist in erster Linie die Reduktion von klassischen klimakterischen Beschwerden wie Hitzewallungen, Schlafstörungen oder Stimmungsschwankungen, aber eine tiefe Knochendichte ist im klinischen Alltag oft ein zusätzliches Argument für deren Einsatz.
Selektive Östrogen-Rezeptor-Modulatoren (SERM)
Selektive Östrogen-Rezeptor-Modulatoren (SERM) haben sowohl agonistische (Knochen) als auch antagonistische Eigenschaften (Brust, Gebärmutter) am Östrogenrezeptor. In der Schweiz ist einzig Raloxifen (Evista©) in einer Dosis von 60 mg täglich zugelassen. Bei postmenopausalen Frauen mit Osteoporose senkt Raloxifen das Risiko vertebraler Frakturen um ca. 40 % (3). Eine Reduktion von nicht vertebralen Frakturen konnte auch in der Langzeitanwendung nicht beobachtet werden, auch wenn die BMD an der Hüfte, verglichen mit Placebo, leicht zunimmt (4). Der Effekt der Therapie hält auch 8 Jahre nach Therapiebeginn noch an und scheint insbesondere bei jüngeren postmenopausalen Frauen vorhanden zu sein (5). Als positive Nebenwirkung vermindert Raloxifen das Risiko von ER-positivem Brustkrebs und garantiert einen adäquaten Endometriumschutz, was die Anwendung insbesondere bei Frauen mit erhöhtem Brustkrebsrisiko attraktiv gestaltet. Andererseits können klimakterische Beschwerden unter Raloxifen verstärkt sein, und es besteht wie bei einer oralen postmenopausalen Hormontherapie ein erhöhtes Risiko für venöse thromboembolische Ereignisse.
Bisphosphonate
Die Bisphosphonate sind die bekanntesten und meist angewendeten Medikamente in der Prävention und Therapie der Osteoporose. Bisphosphonate werden in der Knochenoberfläche eingebaut, wodurch sie eine lange Halbwertszeit (1–10 Jahre) aufweisen. Risedronat und Alendronat werden peroral verwendet, Zoledronat intravenös appliziert, und bei Ibandronat gibt es eine orale wie auch eine intravenöse Formulierung. Bisphosphonate reduzieren das Risiko von vertebralen Frakturen um rund 50–70 % und von Hüftfrakturen um ca. 30–50 % (6). Orale Bisphosphonate können zu Reizungen im oberen Gastrointestinaltrakt (Refluxbeschwerden) führen, die mit korrekter Einnahme reduziert, aber nicht immer vollständig eliminiert werden können. Auch für die Wirksamkeit ist eine korrekte Einnahme essenziell, da die Bioverfügbarkeit mit ungefähr 0,6 % sehr tief ist.
Werden orale Bisphosphonate nicht toleriert oder ist die Therapieadhärenz nicht gegeben, hat sich der Einsatz parenteraler Bisphosphonate bewährt. Beachtenswert sind Daten zu Zoledronat mit dokumentierter frakturreduzierender Wirkung bei älteren Frauen nach Schenkelhalsfraktur und der Beobachtung der Mortalitätssenkung und Reduktion des kardiovaskulären Erkrankungsrisikos (1, 7).
Zoledronat kann einige Tage nach der Infusion zu grippe-ähnlichen Symptomen führen, die jedoch selbstlimitierend sind und symptomatisch behandelt werden (NSAID, Paracetamol). Oft wird diese Nebenwirkung nur bei der ersten Infusion beobachtet. Kieferosteonekrosen (0.2–10 pro 10 000 Patientenjahre) und atypische Femurfrakturen sind unerwünschte Ereignisse, die selten nach Bisphosphonaten auftreten. Die Häufigkeit atypischer Femurfrakturen steigt mit der Dauer der Bisphosphonattherapie (2–5 pro 10 000 Patientenjahre in den ersten 3 Jahren; 13 pro 10 000 Patientenjahre bei einer Behandlungsdauer von > 8 Jahren) (8). Das Risiko einer atypischen Femurfraktur sinkt im ersten Jahr nach Absetzen eines oralen Bisphosphonats um die Hälfte und um mehr als 80 % nach 3 Jahren, was darauf hindeutet, dass eine Medikamentenpause bei einer langfristigen Bisphosphonatbehandlung angemessen ist (1).
Denosumab
Denosumab ist ein monoklonaler Antikörper, der den RANK-Liganden reversibel bindet und dadurch die Differenzierung, die Aktivität und das Überleben der Osteoklasten hemmt. Denosumab führt klinisch zu einer schnellen und praktisch vollständigen Hemmung der Knochenresorption, einer kontinuierlichen Zunahme der Knochendichte über 10 Jahre und einer Reduktion von Wirbelfrakturen (ca. 70 %), peripheren Frakturen (ca. 20 %) und Hüftfrakturen (ca. 40 %) (9). Denosumab wird sehr gut toleriert und kann im Gegensatz zu den Bisphosphonaten auch bei eingeschränkter Nierenfunktion angewendet werden. Bei Auslassen einer Dosis bzw. bei Absetzen der Therapie ohne Folgebehandlung kommt es zu einer überschiessenden Knochenresorption mit akzeleriertem Knochenmassenverlust und erhöhtem Risiko für vertebrale Frakturen, was als Rebound-Effekt bezeichnet wird. Alternativ kann aufgrund der unter Denosumab anhaltenden frakturreduzierenden Wirkung bei geringem Risiko von Spätkomplikationen (Kiefernekrosen, atypische Femurfrakturen) eine Langzeitbehandlung insbesondere bei betagten Personen oder Patienten mit einer Niereninsuffizienz durchgeführt werden.
Osteoanabol-wirkende Therapien
Im Gegensatz zu antiresorptiv wirkenden Präparaten, die die Knochenmineraldichte und Knochenstärke durch Hemmung der Osteoklasten-vermittelten Knochenresorption verbessern, stimulieren osteoanabole Mittel direkt oder indirekt die Differenzierung und Aktivität der Osteoblasten, die neue Knochen bilden (10). Dies führt zu einer Zunahme der trabekulären und kortikalen Dicke, was erheblich zur Verbesserung der Widerstandsfähigkeit des Skeletts beiträgt. Beinahe 20 Jahre lang war das einzige verfügbare osteoanabole Mittel Teriparatid, ein PTH-Rezeptor-Agonist, der vor allem aufgrund seiner höheren Kosten nur als Zweitlinientherapie (nach Bisphosphonaten) eingesetzt werden konnte. Seitdem haben mehrere Studien zum Vergleich von Osteoanabolika zu oralen Bisphosphonaten eine bessere Wirksamkeit zur Verhinderung von Frakturen nachgewiesen, was auch in einer kürzlich veröffentlichten Metaanalyse bestätigt wurde (11). Dies hat dazu geführt, dass Teriparatid, aber auch die neuen osteoanabol-wirken den Substanzen (Romosozumab, Abaloparatid), als Erstlinientherapie bei sehr schwerer Osteoporose, insbesondere nach einer kürzlich erfolgten Fraktur, positioniert wurde (12). Es gibt jedoch erhebliche Unterschiede im Wirkmechanismus und in den klinischen Auswirkungen dieser osteoanabolen Präparate.
Parathormonrezeptor-Agonisten
Teriparatid
Teriparatid (TPT = PTH 1–34) als subkutane Injektion
(20 ug/d) hat eine kurze Wirkungsdauer, wodurch es vorwiegend die Knochenbildung stimuliert, jedoch mit einem sekundären Anstieg der Resorption assoziiert ist.
In der FPT-Studie wurde bei postmenopausalen Frauen, die an Osteoporose mit Wirbelfrakturen litten, mit TPT im Vergleich zu Placebo eine signifikante Verringerung der Wirbelfrakturen (relative Risikoreduktion [RRR] von 86 %) beobachtet (13). Weitere Analysen zeigten, dass TPT bei Patienten mit multiplen und schweren Wirbelfrakturen noch wirksamer war, was die Hauptindikation für seine Verschreibung in der klinischen Praxis darstellt. Bei nicht vertebralen Frakturen zeigte die TPT nach einer medianen Behandlungsdauer von 19 Monaten im Vergleich zu Placebo eine relative Risikoreduktion von 53 % (13). Allerdings war die Anzahl der nicht vertebralen Frakturen in der Studie begrenzt, und unter diesen war die FPT-Studie nicht aussagekräftig genug, um Unterschiede in der Inzidenz von Hüftfrakturen zu erkennen.
Eine aktuelle Metaanalyse von 23 randomisierten kontrollierten Studien mit 8644 Patienten zeigte eine geringere Inzidenz von Hüftfrakturen, die auf die Behandlung mit Teriparatid zurückzuführen waren, im Vergleich zu den Kontrollen (14). Es ist jedoch zu beachten, dass sich diese Metaanalyse auf insgesamt nur 34 Hüftfrakturen stützt und sie nicht eins zu eins auf Frauen mit postmenopausaler Osteoporose übertragbar ist, da sie auch einige Studien bei Männern und Patienten mit steroidinduzierter Osteoporose einschliesst.
In der VERO-Studie wurden Frauen mit hohem Frakturrisiko und prävalenten Wirbelfrakturen randomisiert und erhielten entweder TPT oder Risedronat (ein orales Bisphosphonat) (15). Nach 24 Monaten wurden unter TPT im Vergleich zu Risedronat signifikante Reduktionen der Rate an Wirbelfrakturen und klinischen Frakturen beobachtet.
Die häufigsten Nebenwirkungen unter dem Einsatz von TPT sind orthostatische Hypotonie, Palpitationen, Übelkeit, Beinkrämpfe und Kopfschmerzen. Es können biochemische Veränderungen auftreten wie Hyperkalzämie (3 %), Hyperkalziurie und ein Anstieg des Serumharnsäurespiegels. Es ist zu beachten, dass eine bereits vor Beginn der TPT bestehende Hyperkalzämie oder Hyperkalziurie mit Urolithiasis eine Kontraindikation für die Verschreibung des Medikaments darstellt.
Aufgrund dieser Ergebnisse empfehlen die SVGO/ASCO-Guidelines von 2020 die Behandlung mit TPT als erste oder zweite Wahl (nach einer Bisphosphonattherapie) bei Frauen mit hohem oder sehr hohem Frakturrisiko, die an einer osteoporotischen Wirbelfraktur leiden (12). Die Entwicklung von nachfüllbaren TPT-Biosimilars und in jüngster Zeit auch von TPT-Generika hat dazu geführt, dass TPT heute viel häufiger eingesetzt und leichter erstattet wird als früher. Die Befürchtung der unter TPT sich entwickelnden Osteosarkome wurde aufgrund der langjährigen klinischen Erfahrung ausgeräumt, und es ist heute theoretisch möglich, eine zweite TPT-Sequenz zu verabreichen, wenn dies erforderlich ist.
Abaloparatid
Abaloparatid (APT) ist ein PTH-Rezeptor-Agonist der zweiten Generation. Es ist ein Derivat von PTHrP, hat jedoch auf zellulärer Ebene etwas andere Signaleigenschaften als TPT. So induziert es eine Knochenbildung, die anfänglich der von TPT entspricht, jedoch weniger die Resorption stimuliert (16). Dies ermöglicht u.a. die Verabreichung einer höheren APT-Dosis (80 ug/d) ohne das Risiko einer Hyperkalzämie und führt zu potenziell günstigeren Auswirkungen auf den kortikalen Knochen, insbesondere auf den BMD-Zuwachs an der Hüfte.
Die ACTIVE-Studie sollte nicht nur den Nutzen gegenüber Placebo aufzeigen, sondern auch einen Vergleich mit TPT hinsichtlich des BMD-Gewinns liefern (16). In dieser Studie, in der 2463 postmenopausale Frauen über 18 Monate behandelt wurden, zeigte sich eine signifikante Verringerung des Wirbelfrakturrisikos in der APT-Gruppe, die mit den Effekten von TPT vergleichbar war. Die geschätzte Ereignisrate für nicht vertebrale Frakturen war unter der APT-Behandlung im Vergleich zur Placebogruppe ebenfalls niedriger (RR 0.53 vs. PBO, 95 %-KI 0.32–1.0, p < 0.05), während die TPT das Signifikanzniveau nicht erreichte. Ausserdem wurde in der APT-Gruppe eine stärkere Zunahme der BMD im Vergleich zur TPT an der Hüfte beobachtet (16). Der unterschiedliche Grad der Stimulation der Knochenresorption versus -bildung zwischen diesen beiden Medikamenten könnte teilweise die beobachteten Unterschiede in Bezug auf den BMD-Gewinn erklären, insbesondere im kortikalen Knochenkompartiment.
Obwohl die häufigsten Nebenwirkungen von APT denen von TPT ähneln und die Kontraindikationen die gleichen sind, gibt es einige Unterschiede zwischen diesen Medikamenten. So sind die am häufigsten gemeldeten Nebenwirkungen bei APT orthostatische Hypotonie, Schwindel und Tachykardien. Dagegen war die Inzidenz von Hyperkalzämie, die in der ACTIVE-Studie berichtet wurde, in der APT-Gruppe signifikant niedriger als in der TPT-Gruppe.
Abaloparatid, das in den USA bereits seit mehreren Jahren eingesetzt wird, wurde im März 2024 von Swissmedic für die Behandlung von postmenopausalen Frauen mit Osteoporose und hohem Frakturrisiko zugelassen: Die Bedingungen für die Kostenübernahme wurden jedoch noch nicht festgelegt. Es ist daher noch nicht in den Empfehlungen der SVGO/ASCO enthalten, die 2025 überprüft werden sollen.
Sclerostin-Inhibitor
Romosozumab ist ein monoklonaler Antikörper, der gegen Sclerostin, einem starken Osteoblastenhemmer, gerichtet ist. Im Gegensatz zu PTH-Rezeptor-Agonisten zeichnet sich Romosozumab durch eine doppelte Wirkung, die sowohl osteoanabol als auch antiresorptiv ist, aus (10). Die Verabreichung ist über 12 Monate möglich, in denen ein sehr schneller und massiver Anstieg der Knochenbildung zu beobachten ist, der sich jedoch im Laufe der Behandlung allmählich abschwächt, während die antiresorptive Wirkung anhält. In einer Phase-2-Studie war im Vergleich zu Alendronat und TPT die Zunahme der BMD nach einem Jahr unter Romosozumab etwa doppelt so hoch (17).
Die Wirksamkeit von Romosozumab zur Frakturrisikoreduktion wurde im Rahmen einer 24-monatigen Phase-3-Studie (FRAME) bei postmenopausalen Frauen mit hohem Frakturrisiko untersucht (18). Der primäre Endpunkt von FRAME war eine Verringerung der Inzidenz neuer Wirbelfrakturen. Die Patienten wurden randomisiert und erhielten einmal monatlich 210 mg Romosozumab subkutan oder ein Placebo; im zweiten Jahr erhielten alle Patienten 60 mg Denosumab (6-monatlich).
Nach einem Jahr Behandlung nahm der BMD am Schenkelhals um 5 % und an der LWS um 13 % zu. Im Vergleich zu Placebo wurde eine signifikante Verringerung des Risikos neuer Wirbelfrakturen um 73 % und des Risikos klinischer Frakturen um 36 % erzielt. Es wurde keine signifikante Verringerung der Anzahl nicht vertebraler Frakturen berichtet, obwohl unter Romosozumab eine Verringerung des relativen Risikos um 25 % beobachtet wurde. Sowohl die Originalstudie als auch die Post-hoc-Analysen zeigten jedoch eine signifikante Reduktion der nicht vertebralen Frakturen bereits im ersten Jahr mit Romosozumab bei Frauen mit höherem Risiko (19). Im zweiten Jahr nach der Gabe von Denosumab stieg die BMD weiter an und der bereits beobachtete Rückgang der Frakturen blieb erhalten.
In der Romosozumab-Gruppe waren die unerwünschten Ereignisse hauptsächlich auf Reaktionen an der Injektionsstelle zurückzuführen, und es gab keine Unterschiede zwischen den Gruppen hinsichtlich schwerwiegender unerwünschter Ereignisse, insbesondere kardiovaskulärer Ereignisse. In der Romosozumab-Gruppe traten nur ein Fall einer Osteonekrose des Kiefers und ein Fall einer atypischen Femurfraktur auf.
In der ARCH-Studie wurde Romosozumab 12 Monate lang mit Alendronat verglichen, und anschliessend erhielten beide Arme zwei Jahre lang Alendronat (20). Die in die ARCH-Studie aufgenommene Population wurde speziell wegen eines sehr hohen Risikos für osteoporotische Frakturen rekrutiert. Ausserdem waren 52 % der Teilnehmer über 75 Jahre alt, im Vergleich zu 32 % in der FRAME-Studie. In der Romosozumab-Gruppe wurde nach 12 und 24 Monaten eine signifikante Verringerung neuer Wirbelfrakturen (RR 0.63 und 0.52) sowie klinischer und nicht vertebraler Frakturen (RR 0.72 und 0.81) beobachtet. Der BMD-Gewinn in der Romosozumab-Gruppe war in den ersten 12 Monaten höher als unter Alendronat und reichte von 6 % am Schenkelhals bis zu 13 % an der LWS und blieb auch nach 12 und 24 Monaten Alendronat erhalten. Unerwarteterweise berichteten 2.5 % der Patienten in der Romosozumab-Gruppe und 1.9 % in der Alendronat-Gruppe während der Doppelblindphase über schwerwiegende kardiovaskuläre (CV) unerwünschte Ereignisse (HR, 1.31; 95 %-KI, 0.85 bis 2.00). Obwohl der kausale Zusammenhang zwischen Romosozumab und ischämischen Ereignissen nicht eindeutig belegt ist (21), insbesondere aufgrund des fehlenden Unterschieds vs. PBO in der FRAME-Studie, ist Romosozumab bei vorbestehendem Myokardinfarkt oder Schlaganfall kontraindiziert, und bei Patienten mit hohem CV-Risiko und/oder starker Arterienverkalkung ist weiterhin Vorsicht geboten.
Zusammenfassung
Osteoporose ist eine chronische Erkrankung, die ein lebenslanges Therapiemanagement erfordert, das sowohl nicht medikamentöse als auch medikamentöse Ansätze beinhaltet. Prinzipiell kann bei Patienten mit erniedrigtem Knochenmineralgehalt und/oder moderat erhöhtem Frakturrisiko im Sinne einer Primärprävention eine medikamentöse Behandlung mit Raloxifen oder oralen Bisphosphonaten eingeleitet werden. Bei Patienten mit hohem bzw. sehr hohem Frakturrisiko sind parenterale antiresorptive Präparate (Zolderonat, Denosumab) oder, unter Einbezug von Fachspezialisten, osteoanabole Präparate (Teriparatid, Romosozumab; in Zukunft Abaloparatid) und den daraus sich ableitenden Sequenztherapien der Vorzug zu geben.
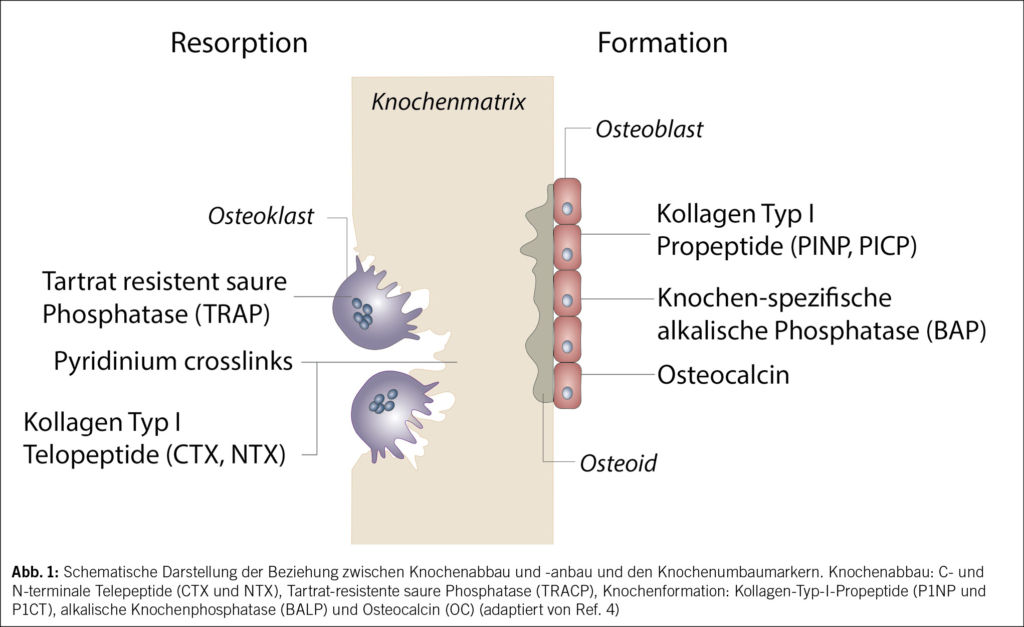
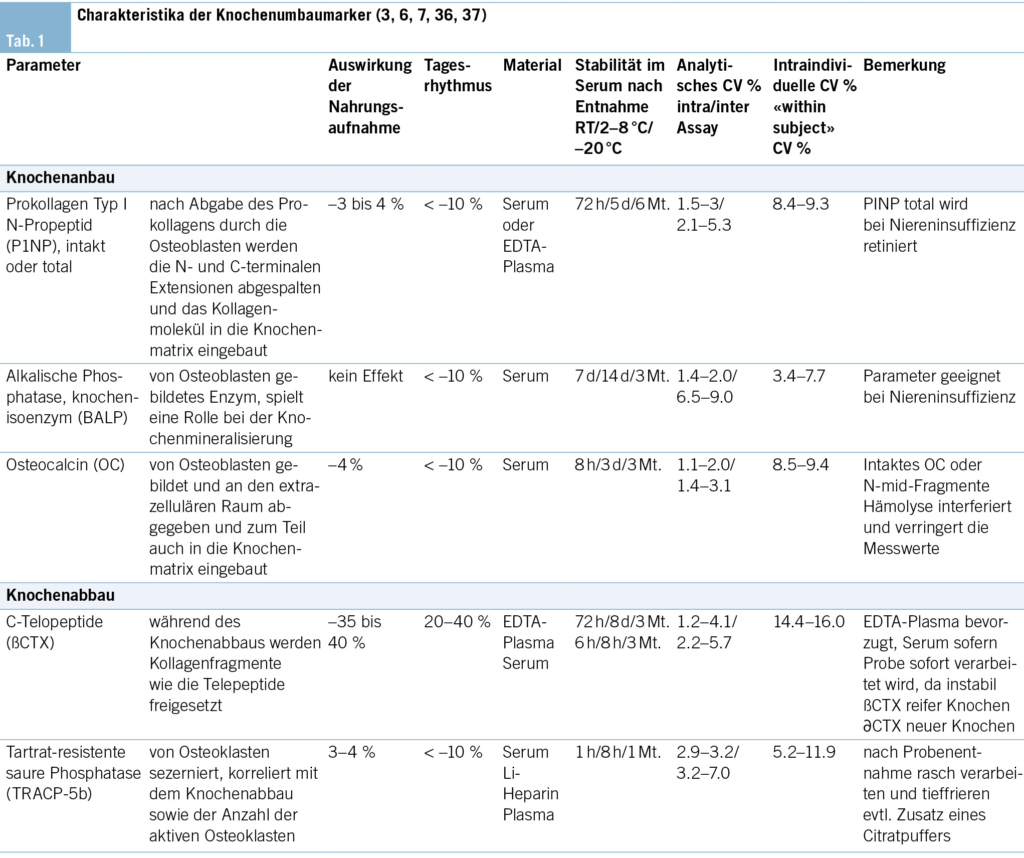
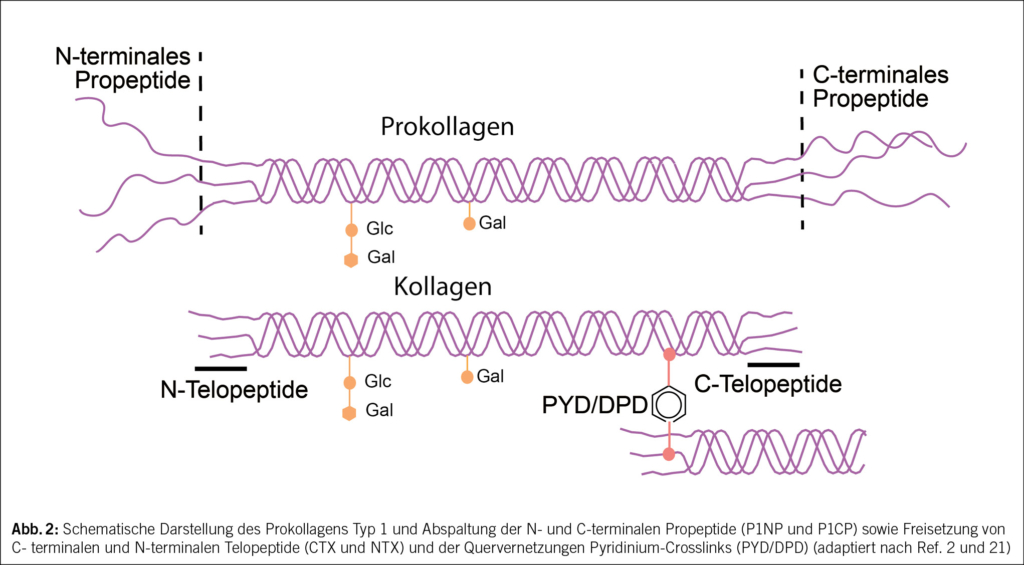
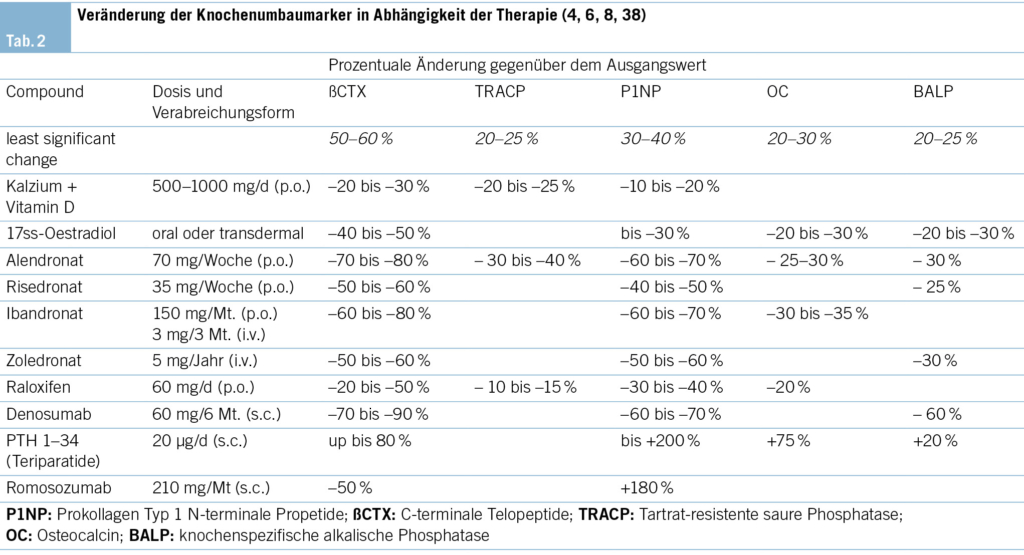
Ein regelmässiges Monitoring ist notwendig, bei dem der klinische Verlauf (neue Frakturen, neue Risikofaktoren für Fragilitätsfrakturen), Knochendichtemessungen alle 2–3 Jahre, die Bestimmung der Knochenumbauwerte (CTX und PINP im Serum) sowie gegebenenfalls zusätzliche Untersuchungen (z. B. Sturz-Assessments) berücksichtigt werden. Bei jeder Folgeuntersuchung wird evaluiert, ob die medikamentöse Therapie deeskaliert, weitergeführt oder ausgebaut werden sollte. Mit diesem Ansatz wird versucht, die Knochengesundheit bis ins hohe Alter zu bewahren und Frakturen zu verhindern. Auf das Konzept sequenzieller medikamentöser Osteoporosetherapien wird im zweiten Artikel dieses Osteoporose-Updates eingegangen.
Klinik für Endokrinologie, Diabetologie und Metabolismus
Universitätsspital Basel
Endonet Praxis und Osteologisches Universitätsforschungszentrum DVO
Aeschenvorstadt 57
4051 Basel
christian.meier@unibas.ch
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Reid IR, Billington EO. Drug therapy for osteoporosis in older adults. Lancet. 2022;399(10329):1080-92.
2. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women‘s Health Initiative randomized controlled trial. JAMA. 2002;288(3):321-33.
3. Seeman E, Crans GG, Diez-Perez A, Pinette KV, Delmas PD. Anti-vertebral fracture efficacy of raloxifene: a meta-analysis. Osteoporos Int. 2006;17(2):313-6.
4. Siris ES, Harris ST, Eastell R, Zanchetta JR, Goemaere S, Diez-Perez A, et al. Skeletal Effects of Raloxifene After 8 Years: Results from the Continuing Outcomes Relevant to Evista (CORE) Study. J Bone Miner Res. 2005;20(9):1514-24.
5. Kanis JA, Johansson H, Oden A, McCloskey EV. A meta-analysis of the efficacy of raloxifene on all clinical and vertebral fractures and its dependency on FRAX. Bone. 2010;47(4):729-35.
6. Drake MT, Clarke BL, Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc. 2008;83(9):1032-45.
7. Lyles KW, Colon-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C, et al. Zoledronic Acid in Reducing Clinical Fracture and Mortality after Hip Fracture. N Engl J Med. 2007;357:nihpa40967.
8. Black DM, Eastell R, Adams AL. Atypical Femur Fracture Risk versus Fragility Fracture Prevention with Bisphosphonates. Reply. N Engl J Med. 2020;383(22):2189-90.
9. Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009;361(8):756-65.
10. Ferrari SL. Osteoporosis: Romosozumab to rebuild the foundations of bone strength. Nat Rev Rheumatol. 2018;14(3):128.
11. Handel MN, Cardoso I, von Bulow C, Rohde JF, Ussing A, Nielsen SM, et al. Fracture risk reduction and safety by osteoporosis treatment compared with placebo or active comparator in postmenopausal women: systematic review, network meta-analysis, and meta-regression analysis of randomised clinical trials. BMJ. 2023;381:e068033.
12. Ferrari S, Lippuner K, Lamy O, Meier C. 2020 recommendations for osteoporosis treatment according to fracture risk from the Swiss Association against Osteoporosis (SVGO). Swiss Med Wkly. 2020;150:w20352.
13. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001;344(19):1434-41.
14. Diez-Perez A, Marin F, Eriksen EF, Kendler DL, Krege JH, Delgado-Rodriguez M. Effects of teriparatide on hip and upper limb fractures in patients with osteoporosis: A systematic review and meta-analysis. Bone. 2019;120:1-8.
15. Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, et al. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018;391(10117):230-40.
16. Miller PD, Hattersley G, Riis BJ, Williams GC, Lau E, Russo LA, et al. Effect of Abaloparatide vs Placebo on New Vertebral Fractures in Postmenopausal Women With Osteoporosis: A Randomized Clinical Trial. JAMA. 2016;316(7):722-33.
17. McClung MR, Grauer A, Boonen S, Bolognese MA, Brown JP, Diez-Perez A, et al. Romosozumab in postmenopausal women with low bone mineral density. N Engl J Med. 2014;370(5):412-20.
18. Cosman F, Crittenden DB, Grauer A. Romosozumab Treatment in Postmenopausal Osteoporosis. N Engl J Med. 2017;376(4):396-7.
19. Cosman F, Crittenden DB, Ferrari S, Lewiecki EM, Jaller-Raad J, Zerbini C, et al. Romosozumab FRAME Study: A Post Hoc Analysis of the Role of Regional Background Fracture Risk on Nonvertebral Fracture Outcome. J Bone Miner Res. 2018;33(8):1407-16.
20. Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, et al. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017;377(15):1417-27.
21. Langdahl BL, Hofbauer LC, Forfar JC. Cardiovascular Safety and Sclerostin Inhibition. J Clin Endocrinol Metab. 2021;106(7):1845-53.