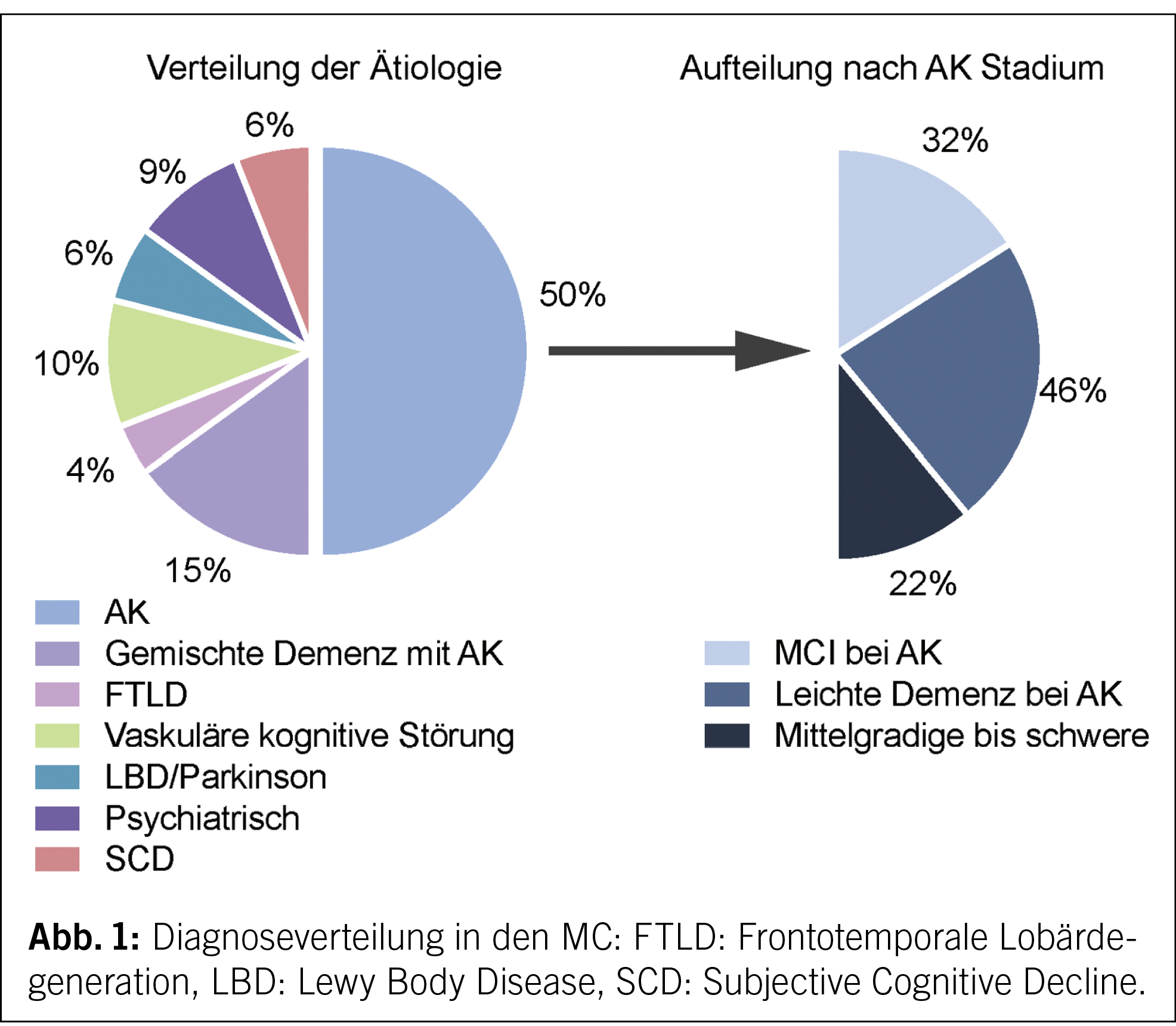
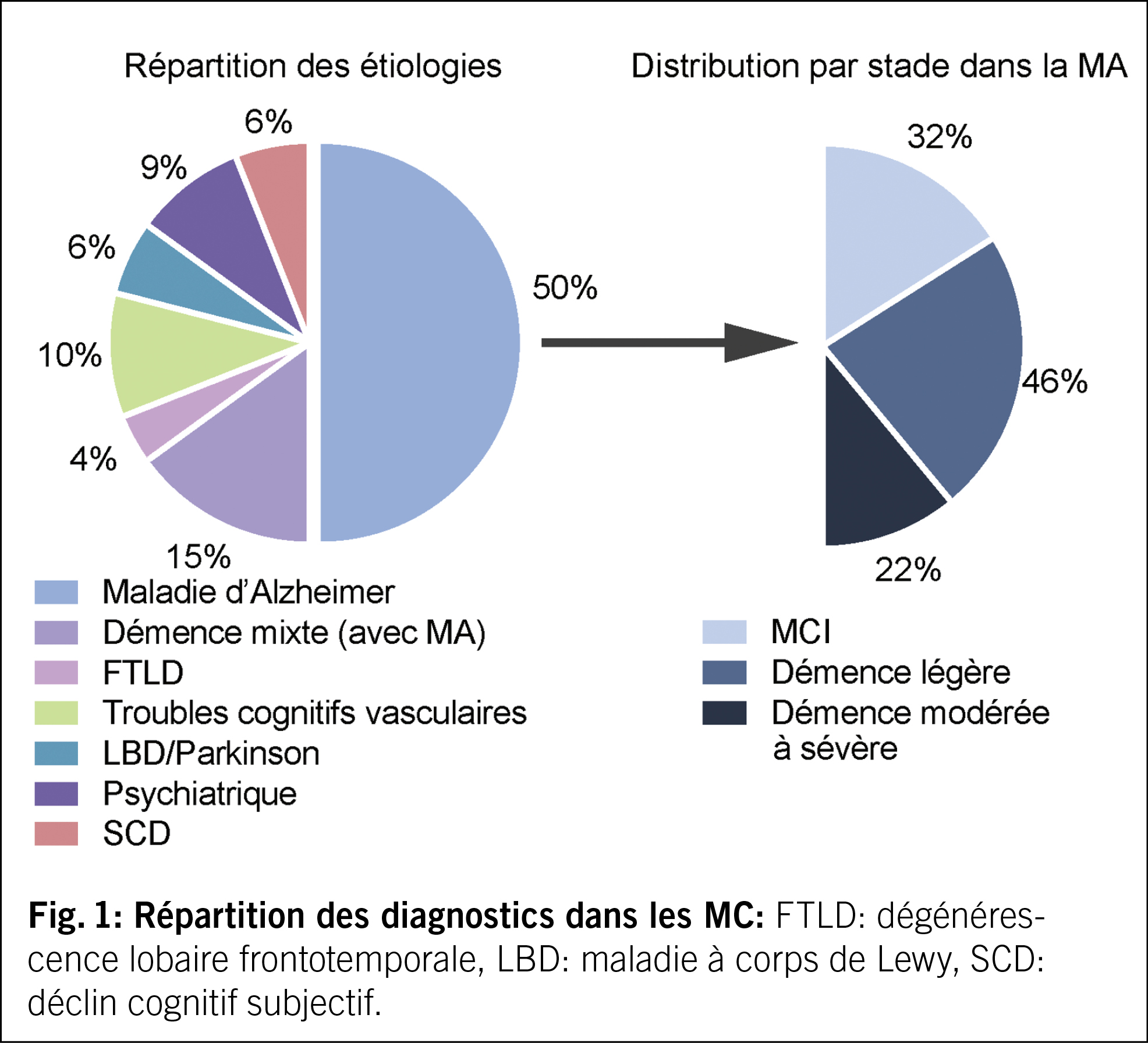
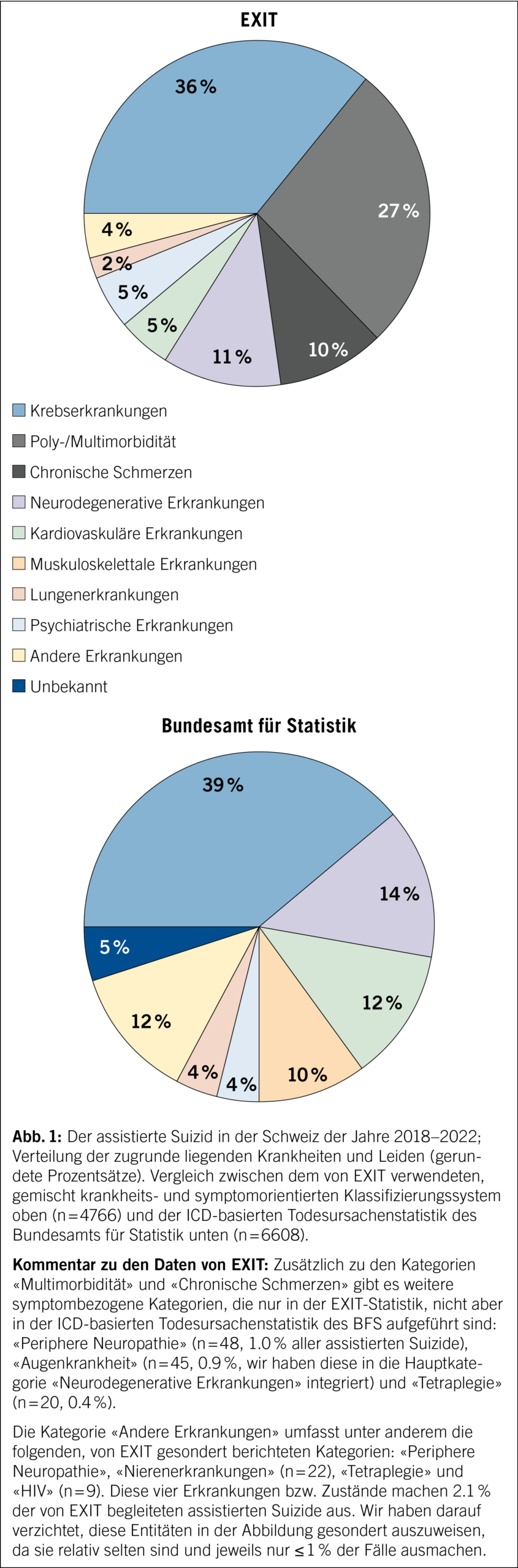
Fussulcera sind am häufigsten vaskulär, druck- oder diabetesbedingt. Für die diabetischen Fussulcera ist das Vorliegen einer Polyneuropathie mit Verlust der Schutzsensibilität und/oder einer peripheren arteriellen Verschlusskrankheit ein wesentlicher Risikofaktor. Die Prävention zielt auf Identifizierung des gefährdeten Fusses, regelmässige Kontrollen des gefährdeten Fusses, Aufklärung von Patienten, Angehörigen und medizinischem Fachpersonal, Sicherstellung des routinemässigen Tragens von geeignetem Schuhwerk sowie die Behandlung von Risikofaktoren für eine Ulceration ab. Bei Vorliegen eines diabetischen Fussulcus besteht die Therapie aus einer Kombination von mechanischer Entlastung (Goldstandard während der Ulcusphase: Vollkontaktgips), Behandlung von Durchblutungsstörungen, Infektbehandlung, Stoffwechselkontrolle und Behandlung von Komorbiditäten, lokaler Ulcuskontrolle und Aufklärung von Patienten und Angehörigen. Bei infizierten Ulcera muss nach dem Vorliegen einer Osteomyelitis gesucht werden. Ohne Osteomyelitis besteht die Therapie aus lokalem Debridement und einer 1–2-wöchigen Antibiotikatherapie. Bei Vorliegen einer Osteomyelitis besteht die Therapie entweder aus der Kombination einer chirurgischen Therapie (Amputation vs. innere Resektion) mit begleitender kurzer Antibiotikatherapie oder aber aus einer rein konservativen Therapie mit 6 Wochen Antibiotika. Nach Ausheilen des Ulcus ist zur Rezidivprophylaxe eine orthopädische Schuhversorgung angezeigt.
Schlüsselwörter: Diabetischer Fuss, Polyneuropathie, periphere arterielle Verschlusskrankheit (pAVK), Prävention, Therapie
Chronische Ulcera der Füsse treten häufig auf. 2012 wurden in Deutschland rund 1% der Versicherten wegen eines Fussulcus behandelt, Tendenz steigend (1). Dabei sind insbesondere die diabetischen Fussulcera zu nennen: Weltweit entsteht alle 1.2 Sekunden ein neues diabetisches Fussulcus (DFU) (2). Nach Armstrong et al. entwickelt rund ein Drittel aller Diabetiker ein DFU (3). Unabhängig von der Wundursache sind Prävalenz bzw. Inzidenz von chronischen Wunden mit zunehmendem Alter erhöht (1). Ausser der gesundheitlichen Einschränkung für den Patienten belasten Fussulcera das Gesundheitssystem finanziell enorm. In den USA wurden 2014 knapp 15% der Medicare-Versicherten wegen einer Fusswunde und Folgezuständen behandelt: geschätzte Kosten 28 Milliarden US-Dollar (4). Armstrong berichtete 2017, dass die Kosten, die durch den diabetischen Fuss in den USA verursacht werden, mit rund 80 Milliarden Dollar vergleichbar mit den Kosten von malignen Tumorerkrankungen seien (3).
Unterscheidung «akutes» versus «chronisches» Ulcus
Eine einheitliche Definition für «akute» oder «chronische»Ulcera generell existiert leider nicht (5). Manche Autoren bezeichnen eine Wunde bereits nach drei Wochen fehlender Abheilung als chronisch (6), während andere Autoren diesen Begriff erst nach vier (7) oder sechs Wochen (8) ausbleibender Wundheilung verwenden. Für DFU wurde der Begriff «chronisches Ulcus» für den Fall ausbleibender Heilung nach vier Wochen definiert (9).
Ulcusformen
Diabetische Fussulcera, Druckulcera und vaskuläre Ulcera sind die häufigsten Formen von Fussulcera (10). Eine Studie aus Deutschland demonstrierte, dass vaskuläre Ulcera (64%) gefolgt von Druckulcera und DFU am häufigsten sind (1). Die vaskulären Ulcera haben mit chronisch-venösen Ulcera (CVU), arteriellen Ulcera sowie gemischt venös-arteriellen Ulcera drei Unterformen (10). In der Praxis der Autoren in der Orthopädie ist das diabetische Fussulcus mit Abstand die häufigste auftretende Ulcusform, weswegen in der Folge im Besonderen auf die DFU eingegangen wird.
Epidemiologie der DFU
Die Inzidenzrate für diabetische Fussulcera beträgt rund 2% pro Jahr, die Lebenszeitinzidenz liegt zwischen 19 und 34% (2). Prädisponierende Faktoren für die Ulcusentwicklung sind Polyneuropathie, periphere arterielle Verschlusskrankheit und Fussdeformitäten (11). Ohne das Vorliegen einer dieser Faktoren zählen Personen mit Diabetes nicht zur Risikogruppe (11). Die Hälfte der Personen mit einem DFU durchläuft eine diabetische Fussinfektion (DFI), aus dieser Gruppe benötigen wiederum letztlich rund 20% eine Amputation (2). Entsprechend ist auch das Lebenszeitrisiko, eine Amputation an der unteren Extremität zu benötigen, bei Diabetikern zehn- bis vierzigfach erhöht (12). Oftmals muss am gleichen Fuss sogar erneut amputiert werden (13). Rund zwei Drittel der Majoramputationen respektive der Amputationen an den unteren Extremitäten werden im deutschsprachigen Raum bei Diabetikern durchgeführt (14, 15). Schliesslich weisen Patienten mit einem DFU mit 30.5% eine sehr ähnliche 5-Jahres-Mortalität wie Krebspatienten auf (3).
Pathogenese der DFU
Schlüsselfaktoren für die Entwicklung eines DFU sind die diabetische Polyneuropathie (PNP) und die periphere arterielle Verschlusskrankheit (pAVK). Die drei Komponenten der PNP erhöhen das Ulcusrisiko (2, 16):
- Die motorische PNP löst eine muskuläre Dysbalance durch den Verlust der intrinsischen Fussmuskulatur aus, was eine Krallenzehendeformität und Distalisierung des plantaren Fettpolsters zur Folge hat. Dies prädisponiert zu Ulcera dorsal am proximalen Interphalangealgelenk und plantar unter den Metatarsophalangealgelenken und den Zehenkuppen.
- Die sensorische PNP reduziert die Schutzsensibilität oder führt zu deren vollständigem Verlust.
- Die autonome PNP verringert zum einen die Schweisssekretion. Zum anderen löst sie einen AV-Shunt Mechanismus aus. Beide Konsequenzen der autonomen PNP trocknen die Haut aus, mit dem Resultat einer Neigung zu Rhagaden, und führen zur Ödembildung.
Wiederholte Mikrotraumata bewirken zuerst die Hyperkeratosenbildung und führen unbehandelt zum Fussulcus (2, 17). Die bei Diabetikern in ca. 50% vorhandene, vor allem crural gelegene pAVK können sowohl die Entstehung als auch das fehlende Abheilen von Fussulcera zusätzlich begünstigen (16, 18). Auch eine eingeschränkte Gelenkbeweglichkeit, wie z.B. bei verkürzter Wadenmuskulatur oder bei einer Grosszehengrundgelenksarthrose, begünstigt die DFU Bildung (16, 19–21).
Grundsätzliche Prophylaxestrategie bei DFU
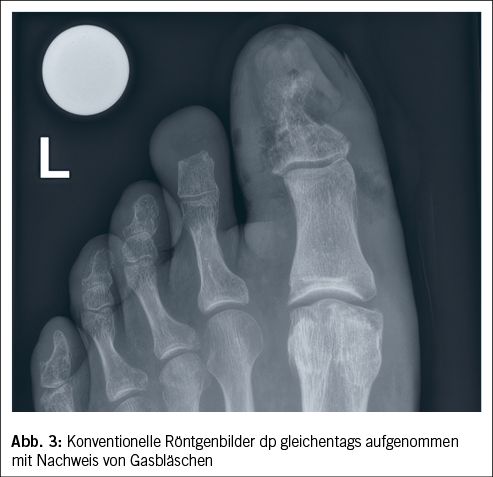
Wie bei allen anderen Krankheitsbildern ist auch bei DFU eine gezielte Prophylaxe die beste Strategie, um DFU und die Folgeschäden zu verhindern. In der Literatur wurden Risikofaktoren-basierte Systeme zur Risikostratifizierung beschrieben (16, 22). Das Ziel dieser Arbeiten war es, in Abhängigkeit vom Vorhandensein bekannter DFU-Risikofaktoren prophylaktische Massnahmen möglichst gezielt zur DFU-Verhinderung einzusetzen. Das IWGDF-Risikostratifizierungssystem wird in der täglichen Praxis der Autoren verwendet (11) (Tab. 1) und orientiert sich am Vorhandensein von
- Verlust der Schutzsensibilität/Polyneuropathie?
- periphere arterielle Verschlusskrankheit?
- Fussdeformität/eingeschränkte Beweglichkeit?
- sonstige Risikofaktoren: früheres Ulcus oder frühere Amputation? Terminale Niereninsuffizienz?
Die IWGDF hat relativ breite Intervalle formuliert. In unserer Erfahrung hat es sich bewährt, zum einen eher die kurzfristigeren Zeitabstände zu verwenden und zum anderen Podolog/-innen und/oder Wundexpert/-innen in diese Kontrollen aktiv mit einzubinden. Wir halten es nur dann für opportun, die längeren vorgeschlagenen Zeitabstände zu verwenden, wenn die Patient/-innen über einen längeren Zeitraum ein hohes Mass an Eigenverantwortung resp. eine gute Adhärenz zu den Prophylaxe- und allfälligen Therapiemassnahmen demonstriert haben.
Präventionsmassnahmen bei DFU
Fünf Punkte wurden von der IWGDF als Schlüsselelemente zur Prävention von DFU definiert und auch in der neuesten Version von 2023 aufrechterhalten (11):
1. Identifizierung des gefährdeten Fusses
2. Regelmässige Kontrolle und Untersuchung des gefährdeten Fusses
3. Aufklärung von Patienten, Angehörigen und medizinischem Fachpersonal
4. Sicherstellung des routinemässigen Tragens geeigneten Schuhwerks
5. Behandlung von Risikofaktoren für eine Ulceration
Identifizierung des gefährdeten Fusses
Grundsätzlich wird bei jedem Diabetiker mit bisher fehlenden Risikofaktoren für ein DFU (IWGDF-Risiko 0) ein jährliches Screening empfohlen (11). Neben einer gezielten Anamnese zählen dazu das Tasten der Fusspulse sowie die Überprüfung der Schutzsensibilität mittels Prüfung der Vibrationswahrnehmung oder Monofilament-Test. Ferner soll auf allfällige neue Fussdeformitäten gescreent werden. Auffällige oder unklare Befunde sollten spezialärztliche Beurteilungen nach sich ziehen und die Kontrollintervalle im Bedarfsfall nach neuer Risikostufe festgelegt werden (vergleiche Tab. 1).
Regelmässige Kontrolle des gefährdeten Fusses
Bei Vorliegen von Risikofaktoren für das Auftreten der DFU sollten die Screening-Untersuchungen häufiger und detaillierter erfolgen (vergleiche Tab. 1) (11). Auffälligkeiten wie ein DFU respektive eine präulceröse eingeblutete Hyperkeratose sollten umgehend der entsprechenden Therapie zugeführt werden. Wie eingangs erwähnt, ist es aus unserer Sicht opportun, die Kontrollen auf die Schultern mehrerer interprofessioneller Fachpersonen wie Wundexpert/-innen oder Podolog/-innen zu verteilen. Wichtig ist die klare Definition, welche ärztliche Person oder Institution den Lead in der Prävention hat.
Schulung von Patienten, Angehörigen und medizinischem Fachpersonal
Die Schulung von Patienten und Angehörigen ist ein weiterer wichtiger Punkt in der Prävention der DFU (11). Der Patient soll dabei in der täglichen Fusskontrolle, im Vermeiden des Barfussgangs und in einer korrekten Fusshygiene instruiert werden. Tägliches Füssewaschen, Abtrocknen der Interspatien sowie eine rückfettende Hautpflege sind wichtige Hygieneaspekte. Ein weiterer wichtiger Punkt ist die Kenntnis über die nächste Anlaufstelle für den Fall von Auffälligkeiten. Nicht zuletzt ist auch die Schulung des Gesundheitspersonals von wichtiger Bedeutung.
Sicherstellung des Tragens von geeignetem Schuhwerk
Angepasstes Schuhwerk soll Verletzungen und wiederholte Mikrotraumata im Bereich der Füsse verhindern. Generell sind eine regelrechte Passform der Schuhe und das Vermeiden von prominenten Nähten und Materialübergängen Grundelemente für die Minimierung des Verletzungsrisikos durch das Schuhwerk. Je nach Risikostufe werden zusätzliche orthopädieschuhtechnische Massnahmen eingesetzt (orthopädische Einlagen, orthopädische Schuhzurichtungen inkl. Fussbettungen, orthopädische Serienschuhe oder orthopädische Massschuhe) (23). Die Versorgungsstufe richtet sich nach dem Ausmass der Fussdeformität (23). Eine interprofessionelle Beurteilung gemeinsam mit Orthopädieschuhmachermeistern ist daher wichtig.
Finanzierung in der Schweiz
Durch die fallführende ärztliche Person sollte auch darauf geachtet werden, dass eine Anmeldung der orthopädischen Schuhversorgung an die IV (Erstversorgung im Alter < 65 Jahren bei Männern und < 64 Jahren bei Frauen) respektive an die AHV (sofern die Patienten älter als oben angegeben sind) erfolgt. Die IV bezahlt zwei Paar Schuhe pro Jahr mit einem Selbstbehalt von 120 CHF pro Jahr (egal ob orthopädische Serienschuhe oder orthopädische Massschuhe), die AHV neu seit 2024 immerhin ein Paar Schuhe pro Jahr mit einem Selbstbehalt von 25% (Anmerkung: Orthopädische Serienschuhe kosten ungefähr 1200 CHF, orthopädische Massschuhe zwischen 5000 und 8000 CHF pro Paar.). Bei Übertritt vom IV- ins AHV-Alter besteht Besitzstandsrecht. Orthopädische Einlagen als alleinige Versorgung werden aus der Grundversicherung nicht übernommen. Leider gibt es in der Branche vereinzelt schwarze Schafe, die den Patienten in Ermangelung einer Abrechnungsberechtigung gegenüber IV/AHV die orthopädischen Schuhe zum vollen Preis verkaufen, ohne auf die genannten Leistungen von IV/AHV hinzuweisen.
Biomechanik
Der plantare Druck beeinflusst die Entstehung eines DFU substanziell. Der Reduktion des plantaren Spitzendruckes sowie der Umverteilung der Druckdosis zwischen den verschiedenen Fussregionen kommt in der DFU-Prävention daher eine besondere Bedeutung zu. Gemäss Drerup et al. kann im Ballenbereich (wo das plantare Fettpolster nach seiner Distalisierung nicht mehr vorhanden ist) durch eine Kombination einer Fussbettung nach Mass mit einer Schuhzurichtung mit Mittelfussrolle und Sohlenversteifung der plantare Spitzendruck um fast die Hälfte reduziert werden (24).
Auch Scherkräfte tragen zu DFU bei. Die plantaren Scherkräfte sind bei Patienten mit diabetischer PNP und Kallusformation in der Push-off-Phase signifikant erhöht (25). Eine Schuhzurichtung mit Sohlenversteifung und Abrollhilfe reduziert die Bewegung in den Metatarsophalangealgelenken und die Bewegung zwischen dem Fuss selbst und der Innensohle. Dies vermindert Scherkräfte und senkt wiederum das DFU-Risiko.
Wie oben erwähnt, sollte die orthopädieschuhtechnische Versorgung auf die individuelle Patientenanatomie ausgerichtet werden, um eine grösstmögliche Adhärenz zu erreichen (26). Eine Versorgung kann in der DFU-Prophylaxe nur wirken, wenn sie auch getragen wird.
Behandlung von Risikofaktoren für Ulcerationen
Lokale Risikofaktoren für ein DFU sollen behandelt werden (17). Neben dem Abtragen von Hyperkeratosen und Anpassung des vorhandenen orthopädischen Schuhwerks zur lokalen Druckentlastung gehört dazu auch die Behandlung von Mykosen oder eines Unguis incarnatus. Der Effekt der plantaren Druckreduktion durch Hyperkeratosenabtragung wurde in der Literatur beschrieben (27).
Behandlung der DFU
Ein DFU sollte rasch und interprofessionell behandelt werden. Die sechs Säulen der Therapie des DFU beinhalten (28):
– Mechanische Entlastung
– Erkennen und Verbesserung von Durchblutungsstörungen
– Infektbehandlung
– Stoffwechselkontrolle und Behandlung von Komorbiditäten
– Lokale Ulcuskontrolle
– Aufklärung von Patienten und Angehörigen
Mechanische Entlastung
Schlüsselelement der DFU-Behandlung ist die mechanische Entlastung. Ohne mechanischer Entlastung kann man trotz optimaler Wundpflege oder Infektbehandlung nicht mit einer Ulcusheilung rechnen.
Die mechanische Entlastung ist stets individuell zu gestalten: Die Ursache für das Auftreten des DFU muss erörtert werden. Neben einer Beurteilung der Fussform gehören hierzu auch eine Analyse der Gelenkbeweglichkeit, eine Abfrage der Angewohnheiten des Patienten (Laufen im angepassten Schuhwerk versus Barfussgang) sowie eine Beurteilung des getragenen Schuhwerks.
Der Goldstandard in der mechanischen Entlastung ist der Vollkontaktgips mit gezielter Ulcusentlastung (29). Nach IWGDF-Leitlinien sollte dieser Vollkontaktgips geschlossen angelegt werden, was sich in der Praxis wegen der Notwendigkeit von Verbandswechseln oftmals schwierig gestaltet. Im Infektfall ist ein geschlossener Gips ohnehin obsolet. Alternativ können Verbandsschuhe verwendet werden, welche auch individuell auf die Bedürfnisse des Patienten angepasst werden können.
Für den Beginn der Entlastung mit Gips oder einer temporären Alternative sprechen der Volumenbedarf von Verbandsmaterial, fluktuierende Schwellungszustände sowie die benötigte rasche Verfügbarkeit der Versorgung (Anmerkung: Produktionsdauer orthopädischer Serienschuh: ca. 3 Wochen; orthopädischer Massschuh: ca. 10–12 Wochen). Individuelle Faktoren, wie beispielsweise ein erhöhtes Sturzrisiko, werden bei der Auswahl des Entlastungstools miteinbezogen (26). Eine operative Entlastung zur Druckreduktion kann bei ausbleibender Heilung erwogen werden. Als Beispiele sind die Achillessehnenverlängerung (30) zur Reduktion des plantaren Druckes im Vorfussbereich, eine Flexoren-Tenotomie bei Krallenzehen (31) oder Resektion des entsprechenden Mittelfussköpfchens (32) bei therapierefraktären plantaren Ulcerationen zu nennen.
Aufgrund der oben genannten Zeitspannen, die für die Fertigung der orthopädischen Schuhversorgung benötigt werden, muss rechtzeitig mit der Planung einer definitiven Lösung begonnen werden.
pAVK bei DFU
Wie eingangs erwähnt, sind ca. 50% der Patienten mit einem DFU gleichzeitig von einer oftmals asymptomatischen pAVK betroffen (18, 33). Daher sollte bei jedem DFU aktiv nach einer pAVK gesucht werden (mindestens: Anamnese und Palpieren der Fusspulse, möglichst zusätzlich mittels ABI, TBI und akustischer Doppleruntersuchung) (18, 34). Bei Verdachtsmomenten für eine pAVK soll obligat eine angiologische Beurteilung erfolgen und eine Revaskularisation in Erwägung gezogen werden (18, 35). Bei fehlender Ulcusheilung trotz regelrechter Behandlung innert 4–6 Wochen sollen bei jedem DFU eine Angiographie und gegebenenfalls Revaskularisierung in Betracht gezogen werden (18).
Das infizierte DFU
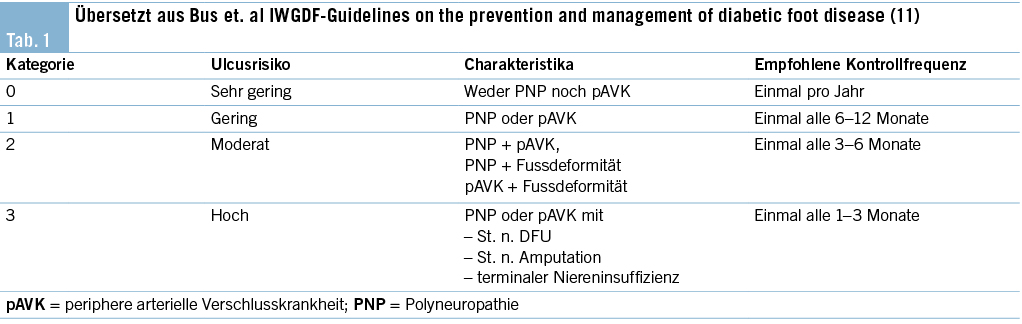
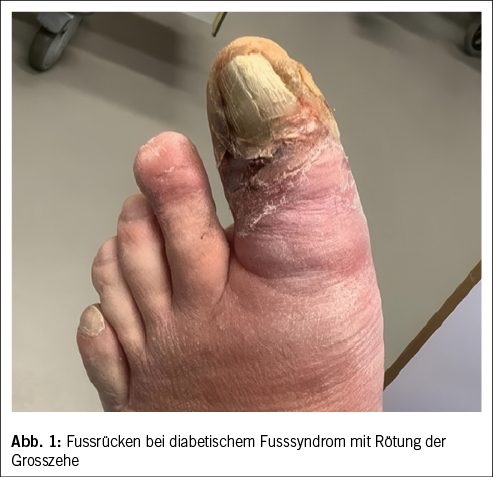
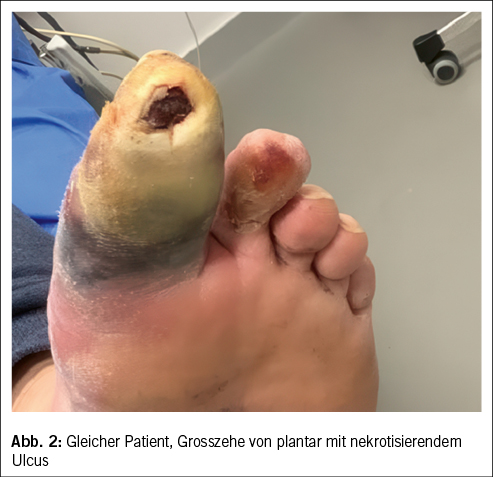
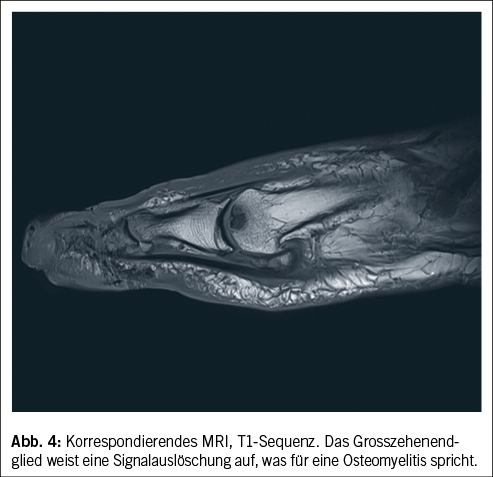
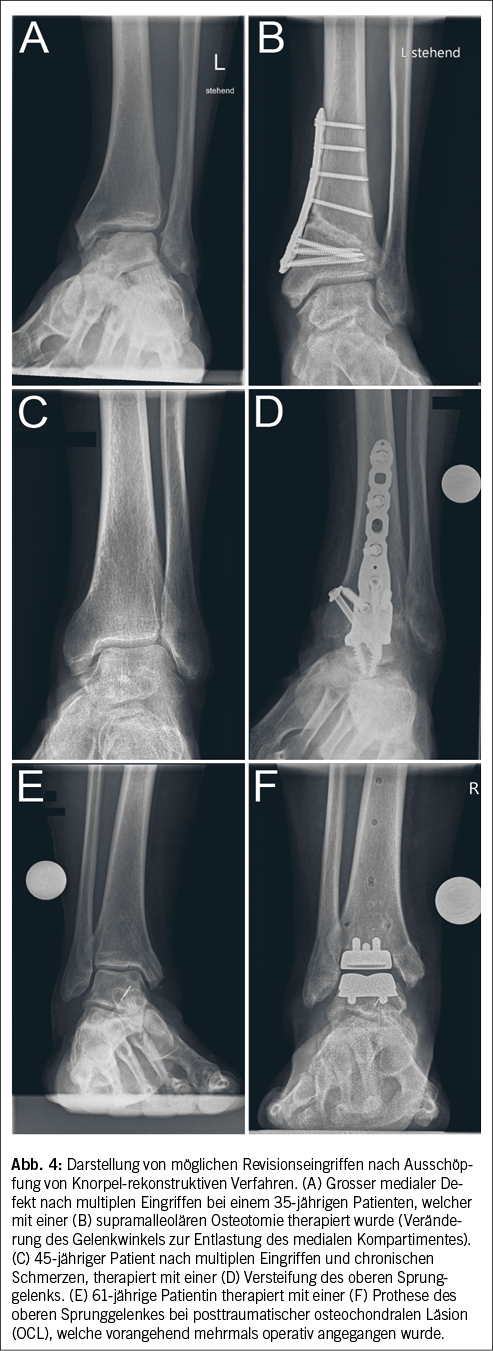
Ein Weichteilinfekt sollte anhand definierter klinischer Kriterien diagnostiziert werden (36). Bei Fehlen dieser klinischen Kriterien für eine Weichteilinfektion und bei Fehlen einer Osteomyelitis sollte auf die Gabe von Antibiotika verzichtet werden (37, 38). Der Verdachtsmoment einer Osteomyelitis kann durch die Kombination eines positiven «Probe-to-Bone-Test» (d.h. direkter Knochenkontakt einer durch die Wunde eingeführten sterilen Metallsonde), erhöhter laborchemischer Entzündungswerte sowie typischer Veränderungen in konventionellen Röntgenaufnahmen gestellt werden (36). Die Magnetresonanztomographie hat eine hohe Sensitivität in der Diagnostik einer Osteomyelitis (39) und dient bei der chirurgischen Planung in der präoperativen Bestimmung der Ausdehnung der Knochenbeteiligung (40). Zur Bestimmung des Schweregrades der Infektion wird die IWGDF/IDSA-DFI-Klassifikation empfohlen (36). Schwere Infektionen (d.h. alle Infektionen, die mit dem Vorhandensein von zwei oder mehr SIRS-Zeichen einhergehen) und moderate Infektionen (d.h. mehr als 2 cm Erythem um das DFU herum und/oder Gewebe tiefer als Haut und Subkutangewebe betroffen) mit relevanten Begleiterkrankungen wie schwere pAVK, Immunsuppression oder terminale Niereninsuffizienz sollten stationär behandelt werden (36). Ohne Knochenbeteiligung besteht die Therapie aus einem lokalen Debridement des infizierten Gewebes und einer Antibiotikatherapie von 1–2 Wochen nach Probenentnahme (36). Bei Nachweis einer Osteomyelitis kann zwischen einer konservativen Therapie (Antibiotika über 6 Wochen) und einer Entfernung des befallenen Knochens (was oftmals eine Amputation nach sich zieht, seltener eine innere Resektion nur des befallenen Knochens, bei der nur der infizierte Knochen entfernt wird [41]) abgewogen werden. Gasbildende Infekte, ausgedehnte Weichteilschäden, stark kompromittierte periphere Durchblutungsverhältnisse und Patientenfaktoren, die gegen eine 6 Wochen andauernde Antibiotikatherapie sprechen, lassen die Amputation bevorzugen. Insbesondere akrale Osteomyelitiden können erfolgreich konservativ therapiert werden (42). In naher Zukunft werden die Ergebnisse einer schweizerischen monozentrischen prospektiv-randomisierten Studie erwartet, im Rahmen derer die Antibiotikatherapiedauer bei diabetischen Fussinfektionen drastisch reduziert wurde (43). Das unter Abbildung 1–4 gezeigte Fallbeispiel zeigt einen 47 Jahre alten Patienten mit schlechter Adhärenz zur Entlastungstherapie mit dem Vollbild einer gasbildenden diabetischen Fussosteomyelitis, der septisch während der Nacht auf unserer Notfallstation vorstellig wurde. Die Therapie bestand in einer sofortigen Grosszehenamputation.
Stoffwechselkontrolle und Behandlung von Komorbiditäten
Komorbiditäten wie Ödeme oder Mangelernährung sollten therapiert werden, um die Abheilung eines DFU zu begünstigen (44). Natürlich ist auch eine gute Blutzuckereinstellung für das Abheilen des DFU anzustreben (45).
Lokale Ulcusversorgung
Ein DFU sollte regelmässig durch medizinisches Fachpersonal debridiert werden (mindestens wöchentlich) (46) und unter der Anwendung des «Standard of care» der Wundversorgung behandelt werden (47). Bei fehlendem Abheilen einer DFU-Wunde innert 4 bis 6 Wochen unter adäquater Therapie muss das DFU anhand der oben genannten Punkte reevaluiert und auch eine sogenannte Advanced Wound Therapy in Betracht gezogen werden (28).
Weiterführende Informationen für Patient
Während der Patient natürlich in der Selbstbehandlung des DFU instruiert werden sollte, müssen er und gegebenenfalls die Angehörigen auch über sogenannte Red Flags für Infekte instruiert werden: Fieber, Schüttelfrost, Verschlechterung des DFU und Hyperglykämie sind besonders zu nennen (44). Bei fehlender Mobilisationsfähigkeit sollte auf den Schutz der nicht betroffenen Gegenseite (z.B. durch ein Fersenentlastungskissen) hingewiesen werden (44).
Leitender Arzt
Technische und Neuro-Orthopädie
Universitätsklinik Balgrist
Forchstrasse 340
8008 Zürich
felix.waibel@balgrist.ch
Universitätsklinik Balgrist
Zürich
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Heyer K, Herberger K, Protz K, Glaeske G, Augustin M. Epidemiology of chronic wounds in Germany: Analysis of statutory health insurance data. Wound Repair and Regeneration. 2016;24(2):434-42.
2. Armstrong DG, Boulton AJM, Bus SA. Diabetic Foot Ulcers and Their Recurrence. New England Journal of Medicine. 2017;376(24):2367-75.
3. Armstrong DG, Swerdlow MA, Armstrong AA, Conte MS, Padula WV, Bus SA. Five year mortality and direct costs of care for people with diabetic foot complications are comparable to cancer. J Foot Ankle Res. 2020;13(1):16.
4. Nussbaum SR, Carter MJ, Fife CE, DaVanzo J, Haught R, Nusgart M, et al. An Economic Evaluation of the Impact, Cost, and Medicare Policy Implications of Chronic Nonhealing Wounds. Value Health. 2018;21(1):27-32.
5. Wunddokumentation BP. Wundkompendium der Schweizerischen Gesellschaft für Wundbehandlung (SAfW) 2012. Supplement; 2012.
6. Gillitzer R. (Modern wound management). Hautarzt. 2002;53(2):130-45; quiz 46-7.
7. Lazarus GS, Cooper DM, Knighton DR, Margolis DJ, Percoraro RE, Rodeheaver G, et al. Definitions and guidelines for assessment of wounds and evaluation of healing. Wound Repair and Regeneration. 1994;2(3):165-70.
8. Téot L, Lambert L, Ourabah Z, Bey E, Steenman C, Wierzbiecka E, et al. Use of topical negative pressure with a lipidocolloid dressing: results of a clinical evaluation. J Wound Care. 2006;15(8):355-8.
9. Musa HG, Ahmed ME. Associated risk factors and management of chronic diabetic foot ulcers exceeding 6 months’ duration. Diabet Foot Ankle. 2012;3.
10. Nunan R, Harding KG, Martin P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Dis Model Mech. 2014;7(11):1205-13.
11. Bus SA, Sacco ICN, Monteiro-Soares M, Raspovic A, Paton J, Rasmussen A, et al. Guidelines on the prevention of foot ulcers in persons with diabetes (IWGDF 2023 update). Diabetes Metab Res Rev. 2024;40(3):e3651.
12. Vamos EP, Bottle A, Edmonds ME, Valabhji J, Majeed A, Millett C. Changes in the incidence of lower extremity amputations in individuals with and without diabetes in England between 2004 and 2008. Diabetes Care. 2010;33(12):2592-7.
13. Miller W, Berg C, Wilson ML, Heard S, Knepper B, Young H. Risk factors for below-the-knee amputation in diabetic foot osteomyelitis after minor amputation. Journal of the American Podiatric Medical Association. 2019;109(2):91-7.
14. Brtek J. Epidemiology of Lower Extremity Amputations in Switzerland from 2005 to 2015. Inaugural-Dissertation zur Erlangung der Doktorwürde der Humanmedizin der Medizinischen Fakultät der Universität Zürich. 2022.
15. Kröger K, Berg C, Santosa F, Malyar N, Reinecke H. Lower Limb Amputation in Germany. Dtsch Arztebl Int. 2017;114(7):130-6.
16. Monteiro-Soares M, Boyko EJ, Ribeiro J, Ribeiro I, Dinis-Ribeiro M. Predictive factors for diabetic foot ulceration: a systematic review. Diabetes Metab Res Rev. 2012;28(7):574-600.
17. Bus SA, Lavery LA, Monteiro-Soares M, Rasmussen A, Raspovic A, Sacco ICN, et al. Guidelines on the prevention of foot ulcers in persons with diabetes (IWGDF 2019 update). Diabetes Metab Res Rev. 2020;36 Suppl 1:e3269.
18. Fitridge R, Chuter V, Mills J, Hinchliffe R, Azuma N, Behrendt CA, et al. The intersocietal IWGDF, ESVS, SVS guidelines on peripheral artery disease in people with diabetes and a foot ulcer. Diabetes Metab Res Rev. 2024;40(3):e3686.
19. Boyko EJ, Ahroni JH, Stensel V, Forsberg RC, Davignon DR, Smith DG. A prospective study of risk factors for diabetic foot ulcer. The Seattle Diabetic Foot Study. Diabetes Care. 1999;22(7):1036-42.
20. Ledoux WR, Shofer JB, Smith DG, Sullivan K, Hayes SG, Assal M, et al. Relationship between foot type, foot deformity, and ulcer occurrence in the high-risk diabetic foot. J Rehabil Res Dev. 2005;42(5):665-72.
21. Pham H, Armstrong DG, Harvey C, Harkless LB, Giurini JM, Veves A. Screening techniques to identify people at high risk for diabetic foot ulceration: a prospective multicenter trial. Diabetes Care. 2000;23(5):606-11.
22. Monteiro-Soares M, Boyko EJ, Ribeiro J, Ribeiro I, Dinis-Ribeiro M. Risk stratification systems for diabetic foot ulcers: a systematic review. Diabetologia. 2011;54(5):1190-9.
23. Koller A, Metzger C, Möller M, Stumpf J, Zink KS. Risikoklassen beim diabetischen Fußsyndrom. OST Sonderhef Diabetes. 2005:45-7.
24. Drerup B, Wetz H, Kolling C. Der Einfluss der Fußbettung und Schuhzurichtung auf die plantare Druckverteilung. Med Orthop Tech. 2000;120:84-90.
25. Hamatani M, Mori T, Oe M, Noguchi H, Takehara K, Amemiya A, et al. Factors Associated With Callus in Patients with Diabetes, Focused on Plantar Shear Stress During Gait. J Diabetes Sci Technol. 2016;10(6):1353-9.
26. Peter-Riesch B. Offloading – Key issues and actions in initial management of acute diabetic foot syndrome and foot ulcer (DFS/DFU). QualiCCare association. 2020.
27. Pitei DL, Fwoster A, Edmonds M. The effect of regular callus removal on foot pressures. J Foot Ankle Surg. 1999;38(4):251-5; discussion 306.
28. Rayman G, Vas P, Dhatariya K, Driver V, Hartemann A, Londahl M, et al. Guidelines on use of interventions to enhance healing of chronic foot ulcers in diabetes (IWGDF 2019 update). Diabetes Metab Res Rev. 2020;36 Suppl 1:e3283.
29. Bus SA, Armstrong DG, Crews RT, Gooday C, Jarl G, Kirketerp-Moller K, et al. Guidelines on offloading foot ulcers in persons with diabetes (IWGDF 2023 update). Diabetes Metab Res Rev. 2024;40(3):e3647.
30. Mueller MJ, Sinacore DR, Hastings MK, Strube MJ, Johnson JE. Effect of Achilles Tendon Lengthening on Neuropathic Plantar Ulcers* : A Randomized Clinical Trial. JBJS. 2003;85(8):1436-45.
31. Bonanno DR, Gillies EJ. Flexor Tenotomy Improves Healing and Prevention of Diabetes-Related Toe Ulcers: A Systematic Review. J Foot Ankle Surg. 2017;56(3):600-4.
32. Kalantar Motamedi A, Ansari M. Comparison of Metatarsal Head Resection Versus Conservative Care in Treatment of Neuropathic Diabetic Foot Ulcers. J Foot Ankle Surg. 2017;56(3):428-33.
33. Prompers L, Huijberts M, Apelqvist J, Jude E, Piaggesi A, Bakker K, et al. Optimal Organization of Health Care in Diabetic Foot Disease: Introduction to the Eurodiale Study. The International Journal of Lower Extremity Wounds. 2007;6(1):11-7.
34. Forsythe RO, Apelqvist J, Boyko EJ, Fitridge R, Hong JP, Katsanos K, et al. Effectiveness of revascularisation of the ulcerated foot in patients with diabetes and peripheral artery disease: A systematic review. Diabetes Metab Res Rev. 2020;36 Suppl 1:e3279.
35. Aboyans V, Ricco JB, Bartelink MEL, Bjorck M, Brodmann M, Cohnert T, et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Rev Esp Cardiol (Engl Ed). 2018;71(2):111.
36. Senneville É, Albalawi Z, van Asten SA, Abbas ZG, Allison G, Aragón-Sánchez J, et al. IWGDF/IDSA guidelines on the diagnosis and treatment of diabetes-related foot infections (IWGDF/IDSA 2023). Diabetes Metab Res Rev. 2024;40(3):e3687.
37. Abbas M, Uçkay I, Lipsky BA. In diabetic foot infections antibiotics are to treat infection, not to heal wounds. Expert Opinion on Pharmacotherapy. 2015;16(6):821-32.
38. Gardner SE, Haleem A, Jao Y-L, Hillis SL, Femino JE, Phisitkul P, et al. Cultures of Diabetic Foot Ulcers Without Clinical Signs of Infection Do Not Predict Outcomes. Diabetes Care. 2014;37(10):2693-701.
39. Dinh MT, Abad CL, Safdar N. Diagnostic accuracy of the physical examination and imaging tests for osteomyelitis underlying diabetic foot ulcers: meta-analysis. Clin Infect Dis. 2008;47(4):519-27.
40. Cohen M, Cerniglia B, Gorbachova T, Horrow J. Added value of MRI to X-ray in guiding the extent of surgical resection in diabetic forefoot osteomyelitis: a review of pathologically proven, surgically treated cases. Skeletal Radiol. 2019;48(3):405-11.
41. Schöni M, Soldevila-Boixader L, Böni T, Muñoz Laguna J, Uçkay I, Waibel FWA. Comparative Efficacy of Conservative Surgery vs Minor Amputation for Diabetic Foot Osteomyelitis. Foot Ankle Int. 2023;44(11):1142-9.
42. Lázaro-Martínez JL, Aragón-Sánchez J, García-Morales E. Antibiotics versus conservative surgery for treating diabetic foot osteomyelitis: a randomized comparative trial. Diabetes Care. 2014;37(3):789-95.
43. Waibel F, Berli M, Catanzaro S, Sairanen K, Schöni M, Böni T, et al. Optimization of the antibiotic management of diabetic foot infections: protocol for two randomized controlled trials. Trials. 2020;21(1):54.
44. Schaper NC, van Netten JJ, Apelqvist J, Bus SA, Hinchliffe RJ, Lipsky BA, et al. Practical guidelines on the prevention and management of diabetic foot disease (IWGDF 2019 update). Diabetes/Metabolism Research and Reviews. 2020;36:e3266.
45. Dutta A, Bhansali A, Rastogi A. Early and Intensive Glycemic Control for Diabetic Foot Ulcer Healing: A Prospective Observational Nested Cohort Study. Int J Low Extrem Wounds. 2021:15347346211033458.
46. Peter-Riesch B, Czock A, Uckay I, Interdisciplinary Expert Group on the Diabetic F. Swiss interdisciplinary guidance on good practices for acute and complicated diabetic foot syndromes. Swiss Med Wkly. 2021;151:w30045.
47. Frykberg RG, Banks J. Challenges in the Treatment of Chronic Wounds. Adv Wound Care (New Rochelle). 2015;4(9):560-82.