Einleitung
Palliative Care entwickelte sich primär in der Behandlung und Begleitung von Krebspatienten und fokussierte auf die letzte Krankheitsphase, in der keine onkologischen, krankheitsbeeinflussenden Massnahmen mehr möglich sind. In diesem Verständnis sind die Hauptziele der palliativen Behandlung die Linderung der Symptome am Lebensende, die Begleitung und Unterstützung des Patienten und der Angehörigen im Abschiedsprozess und die Organisation des Betreuungsnetzes, meistens mit Unterstützung durch spezialisierte Palliativdienste (stationär und ambulant).
In den letzten Jahren hat sich das Verständnis von Palliative Care erweitert. Die Erkenntnis beginnt sich in verschiedenen Fachrichtungen durchzusetzen, dass Patienten und Angehörige von einem frühen Einbezug palliativer Ansätze profitieren, begleitend zu krankheitsmodifizierenden und partiell kurativen Therapien. Dieses Konzept wird in der Literatur als Early Palliative Care (1) beschrieben und bezieht sich nicht nur auf onkologische Diagnosen, sondern zunehmend auch auf neurologische oder internistische wie beispielsweise die Herzinsuffizienz, die COPD und ganz besonders auch auf die Multimorbidität alter Menschen.
Demografie und Medizin
Das Sterben und damit auch die letzte Lebensphase hat sich für den Grossteil der Menschen ins hohe Alter verschoben, wir leben immer länger und sterben später (2). Ein wichtiger Grund für diese Entwicklung ist der medizinische Fortschritt. Früher tödliche Krankheiten können heute erfolgreich so behandelt werden, dass wir noch viele Jahre mit ihnen leben können. Die Kehrseite dieser Entwicklung ist die steigende Multimorbidität: Patienten überleben heute eine erste akute oder chronische Krankheit und erleben früher oder später eine zweite, überleben auch die zweite und erleben und überleben damit eine dritte und so fort (3).
Das fortgeschrittene Alter zusammen mit der Multimorbidität führen zu einer zunehmenden Gebrechlichkeit (frailty) und Pflegebedürftigkeit, weshalb über die Hälfte der über 65-Jährigen in der Schweiz das Lebensende in einem Pflegeheim erlebt und auch dort verstirbt. Und weil die Prävalenz der Demenzerkrankungen mit steigendem Alter zunimmt, sind rund ein Drittel der alten und meist multimorbiden Menschen in der letzten Lebensphase zusätzlich von einer Demenz betroffen.
Die Behandlung, Betreuung und Begleitung dieser geriatrischen Patienten erfordern ein adaptiertes und erweitertes Verständnis von Palliative Care. Sie wird nicht in einem spezialisierten Milieu geleistet, sondern liegt vor allem in den Händen der Hausärzte, zusammen mit den ambulanten Pflegediensten und dem Personal der Pflegeheime. Wie dieses Verständnis aussieht, wo und wie es sich vom ursprünglichen Konzept in der Onkologie unterscheidet und was bei alten Menschen in der Behandlung besonders zu beachten ist, wird in den folgenden Abschnitten ausgeführt.
Wann beginnt Palliative Care bei geriatrischen Patienten?
In den nationalen Leitlinien Palliative Care steht: «Palliative Care umfasst die Betreuung und die Behandlung von Menschen mit unheilbaren, lebensbedrohlichen und/oder chronisch fortschreitenden Krankheiten. Sie wird vorausschauend miteinbezogen, ihr Schwerpunkt liegt aber in der Zeit, in der die Kuration der Krankheit als nicht mehr möglich erachtet wird und kein primäres Ziel mehr darstellt (4).»
Gemäss dieser Definition wären alle multimorbiden Patienten Palliativpatienten. Diese Auffassung greift aber zu kurz. Alte Menschen mit Einschränkungen durch eine oder meist mehrere chronische, fortschreitende Krankheiten benötigen ein Miteinander von geriatrischen und palliativen Ansätzen. Der Geriater James Pacala hat dies auf den Punkt gebracht unter dem Titel «Is palliative care the ‹new› geriatrics? Wrong question – we are better together»(5). Er plädiert darin im Sinne der Early Palliative Care für einen frühen, integrativen Einsatz von palliativen Prinzipien statt dem verbreiteten sequenziellen Vorgehen mit kurativen Bemühungen so lange wie möglich und erst anschliessendem Wechsel auf ein palliatives Konzept. Im deutschsprachigen Raum ist für dieses integrative Konzept der Begriff der «Palliativen Geriatrie» entstanden. Die Fachgesellschaft für Palliative Geriatrie FGPG umschreibt den Ansatz folgendermassen:
«Palliative Geriatrie ist ein umfassender, multiprofessioneller Betreuungsansatz für hochbetagte Menschen in ihrer oft langen letzten Lebensphase. Ziel ist es, den Betroffenen bis zu ihrem Tod ein gutes, ihren körperlichen und psychischen Bedürfnissen entsprechendes Leben zu ermöglichen und die An- und Zugehörigen in dieser schweren Zeit zu unterstützen. Dies gelingt durch das Zusammenführen der Prinzipien der Geriatrie mit jenen von Palliative Care. Es kommen sowohl kurative als auch rehabilitative und palliative Massnahmen zum Einsatz. Je näher das Lebensende rückt, desto deutlicher verschiebt sich das Angebot zugunsten hospizlich-palliativer Massnahmen. Palliative Geriatrie soll in allen Versorgungssettings verwirklicht werden, beispielsweise zu Hause, in der Wohngemeinschaft, im Krankenhaus, im Pflegeheim oder im Hospiz (6).»
Die amerikanischen Kardiologen sprechen von einem «Tandem», das ab Beginn einer chronischen Herzinsuffizienz zum Einsatz kommen soll (7): Mit der Diagnosestellung einer chronischen, unheilbaren Krankheit sind bereits palliative Ansätze mitzudenken. Dieses Bild können wir auch für den multimorbiden Menschen übernehmen (Abb. 1).
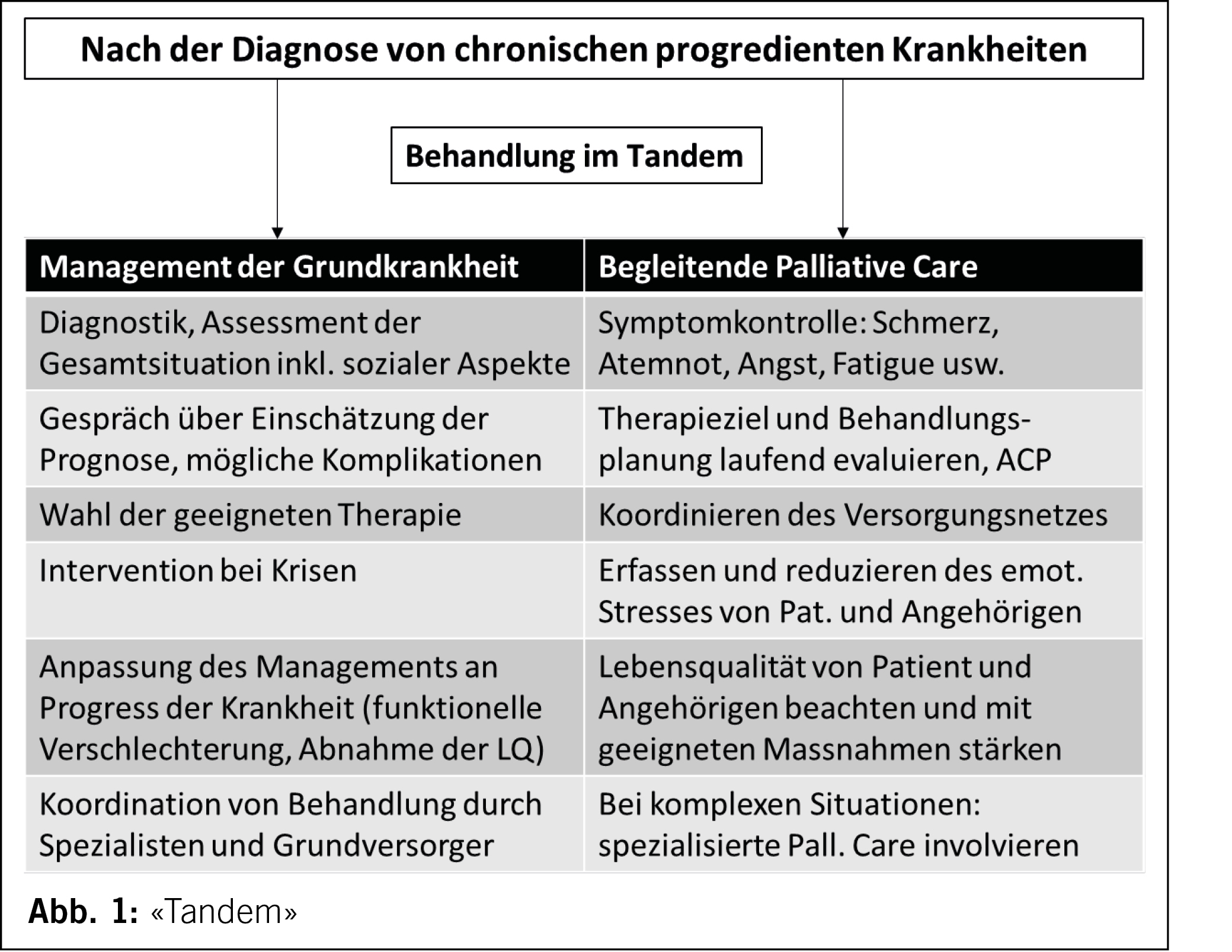
Individueller Strategiewechsel
Das Konzept von Palliative Care ist von den behandelnden Ärzten früh im Krankheitsverlauf mitzudenken und individuell zu integrieren. Leitend in der Behandlungsplanung wird es, wenn «die Kuration kein primäres Ziel mehr darstellt». Diese Formulierung in den nationalen Leitlinien (4) fordert: Das gemeinsame Behandlungsziel muss im Verlauf immer wieder reevaluiert werden im Gespräch mit dem Patienten (und meistens auch mit seinen Angehörigen) im Sinne des shared decision making. Der Zeitpunkt des Shifts zu einem vorwiegend palliativen Prozedere wird somit primär vom Patienten bestimmt. Bei Urteilsunfähigkeit im Rahmen einer Demenzerkrankung können wir uns idealerweise auf ein Dokument der gesundheitlichen Vorausplanung beziehen, sonst liegt die Entscheidung in der Hand der Vertretungspersonen gemäss Erwachsenenschutzrecht.
Den Entscheidungen vorausgehen muss immer eine offene Kommunikation mit dem Patienten und/oder seinen Angehörigen: «Eine verständliche und wiederholte, stufenweise Aufklärung versetzt den Patienten in die Lage, realistische Erwartungen zu entwickeln, und ermöglicht eine eigenständige Willensbildung und Entscheidung. Grundvoraussetzungen dazu sind Empathie und Wahrhaftigkeit gegenüber dem Patienten und die Bereitschaft, Möglichkeiten und Grenzen der kurativen wie der palliativen Behandlung offenzulegen (8).»
Letztlich entscheidet der autonome Patient, wie lange er gegen die Krankheiten ankämpfen will, auch wenn die Belastung durch die Therapien möglicherweise hoch und die Aussichten auf Erfolg klein sind. Wichtig ist, dass wir stets ehrlich über die Behandlungschancen und die begleitenden Belastungen informieren. Das beinhaltet auch, nur für diese Patientengruppe sinnvolle, indizierte Massnahmen vorzuschlagen; es ist ethisch nicht zu rechtfertigen, medizinisch aussichtslose Behandlungen (Futility) vorzuschlagen oder durchzuführen. Auf die Situation bei urteilsunfähigen Patienten wird weiter unten eingegangen.
Im Gegensatz zur Situation von onkologischen Patienten, wo die Krebserkrankung die prognosebestimmende Diagnose ist und ihr Überschreiten der Heilbarkeitsgrenze den Wechsel zur palliativen Phase markiert, ist es bei Multimorbidität und chronischem Organversagen ein kontinuierlicher Prozess, der mit jeder Krise einen Schritt mehr in ein palliatives Behandlungskonzept führt (Abb. 2). Nach jeder überstandenen Krise ist eine Standortbestimmung sinnvoll, um gemeinsam die aktuellen Behandlungsziele zu evaluieren, die Prognose zu thematisieren und die Behandlung allenfalls anzupassen.
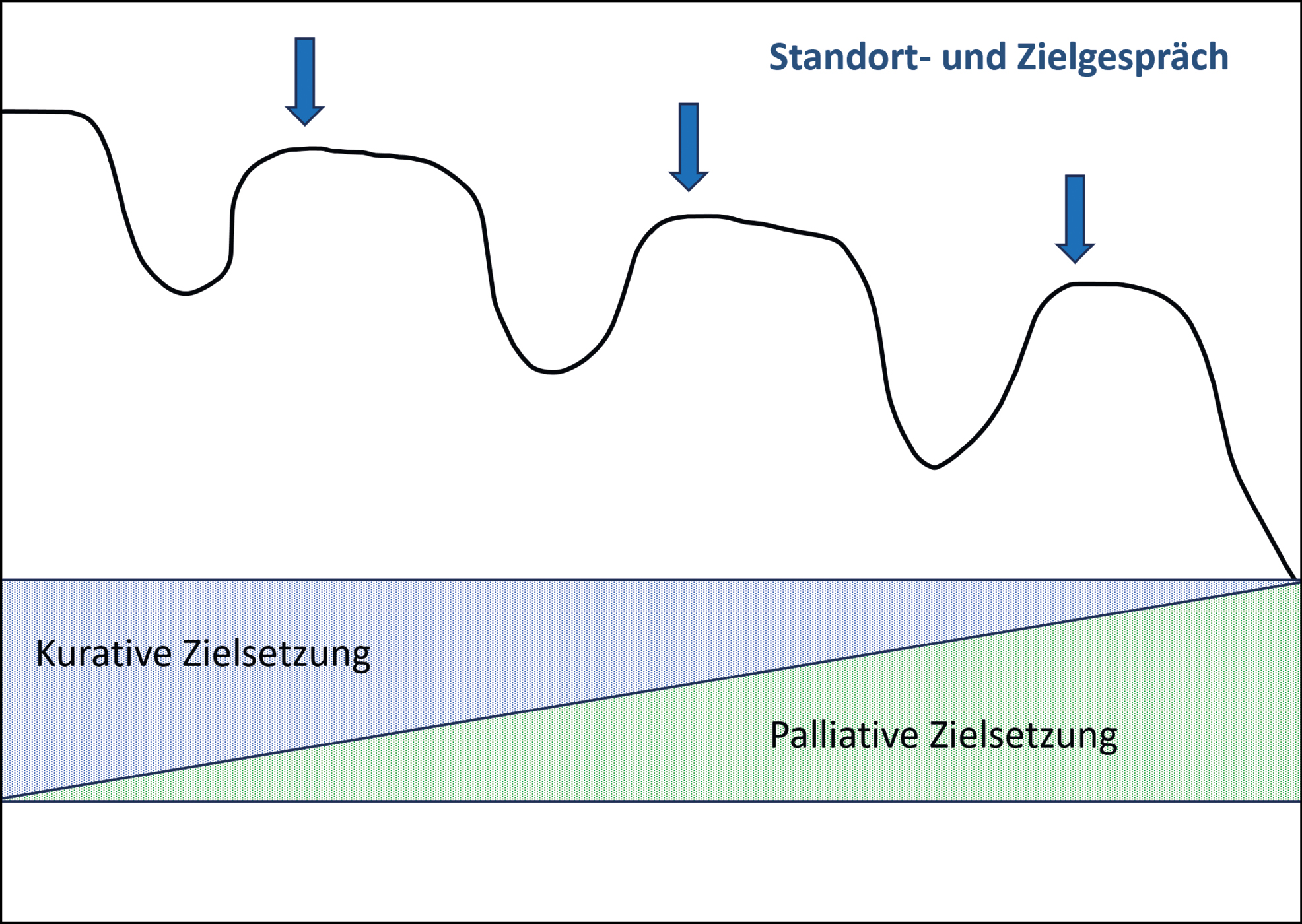
Lebens- und Behandlungsziele
Das übergeordnete Behandlungsziel
Zielführender, als nur über einzelne Behandlungsoptionen zu diskutieren, ist das Gespräch über die aktuellen Lebensziele der Person. Was erhofft sich der alte Mensch noch vom Leben, was ist ihm wichtig ist für die verbleibende Lebenszeit? Das kann für den einen bedeuten, noch möglichst lange zu leben, auch unter Inkaufnahme von zunehmender Abhängigkeit. Für den anderen ist die Erhaltung von Fähigkeiten zu bestimmten Aktivitäten prioritär, zum Beispiel spazieren gehen zu können, selbständig zu bleiben bei der Körperpflege; beim Verlust dieser Funktionen möchte er lieber keine weiteren Interventionen zur Lebensverlängerung. Die Frage der Motivation einer Patientengruppe mit medianem Alter von 84 zu einem geplanten Aortenklappenersatz (TAVI) ergab folgende Ziele: Die Erhaltung der ability to do a specific activity war der Hauptgrund mit 48%, maintaining independence stand mit 30% an zweiter Stelle und staying alive war für nur 7% im Vordergrund (9). Für die meisten hochbetagten Menschen stehen ihre individuelle Lebensqualität im Vordergrund und der Erhalt der für sie persönlich wichtigen Funktionen. Ihre Lebensqualität hängt weniger von den verbleibenden oder nachlassenden Kräften ab (intrinsic capacity) als von der Erhaltung der Möglichkeiten (functional abilities), das sein und tun zu können, was ihnen wichtig ist (10).
Die Prioritäten der Patienten sind dem Hausarzt nicht in jedem Fall klar, wie eine Studie mit Schweizer Hausärzten gezeigt hat. In 55% der Fälle sahen die Hausärzte zwar das wichtigste oder zweitwichtigste Problem der Patienten im Vordergrund, aber bei 45% kannte der Hausarzt die für den Patienten prioritären Probleme nicht (11)! Die Versicherung, dass Arzt und Patient das gleiche Ziel verfolgen, muss im Behandlungsverlauf zwingend immer wieder Thema sein.
Aspekte der Zielklärung
Es ist grundsätzlich sinnvoll, mit älteren Menschen über ihre Lebensziele zu sprechen und davon abgeleitet über konkrete aktuelle und zukünftige Behandlungsziele und -grenzen. Je mehr wir über ihre Werte, Hoffnungen und Befürchtungen wissen, umso besser können wir konkrete Behandlungsvorschläge formulieren und mit den Betroffenen diskutieren. Dieser Prozess des Advance Care Planning (ACP) und die Festlegung der gewünschten Massnahmen bei einer akuten Gesundheitsstörung in einer ärztlichen Notfallanordnung (ÄNO), die verbindlich die erwünschten und unerwünschten Notfallmassnahmen regelt, werden im Beitrag von Klaus Bally in dieser Ausgabe ausgeführt.
Beim Eintritt in ein Pflegeheim ist es wichtig, gemeinsam mit Patient, Angehörigen und Pflegepersonal in einem Standortgespräch die Gesamtsituation zu besprechen und die aktuellen Ziele und Erwartungen, aber auch die Grenzen zu klären. Pflegeinstitutionen betreuen heute pflegebedürftige Menschen mit sehr unterschiedlichen Zielen. Eine wachsende Zahl der Eintritte erfolgt zur weiteren Rehabilitation nach Hospitalisation mit dem Ziel, wieder nach Hause zurückkehren zu können. Für andere Bewohner steht im Fokus, im Pflegeheim einen neuen Lebensabschnitt in guter Lebensqualität verbringen zu dürfen. Sie erwarten, dass gesundheitliche Probleme adäquat behandelt werden und ihre Funktionen soweit möglich erhalten bleiben. Die dritte Gruppe bilden Menschen mit einer fortgeschrittenen Krankheit, die unter belastenden Symptomen leiden und wissen, dass ihre Lebenserwartung begrenzt ist. Sie hoffen, dass sie gute Palliative Care erhalten, Lebensverlängerung ist kein prioritäres Ziel mehr. Die letzte Gruppe, die aufgrund der verkürzten Spitalaufenthalte deutlich gewachsen ist, sind Menschen, die zum Sterben ins Pflegeheim verlegt werden und oft nur noch wenige Tage oder Wochen leben. Sie benötigen eine gute end of life care.
Im Standortgespräch wird die medizinische Situation zusammengefasst, die Prognose erörtert und das prioritäre Ziel gemeinsam definiert, damit alle Beteiligten am gleichen Strick ziehen und Missverständnisse und Spannungen vermieden werden (Abb. 3).
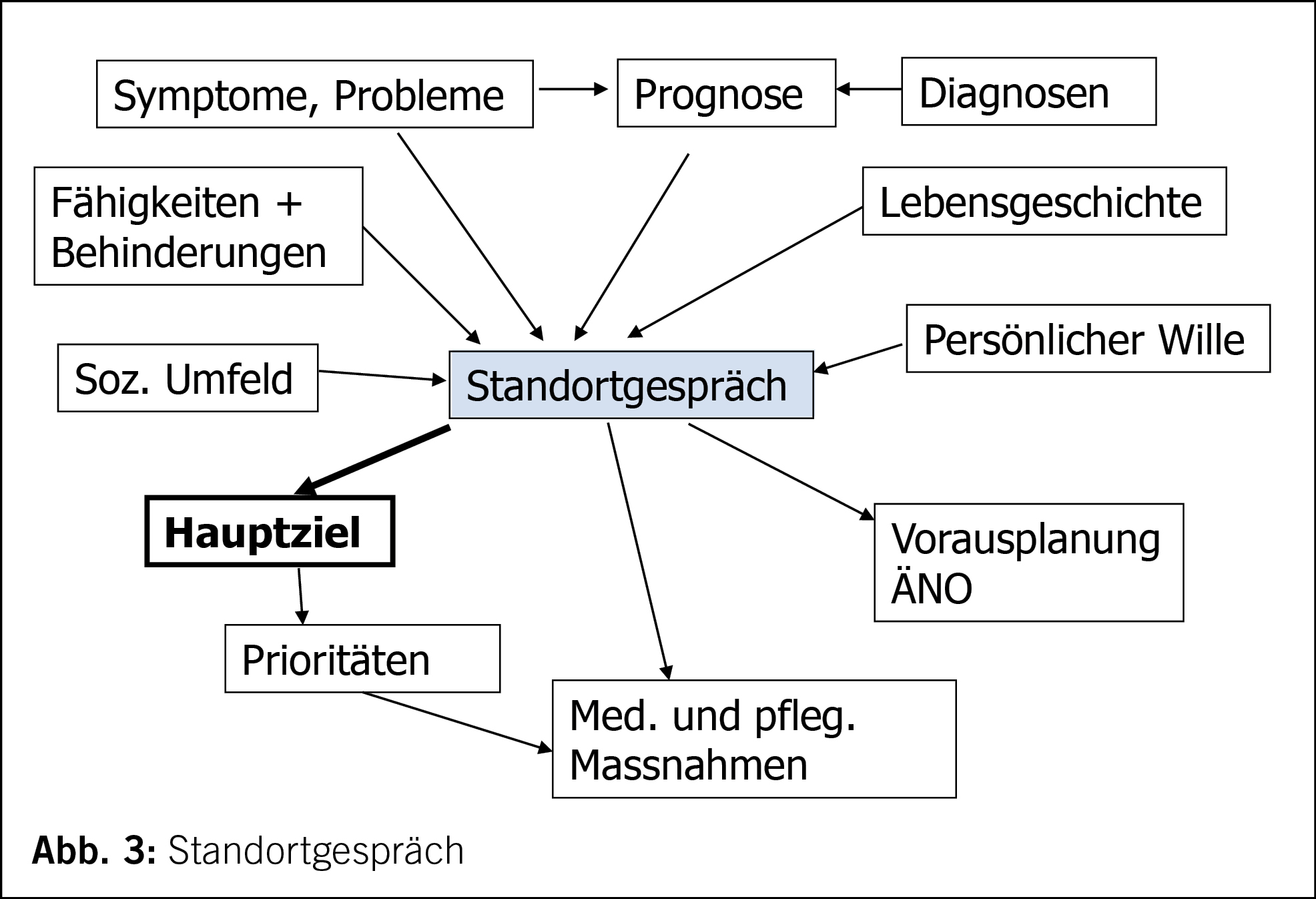
Umgang mit Futility
Alte Menschen dürfen auch unrealistische Ziele haben. Die Hoffnung spielt dabei eine wesentliche Rolle, und sie kann durchaus auch palliative Wirkung entfalten. Ärztliche Aufgabe ist es, empathisch die unrealistischen Hoffnungen zu akzeptieren, aber nicht zu bekräftigen und sich nicht verleiten zu lassen, eine Übertherapie bzw. eine aussichtslose Behandlung anzubieten (12). Ist von einer höchstwahrscheinlichen Wirkungs- oder Aussichtslosigkeit einer Behandlung (quantitative Futility) auszugehen, entfällt die medizinische Indikation für deren Einsatz. Qualitative Futility ist eine individuelle Beurteilung: Eine Behandlung kann potenziell wirksam sein, aber ohne Aussicht darauf, das übergeordnete Therapieziel (z.B. Heilung, Weiterleben mit akzeptabler Lebensqualität) zu erreichen. Dann belastet sie den Patienten nur unnötig(13).
Fachpersonen können sich manchmal genötigt fühlen, Behandlungen durchzuführen, obwohl diese aus ihrer Sicht nicht dem Patientenwohl dienen. Dazu gehört eine explizite Erwartungshaltung respektive der Druck von Patient und Angehörigen (14). In diesen Situationen ist eine empathische Kommunikation gefragt, die kulturelle und religiöse Überzeugungen, Vorstellungen und Wissensstand der betroffenen Personen berücksichtigt und ihre Bedürfnisse, Wünsche und Befürchtungen soweit möglich einbezieht. Der Arzt orientiert sich dabei stets am Behandlungsziel und an der Chance, das Ziel zu erreichen unter Berücksichtigung der begleitenden Belastungen.
Umsetzung im Alltag
Jede laufende oder geplante medizinische Massnahme für einen multimorbiden alten Menschen muss daran gemessen werden, ob sie dem besprochenen Behandlungsziel dient oder nur den aktuellsten medizinischen Guidelines folgt. Das betrifft medikamentöse Behandlungen (auch präventive wie Statine), aber auch Abklärungen, Kontrollen, Interventionen, Überweisungen zu Spezialisten oder ins Spital. Ein regelmässiger Medikamentencheck mit der Frage, ob für jedes Medikament noch eine Indikation in Bezug auf das übergeordnete Behandlungsziel besteht und ob die belastendsten Probleme des Patienten adäquat behandelt werden, ist zu empfehlen (Abb. 4).
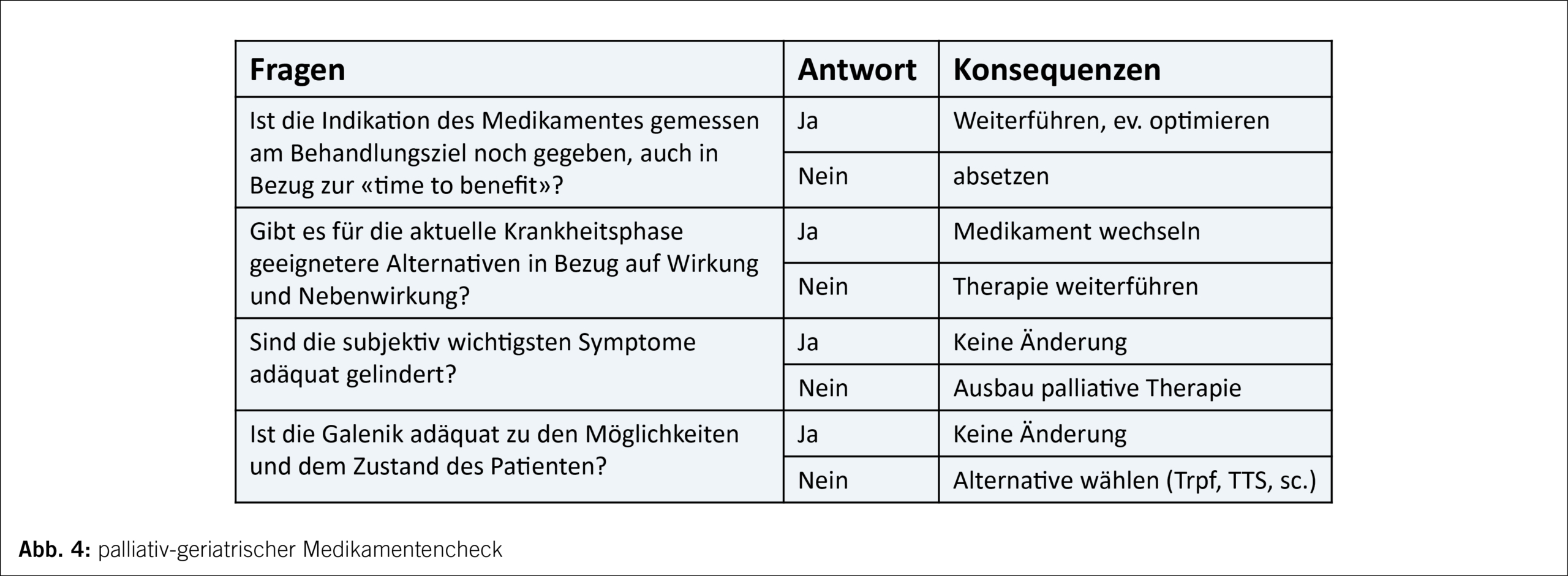
Bei Patienten im Pflegeheim ist es zusätzlich wichtig, im Gespräch mit den Pflegenden und Therapeuten regelmässig zu evaluieren, ob die pflegerischen und therapeutischen Massnahmen (noch) dem Behandlungsziel dienen. Wie lange ist es sinnvoll, die Mobilisation und das Selbsthilfetraining zu forcieren, wie häufig machen Blutzuckermessungen Sinn, was steht bei der Ernährung im Vordergrund (Proteinergänzungsnahrung oder einfach essen, was Freude macht), ist die Trinkmenge noch relevant? Es braucht immer wieder eine kritische Überprüfung: Welches und wessen Behandlungsziel verfolgen wir? Leitet uns das Behandlungsziel des Patienten oder eher das der Angehörigen, der Therapeuten, der Pflege oder des Organspezialisten?
Herausforderungen im Entscheidungsprozess
Prognose
Multimorbide alte Menschen befinden sich meistens in einem sehr labilen Gleichgewicht, das infolge einer neuen gesundheitlichen Störung, eines Sturzes mit Verletzungsfolgen oder einer plötzlichen Verschlechterung sehr schnell kippen kann. Diese unsichere Prognose erschwert es den alten Menschen, ihre persönlichen Zielsetzungen zu finden: Kann ich noch Pläne machen, oder soll ich mich mehr mit dem Ende auseinandersetzen? Sie ist aber auch eine Herausforderung für die Angehörigen oder das Pflegepersonal. Wo soll der Schwerpunkt in der Betreuung gesetzt werden? Förderung der Selbsthilfe und Selbständigkeit (im Blick auf eine noch längere Zukunft) oder einfach gute Symptomlinderung und Verzicht auf funktionelle Förderung – die vom Patienten oft gar nicht so geschätzt wird – im Blick auf das bevorstehende Ende? In gemeinsamen Gesprächen über die Konsequenzen ist mit dem Patienten zu evaluieren, was ihm wichtiger ist.
Auch für medizinische Entscheidungen ist die Prognose zentral. Wie aggressiv soll abgeklärt werden bei neuen Problemen? Wie lange braucht es, bis der Patient von einer möglichen Intervention profitieren kann (time to benefit)? Wie gross ist die Chance, dass der Patient die Intervention mit einem Nutzen übersteht? Die Prognoseeinschätzung bei multimorbiden Patienten ist eine Herausforderung, und wir Ärzte tendieren dazu, die Prognose eher zu optimistisch einzuschätzen. Eine wichtige Hilfestellung ist die Einschätzung des Frailty-Grades, am besten mit der Clinical Frailty Scale (15). Bei einem Frailty-Grad eins bis drei kann von einer nur minimen Vulnerabilität ausgegangen werden mit hoher Chance auf ein gutes Outcome, bei Grad vier bis sechs sind die potenziellen Risiken bereits wesentlich grösser, und eine schlechtere Erholung ist zu erwarten. Diagnostizieren wir einen Frailty-Grad von sieben bis neun, ist eine hohe Vulnerabilität gegeben mit entsprechendem Risiko. Interventionen sind am ehesten noch zur Symptomlinderung beim Versagen anderer weniger invasiver Massnahmen in Betracht zu ziehen.
Hilfreich kann auch ein Prognoserechner sein, der entweder die Prognose des Arztes unterstützt oder ihn durch eine andere Berechnung auffordert, seine Einschätzung nochmals zu überdenken. Ein praxisorientierter Rechner, der online ausgefüllt werden kann, ist der eprognosis calculator (16), der auch mitberücksichtigt, ob der Patient zu Hause oder im Pflegeheim lebt.
Ambivalenz
Das Verhältnis der meisten Menschen zum Tod ist zwiespältig. Sterben und Tod sind eine nicht lernbare Grenzerfahrung. Sich vor ihnen zu fürchten, ist natürlich, denn sie stellen die wohl grösste Verunsicherung im Leben eines Menschen dar. Angesichts des drohenden Endes kommt es immer wieder vor, dass Menschen den Tod zwar akzeptieren im Sinne von «Schon, aber nicht gerade jetzt», das heisst, im Moment des möglicherweise kurz bevorstehenden Todes möchten sie ihn doch noch etwas hinauszögern. Der Medizinethiker Daniel Callahan schrieb dazu: «Anstatt zu denken […], dass dieser Tod jetzt besser sein kann als ein anderer späterer Tod, ist es die moderne Art, immer den späteren, anderen Tod zu bevorzugen» (17). Solche Ambivalenzen sind normal, auch bei Menschen, denen wir die Fähigkeit zu autonomem Leben und Handeln keineswegs absprechen würden. Sie stellen eine Herausforderung für selbstbestimmte Entscheidungen am Lebensende dar, weil sie nicht einfach aufzulösen sind, sondern vorerst einmal ausgehalten und besprochen werden müssen (18). Solange der Patient urteilsfähig ist, gilt sein aktueller Wunsch, auch wenn dieser früher festgehaltenen Willensäusserungen widerspricht.
Balance of Burden and Benefit
Entscheidungen für und mit alten, oft gebrechlichen Menschen sind komplex; sie nur auf medizinischen Guidelines zu basieren, ist zu eindimensional. Neben den persönlichen Zielen der Betroffenen und den Möglichkeiten der Medizin sind weitere Blickwinkel einzubeziehen. Was bringt die erwogene Massnahme an potenziellem Nutzen, aber auch an Belastungen und Risiken für diesen alten Menschen? Im gemeinsamen Entscheidungsgespräch mit Patient und Angehörigen können die persönlichen Sichtweisen aufgenommen und Vor- und Nachteile abgewogen werden (Abb. 5). Ärztliche Aufgabe ist es dabei, offen und ehrlich zu informieren, die eigene Meinung aber soweit möglich zurückzuhalten.
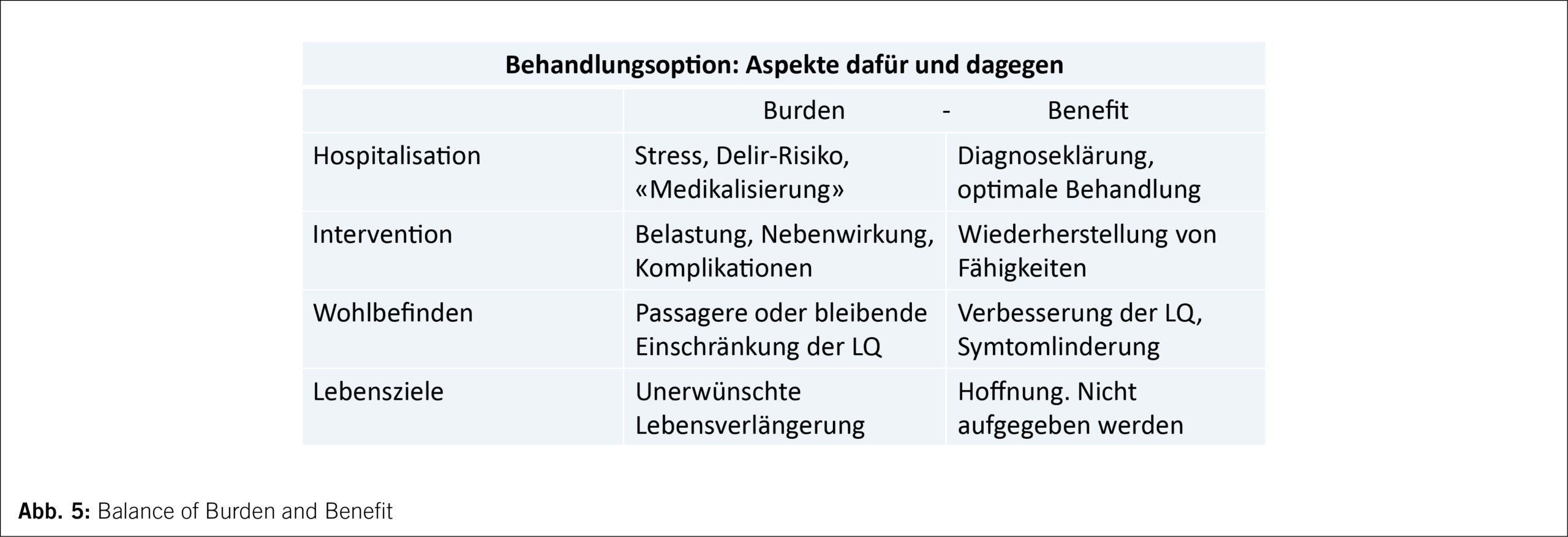
Bei den Entscheidungen zum weiteren Vorgehen geht es immer um die Frage, wie kurativ oder wie palliativ behandelt und wie lange das mögliche Sterben verhindert werden soll. Callahan bringt es auf den Punkt: «Bei jeder schweren Erkrankung – ganz besonders bei alten Menschen – sollte die Frage gestellt und die Möglichkeit geprüft werden: Kann diese Erkrankung die tödliche sein, oder – weil irgendeine Krankheit die tödliche sein muss – sollte man ihr bald erlauben, tödlich zu sein? Wenn ja, sollte ihr gegenüber umgehend eine andere Strategie ins Spiel kommen, das Bemühen um einen friedlichen Tod sollte wichtiger werden als der Kampf um eine Heilung»(17).
Sterbewünsche
Hochaltrige Menschen äussern häufig Gedanken zum Sterben. Diese Gedanken reichen vom Standpunkt «Es ist noch zu früh, ich will noch leben» bis zum konkreten Plan, das Leben zu beenden durch einen assistierten Suizid. Ralf Jox hat die unterschiedlichen Haltungen zum Ende folgendermassen kategorisiert (19):
– Ich bin nicht bereit für den Tod und akzeptiere ihn nicht.
– Ich bin nicht bereit für den Tod, aber akzeptiere ihn.
– Ich bin bereit für den Tod und akzeptiere ihn.
– Ich bin bereit für den Tod, akzeptiere ihn und wünsche mir, der Tod würde kommen.
– Ich denke darüber nach, meinen Tod zu beschleunigen, habe aber keinen bestimmten Plan.
– Ich denke darüber nach, meinen Tod zu beschleunigen und habe einen bestimmten Plan.
Für die Betroffenen sind Möglichkeiten, über ihr Sterben, ihre Ängste und mögliche Sterbewünsche zu sprechen, wichtig. Oft reden sie nicht von sich aus darüber, sie möchten ihren Arzt, die Pflegenden oder die Angehörigen nicht enttäuschen. Deshalb kann die Frage, ob sie manchmal ans Sterben denken, eine Türe öffnen, die Gespräche über den Lebenssinn und den Grad und den Grund von Sterbewünschen ermöglichen. Häufig sind es nicht so sehr Schmerzen oder körperliche Symptome, die zum Sterbewunsch führen, sondern Vereinsamung oder das Vermeiden eines Heimeintrittes und immer häufiger die Angst vor dem Verlust von Selbständigkeit und Würde. Der Wunsch nach ultimativer Autonomie kann auch die Kontrolle des Sterbezeitpunktes und der Todesumstände umfassen, was dann in die Planung eines assistierten Suizides münden kann.
Sterbewünsche sind auch Hilfeschreie und ein Wunsch nach einfühlsamer Kommunikation. Aktives Zuhören, gegenseitiges Verstehen und das Etablieren einer von Vertrauen getragenen Beziehung ermöglichen das richtige Deuten der Signale und bilden Ausgangspunkt und Vorbedingung für hilfreiche Angebote und Entscheidungen (20). Ergebnis der Gespräche kann sein, dass die Medikamente überprüft werden und alle lebenserhaltenden Massnahmen abgesetzt werden, dass man gemeinsam das Warten aushält und Leiden lindert oder dass der Patient doch den Entscheid für einen assistierten Suizid fällt. In diesem Falle ist es die persönliche Entscheidung des Arztes, ob und wie weit er sich an den vorbereitenden Schritten beteiligen will (21).
Symptomlinderung
Eine optimale Symptomkontrolle ist ein Grundanliegen von Palliative Care und erfordert eine gute Zusammenarbeit zwischen Ärzteschaft und Pflegenden bzw. zu Hause mit den Angehörigen. Die wichtigsten Symptome wie Schmerzen, Atemnot, Übelkeit oder Angst sind subjektive Empfindungen, die wir nicht messen oder objektivieren können, es zählt allein, was die Betroffenen darüber berichten. Ist die Kommunikation mit dem Patienten nicht mehr möglich, werden die Beobachtungen im Alltag durch die Angehörigen und die Pflegenden zur wichtigen Grundlage für die Planung palliativer Behandlungsschritte.
Worunter leiden alte Menschen?
Multimorbide alte Menschen leiden nicht nur unter den genannten Symptomen, sondern ebenso unter Funktionseinschränkungen, die ihre Lebensqualität vermindern können. Um das Leiden dieser Patienten zu erfassen und zu verstehen, braucht es offene Fragen wie «Was macht Ihnen aktuell am meisten Sorgen?» oder «Worunter leiden Sie in der aktuellen Situation am meisten?». Wird für das Assessment ein etabliertes Tool wie ESAS verwendet, ist es zu erweitern mit den funktionellen Beschwerden, die subjektiv als belastend empfunden werden (Abb. 6). Manchmal leiden betagte Menschen mehr darunter, dass sie inkontinent sind oder sich nicht mehr selbständig auf dem WC versorgen können wegen Einschränkungen in der Bewegungsfähigkeit als unter ihren Schmerzen oder der Atemnot.

Ziel des Assessments mit Quantifizierung des subjektiven Leidensdruckes ist es, die Prioritäten dort zu setzen, wo am meisten Leiden entsteht, weil wir nie alle Symptome und Probleme beheben können. Entsprechend werden dann Medikamente zur Symptomlinderung eingesetzt, ergänzt durch funktionelle Hilfsmittel, Physiotherapie oder das Erlernen von kompensatorischen alternativen Abläufen.
Die Symptome und deren Behandlungsmöglichkeiten bei alten Menschen unterscheiden sich nicht grundsätzlich von den Standards der Palliativmedizin für jüngere Patienten. In anderen Beiträgen in dieser Ausgabe wird darauf eingegangen. Wegen der häufig vorliegenden Organinsuffizienzen sind jedoch Dosierungsanpassungen oder Kontraindikationen zu beachten.
Schmerztherapie
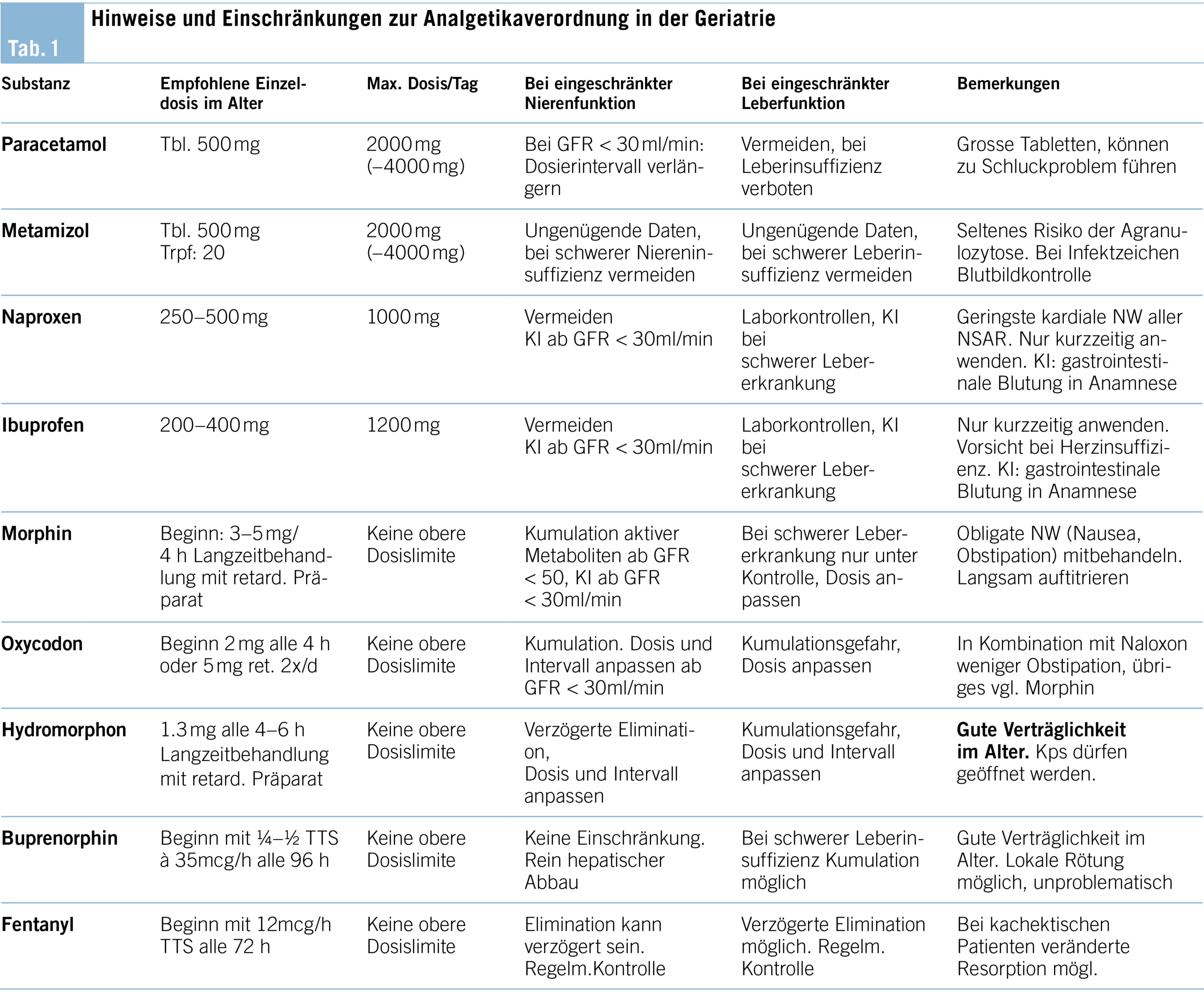
Chronische Schmerzen sind das häufigste Symptom alter Menschen, das sie auch in der Alltagsgestaltung einschränkt und oft täglich stark beeinträchtigt. Selten lassen sie sich vollständig beseitigen, wichtig für das Behandlungskonzept ist die Klärung eines realistischen Zieles: Schmerzfreiheit in Ruhe oder erträgliches Schmerzlevel bei Bewegung, Verhinderung von akuten Schmerzattacken. Die häufigsten Schmerzursachen liegen im Bewegungsapparat, nächtliche neuropathische Schmerzen werden gerne übersehen und als Schlafstörung behandelt. Primär ist eine kausale, gezielte Behandlung anzustreben wie Gelenksinfiltrationen oder -ersatz, in den meisten Fällen werden aber Analgetika notwendig werden. Welche Analgetika in welcher Dosierung bei geriatrischen Patienten eingesetzt werden können und was zu beachten ist, wird in (Tab. 1) zusammengefasst.
Total Pain
Chronische Schmerzen sind selten nur somatischen Ursprungs, sehr oft spielen Komponenten eines «Total Pain» mit. Dies gilt nicht nur für Schmerzen, sondern ebenso für andere Symptome. Im fortgeschrittenen Alter gibt es viele Facetten, die hinter chronischen Beschwerden stehen:
Seelischer Schmerz: Das hohe Alter ist gekennzeichnet durch die Zunahme von schmerzlichen Abschieden, z.B. von der Gesundheit, von der Lebenskraft, von der Mobilität, von geliebten Menschen und geliebten Umwelten, für viele auch vom eigenen Zuhause, vom sozialen Status und von der Unabhängigkeit. Biografische Erfahrungen können hochkommen und im hohen Alter Einfluss haben, wie körperliche Schmerzen erlebt und geäussert werden. Alte, verdrängte und nie aufgearbeitete Traumata können aus der Tiefe auftauchen und wiedererlebt werden.
Sozialer Schmerz: Viele Menschen sind im hohen Alter einsam, fühlen sich nutzlos in der Gesellschaft, haben Aufgaben und alle Freunde verloren. Diese Einsamkeit wird noch verstärkt durch einschränkende Massnahmen, wie sie während der Covid-19-Pandemie verordnet wurden. Und das Pflegeheim ist kein Prestigeort, sondern für viele ein schambesetzter Lebensort, an den sie nie hinwollten.
Spiritueller Schmerz: Gerade im hohen Alter stellt sich die Sinnfrage oft mit grosser Dringlichkeit. Einerseits sehen viele keinen Sinn mehr in ihrem Leben, wenn sie ins Heim umziehen müssen, andererseits wirft das absehbare Lebensende seine Schatten voraus und führt zu Gedanken der Lebensbilanz: «Was habe ich alles verpasst in meinem Leben, was habe ich falsch gemacht? Warum bin ich abhängig und andere in meinem Alter sind noch selbständig?»
Zu- und Hinhören, den Raum öffnen für persönliche Verletzungen und Ängste und das vorsichtige Erklären der Zusammenhänge können Ansätze sein, den Total Pain aufzulösen.
Palliative Care bei Demenz
Bis zu einem Drittel der Menschen über 80 Jahren leiden unter kognitiven Einschränkungen im Rahmen einer Demenzerkrankung. Dieser Umstand stellt besondere Herausforderungen an das Behandlungs- und Betreuungsteam bei der Vorausplanung, bei Entscheidungen und beim Symptommanagement. Deshalb ist es wichtig, eine kognitive Verschlechterung frühzeitig zu erkennen, um entsprechend zu planen und das Behandlungskonzept anzupassen. Für ein Screening auf kognitive Probleme eigenen sich folgende Tools: Uhrentest, MoCa-Test, DemTect-Test und bei schon etwas fortgeschrittener Demenz der MMS. Alle diese Tests findet man im Internet zum Herunterladen, sie sind lediglich Screenings und reichen nicht für die Diagnosestellung.
Vorausplanung
Bei einer unheilbaren somatischen Erkrankung machen sich die meisten Menschen Gedanken zum weiteren Verlauf und zu ihrem Ende und lassen sich auf eine Vorausplanung ein. Bei der Diagnose einer Demenzerkrankung beschäftigen sich die Betroffenen primär mit der unmittelbaren Zukunft («Wie lange darf ich noch Auto fahren?»), der Gedanke ans Lebensende ist noch weit weg. Wegen der im Verlauf zunehmenden Urteilsunfähigkeit ist es sehr wichtig, frühzeitig über die Wünsche und Behandlungsgrenzen in fortgeschrittenem Krankheitsstadium zu sprechen und sie schriftlich festzuhalten. Dies erfordert eine einfühlsame Kommunikation über die Prognose, die Erwartungen und mögliche Komplikationen im Krankheitsverlauf. Der Einbezug der Angehörigen ist dabei wichtig, damit auch sie die Gedanken und Wünsche des Patienten kennen und bei späteren schwierigen Entscheidungen darauf Bezug genommen werden kann.
Symptommanagement
Die häufigen Symptome können als individuelles subjektives Erleben nur im Gespräch mit dem Patienten erfahren werden. Wenn die Kommunikationsfähigkeit im Rahmen einer neurodegenerativen Erkrankung beeinträchtigt ist, werden Symptome oft nicht erkannt und bleiben unterbehandelt. Die Beobachtung der Patienten durch die Betreuenden wird zur wichtigen Quelle von Hinweisen auf Symptome. Verhaltensänderungen und -auffälligkeiten können Ausdruck von unbehandelten Symptomen sein, in erster Linie von Schmerzen. Pflegende und Angehörige sind aufzufordern, Verhaltensänderungen zu dokumentieren. Entsprechende Tools wie ECPA oder BESD sind in Pflegeheimen heute etabliert. Sie bilden die Grundlage für das interprofessionelle Gespräch zur Analyse, welche Probleme hinter dem Verhalten stehen könnten und wie sie angegangen werden können. Oft bringt erst die Einleitung einer probatorischen Analgetikatherapie und anschliessenden Beobachtung des Patienten die Antwort, ob ein Schmerzproblem hinter dem veränderten Verhalten steht. Opiate können vorsichtig dosiert auch bei einer Demenz eingesetzt werden. Langzeitanwendungen von Opiaten sind aber kritisch zu hinterfragen, und eine Dosisreduktion sollte regelmässig versucht werden.
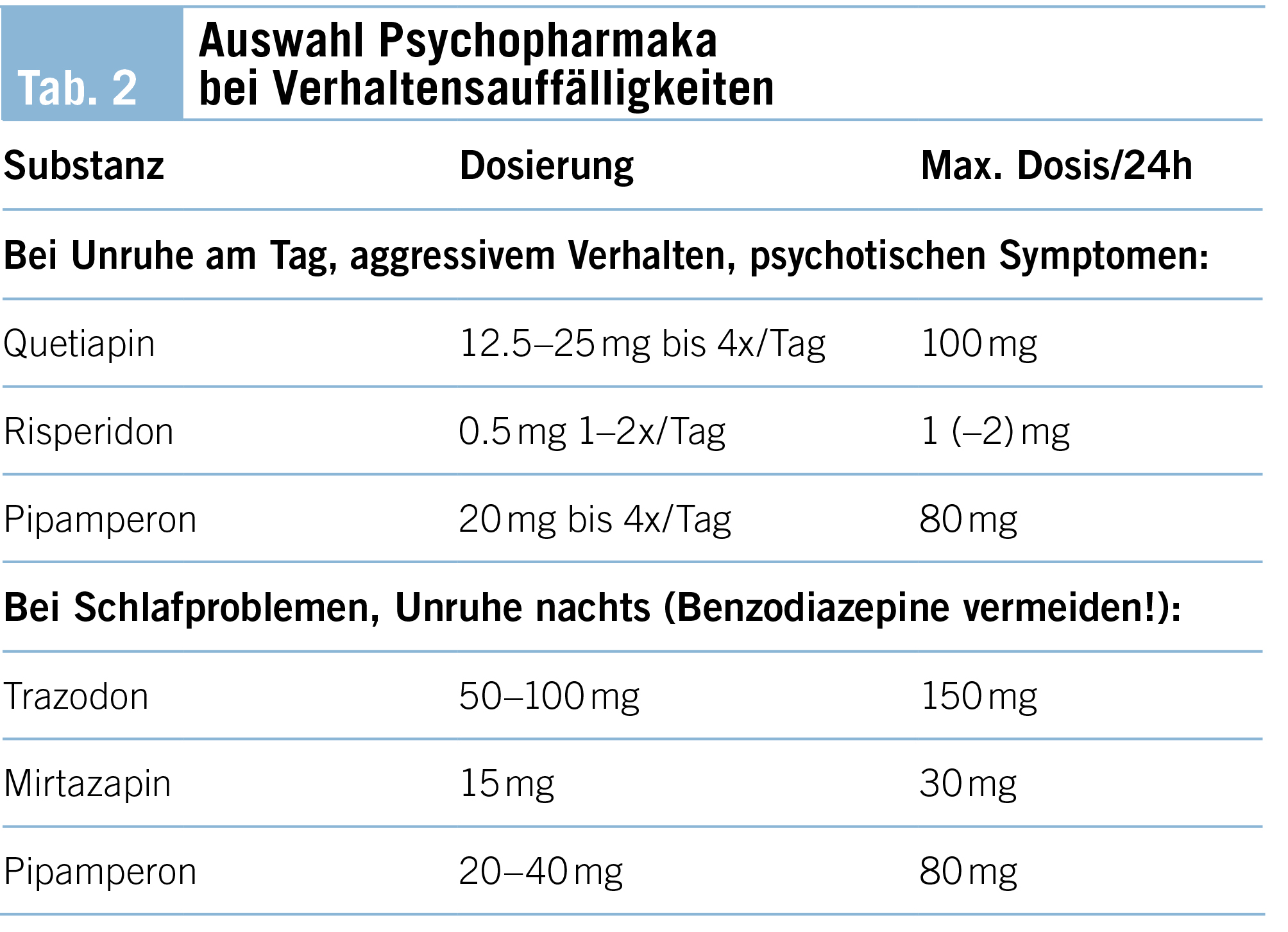
Demenzkranke Menschen leiden nicht nur unter somatischen, sondern phasenweise auch unter neuropsychiatrischen Symptomen oder Verhaltensänderungen (BPSD) wie Angst, Wahnvorstellungen, Halluzinationen, Agitiertheit oder Aggressionen. Darunter leiden vor allem auch die Betreuenden. Psychopharmaka sind als palliative Massnahmen indiziert, wenn trotz Validation und Milieuanpassung keine Entspannung und Linderung erreicht werden können und körperliche Ursachen wie Harnverhalt, Obstipation, Schmerzen, Atemnot oder Delir ausgeschlossen sind. In (Tab. 2) wird eine Auswahl von bewährten Psychopharmaka aufgelistet.
Entscheidungsfindung
Mit fortschreitender Demenz wird das Behandlungsziel der Erhaltung von Lebensqualität zunehmend wichtiger als das Ziel der Lebensverlängerung. Ein regelmässiger Medikamentencheck hilft, die Indikation von einzelnen Medikamenten, wie z.B. Statine oder die Ziele der Blutdrucksenkung, zu hinterfragen. Eine optimale Einstellung des Blutzuckers mit regelmässigen Kontrollen und Nachspritzschema wird zunehmend unwichtiger, kann aber für den Patienten viel Stress bedeuten.
Bei Komplikationen stellt sich die Frage, wie aggressiv abgeklärt und behandelt werden soll. Für die Entscheidungsfindung ist es hilfreich, die Balance of Burden and Benefit gemeinsam mit den Angehörigen zu prüfen auf der Grundlage der vom Patienten früher geäusserten Wertvorstellungen, Ziele und Grenzen. Für die Familie ist es wichtig, sich der Progredienz der Krankheit bewusst zu sein und zu verstehen, dass die Demenz eine lebensbeendigende Krankheit sein kann. Entscheidungen haben immer auf dem mutmasslichen Willen des Patienten zu beruhen und nicht auf unrealistischen Hoffnungen oder Ängsten der Angehörigen, die ihren geliebten Patienten nicht verlieren möchten.
Sterbephase
Den Beginn der Sterbephase bei fortgeschrittener Demenz zu definieren, ist schwierig. Bei vielen Patienten beginnt sie mit verminderter Nahrungs- und Flüssigkeitsaufnahme und entsprechendem Gewichtsverlust. Behandelbare Ursachen sind in einem ersten Schritt auszuschliessen. Den Angehörigen muss verständlich gemacht werden, dass der Patient weniger isst, weil sich die Krankheit dem Ende nähert und nicht, dass es ihm schlechter geht, weil er nicht mehr isst. Forcierte Nahrungszufuhr kann das Sterben nicht hinauszögern, eine Sondenernährung verlängert die Lebenserwartung nicht und verhindert auch keine Aspirationspneumonien (22), und beides dient nicht dem Wohlbefinden. Die Lieblingsnahrung zu riechen und zu schmecken, bietet mehr Lebensqualität als eine optimierte Kalorienzufuhr und ermöglicht den Angehörigen, Zuwendung zu schenken. Mundpflege mit dem Lieblingsgetränk lindert ein allfälliges Durstgefühl.
Die Ablehnung einer Medikamenteneinnahme ist als Willensäusserung zu respektieren, einzig symptomlindernde Medikamente (v.a. Opiate) sind als TTS oder als regelmässige subcutane Applikation weiterzuführen, entsprechende Reserveverordnungen sind frühzeitig zu hinterlegen.