Dieser Praxis-Fall beschreibt eine 28-jährige Patientin, die unter unklarer Restharnbildung leidet. In der urogynäkologischen Untersuchung zeigt sich eine stark hyperkapazitäre Blase bei atonem Detrusor. Nach Ausschluss weiterer gynäkologischer und neurologischer Differentialdiagnosen wurde die Diagnose des Fowler-Syndroms gestellt. Dabei handelt es sich um eine schmerzlose Restharnbildung bei typischem Beckenboden-EMG mit Beckenbodendyskoordination. Die Diagnose kann nur durch eine vollständige Urodynamik mit Beurteilung der Miktionsphase, der Druckflusskurve einschliesslich EMG-Ableitung gestellt werden. Kausale Therapien existieren keine. Sakrale Neuromodulation, perkutane tibiale Nervenstimulation oder intermittierende Selbstkatheterisierung sind mögliche Therapieansätze.
Anamnese und Befunde
Zuweisung der 28-jährigen Patientin in die urogynäkologische Sprechstunde bei rezidivierenden Harnwegsinfektionen aufgrund erhöhter Restharnwerte. Im Rahmen einer regulären gynäkologischen Kontrolle zeigte sich im transvaginalen Ultraschall eine stark gefüllte Harnblase, unmittelbar nach Spontanmiktion. Ebenso traten in den letzten Monaten rezidivierende Harnwegsinfektionen (HWI’S) auf, die stark symptomatisch waren und antibiotisch behandelt werden mussten. Auf Nachfrage berichtete die junge Patientin, dass sie seit 2-3 Jahren die Blase nicht mehr richtig entleeren könne und Restharngefühl bestehe.
In der Anamnese hatte die Patientin beim ersten Kind eine sekundäre Sectio caesarea, das 2. Kind kam per Spontangeburt. Zudem besteht eine bekannte peritoneale Endometriose sowie ein Uterus myomatosus mit einem Hinterwandmyom von 40mm. Die Antikonzeption wird mittels Hormonspirale durchgeführt. 2017 litt die Patientin an Nephrolithiasis mit vorübergehender Harnableitung mittels Doppel-J-Katheter links.
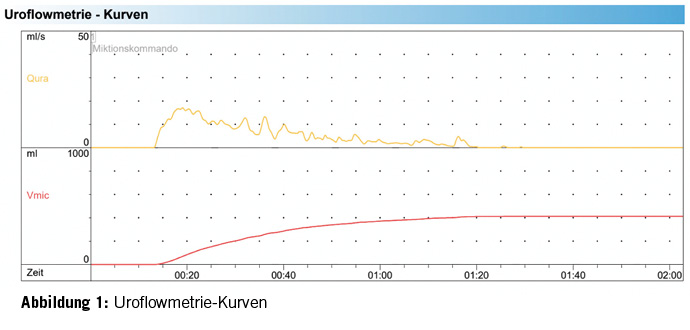
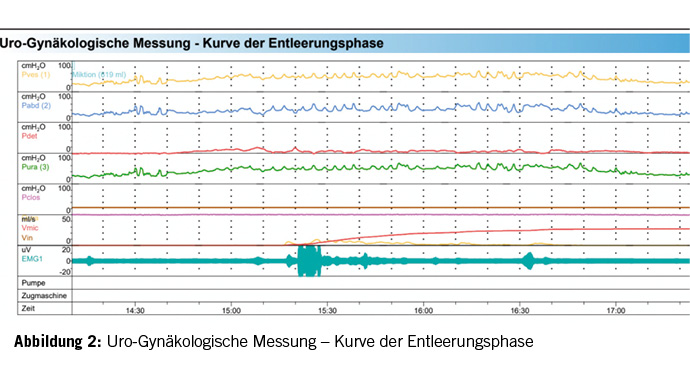
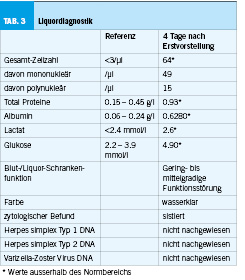
Zur weiteren Abklärung der erhöhten Restharnwerte erhielt die Patientin ein Aufgebot in die urodynamischen Spezialsprechstunde. Die urogynäkologische Untersuchung zeigte sich bis auf eine Zystozele I° und schwache Levatorenschenkel unauffällig. Unauffällige Urethralkalibrierung bis Charr 25. In der Untersuchung fiel eine, für eine so junge Patientin, ausgeprägte Blasenentleerungsstörung mit stark erhöhten Restharnwerten auf. Im Uroflow zeigte sich eine mehrgipflige verlängerte Spontanmiktion von 413ml mit deutlich erniedrigtem Flow sowie stark erhöhtem Restharnwert von 250ml (Normwert <100ml) (Abbildung 1). Zystotonometrisch zeigte sich eine hyperkapazitäre Blase von 619ml (Normwert 500ml) mit einem normalen ersten Harndrang bei einer Füllmenge von 319ml. In der Entleerungsphase fiel ein atoner Detrusor auf. Die Miktion erfolgte hauptsächlich über die Bauchpresse. In der Beckenboden-Elektromyographie (EMG) zeigte sich eine verstärkte Aktivität im Sinne einer Detrusor-Sphinkter-Dyskoordination (Abbildung 2). Kein Hinweis einer Obstruktion. Die Urethro-Zystoskopie fiel unauffällig aus (Abbildung 3). Ebenso zeigte sich im Urinstatus ein erneuter Harnwegsinfekt, der resistenzgerecht antibiotisch therapiert wurde. Zusammenfassend zeigte sich somit eine unklare Blasenentleerungsstörung, die zu rezidivierenden HWI’s führt. Als erste Therapieoption wurde mit der Patientin eine getimte Miktion alle 2-3 Stunden sowie eine Beckenbodenphysiotherapie mit Biofeedback und Trink- und Miktionstraining besprochen.
Differentialdiagnostische Überlegungen
Grundsätzlich müssen differentialdiagnostisch die verschiedenen Mechanismen, die zur unvollständigen Blasenentleerung führen, beachtet werden. Hierbei können neurologische von nicht-neurologischen Ursachen unterschieden werden (1).
Neurologische Ursachen
Eingeschränkte Detrusoraktivität
Grundsätzlich tritt mit zunehmendem Alter eine signifikante Reduktion Nervenfunktionalität und folglich der Muskelaktivität auf mit ggf. erhöhten Restharnwerten.
Ein Diabetes mellitus kann alleine, oder insbesondere in Kombination mit hohem Alter, die Detrusoraktivität durch eine zunehmende Neuropathie einschränken (2).
Weitere neurologische Krankheitsbilder mit eingeschränkter Detrusoraktivität können eine Multiple Sklerose oder eine Parkinson-Erkrankung sein. Insbesondere bei jungen Patient_innen sollte eine Multiple Sklerose ausgeschlossen werden. Eine Parkinson-Erkrankung kann ebenso zu einer Blasenentleerungsstörung führen, wenn auch öfters zur überaktiven Blase (1,3).
Neurologische Krankheitsbilder mit Schädigung der Cauda equina und des sakralen Rückenmarks können zu einer Blasenatonie (Schädigungen des Gehirns hingegen zu einer Detrusorhyperreflexie und im Bereich des Rüchenmarks zu einer Detrusor-Sphinkter-Dyssynergie) führen. Viele Patient_innen leiden nach Wirbelsäulentraumata (Spinalkanalstenosen, mediale Diskushernien und traumatische Verletzungen) unter erhöhtem Restharn. Zusätzlich kann es als Folge ausgedehnter gynäkologischer und viszeralchirurgischer Operationen zur iatrogenen Denervierung der Blase kommen (1).
Nicht-neurologische Ursachen
Obstruktion
Unter den obstruktiven Differentialdiagnosen werden anatomische Gegebenheiten zusammengefasst, die zu einer
Obstruktion der Urethra führen. Einerseits kann ein Beckenbodendeszensus (vor allem eine Zystozele) zu einem Quetsch- hahnphänomen und somit zu einem Abknicken der Urethra führen. Andererseits können Raumforderungen im kleinen Becken zu einer externen Obstruktion der Urethra führen. Dabei sollte vor allem an Uterusmyome, Adnexbefunde aber auch Darmpathologien und -tumore gedacht werden.
Intrinsische Ursachen einer Urethraobstruktion sind Urethrastrikturen (iatrogen und idiopathisch) und –divertikel. Ebenso sollten intraluminale Befunde der Urethra wie Steine, Malignome, aber auch ein erodiertes Band nach suburethraler Schlingeneinlage, ausgeschlossen werden (1).
Weitere Abklärungsschritte und Verlauf
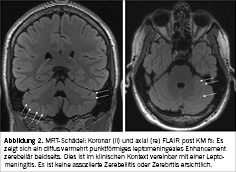
Die junge Patientin wurde im Anschluss engmaschig in die urogynäkologische Sprechstunde angebunden. Da sich in der klinischen Untersuchung eine Zystozele I° zeigte, wurde zum Ausschluss eines Quetschhahnphänomens eine Pessartherapie versucht. Bei fehlender Besserung der Symptomatik trotz Pessar wurde die Therapie im Verlauf auf Wunsch der Patientin wieder gestoppt. Zum Ausschluss einer neurologischen Ursache, insbesondere einer Multiplen Sklerose, wurde die Patientin den Kolleginnen der Neurologie zugewiesen. Die klinische Untersuchung zeigte sich dabei unauffällig, ebenso wurde ein unauffälliges MRI Neurocranium inkl. Wirbelsäule durchgeführt.
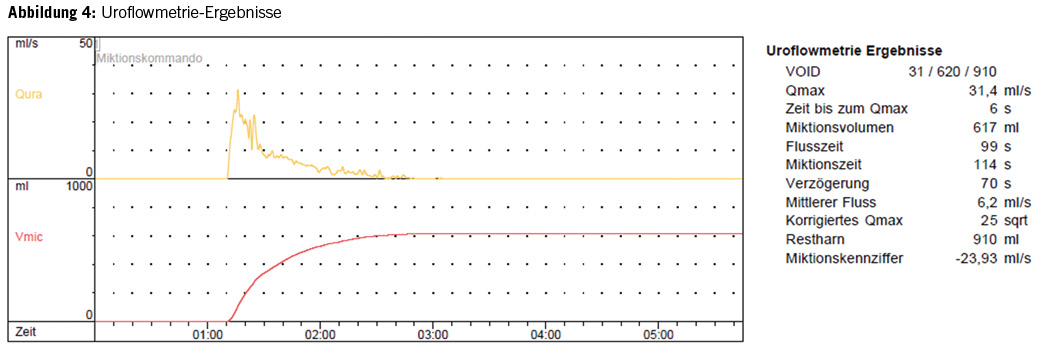
Im Verlauf wurde bei hohem Leidensdruck der Patientin und fehlender Besserung durch die Physiotherapie und getimte Miktion eine medikamentöse Therapie mit einem blasentonisierenden Medikament versucht, ebenfalls ohne deutliche Besserung. Zwischenzeitlich traten wiederholt symptomatische Harnwegsinfektionen mit der Notwendigkeit einer antibiotischen Therapie auf. Konservative prophylaktische Therapieversuche zur Reduktion der HWI’s waren ebenfalls frustran. Es wurden wiederholt Uroflow-Messungen durchgeführt. Dabei zeigte sich, dass die Restharnwerte umso grösser waren, je höher das gesamte Blasenvolumen war. Maximal zeigte sich eine stark hyperkapazitäre Blase mit einem Volumen von 1500ml, wobei über 900ml als Restharn in der Blase verblieben (Bild 4).
Bei hohem Leidensdruck der Patientin aufgrund der erhöhten Restharnwerte und der folgenden HWIs erfolgte die interdisziplinäre Vorstellung und Besprechung des Falles.
Diagnose
Aufgrund der multiplen unauffälligen Abklärungen wurde bei unklarer Blasenentleerungstörung der jungen Patientin die Diagnose des seltenen Fowler-Syndroms gestellt. Das Krankheitsbild präsentiert sich mit schmerzlosem Harnverhalt aufgrund einer fehlenden Urethrasphinkter-Relaxation. Es können sich Restharnmengen von über einem Liter zeigen (4,5).
Kommentar
Beim Fowler-Syndrom handelt es sich um eine seltene Erkrankung, die typischerweise bei jungen Frauen (Durchschnittsalter 27 Jahre) auftritt und sich durch unerklärten, schmerzlosen Harnverhalt manifestiert. Die hohen Restharnwerte prädisponieren für rezidivierende Harnwegsinfektionen, mit hohem Leidensdruck der jungen Patientinnen. Da es sich beim Fowler-Syndrom um eine Ausschlussdiagnose handelt, besteht oft ein jahrelanger Leidensweg bis die Diagnose gestellt wird. In der Literatur wird eine Assoziation mit dem polyzystischen Ovarialsyndrom beschrieben. Dies war bei unserer Patientin nicht der Fall. Die Aetiologie des Fowler-Syndroms ist unklar. Es besteht keine kausale Therapie (4). Mögliche Therapieansätze sind die sakrale Neuromodulation. Dabei kommt es zur Schrittmacheranlage, der durch externe Impulse die Sakralnerven ansteuert. Alternativ kann eine perkutane tibiale Nervenstimulation erfolgen, dabei wird der Nervus tibialis im Bereich des Fusses extern stimuliert. Als weniger invasive Therapieoption kann mit den Patient*Innen die intermittierende Selbstkatheterisierung besprochen werden (4). Wir haben mit der Patientin die verschiedenen Therapieoptionen besprochen und sie zur Besprechung der definitiven Therapie den Kolleg_innen der Urologie zugewiesen.
Im Artikel verwendete Abkürzungen
EMG Elektromyographie
HWI’s Harnwegsinfektionen
Kantonsspital St. Gallen
Rorschacherstrasse 95/Haus 06
9007 St. Gallen
desiree.abgottspon@kssg.ch
Historie
Manuskript eingereicht: 25.09.2023
Manuskript akzeptiert: 01.11.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
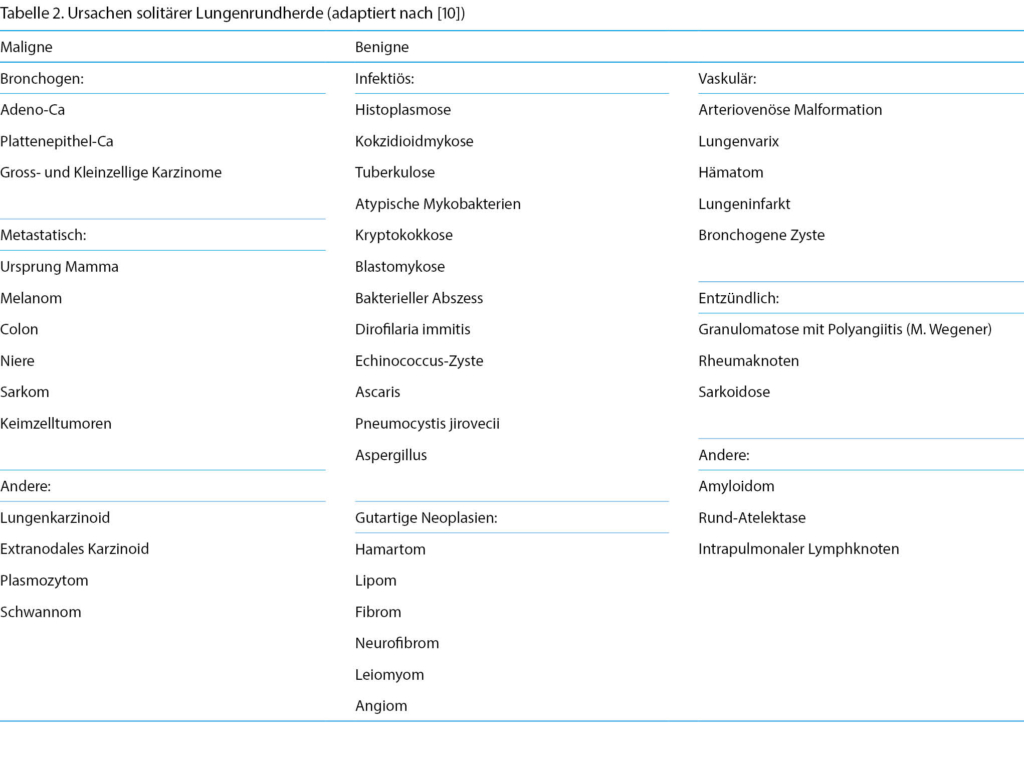
1. Ihnenfeld I, Blick N, Passweg D. Störung der Harnblasenentleerung bei der Frau. info@gynäkologie, Volume 23, Augsgabe 3, 2023. p. 11 – 15.
2. Olujide LO, O’Sullivan SM. Female voiding dysfunction. Best Pract Res Clin Obstet Gynaecol. 2005;19(6):807-28.
3. Griebling TL. Urologic Issues in Geriatric Health Care. Clin Geriatr Med. 2015;31(4):xiii-xiv.
4. Szymanski JK, Słabuszewska-Józwiak A, Jakiel G. Fowler’s Syndrome-The Cause of Urinary Retention in Young Women, Often Forgotten, but Significant and Challenging to Treat. Int J Environ Res Public Health. 2021;18(6).
5. Fowler CJ, Christmas TJ, Chapple CR, Parkhouse HF, Kirby RS, Jacobs HS. Abnormal electromyographic activity of the urethral sphincter, voiding dysfunction, and polycystic ovaries: a new syndrome? BMJ. 1988;297(6661):1436-8.