- Aktuelle Therapieoptionen der atopischen Dermatitis
Die atopische Dermatitis (AD) ist eine chronisch-entzündliche Hauterkrankung, die durch Juckreiz, Ekzeme und eine gestörte Hautbarriere gekennzeichnet ist. Die Therapie der AD hat sich in den letzten Jahren durch neue topische und vor allem systemische Behandlungsoptionen deutlich erweitert. Neben der Basistherapie, klassischen, topischen Kortikosteroiden und Calcineurin-Inhibitoren stehen seit einigen Jahren auch andere Topika und bei schweren Formen systemische Biologika und Januskinase-Inhibitoren zur Verfügung. Die Auswahl der Therapie erfolgt individualisiert und stufenbasiert unter Berücksichtigung von Schweregrad, Komorbiditäten und Patientenpräferenzen. Dieser Beitrag gibt einen aktuellen Überblick über die evidenzbasierten Therapieoptionen, diskutiert deren Wirksamkeit und Sicherheit und gibt einen Ausblick auf zukünftige Entwicklungen.
Atopic dermatitis (AD) is a chronic inflammatory skin disease characterized by pruritus, eczema, and impaired skin barrier. In recent years we have seen significant advances in the treatment of AD, with the introduction of new topical and systemic therapies. In addition to basic therapy and classic topical steroids and calcineurin inhibitors other topical substances and for severe forms systemic biologics and Janus kinase inhibitors are now available. Therapy selection is individualized, level-based considering disease severity, and regarding comorbidities and patient preferences. This article provides an up-to-date overview of evidence-based therapeutic options, discusses their efficacy and safety, and offers an outlook on future developments.
Keywords: Atopic dermatitis, biologics, JAK inhibitors, systemic therapy, topical treatment
Einleitung
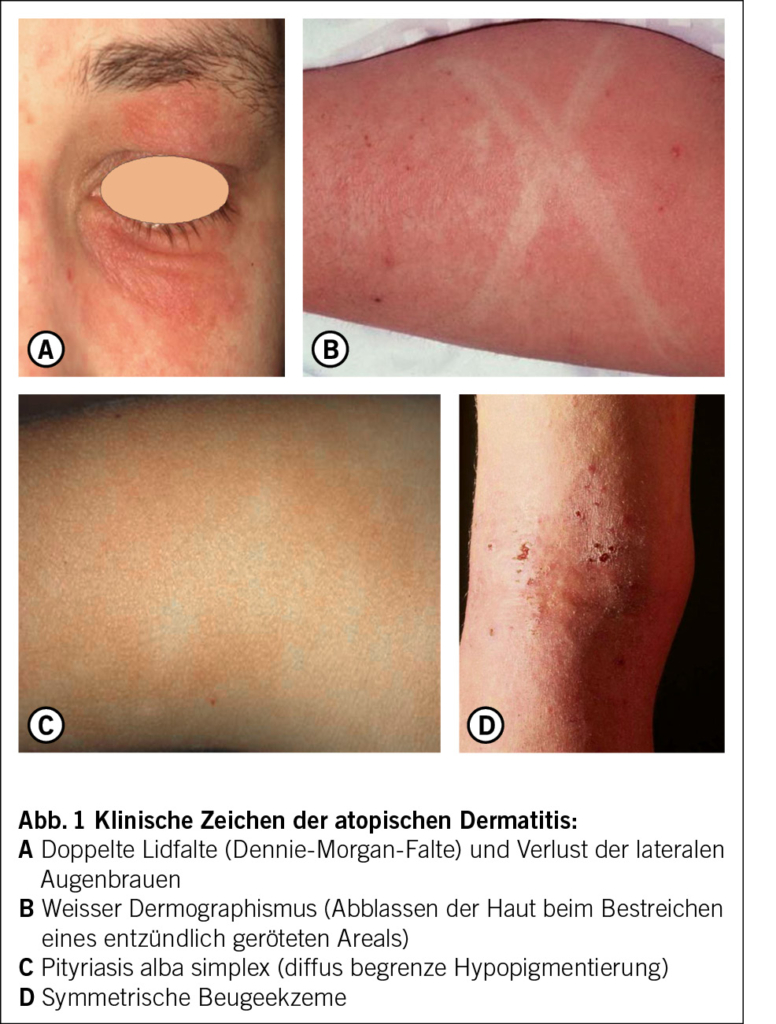
Die atopische Dermatitis (AD), auch Neurodermitis genannt, ist eine der häufigsten chronisch-entzündlichen Hauterkrankungen. Sie ist gekennzeichnet durch einen chronischen Verlauf mit trockener Haut, einen oft sehr stark belastenden Pruritus und diverse Hautveränderungen wie symmetrische Beugeekzeme oder «Head and Neck Type» vor allem bei Erwachsenen. Zusätzlich gibt es diverse andere Hautstigmata (Abb. 1). Sie betrifft Kinder und Erwachsene und ist mit einer erheblichen Beeinträchtigung der Lebensqualität verbunden (1, 2). Die Pathogenese ist multifaktoriell und umfasst genetische, immunologische und Umweltfaktoren (3, 4). In den letzten Jahren haben neue Erkenntnisse zur Pathophysiologie zu innovativen Therapieansätzen geführt und so die Behandlungsmöglichkeiten erweitert.
Pathogenese und neue Erkenntnisse
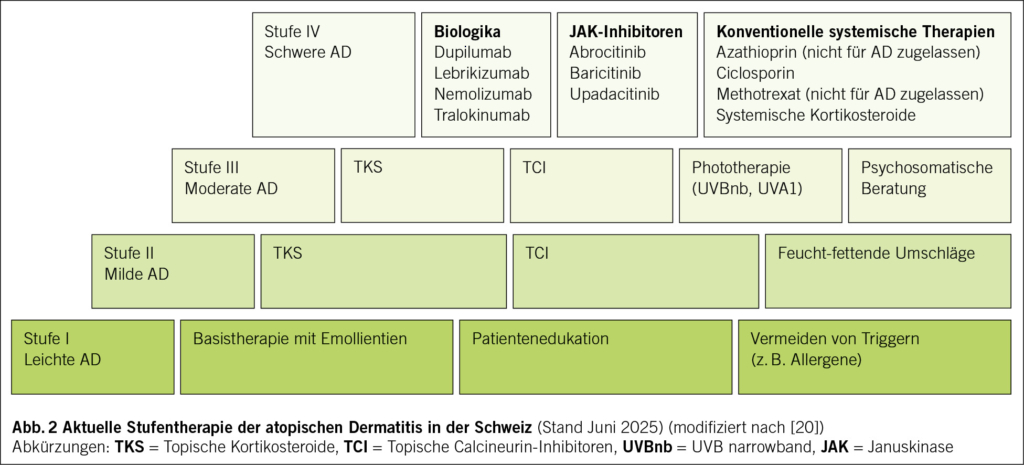
Die AD ist durch eine gestörte Hautbarriere und eine Fehlregulation des Immunsystems gekennzeichnet. Genetische Prädispositionen, insbesondere Mutationen im Filaggrin-Gen bei kaukasischen Patienten, führen zu einer erhöhten Permeabilität der Haut (5). Immunologisch dominieren Th2-vermittelte Entzündungsreaktionen mit erhöhter Produktion von Interleukin-4, -13 und -31 (6). Diese Erkenntnisse haben zur Entwicklung gezielter Therapien geführt, welche bei schweren Verläufen eingesetzt werden können. Das Therapieschema basiert auf einem stufenweisen Vorgehen, abhängig vom Schweregrad der Erkrankung sowie Ansprechen und Nebenwirkungen der jeweiligen Therapie (Abb. 2).
Basistherapie und nicht medikamentöse Massnahmen
Die Basistherapie bildet das Fundament jeder AD-Behandlung und umfasst die tägliche Anwendung von rückfettenden und feuchtigkeitsbindenden Emollientien (7). Ziel ist die Wiederherstellung und Erhaltung der Hautbarriere. Zusätzlich wird insb. bei Kindern weiterhin die Anwendung von desinfizierenden Bleichebädern empfohlen. Falls vorhanden, sollten individuelle Triggerfaktoren unbedingt gemieden werden sowie eine gute Patientenschulung erfolgen (8). Studien zeigen, dass eine konsequente Basistherapie die Schubfrequenz und den Bedarf an medikamentöser Therapie signifikant reduziert (9).
Topische Therapien
Topische Kortikosteroide
TKS sind weiterhin die wichtigste und kostengünstigste antientzündliche Therapie bei akuten Schüben. Sie werden je nach Schweregrad und Lokalisation in unterschiedlichen Wirkstärken eingesetzt (10). Nebenwirkungen wie Hautatrophie und periorale Dermatitis sind bei sachgemässer Anwendung selten (11).
Topische Calcineurin-Inhibitoren
TCI (Tacrolimus, Pimecrolimus) sind besonders für empfindliche Hautareale wie Gesicht und Intertrigines geeignet. Sie ermöglichen ein proaktives Therapiekonzept, bei dem nach Abklingen des akuten Schubs eine intermittierende Anwendung erfolgt, um Rezidive zu verhindern (12, 13). Eine Hautatrophie wird nicht induziert, sie erhöht aber das Risiko für weissen Hautkrebs im höheren Alter.
Weitere Topika
Phosphodiesterase-4-Hemmer (Crisaborole) stellen eine neue Option für milde bis moderate AD dar. Sie wirken entzündungshemmend und zeigen ein günstiges Nebenwirkungsprofil (14), sind aber in der Schweiz nicht zugelassen. Weitere entzündungshemmende Substanzen wie Produkte basierend auf Levomenol/Heparin-Natrium können bei leichteren Fällen eingesetzt werden, topische JAK-Inhibitoren wie Ruxolitinib sind aktuell noch in der aktiven Studienphase, Delgocitinib ist in der Schweiz fürs chronische Handekzem zugelassen. Andere, in der Schweiz (noch) nicht zugelassene Substanzen wie Roflumilast oder Tapinarof sind weitere, vielversprechende Topika in Entwicklung.
Vergleichende Studien zeigen, dass die Wirksamkeit von TKS und TCI ähnlich ist, wobei letztere insbesondere bei langfristiger Anwendung Vorteile bieten (15). Der proaktive Einsatz (Beginn bereits bei ersten Zeichen eines Schubs, Anwendung einige Tage über den Schub hinaus) von TKS wie TCI wirkt sich bei AD oft günstig aus und führt letztendlich zu einem geringeren Bedarf dieser Substanzen.
Lichttherapie
Die Phototherapie, insbesondere die UVB-Schmalband- und UVA1-Bestrahlung, ist eine bewährte Option für Patient/-innen mit moderater bis schwerer AD, die auf topische Therapien nicht ausreichend ansprechen (16). Die Balneo-Phototherapie kombiniert UV-Bestrahlung mit Solebädern und zeigt eine zusätzliche Wirksamkeit (17). Limitationen bestehen bei Kindern, Schwangeren und bei Langzeitgebrauch aufgrund des Hautkrebsrisikos (18), welches allerdings bei den modernen Lichtqualitäten (UVB narrowband) deutlich reduziert ist.
Systemische Therapien
Indikationen
Eine systemische Therapie ist bei mittelschwerer bis schwerer AD indiziert, wenn topische und Lichttherapien nicht ausreichend wirksam sind oder kontraindiziert erscheinen (19–21).
Klassische Immunsuppressiva
Ciclosporin A ist das am besten untersuchte klassische Immunsuppressivum zur Kurzzeitbehandlung schwerer AD und auch in dieser Indikation zugelassen. Es wirkt schnell, ist aber aufgrund von Nebenwirkungen wie Nephrotoxizität und Hypertonie auf maximal ein Jahr begrenzt (19). Andere Immunsuppressiva wie Methotrexat, Azathioprin oder Mycophenolatmofetil werden off-label eingesetzt, insbesondere bei Kontraindikationen für Biologika (22, 23).
Systemische Glukokortikoide
Systemische Glukokortikoide sollten aufgrund des ungünstigen Nebenwirkungsprofils nur kurzfristig zur Überbrückung schwerer Schübe eingesetzt werden (21, 22).
Biologika und Januskinase-Inhibitoren (JAKi)
Hier haben sich in den letzten Jahren entscheidende Veränderungen ergeben, sind doch mehrere Biologika und JAKi spezifisch für die atopische Dermatitis neu auf den Markt gekommen und in der Schweiz auch zugelassen (21, 22). Dadurch stehen für Patient/-innen mit moderater und schwerer atopischer Dermatitis erstmals hochwirksame und spezifische Substanzen zur Verfügung; für deren Erstattung durch die Krankenkassen sind allerdings gewisse Voraussetzungen notwendig. Neben einem ausreichenden Schweregrad muss vorangehend eine Lichttherapie als auch eine anderweitige erfolglose oder wegen Nebenwirkungen nicht durchführbare Therapie mit anderen Immunsuppressiva durchgeführt werden. Zusätzlich kann die Indikationsstellung nur durch eine/n Spezialärzt/-in für Dermatologie und Venerologie oder Allergologie und klinische Immunologie gestellt werden.
Dupilumab ist der erste, in der Schweiz seit 2017 zugelassene, monoklonale Antikörper für die AD-Therapie, der die Signalwege von Interleukin-4 und -13 blockiert. Studien belegen eine signifikante Reduktion von Ekzemschwere und Juckreiz bei guter Verträglichkeit (24, 25). Dupilumab ist in der Schweiz zudem für mehrere andere Indikationen wie Asthma bronchiale, eosinophile Oesophagitis, chronische Rhinosinusitis mit nasalen Polypen und Prurigo nodularis zugelassen und ist daher bei atopischen und anderen spezifischen Komorbiditäten oft gut geeignet.
Neuere Biologika wie Tralokinumab und Lebrikizumab richten sich spezifisch gegen Interleukin-13 und zeigen ebenfalls überzeugende Wirksamkeit in Phase-III-Studien (26–29) und werden bereits erfolgreich in der Praxis eingesetzt.
Die 3 Substanzen sind teilweise ähnlich in Wirkungsweise und Nebenwirkungen und unterscheiden sich teils in den weiteren Indikationen, Dosierungsintervallen und der Zulassung für verschiedene Altersstufen. Bei allen liegen bereits Langzeitdaten über mehrere Jahre sowie in der «Real World»-Anwendung vor. Diese zeigen eine persistierende Wirkung bei gleichbleibend niedrig bleibenden Nebenwirkungen; Laborkontrollen sind nicht notwendig.
Nemolizumab ist seit 2025 in der Schweiz für die Behandlung der mittelschweren bis schweren atopischen Dermatitis sowie der Prurigo nodularis zugelassen. Der monoklonale Antikörper blockiert den Interleukin-31-Rezeptor und adressiert damit gezielt den chronischen Pruritus, der ein zentrales Symptom der Erkrankung darstellt. In Phase-III-Studien zeigte Nemolizumab eine signifikante Reduktion vom Juckreiz und Schweregrad des Ekzems bei insgesamt guter Verträglichkeit. Besonders die Verbesserung der Schlafqualität und Lebensqualität der Patient/-innen wurde hervorgehoben (30).
Alle Biologika werden subkutan in Abständen zwischen 2 und 4 Wochen appliziert. Mittels Fertigspritzen können diese nach entsprechender Instruktion auch durch die Betroffenen selbst appliziert werden.
Januskinase-Inhibitoren (JAKi)
Abrocitinib, Baricitinib und Upadacitinib sind oral verfügbare JAK-Inhibitoren, die eine schnelle Linderung des Juckreizes, oft schon innert Tagen, und eine deutliche Verbesserung der Hautsymptome bewirken (31, 32). Sie bieten insbesondere bei schwerer, therapieresistenter AD eine wertvolle Alternative zu Biologika. Das Nebenwirkungsprofil umfasst Infektionen, Thromboserisiko und Laborveränderungen, weshalb ein Monitoring erforderlich ist (33). Es liegen auch für die JAKi ausgiebige Langzeitdaten und «Real World»-Daten vor. Alle diese JAKi werden in Tablettenform 1 x/Tag eingenommen.
Vergleichsstudien zeigen, dass JAK-Inhibitoren einen schnelleren Wirkeintritt als Biologika haben, während Biologika durch eine sehr gute Langzeitverträglichkeit überzeugen (34, 35). In Abb. 2 ist ein aktuelles stufenbasiertes Therapieschema der AD in Anlehnung an internationale Guidelines aufgezeigt (20).
Systemische Therapie bei Kindern unter 6 Jahren
Die systemische Therapie der atopischen Dermatitis im frühen Kindesalter stellt eine besondere Herausforderung dar. Für Kinder ab sechs Monaten ist Dupilumab zugelassen und stellt aktuell die wichtigste evidenzbasierte Option dar. Die Sicherheit und Wirksamkeit dieser Therapie wurde in einer aktuellen vierjährigen Langzeitstudie eindrucksvoll belegt (36), wobei über zwei Drittel der behandelten Kinder eine anhaltende Remission (EASI-90) erreichten. Ciclosporin A kann bei schweren, therapierefraktären Verläufen als Off-Label-Option in Erwägung gezogen werden, erfordert jedoch ein engmaschiges Monitoring. Die Anwendung anderer systemischer Immunsuppressiva bleibt in diesem Alter die Ausnahme und sollte individuell geprüft werden (4, 36).
Individualisierte und patientenzentrierte Therapie
Die Wahl der Therapie sollte individuell erfolgen und Komorbiditäten, Alter, Lebenssituation und Patientenpräferenzen berücksichtigen (37). Moderne Therapiealgorithmen ermöglichen eine flexible Anpassung an den Krankheitsverlauf. Die Einbindung der Patient/-innen in die Therapieentscheidung fördert die Adhärenz und verbessert die Behandlungsergebnisse (38).
Ausblick und zukünftige Trends
Die Pipeline neuer Wirkstoffe ist vielversprechend: Weitere Biologika und zielgerichtete Therapien befinden sich in fortgeschrittener Entwicklung (39). Personalisierte Medizin, Biomarker-basierte Therapieentscheidungen und digitale Tools zur Verlaufskontrolle werden die Versorgung weiter verbessern (40). Auch Aspekte wie verbesserte Patientenedukation, individuell auf die Patient/-innen abgestimmte Beratung und Schulungen (www.aha.ch) und digitale Hilfsmittel werden dazu beitragen, Patient/-innen mit atopischer Dermatitis besser betreuen zu können (41).
Unter den neueren immunmodulatorischen Ansätzen gewinnen auch OX40-gerichtete Therapien an Bedeutung. Amlitelimab (Anti-OX40L-Antikörper) und Rocatinlimab (Anti-OX40-Antikörper) befinden sich in fortgeschrittener klinischer Entwicklung. Beide Substanzen modulieren die T-Zell-Aktivierung und zeigen in Phase-III-Studien eine anhaltende Wirksamkeit mit teils lang anhaltenden Remissionen nach Therapieende. Erste Daten deuten auf ein günstiges Sicherheitsprofil und einen nachhaltigen Effekt auf das immunologische Gedächtnis hin (42, 43). Diese und wohl auch mehrere Therapien könnten künftig insbesondere für Patient/-innen mit chronisch-rezidivierendem Verlauf und unzureichendem Ansprechen auf etablierte Biologika eine relevante Option darstellen. Herausforderungen bleiben die Kosten und der Zugang zu modernen Therapien; zudem sind auch weiterhin Beobachtungen im «Real World»-Setting notwendig. Auch sind vergleichende Studien zwischen einzelnen Biologika, JAKi und zwischen den beiden Gruppen sinnvoll. Im Weiteren sind moderne Therapieansätze für Formen der atopischen Dermatitis mit lokalisierter Beteiligung etwa nur des Gesichts oder der Hände zurzeit in klinischer Erprobung und dürften bald für die Routine zur Verfügung stehen. Mit dem topischen angewendeten JAKi Delgocinib ist für das schwere Handekzem bereits ein solches Produkt in der Schweiz zugelassen (44).
Mittelfristiges Ziel ist neben einer möglichst vollständigen Langzeitkontrolle der Erkrankung auch eine Modellierung und Beeinflussung der Erkrankung im Sinne einer «Disease modification», die mit solchen innovativen Therapien angestrebt werden kann (45). Wichtig ist dabei auch, dass Unterschiede etwa im Geschlecht, Alter oder ethnischen Hintergrund im Sinne einer präzisierten Medizin auch im Bereich der atopischen Dermatitis mitberücksichtigt werden (46, 47).
Fazit
Die Therapie der atopischen Dermatitis hat sich in den letzten Jahren grundlegend gewandelt. Neben bewährten Basis- und topischen Therapien stehen heute hochwirksame und sichere systemische Optionen zur Verfügung. Die individualisierte, patientenzentrierte Therapie und die konsequente Umsetzung moderner Leitlinien ermöglichen eine deutliche Verbesserung der Lebensqualität für Betroffene.
Dr. med. Claudia Lang 1
PD Dr. med. Matthias Möhrenschlager 2
Prof. Dr. med. Peter Schmid-Grendelmeier 3
1 Universitätsspital Zürich, Rämistrasse 100, 8091 Zürich
2 Dermatologische Abteilung, Hochgebirgsklinik Davos Wolfgang, Medizincampus Davos
3 Christine Kühne Center for Allergy research and Education CK-CARE, Davos
Copyright
Aerzteverlag medinfo AG
Zweitabdruck von der «Therapeutische Umschau» 4/25
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Claudia.lang@usz.ch
Die Autorenschaft hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
. Wollenberg A, Barbarot S, Bieber T, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2023;37:1-46.
2. Kurzen H, Sebastian M, von Kiedrowski R, et al. Atopische Dermatitis – Ein praxisnaher Behandlungspfad. Onkoderm. 2025; Beilage DD_023_ONLINE.
3. Guttman-Yassky E, Renert-Yuval Y, Brunner PM. Atopic dermatitis. Lancet. 2025; 405
4. Weidinger S, Novak N. Atopic dermatitis. Lancet. 2016;387:1109-22.
5. Palmer CN, Irvine AD, Terron-Kwiatkowski A, et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis. Nat Genet. 2006;38:441-6.
6. Guttman-Yassky E, Nograles KE, Krueger JG. Contrasting pathogenesis of atopic dermatitis and psoriasis—part I: clinical and pathologic concepts. J Allergy Clin Immunol. 2011;127:1110-8.
7. Langan SM, Irvine AD, Weidinger S. Atopic dermatitis. Lancet. 2020;396:345-60.
8. Ring J, Alomar A, Bieber T, et al. Guidelines for treatment of atopic eczema (atopic dermatitis) part I. J Eur Acad Dermatol Venereol. 2012;26:1045-60.
9. Cork MJ, Danby SG, Vasilopoulos Y, et al. Epidermal barrier dysfunction in atopic dermatitis. J Invest Dermatol. 2009;129:1892-908.
10. Sidbury R, Davis DM, Cohen DE, et al. Guidelines of care for the management of atopic dermatitis: section 3. J Am Acad Dermatol. 2014;71:327-49.
11. Hengge UR, Ruzicka T, Schwartz RA, Cork MJ. Adverse effects of topical glucocorticosteroids. J Am Acad Dermatol. 2006;54:1-15.
12. Paller AS, Lebwohl M, Fleischer AB Jr, et al. Tacrolimus ointment is effective for atopic dermatitis in children. J Pediatr. 2001;139:145-52.
13. Wahn U, Bos JD, Goodfield M, et al. Efficacy and safety of pimecrolimus cream in children and adolescents. J Allergy Clin Immunol. 2002;110:277-84.
14. Eichenfield LF, Call RS, Forsha DW, et al. Safety and efficacy of crisaborole ointment. J Am Acad Dermatol. 2017;76:113-21.
15. Zuberbier T, Orlow SJ, Paller AS, et al. Patient perspectives on the management of atopic dermatitis. J Allergy Clin Immunol. 2006;118:226-32.
16. Legat FJ, Hofer A, Quehenberger F, et al. Narrowband UVB, UVA1, and balneophototherapy in chronic atopic dermatitis. J Am Acad Dermatol. 2003;49:352-9.
17. Kerscher M, Volkenandt M, Grussendorf-Conen EI, et al. Balneophototherapy in atopic dermatitis. Dermatology. 1997;194:256-60.
18. Garritsen FM, Brouwer MW, Limpens J, Spuls PI. Photo(chemo)therapy in the management of atopic dermatitis. JAMA Dermatol. 2014;150:1006-23.
19. Wollenberg A, Christen-Zäch S, Taieb A, et al. European Task Force on Atopic Dermatitis/EADV Eczema Task Force position paper on diagnosis and treatment of atopic dermatitis. J Eur Acad Dermatol Venereol. 2018;32:657-82.
20. Wollenberg A, Kinberger M, Arents B et al. European Guideline (EuroGuiDerm) on atopic eczema: Living update. J Eur Acad Dermatol Venereol. 2025
21. Werfel T, Heratizadeh A, Aberer W et al. S3 guideline Atopic dermatitis: Part 2 – Systemic treatment. J Dtsch Dermatol Ges. 2024; 22:307-320.
22. Harper JI, Ahmed I, Barclay G, et al. Cyclosporin for severe childhood atopic dermatitis: short course versus continuous therapy. Br J Dermatol. 2000;142:52-8.
23. Meggitt SJ, Gray JC, Reynolds NJ. Azathioprine dosed by thiopurine methyltransferase activity for moderate-to-severe atopic eczema: a double-blind, randomized controlled trial. Lancet. 2006;367:839-46.
24. Simpson EL, Bieber T, Guttman-Yassky E, et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med. 2016;375:2335-48.
25. Blauvelt A, de Bruin-Weller M, Gooderham M, et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab. J Am Acad Dermatol. 2020;82:377-88.
26. Silverberg JI, et al. Two phase 3 trials of lebrikizumab for moderate-to-severe atopic dermatitis. N Engl J Med. 2023;388(12):1080-1091.
27. Blauvelt A, et al. Efficacy and safety of lebrikizumab in moderate-to-severe atopic dermatitis: 52-week results of two randomized double-blinded placebo-controlled phase III trials. Br J Dermatol. 2023;188(6):740-748.
28. Wollenberg A, Howell MD, Guttman-Yassky E et al. Treatment of atopic dermatitis with tralokinumab, an anti-IL-13 mAb. J Allergy Clin Immunol. 2019 Jan;143(1):135-141.
29. Wollenberg A, Blauvelt A, Guttman-Yassky E et al. ECZTRA 1 and ECZTRA 2 study investigators. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol. 2021; 184437-449.
30. Kabashima K, Matsumura T, Komazaki H, et al. Nemolizumab in patients with moderate-to-severe atopic dermatitis: results from two phase III, randomized, double-blind, placebo-controlled studies. Br J Dermatol. 2023;188(3):e123–e134.
31. Guttman-Yassky E, et al. Upadacitinib in atopic dermatitis: Four-year safety and efficacy data. J Am Acad Dermatol. 2024;90(2):456-468.
32. Reich K, Gooderham M, Green LJ, et al. Efficacy and safety of abrocitinib in adults and adolescents with moderate-to-severe atopic dermatitis. JAMA Dermatol. 2020;156:863-73.
33. FDA Drug Safety Communication. FDA warns about increased risk of serious heart-related events, cancer, blood clots, and death with JAK inhibitors. 2021. [Internet]. [abgerufen am 1. Mai 2025].
34. Bieber T, et al. Head-to-head comparison of upadacitinib and dupilumab in atopic dermatitis. N Engl J Med. 2021;384:2187-2200.
35. Wollenberg A, et al. Long-term safety and efficacy of dupilumab in atopic dermatitis. J Allergy Clin Immunol. 2022;149:915-928.
36. Guttman-Yassky E, et al. Long-term efficacy of dupilumab in pediatric atopic dermatitis: 4-year results from LIBERTY AD PEDS. Lancet. 2025;405:583-596
37. Onkoderm.de. Behandlungspfad Atopische Dermatitis 2025. [Internet]. [abgerufen am 1. Mai 2025].
38. Medical Tribune Schweiz. Atopische Dermatitis: Systemtherapie-Empfehlungen. 2023. [Internet]. [abgerufen am 1. Mai 2025].
39. Langan SM, Irvine AD, Weidinger S. Atopic dermatitis. Lancet. 2020;396:345-60.
40. Bieber T. Disease modification in inflammatory skin disorders: opportunities and challenges. Nat Rev Drug Discov. 2023;22(8):662-680
41. Traidl-Hoffmann C, Afghani J, Akdis CA et al. Navigating the evolving landscape of atopic dermatitis: Challenges and future opportunities: The 4th Davos declaration. Allergy. 2024; 79:2605-2624
42. Blauvelt A, et al. Phase 2b trial of amlitelimab, an anti-OX40L antibody, in moderate-to-severe atopic dermatitis. N Engl J Med. 2023;389:2167-2178.
43. Guttman-Yassky E, et al. Rocatinlimab, an anti-OX40 antibody, in moderate-to-severe atopic dermatitis: a randomized phase 2b study. J Allergy Clin Immunol. 2024;153:1234-1246
44. Worm M, Thyssen JP, Schliemann S et al T. The pan-JAK inhibitor delgocitinib in a cream formulation demonstrates dose response in chronic hand eczema in a 16-week randomized phase IIb trial. Br J Dermatol. 2022; 187: 42-51
45. Thyssen JP, Schmid-Grendelmeier P. Long-term disease control in atopic dermatitis using biologics. Lancet. 2023; 401: 172-173
46. Brunner PM, Guttman-Yassky E. Racial differences in atopic dermatitis. Ann Allergy Asthma Immunol. 2019; 122:449-455
47. Lang CCV, Renert-Yuval Y, Del Duca E et al. Immune and barrier characterization of atopic dermatitis skin phenotype in Tanzanian patients. Ann Allergy Asthma Immunol. 2021;127:334-341
der informierte @rzt
- Vol. 15
- Ausgabe 10
- Oktober 2025