- Aktuelles zur chronisch obstruktiven Lungenkrankheit
Die grundlegenden Pathomechanismen der COPD, die zur Beschwerdesymptomatik unterschiedlichen Ausmasses führen und durch inhalative Noxen, hauptsächlich beim inhalativen Nikotinkonsum, ausgelöst werden, sind ein Ödem der Bronchialschleimhaut, Spasmus der Bronchialmuskulatur und
Hypersekretion mit vermehrter Schleimbildung. Die Behandlungsstrategien setzen demzufolge an einem oder mehreren dieser Probleme an. Bei der COPD Diagnostik stellen die Früherkennung und die korrekte differentialdiagnostische Abgrenzung zu anderen Lungenerkrankungen, wie z.B. Asthma, Bronchiektasien, etc. eine spezielle Herausforderung dar.
Wenn der Patient unter persistierender und progredienter Dyspnoe oder chronischem Husten leidet, immer wieder Atemwegsinfekte bekommt und bestimmte anamnestische Kriterien aufweist, wie z.B. die Exposition gegen inhalative Noxen, aber auch familiäre Belastung oder niedriges Geburtsgewicht oder auch Frühgeburtlichkeit, sollte an eine COPD gedacht werden.
Spirometrische Abklärung
Zur Diagnosesicherung ist stets eine spirometrische Abklärung essentiell und unverzichtbar. In der Allgemeinarztpraxis ist die Spirometrie sehr gut geeignet, die nicht reversible Obstruktion nachzuweisen und das Ausmass der Atemflusseinschränkung zu erkennen.
Die Spirometrie ist zudem wichtig für die Einschätzung des Schwergrades und die Prognose der COPD Erkrankung, hingegen ist das medikamentöse COPD Management von der Einteilung in die Gruppen A bis D, ausgehend von der klinischen Symptomatik – hier vor allem Dyspnoe – und der Exazerbationshäufigkeit, abhängig.
Mindestens einmal im Verlauf einer COPD sollte eine fachärztliche Vorstellung beim Pneumologen erfolgen, dies v.a. dann, wenn Patienten nicht auf die Standardtherapie ansprechen, bzw. weiter symptomatisch sind, häufig exazerbieren, bzw. wegen einer Exazerbation hospitalisiert werden mussten.
Vor allem dann, wenn sich mit der spirometrischen Einschränkung das Ausmass der Dyspnoe nicht ausreichend erklären lässt, sollte auch eine Vorstellung beim Kardiologen erfolgen, da kardiale Komorbiditäten bei COPD relativ häufig sind.
Individualisierung der Therapie
Bei der COPD Therapie hat sich zunehmend die Individualisierung durchgesetzt. Hier geht es v.a. um den Entscheid, welcher Patient von welcher Medikation am besten profitiert, bzw. nicht profitiert. Entscheidend ist immer das klinische Gesamtbild des jeweiligen Patienten mit den entsprechenden anamnestischen, symptomatischen Gegebenheiten einschliesslich der Komorbiditäten im Sinne eines Mosaikbildes, so dass für jeden Patienten ein individuelles Therapiekonzept erstellt werden kann. Ein Behandlungskonzept nach der Methode one size fits all ist bei der Behandlung der COPD fehl am Platz. Auch wenn keine medikamentöse kurative Therapie der COPD existiert, gibt es keinen Grund für einen therapeutischen Nihilismus.
Therapieziele sind neben der Bekämpfung der COPD-Entzündung die Symptomlinderung, das Steigern der Belastbarkeit, die Vermeidung von Exazerbationen und damit gesamthaft die Verbesserung der Lebensqualität des Patienten mit COPD.
Grundpfeiler der COPD Therapie sind die Bronchodilatatoren, vertreten durch die Gruppe der (langwirksamen) Betamimetika (LABA) und die (langwirksamen) Parasympatholytika (LAMA). Die kurzwirksamen Betamimetika spielen bei der Dauertherapie der COPD eine untergeordnete Rolle, ausser bei sehr geringer Symptomatik.
Die LABA und LAMA Wirkstoffe vermindern die Überblähung vor allem auch bei körperlicher Belastung, mit LAMA wird gegenüber LABA eine effektivere Prävention gegenüber Exazerbationen erreicht.
Grundsätzlich ist der Beginn mit einer fixen LABA/LAMA Kombination bei ausgeprägt symptomatischen Patienten von Vorteil, da beide Wirkstoffgruppen zusammen sich in ihrem Wirkmechanismus verstärken und effektiver symptomlindernd sind.
Schweregrad GOLD 1 bis 4 und Symptomatik / Exazerbationen GOLD Gruppe A bis D
Auch bei der aktualisierten GOLD Empfehlung zur Diagnostik und Therapie der COPD richtet sich die Einteilung in die jeweiligen Schweregrade GOLD 1 bis 4 nach der Flusslimitierung in der Lungenfunktion von GOLD 1 (FEV1 ≥ 80 % vom Sollvolumen) bis GOLD 4 (FEV1 < 30 % vom Sollvolumen).
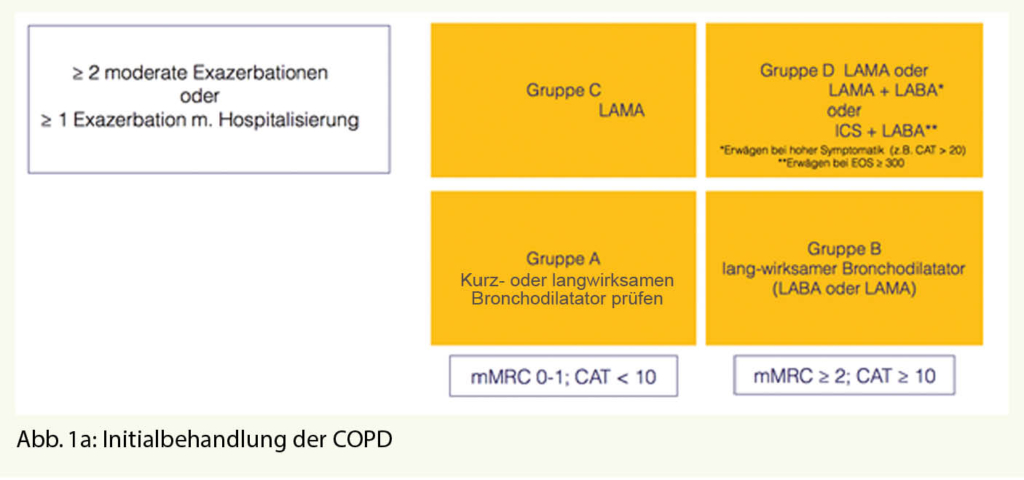
Die weitere Einteilung erfolgt nach der bereits bekannten Vierfeldertafel, wobei sich hier die Graduierung einerseits nach der Exazerbationsanamnese und anderseits Symptomatik der Erkrankung richtet und wie bisher in die Gruppen A, B, C und D erfolgt. Zu den Hochrisikogruppen C und D zählen Patienten mit zwei und mehr Exazerbationen im Vorjahr oder mindestens einer exazerbationsbedingten Krankenhauseinweisung, Diese beiden Gruppen C und D unterscheiden sich dann wiederum durch die Schwere der Symptomatik, die sich am einfachsten mit der mMRC-(modified-Medical-Research-Council-) Skala bestimmen lässt, welche das wichtige Symptom Dyspnoe abfragt.
Die Einstufung in diese 4 Therapiegruppen entscheidet über die jeweils empfohlene Therapie, wobei neu nun zwischen therapienaiven Patienten (Abb. 1a), also bei denen neu mit der COPD Therapie begonnen werden soll, und vorbehandelten Patienten (Abb. 1b) unterschieden wird und hierbei für das therapeutische Vorgehen Algorithmen entwickelt wurden.
Bronchodilatatoren spielen hier die Hauptrolle bei der COPD Therapie, langwirksame Präparate sollten spätestens ab Gruppe B zum Einsatz kommen.
Eosinophilenzahl und ICS
Eine der wichtigsten Fragen bei der COPD Therapie ist, welcher Patient von einer Therapie mit inhalativen Kortikosteroiden (ICS) profitiert. Bei der Initialtherapie eines COPD Patienten ist die ICS Zugabe nur bei schwer kranken Häufigexazerbierern, sowie bei relevanter zusätzlicher asthmatischer Komponente gerechtfertigt.
Problematisch ist, dass immer noch in praxi COPD Patienten weiterhin mit einem ICS behandelt werden – auch ohne gehäufte Exazerbationen und starke Symptomatik. Hier haben einige Studien gezeigt, dass es durchaus ohne relevant erhöhtes Risiko möglich und sinnvoll ist, ICS bei einem Teil der Patienten, die kein Kriterium für diese Therapie aufweisen aber dennoch damit behandelt sind, abzusetzen. Dies auch vor dem Hintergrund, dass unter ICS ein erhöhtes Pneumonierisiko bei COPD besteht, vor allem bei weniger symptomatischen und Geringexazerbierern, so dass immer betont werden muss, jeweils das Risiko einer ICS Therapie gegenüber dem potentiellen Nutzen abzuwiegen.
Zudem wird bei der aktuellen GOLD Richtlinie berücksichtigt, dass neben der Exazerbationsfrequenz die Eosinophilenzahl im Blut ein geeigneter Marker für das Ansprechen einer ICS Gabe bei der COPD Therapie ist.
In Studien zeigte sich, dass Patienten, die eine Eosinophilenzahl von 300/μl Blut oder mehr aufzeigen, bezüglich Reduktion der Exazerbationsrate von einer zusätzlichen ICS Therapie profitieren. Hingegen ist dieser Effekt bei COPD Patienten mit Werten von weniger als 100 Eosinophilen/μl sehr gering, so dass nun von GOLD empfohlen wird, sich bei der Eskalation oder auch Deeskalation der COPD Therapie auch an der im Differentialblutbild gemessenen Eosinophilenzahl zu orientieren (Abb. 2).
Die Eosinophilenzahl ist somit ein wichtiger Biomarker bei der COPD Therapie und es ist für die Therapieentscheidungen hilfreich, vor allem beim vorbehandelten COPD Patienten ein Differentialblutbild zu bestimmen.
Als initiale Option sollte die Kombination aus LABA/ICS bei Patienten mit starker Symptomlast und hohem Exazerbationsrisiko, also GOLD-Gruppe D, nur dann als Option erwogen werden, wenn die Eosinophilenzahl 300/μl Blut überschreitet. Zudem kann diese Kombination bei COPD Patienten mit Asthma und/oder Allergien in der Anamnese eine initiale Therapieoption sein.
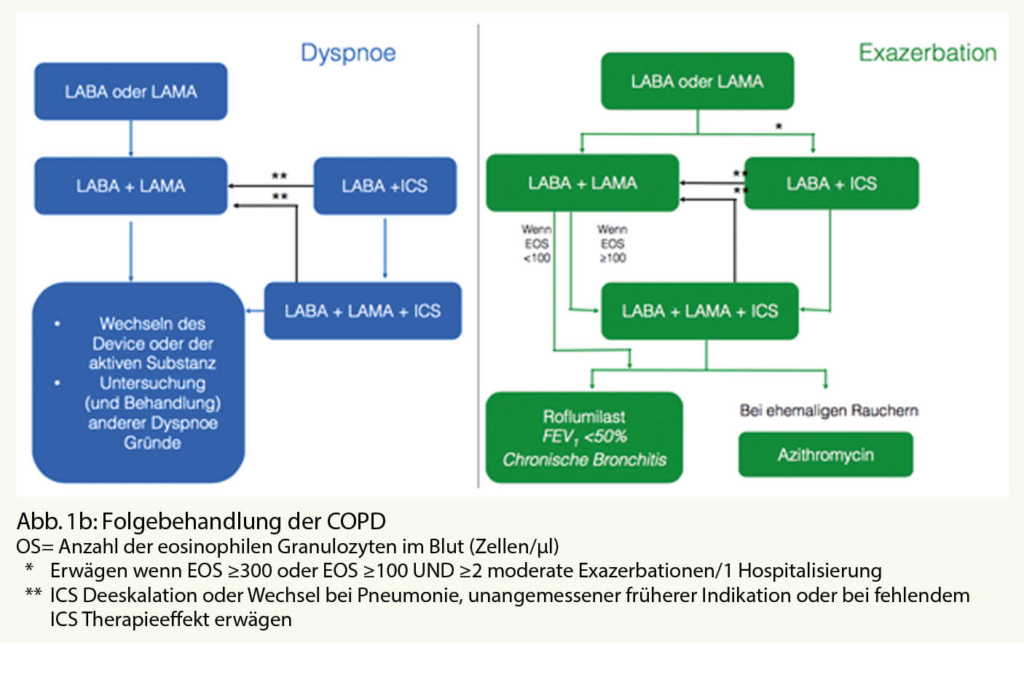
Therapieentscheidend für die medikamentöse COPD Therapie bei vorbehandelten Patienten, bzw. im Follow-up, ist, welche Problematik beim COPD Patient dominiert, einerseits das Kardinalsymptom Dyspnoe oder aber Exazerbationen (Abb. 1 b).
Steht die Dyspnoe im Vordergrund sollte die bronchodilatatorische Therapie eskaliert werden, von der Mono (LABA oder LAMA)- zur dualen Therapie (LABA/LAMA) oder von LABA/ICS zur Tripeltherapie (LABA/LAMA/ICS) respektive Wechsel auf eine Kombination von Bronchodilatatoren (LABA/LAMA).
Gegebenenfalls ist auch ein Device- und/oder Wirkstoffwechsel in Betracht zu ziehen.
Bei häufigen Exazerbationen ist das Ziel einer Addition eines ICS zu entweder einem bereits etablierten LAMA, LABA oder LAMA/LABA die Vermeidung weiterer Exazerbationen, vor allem dann, wenn wie bereits erwähnt, die Eosinophilenzahl bei ≥ 300 Zellen/µl Blut liegt.
Bei weniger als 100 eosinophilen Zellen/µl Blut sollten Alternativen wie der orale Entzündungshemmer und PDE4-Inhibitor Roflumilast oder auch Azithromycin erwogen werden.
Management-Zyklus Prüfen, Bewerten und Anpassen
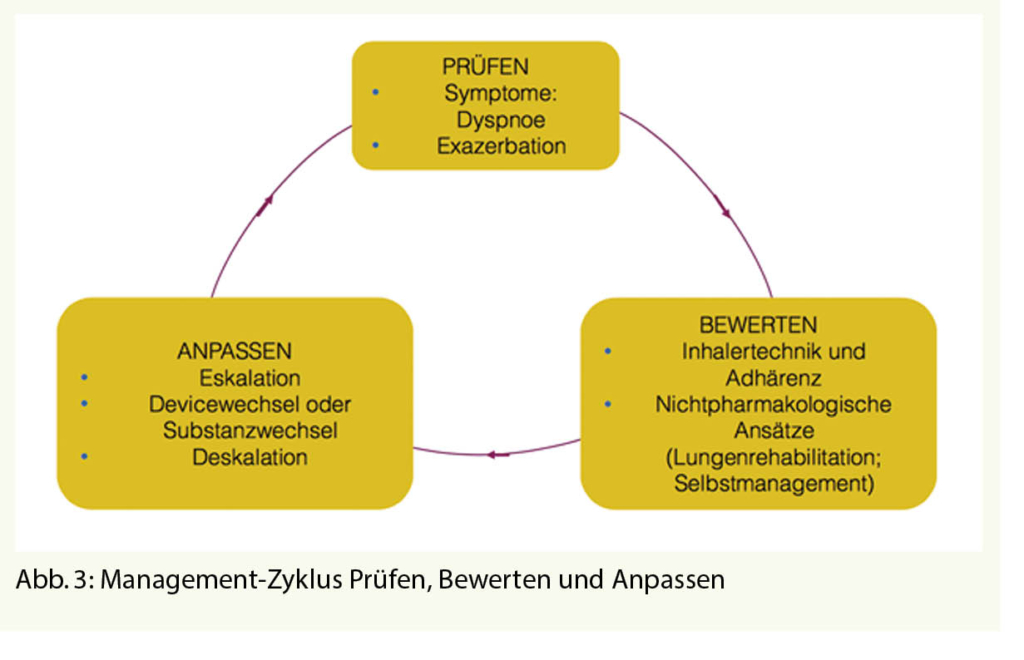
Bei der Therapiesteuerung der COPD ist es unabdingbar, den Therapieerfolg wie auch beim Asthma regelmässig zu kontrollieren und die Behandlung ggf. anzupassen, z.B. dann, wenn der Patient weiterhin symptomatisch ist, doch häufiger exazerbiert, wenn die bei jedem Patientenkontakt zu kontrollierende Inhalationstechnik nicht optimal passt und ggf. das Inhalationsdevice gewechselt werden muss oder (neue) aggravierende Begleiterkrankungen bestehen.
Damit die Patienten nach der erfolgten Initialtherapie nicht sich selbst überlassen bleiben, wird empfohlen, nach einem Management-Zyklus aus Prüfen, Bewerten und Anpassen vorzugehen und entsprechende Massnahmen zu ergreifen, wenn die Therapie noch nicht optimal läuft, bzw. die gewünschten Therapieziele noch nicht erreicht sind. (Abb. 3).
Das Trainieren der korrekten Inhalationstechnik im Rahmen von Patientenschulungen ist essentiell, ein Inhalations-Medikament kann nur dann effektiv sein, wenn es auch dort hingelangt, wo es hin soll. Ohne eine eingehende und individuelle Schulung der Inhalation bleibt der Behandlungserfolg meist aus. Um den korrektem Inhalatorgebrauch sicherzustellen, macht es Sinn, die Inhalationstechnik bei möglichst jeder Konsultation zu kontrollieren. Am besten demonstriert der Patient, wie er den Inhalator anwendet, dabei können dann allfällige Fehler korrigiert werden.
Das Erkennen und Selbst-Management von Exazerbationen kann mit Hilfe eines COPD Aktionsplan vermittelt werden. Neben der klassischen Patientenschulung kann mit einem individuell angepassten Coaching und einer Beratung eine bessere Krankheitsbewältigung erreicht werden.
Aufgrund der Belastungsdyspnoe vermeiden COPD Patienten sehr häufig, sich körperlich zu belasten und dekonditionieren damit noch mehr. Um dieser Abwärtsspirale entgegenzuwirken, sind Rehabilitationsmassnahmen mit regelmässigem körperlichem Training mindestens genauso wichtig, wie die inhalative medikamentöse Therapie. Damit verbessern sich Ausdauer, Dyspnoe und das Exazerbationsrisiko sowie vor allem die Lebensqualität.
Grundsätzlich kann letztere vor allem durch den Rauchstopp, die Einhaltung der medikamentösen Therapie mit möglichst optimaler Inhalationstechnik und die regelmässige körperliche Betätigung mit Training mindestens 2 Mal/Woche gebessert werden und möglichst lange auch erhalten bleiben.
Copyright bei Aerzteverlag medinfo AG
LungenZentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
a.piecyk@lungenzentrum.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Die COPD Therapie richtet sich vor allem nach der Symptomatik und der Exacerbationshäufigkeit.
- Langwirksame Bronchodilatatoren (LAMA und LABA) sind die Basistherapie bei symptomatischen Patienten mit COPD.
- Inhalative Steroide (ICS) sind erst bei höherem Exacerbationensrisiko (mehr als zwei Exacerbationen/a oder mindestens mehr als eine hospitalisationspflichtige Exacerbation/a) und ggf. erhöhter Eosinophilenzahl (grösser 300/yl) oder bei asthmatischer Komponente indiziert.
- Die COPD Therapie sollte regelmässig überprüft und ggf. adjustiert werden, eventuell ist auch eine Therapiedeeskalation gerade hinsichtlich der Behandlung mit ICS zu erwägen.
- Der Rauchstopp, die regelmässige Überprüfung der Inhalationstechnik und die Empfehlung zur regelmässigen körperlichen Aktivität, möglicherweise auch im Rahmen ambulanter/stationärer Rehabilitation sind essentielle Therapiebausteine.
Graf J, Jörres RA, Lucke T, Nowak D, Vogelmeier C, Ficker JH: Medical treatment of COPD—an analysis of guideline-adherent prescribing in a large national cohort (COSYCONET). Dtsch Arztebl Int 2018; 115: 599–605. DOI: 10.3238/arztebl.2018.0599
Vogelmeier C, et al.: Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin e.V. und der Deutschen Atemwegsliga e.V., unter Beteiligung der Österreichischen Gesellschaft für Pneumologie (Hrsg.): Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). Pneumologie 2018; 72: 253–308
Global Initiative for Chronic Obstructive Lung Disease: Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease (2020 Report). https://goldcopd.org/wp-content/uploads/2019/11/GOLD-2020-REPORT-ver1.0wms.pdf
Agusti A, et al.: Inhaled corticosteroids in COPD: Friend or foe? Eur Respir J 2018; 52 (6). pii: 1801219 CrossRef
der informierte @rzt
- Vol. 10
- Ausgabe 9
- September 2020