- Demenz-Biomarker in Plasma und Liquor
Die Suche nach neuen Behandlungen, die auf die asymptomatische Periode vor dem Beginn einer kognitiven Beeinträchtigung und Demenz abzielen, ist, in Kombination mit Studien zu diagnostischen und prognostischen Biomarkern, ein vielversprechender Weg für die Zukunft. Wir geben einen Überblick über die Demenz-Biomarker, die für den aktuellen klinischen Einsatz validiert sind und zeigen, in welche Richtungen sich die Praxis in diesem Bereich orientieren kann.
Wissenschaftliche Fortschritte führen zu einem «klinisch-biologischen» Ansatz bei der Diagnose von Demenz unter Verwendung von Biomarkern, die eine genauere und frühere Diagnose von Demenz vor dem Auftreten von kognitiven Störungen ermöglichen (1). Das Interesse einer frühzeitigen Diagnose besteht darin, eine pharmakologische Behandlung und angemessene Unterstützung für den Patienten und sein Umfeld einsetzen zu können (2). Aus diesem Grund wird die Entwicklung neuer Behandlungen, die auf die asymptomatische, aber biologisch aktive Periode der Krankheit abzielen, von Studien zu diagnostischen und prognostischen Biomarkern begleitet.
Die Entwicklung von Biomarkern für Demenz hat sich seit Mitte der 2000er Jahre deutlich weiterentwickelt, vor allem durch die Identifizierung und Validierung von Liquor (LCR)-Biomarkern für die Alzheimer-Krankheit (AD) (3). Das Ziel dieses Artikels ist es, eine Zusammenfassung der aktuellen klinischen Anwendung der Demenz-Biomarker sowie einige vielversprechende Wege für die Zukunft zu präsentieren (Tab. 1).
Alzheimer-Krankheit und Liquor
Die AD ist die häufigste neurodegenerative Erkrankung. Sie macht 60% aller Demenzerkrankungen aus (1). Die Neuropathologie umfasst die Bildung von extrazellulären Aggregaten des Peptids β-Amyloid42 (Aβ42), die als Amyloid-Plaques bezeichnet werden, und die neurofibrilläre Degeneration, die aus intraneuronalen Clustern von hyperphosphorylierten Tau-Proteinfilamenten besteht. Es besteht eine Korrelation zwischen dem Ausmass der neurofibrillären Degeneration und dem Schweregrad der kognitiven Beeinträchtigung, im Gegensatz zu den Amyloid-Plaques-Ablagerungen, die zu Beginn der Symptome oft diffus sind (1).
Drei Haupt-Biomarker im Liquor sind bei AD anerkannt und wurden in zahlreichen Studien untersucht. Dies sind Aβ42, dessen Konzentration aufgrund seiner Akkumulation in kortikalen Plaques abnimmt, das Gesamt-Tau-Protein (Tau) und das phosphorylierte Tau (p-Tau); hohe Konzentrationen der beiden letztgenannten Marker korrelieren jeweils mit neuronalem Verlust und neurofibrillärer Degeneration. Ihre Sensitivität und Spezifität erreichen 85-90% (4). Solche Konzentrationen werden auch im Liquor von Patienten mit Alzheimer im Stadium der leichten kognitiven Beeinträchtigung (MCI) gefunden. Bei letzterer sind kognitive Störungen nicht mit einer signifikanten Beeinträchtigung der Autonomie des Patienten verbunden wie bei Demenz. In der Tat geht die Senkung von Aβ42 im Liquor der kognitiven Beeinträchtigung der AD um mindestens 10 Jahre voraus (4). Allerdings treten Amyloid-Plaques mit zunehmendem Alter häufiger auf, so dass dieser Marker ab einem Alter von 80 Jahren weniger spezifisch ist.
Kontraindikationen für Liquor-Biomarker-Tests sind solche, die mit der Durchführung der Lumbalpunktion im Zusammenhang stehen, wie z.B. intrakranieller Bluthochdruck, Krampfanfälle, erhöhtes Blutungsrisiko (einschliesslich gerinnungshemmender Behandlungen) oder Hautinfektionen an der Punktionsstelle. Das Risiko des Absetzens der Antikoagulation für eine Lumbalpunktion sollte immer sorgfältig abgewogen werden. Die Daten in der Literatur divergieren hinsichtlich der Überlegenheit von Liquor-Biomarkern im Vergleich zu anderen Biomarkern, die auf strukturellem, funktionellem oder Amyloid-Neuroimaging (MRT, 18F-FDG-PET oder Amyloid-PET) basieren. Daher gibt es keine Empfehlung für die bevorzugte Verwendung eines bestimmten Biomarkers. Vielmehr hängt die Wahl von den Kosten und der Verfügbarkeit der Untersuchung sowie von der lokalen Expertise der Memory Clinic ab.
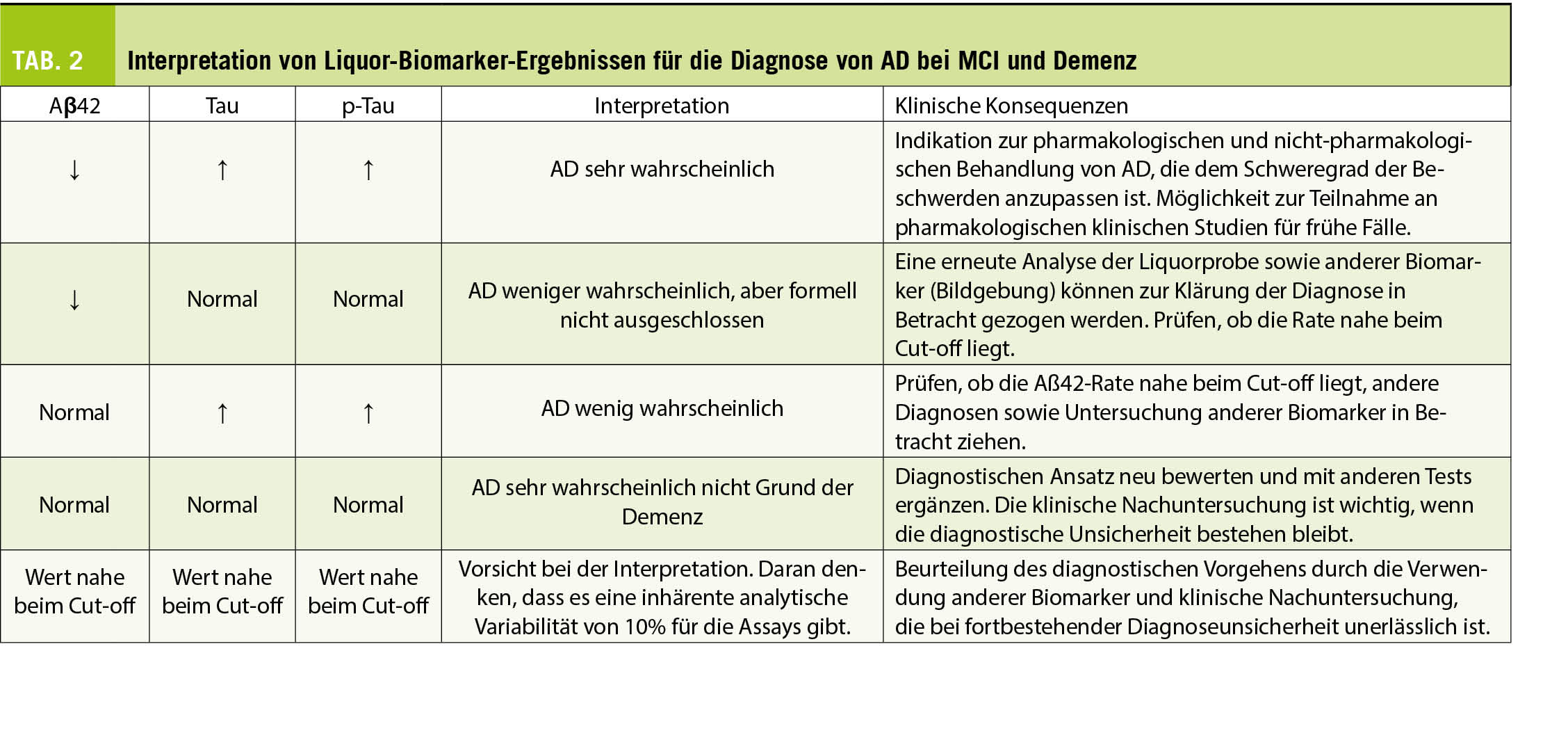
In der aktuellen klinischen Praxis sind Biomarker der AD im Liquor nützlich für die Diagnose der AD, insbesondere im milden Stadium und bei der Differenzialdiagnose atypischer Krankheitsbilder (frühes Alter, vor allem Beeinträchtigungen, die nicht das Gedächtnis betreffen etc.) (Tab. 2).
Andere Demenzerkrankungen und Liquor-Biomarker
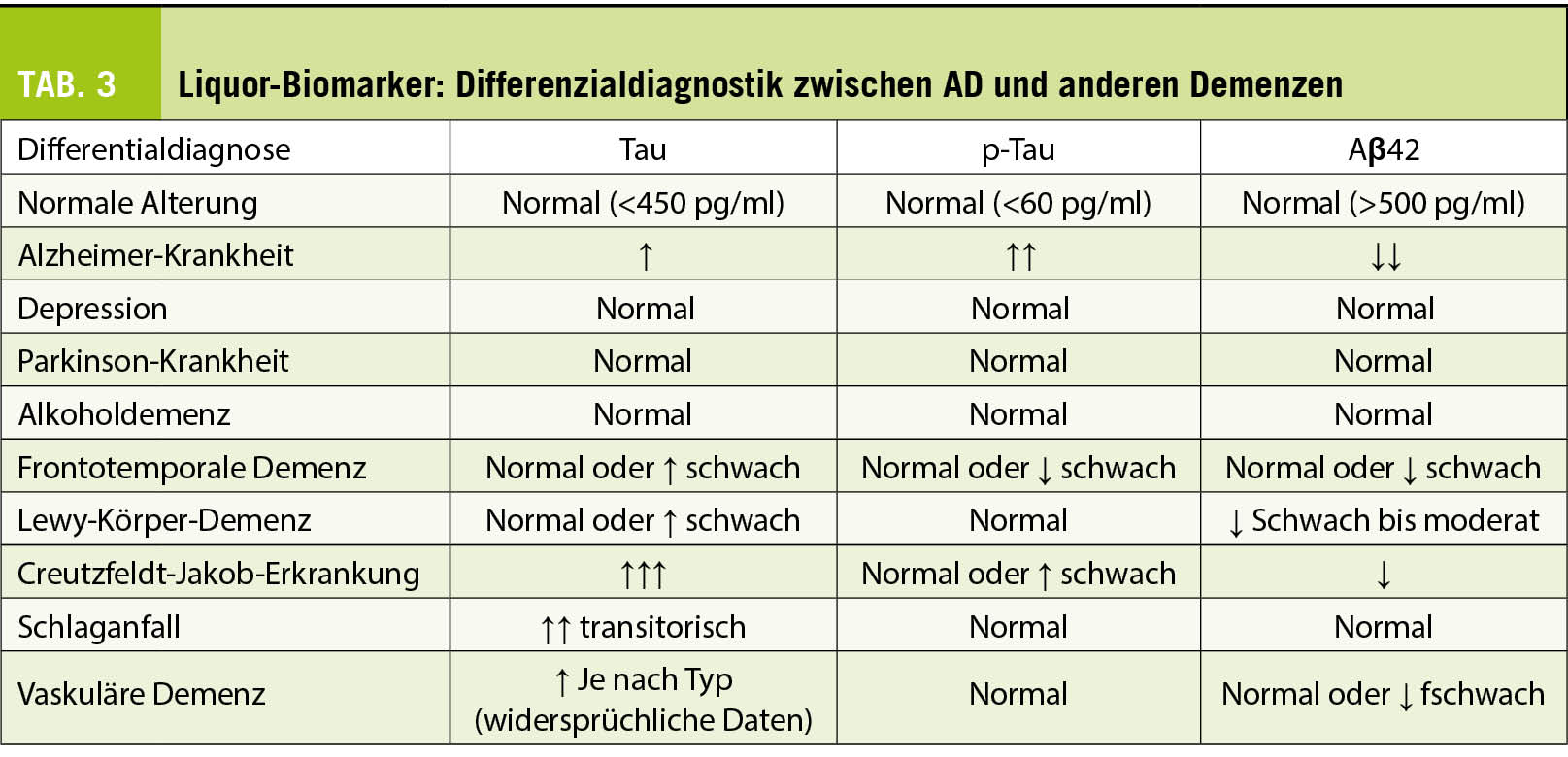
Die klinische Verwendung von Liquormarkern für AD in der Differentialdiagnose von Demenz ist in Tabelle 3 zusammengefasst.
Schliesslich sei hier noch an seltenere Erkrankungen wie Creutzfeldt-Jakob erinnert, für die das Vorhandensein des 14-3-3-Proteins im Liquor eine grosse diagnostische Hilfe darstellt, sowie an Autoimmun-, paraneoplastische und infektiöse Enzephalitiden, bei denen spezifische Antikörper im Liquor gefunden werden können. Obwohl diese Assays in der Praxis verfügbar sind, sind sie nicht Gegenstand der täglichen Routine, vervollständigen jedoch das Vorgehen bei einem auffälligen Krankheitsbild.
Andere Biomarker sind bei bestimmten kognitiven Pathologien erhöht, wie z.B. das Leichtketten-Neurofilament (L-CNF), das die axonale Zerstörung widerspiegelt, oder Entzündungsmarker wie die Matrix-Metalloprotease 9 (5, 6).
Die Parkinson-Krankheit und die Lewy-Körper-Demenz sind das Ergebnis aus der Anhäufung von Alpha-Synuclein (α-syn) im Gehirn in Einschlüssen, die «Lewy-Körper» genannt werden und bei Patienten mit diesen beiden verwandten Krankheiten beobachtet werden (7). Amyloid-Plaques und neurofibrilläre Degeneration sind ebenfalls häufig vorhanden (bei bis zu 40% der Fälle). Die Bestimmung der α-syn-Konzentration im Liquor erlaubt keine Differenzialdiagnose zwischen den Synucleinopathien. Es werden jedoch verminderte Gesamt-α-syn-Konzentrationen und erhöhte oligomere und phosphorylierte α-syn-Konzentrationen bei Parkinson-Patienten im Vergleich zu Kontrollen beobachtet, die mögliche Marker in der zukünftigen klinischen Praxis darstellen.
Diese Mischformen mit der AD unterscheiden sich in der Prognose; niedrige Konzentrationen von Aβ42 im Liquor sind mit der Entwicklung von kognitiven Beeinträchtigungen bei Patienten mit Parkinson-Krankheit verbunden. Bei der Lewy-Körper-Demenz sind die Tau-Konzentrationen höher als bei der Parkinson-Krankheit, aber niedriger als bei der Alzheimer-Krankheit, wobei ein Zusammenhang zwischen der gefundenen Konzentration und dem Schweregrad der Demenz besteht. Derzeit ist die Verwendung dieser Marker ausserhalb der Diagnose von AD nicht klinisch validiert.
Biomarker für Demenz im Plasma
Sie haben Vorteile gegenüber Liquormarkern, wie z.B. die einfache Durchführung eines Bluttests in verschiedenen Umgebungen (Büro, Krankenhaus, zu Hause), die Annehmlichkeit, den Assay zu anderen Markern hinzufügen zu können, die bereits Teil der üblichen Gesundheitsuntersuchung sind, mit einem weniger invasiven und potenziell weniger teuren Verfahren als Positronen-Emissions-Tomographie (PET-Amyloid, PET-Tau).
Bislang sind sie nur Gegenstand von Forschungsprotokollen, und keiner der genannten Marker ist ausreichend genau, standardisiert und reproduzierbar, um in der klinischen Praxis eingesetzt zu werden. Darüber hinaus haben Biomarker, die die Aktivität des zentralen Nervensystems widerspiegeln, eine sehr niedrige Konzentration im peripheren Blut und können das Produkt einer Aktivität ausserhalb des Gehirns sein oder entsprechend einer Störung ihrer Clearance schwanken.
Die meisten bisherigen Studien haben sich auf die klassischen Marker der AD konzentriert: Aβ, Tau und p-Tau, gefolgt von genetischen Markern und Biomarkern, die auf anderen Mechanismen basieren, die mit der Demenz zusammenhängen, wie Entzündung, Immunantwort, oxidativer Stress, DNA-Schäden, mitochondriale Dysfunktion und neuronale oder mikrovaskuläre Schäden. Derzeit gibt es über 150 Blut-Biomarker. Wir fassen hier diejenigen mit dem grössten Potenzial für den klinischen Einsatz zusammen:
1. Aβ42, Aβ40 und das Aβ42/Aβ40-Verhältnis: Mehrere Studien haben zunehmend niedrigere Plasmaspiegel von Aβ42, Aβ40 und Aβ40/Aβ40 bei Menschen mit subjektivem kognitivem Abbau, einer MCI und Demenz aufgrund von AD im Vergleich zu Menschen ohne Erkrankung oder kognitive Beschwerden dokumentiert. Dennoch gibt es eine grosse Variabilität mit schlechter Übereinstimmung zwischen den verschiedenen vorgeschlagenen Techniken. Die periphere Expression von Aβ, insbesondere diejenige sekundär zur Freisetzung von Aβ-Peptiden aus Thrombozyten und Endothelzellen, hauptsächlich in der 40-Aminosäure-Version des Peptids (Aβ40), sowie andere Serumproteine sind zusätzliche Störfaktoren, die die Nützlichkeit dieser Tests verringern (8).
2. Tau und p-Tau: Der Test mit dem grössten klinischen Potenzial ist der p-Tau-Assay, der am besten mit den Liquorwerten korreliert. Zwei Isoformen zeigen die ermutigendsten Ergebnisse: p-Tau181 und p-Tau217. Letzteres hat sich in einer kürzlich durchgeführten Studie als überlegen erwiesen, die zeigte, dass p-Tau217 eine Sensitivität und Spezifität von 91% bei der Differenzierung von Demenz aufgrund von AD im Vergleich zu anderen neurodegenerativen Ätiologien aufweist. Dies ist das signifikanteste Ergebnis aller bisher untersuchten Plasmamarker, erfordert aber eine Validierung auf Ebene der Gesamtbevölkerung (9, 10).
3. Nf-L: Dies ist ein Protein, das ausschliesslich im neuronalen Zytoplasma vorkommt und als sensibler, aber unspezifischer Marker für axonale Verletzungen bei verschiedenen neurologischen Erkrankungen beschrieben und in Liquor und Plasma gemessen wird. Erhöhte Serumspiegel wurden bei Menschen mit Alzheimer, aber auch in Fällen von vaskulärer Demenz einschliesslich Post-Schlaganfall, frontotemporale Demenz, atypische Parkinson-Syndrome, Normaldruckhydrozephalus und Schädel-Hirn-Trauma gefunden. Bei AD würde Nf-L den neuronalen Verlust in Verbindung mit Amyloid wie dem p-Tau-Protein, aber auch mit anderen Mechanismen widerspiegeln und wäre somit ein globaler Marker für den Schweregrad des neuronalen Verlusts (11).
4. Amyloid-Vorläuferprotein-Spaltungsenzym 1 von β (BACE1): Dies ist das Enzym, das für die erste Spaltung verantwortlich ist, die die Aβ-Peptide verursacht. Die im Plasma gemessene Enzymaktivität ist progressiv erhöht bei Patienten mit MCI, bei denen die Erkrankung im Verlauf eines 3-Jahres-Follow-up zu einer Demenz vom Alzheimer-Typ fortgeschritten ist (12).
5. Sonstiges: Mikro-RNAs (miRNAs) sind kleine RNAs (18-25 Nukleotide), die die Expression anderer Gene auf der post-transkriptionellen Ebene regulieren. Eine Klasse von miRNAs, die mit verschiedenen an der AD beteiligten Genen assoziiert sind, weist in der RT-PCR-
Analyse eine verminderte Serumexpression auf und ist daher ein potenzieller Marker im Prodromalstadium (13).
Die Unterexpression anderer Klassen von mRNAs ist bei vaskulärer Demenz und der Lewy-Körperchen-Krankheit beschrieben worden (14).
Mehrere entzündliche Biomarker sowie Moleküle, die an der endothelialen Dysfunktion und
der Kaskade der Koagulation beteiligt sind, werden auch bei vaskulärer Demenz und AD untersucht (6). Auf ähnliche Weise wie bei den Liquor-Biomarkern werden die Plasmaspiegel von Gesamt-, phosphoryliertem und aggregiertem α-syn bei der Lewy-Körper- und der Parkinson-Krankheit untersucht (17).
Schlussfolgerungen
Der klinisch-biologische Ansatz in der Demenzdiagnostik sowie therapeutische Studien, die auf die präsymptomatischen Phasen der Erkrankungen abzielen, haben die Suche nach Biomarkern in Plasma und Liquor beschleunigt.
Obwohl in der gegenwärtigen Praxis nur Biomarker für die Alzheimer-Krankheit im Liquor verwendet werden, besteht die Aussicht, verschiedene Panels von Plasma- und Liquor-Biomarkern zu entwickeln, die sowohl die Ätiologie(n) der Demenz genau bestimmen können, als auch den Schweregrad der Krankheit widerspiegeln und daher zur Therapieüberwachung eingesetzt werden können.
Copyright Aerzteverlag medinfo AG
Service de Gériatrie, Département des Réadaptations et Gériatrie
Hôpitaux Universitaires de Genève
Hôpital des Trois Chêne
Chemin du Pont-Bochet 3
1226 Thônex
Service de Gériatrie, Département des Réadaptations et Gériatrie
Hôpitaux Universitaires de Genève
Hôpital des Trois Chêne
Chemin du Pont-Bochet 3
1226 Thônex
Aline.mendes@hcuge.ch
Die Autorinnen haben keinen Interessenskonflikt im Zusammenhang mit dem Artikel zu deklarieren.
◆ Der «klinisch-biologische» Ansatz zur Demenzdiagnose mit Hilfe von Biomarkern ermöglicht es, zeitigere Diagnosen zu stellen, vor oder zu Beginn von kognitiven Störungen. Dies ist besonders wichtig bei der Suche nach neuen pharmakologischen Behandlungen.
◆ Liquor-Biomarker sind in einem frühen Stadium der Alzheimer-Krankheit verändert und ihre Realisierung ist derzeit in atypischen klinischen Situationen und zur Bestätigung der Ätiologie angezeigt.
◆ Biomarker im Plasma sind Gegenstand mehrerer Forschungsprotokolle und haben in letzter Zeit einige ermutigende Ergebnisse geliefert, aber ihre Verwendung in der klinischen Praxis ist nicht validiert.
1. Elahi FM, Miller BL. A clinicopathological approach to the diagnosis of dementia. Nat Rev Neurol. 2017 Aug;13(8):457–76.
2. Simonsen AH, Herukka S-K, Andreasen N, Baldeiras I, Bjerke M, Blennow K, et al. Recommendations for CSF AD biomarkers in the diagnostic evaluation of de¬mentia. Alzheimers Dement J Alzheimers Assoc. 2017 Mar;13(3):274–84.
3. Hampel H, O’Bryant SE, Molinuevo JL, Zetterberg H, Masters CL, Lista S, et al. Blood-based biomarkers for Alzheimer disease: mapping the road to the clinic. Nat Rev Neurol. 2018;14(11):639–52.
4. Olsson B, Lautner R, Andreasson U, Öhrfelt A, Portelius E, Bjerke M, et al. CSF and blood biomarkers for the diagnosis of Alzheimer’s disease: a systematic re¬view and meta-analysis. Lancet Neurol. 2016 Jun;15(7):673–84.
5. Llorens F, Schmitz M, Ferrer I, Zerr I. CSF biomarkers in neurodegenerative and vascular dementias. Prog Neurobiol. 2016 May;138–140:36–53.
6. Cipollini V, Troili F, Giubilei F. Emerging Biomarkers in Vascular Cognitive Impair¬ment and Dementia: From Pathophysiological Pathways to Clinical Application. Int J Mol Sci. 2019 Jun;20(11). DOI: 10.3390/ijms20112812
7. Parnetti L, Paciotti S, Farotti L, Bellomo G, Sepe FN, Eusebi P. Parkinson’s and Lewy body dementia CSF biomarkers. Clin Chim Acta Int J Clin Chem. 2019 Aug;495:318–25.
8. Ritchie C, Smailagic N, Noel-Storr AH, Takwoingi Y, Flicker L, Mason SE, et al. Plasma and cerebrospinal fluid amyloid beta for the diagnosis of Alzheimer’s di¬sease dementia and other dementias in people with mild cognitive impairment (MCI). Cochrane Database Syst Rev. 2014 Jun;(6):CD008782.
9.. Janelidze S, Mattsson N, Palmqvist S, Smith R, Beach TG, Serrano GE, et al. Plasma P-tau181 in Alzheimer’s disease: relationship to other biomarkers, diffe¬rential diagnosis, neuropathology and longitudinal progression to Alzheimer’s de¬mentia. Nat Med. 2020;26(3):379–86.
10. Janelidze S, Stomrud E, Smith R, Palmqvist S, Mattsson N, Airey DC, et al. Ce¬rebrospinal fluid p-tau217 performs better than p-tau181 as a biomarker of Alzheimer’s disease. Nat Commun. 2020 03;11(1):1683.
11. Gaetani L, Blennow K, Calabresi P, Filippo MD, Parnetti L, Zetterberg H. Neurofi¬lament light chain as a biomarker in neurological disorders. J Neurol Neurosurg Psychiatry. 2019 Aug;90(8):870–81.
12. Shen Y, Wang H, Sun Q, Yao H, Keegan AP, Mullan M, et al. Increased Plasma Beta-Secretase 1 May Predict Conversion to Alzheimer’s Disease Dementia in In¬dividuals With Mild Cognitive Impairment. Biol Psychiatry. 2018 01;83(5):447–55.
13. Takousis P, Sadlon A, Schulz J, Wohlers I, Dobricic V, Middleton L, et al. Differen¬tial expression of microRNAs in Alzheimer’s disease brain, blood, and J Alzheimers Assoc. 2019;15(11):1468–77.
14. Shigemizu D, Akiyama S, Asanomi Y, Boroevich KA, Sharma A, Tsunoda T, et al. A comparison of machine learning classifiers for dementia with Lewy bodies using miRNA expression data. BMC Med Genomics. 2019 30;12(1):150.
15. Engelhart MJ, Geerlings MI, Meijer J, Kiliaan A, Ruitenberg A, van Swieten JC, et al. Inflammatory proteins in plasma and the risk of dementia: the rotterdam study. Arch Neurol. 2004<,61(5):668-72.
16. Ray S, Britschgi M, Herbert C, Takeda-Uchimura Y, Boxer A, Blennow K, et al. prediction of clinical Alzheimer’s diagnosis based on plasma si¬gnaling proteins. Nat Med. 2007; 13(11):1359–62.
17. Chang C-W, Yang S-Y, Yang C-C, Chang C-W, Wu Y-R. Plasma and Serum Alpha-Synuclein as a Biomarker of Diagnosis in Patients With Parkinson’s Disease. Front Neurol. 2020 Jan;10. DOI: 10.3389/fneur.2019.01388
der informierte @rzt
- Vol. 11
- Ausgabe 10
- Oktober 2021