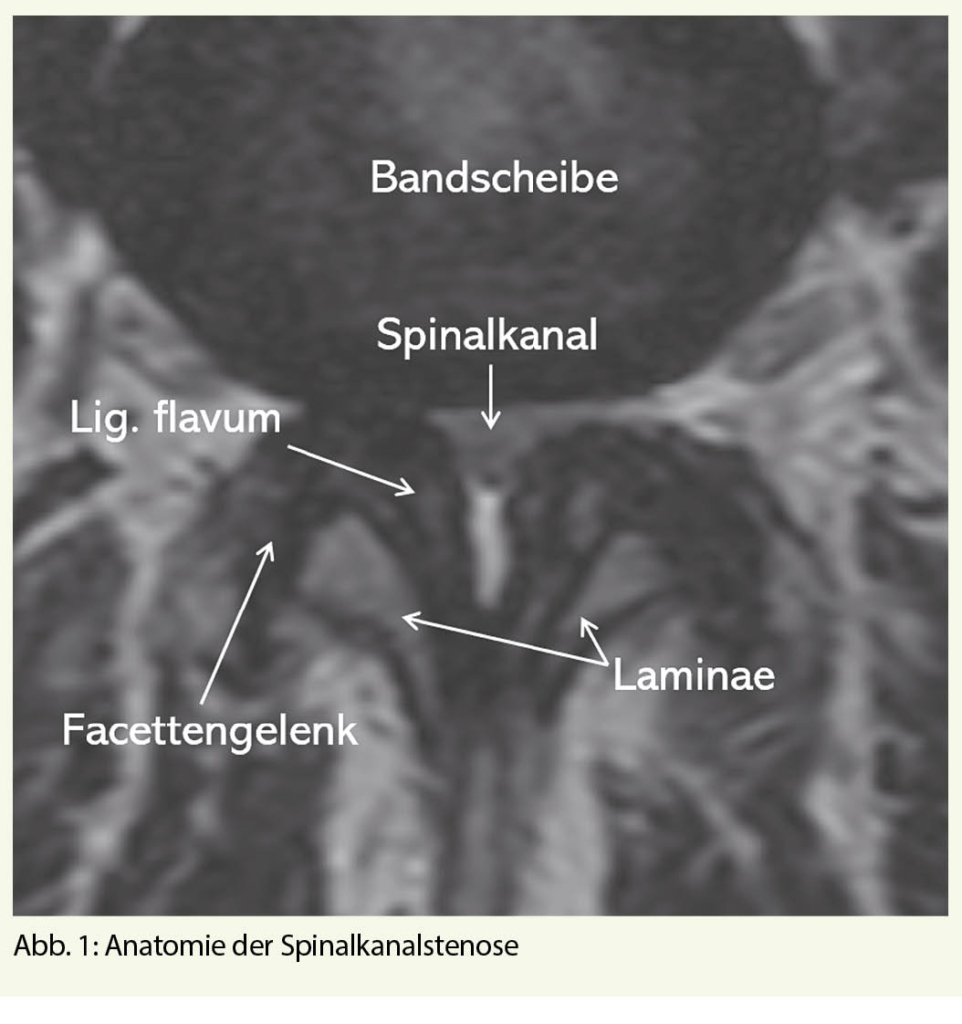
- Die lumbale Spinalkanalstenose
Eine Gehstreckenverminderung im hohen Alter mit Einbusse der Lebensqualität ist oft durch eine lumbale Spinalkanalstenose bedingt. Eine solche frühzeitig oder überhaupt zu diagnostizieren ist deshalb essenziell. Dieser Übersichtsartikel soll aufzeigen, welche Schritte bis zur Diagnose einzuleiten sind und wie eine zielgerichtete (chirurgische) Behandlung erfolgen kann.
Die Spinalkanalstenose ist eine vorwiegend degenerative Erkrankung der Wirbelsäule, deren Erstbeschreibung auf Verbiest im Jahre 1950 (1) zurück geht. Ursächlich ist vor allem die auf Belastung reaktive Hypertrophie der Facettengelenke, welche zur Einengung des Spinalkanals führt. Durch die typische Claudicatio spinalis entsteht eine deutliche Minderung der Gehstrecke und Einschränkung der Lebensqualität. Die Spinalkanalstenose ist schleichend progredient und meist erst spät symptomatisch, d.h. betrifft meist Patienten im höheren Alter. Durch die demographische Entwicklung ist somit ein relativ grosser Anteil der Bevölkerung betroffen, weshalb die Identifizierung dieser gut behandelbaren Ursache für Bein- und Rückenschmerzen umso wichtiger ist. Die Diagnose ist, obwohl klare Kriterien fehlen, glücklicherweise durch die gezielte Anamnese und Untersuchung sowie zumindest einer MRT Untersuchung relativ einfach zu stellen. Bei Versagen der meist nur kurz wirksamen konservativen Therapie zeigt die mikrochirurgische Dekompression ausgezeichnete Resultate, auch im hohen Alter.
Epidemiologie
Gemäss Framingham Studie liegt die Prävalenz der radiologisch diagnostizierten, erworbenen lumbalen Spinalkanalstenose bei 22.5% für relative und bei 7.3% für absolute Stenosen. Die Daten zeigen, dass v.a. Menschen im höheren Alter betroffen sind: Bei unter 40-Jährigen ist die Prävalenz bei 20.0%, bzw. 4.0%. Demgegenüber ist die Prävalenz bei 60-69 Jährigen sogar bei 47.2%, respektive 19.4% (2).
Daten aus einer japanischen Kohorte ergeben eine noch höhere Prävalenz bei moderater oder schwerer Spinalkanalstenose von 76.5%. Wichtig anzufügen ist, dass symptomatische Stenosen deutlich weniger oft vorkommen, in dieser Kohorte war die Prävalenz bei 9.3% (3).
Andere Risikofaktoren neben dem Alter sind Adipositas, ein kongenital enger Spinalkanal, aber auch arbeitsbedingte repetitive mechanische Reizung der Wirbelsäule. Zudem neigen Männer öfter zu einer Spinalkanalstenose als Frauen (3, 4).
Ursache
Es kann zwischen kongenitaler und erworbener Spinalkanalstenose unterschieden werden, wobei letztere deutlich häufiger vorkommt (2). Diese entsteht durch die natürliche Abnutzung an der Wirbelsäule, welche durch oben beschriebene Faktoren beeinflusst wird. Die Dehydratation der Bandscheibe bedingt eine Höhenminderung dieser, was sich wiederum auf die Facettengelenke und Bänder auswirkt. Als im Pathomechanismus neben den subkapsulären Bändern wichtigstes Band, wird das Lig. flavum zunehmend schlaff und eingefaltet. Die Facettengelenke reagieren mit einer Hypertrophie. Zusammen mit der Vorwölbung der Bandscheibe führen diese Veränderungen zur Spinalkanalstenose (Abb. 1). Diese kann zentral, rezessal, foraminal oder gemischt auftreten (5).
Schmerzen, bzw. die typische Symptomatik, entstehen einerseits durch die direkte Kompression nervaler Strukturen, aber auch durch die Störung der Mikrozirkulation entweder auf dem arteriellen oder auch auf dem venösen Schenkel inkl. Anhäufung von Metaboliten. Der genaue Mechanismus ist allerdings noch ungeklärt (6).
Anamnese und Untersuchung
Die klassische Symptomatik besteht aus gehstreckenabhängigen Schmerzen in den Beinen oder auch dem Gesäss, welche sich durch Hinsetzen oder Flexion des Rumpfes lindern lassen. Dies wird auch als Claudicatio spinalis bezeichnet. Meist reicht das alleinige Stehenbleiben zu Schmerzlinderung im Gegensatz zur vaskulären Claudicatio intermittens nicht aus. Typischerweise werden die Symptome durch eine Inklination gelindert. So wird das Bergaufgehen präferenziert und Velofahren trotz eingeschränkter Gehstrecke toleriert; sich auf dem Einkaufswagen Abstützen wird als entlastend empfunden. Häufig beschreiben Betroffene beim Gehen eine Müdigkeit oder Schwäche in den Beinen, teilweise auch Taubheitsgefühle und Parästhesien. Lumbale Rückenschmerzen, welche durch die degenerativen Veränderungen an den Facetten und der Bandscheibe hervortreten, stehen meist im Hintergrund.
Zu neurologischen Defiziten wie Lähmungserscheinungen oder Mastdarm-/Blasenentleerungsstörungen kommt es glücklicherweise selten bzw. nur in einem sehr fortgeschrittenen Stadium. So ist auch die neurologische Untersuchung meist unauffällig. In der Ganganalyse findet sich oft eine vornübergebeugte Haltung und ein breitbasiges Gangbild bei deutlich verminderter Gehstrecke. Zum Ausschluss einer Hüftpathologie sollte die Untersuchung der Hüfte nicht fehlen.
Bildgebende Diagnostik
Neben einer gründlichen Anamnese und Untersuchung gehören eine MRT sowie ein Röntgen in zwei Ebenen zur Abklärung. Die MRT gibt Auskunft über die Verhältnisse im Spinalkanal und zeigt die Engstellen auf. Ein stehendes Röntgen verschafft eine Übersicht und zeigt das Alignement bei Belastung. Röntgenfunktionsaufnahmen helfen zudem eine dynamische Olisthese zu identifizieren. Der CT oder CT-Myelographie kommt nur eine untergeordnete Rolle zu, d.h. bei kontraindizierter MRT.
Radiologische Kriterien für eine Spinalkanalstenose gibt es leider keine einheitlichen. Einerseits gibt es quantitative Abmessungen des Spinalkanals, wie zum Beispiel die Einteilung in relative (Durchmesser 10-12 mm) oder absolute Stenosen (Durchschnitt ≤10 mm) (7), andererseits qualitative Einteilungen, mit zu Hilfenahme der Abgrenzbarkeit von Liquor (Einteilung nach Schizas (8)).
Wichtig bei der Diagnose der symptomatischen Spinalkanalstenose ist die Kombination aus typischer Klinik und passender Bildgebung.
Differentialdiagnose
Differentialdiagnosen lassen bei gegebener Konstellation oder atypischen Symptomen an eine Polyneuropathie oder PAVK denken. Aufschluss betreffend der PAVK geben der Gesamtgesundheitszustand, aber auch das Tasten der Fusspulse kann hilfreich sein. Typischerweise treten dabei die Schmerzen auch beim Radfahren auf oder lassen sich nicht durch die alleinige Inklination vermindern. Bei Zweifeln ist eine angiologische Untersuchung angebracht.
Eine Elektrophysiologie ist zwar für die Diagnose einer Spinalkanalstenose nicht zwingend oder gar wegweisend, hilft aber die eher distal betonten, (Ruhe)-Schmerzen einer Polyneuropathie abzugrenzen.
Therapie
Die Therapie der Spinalkanalstenose richtet sich nach dem Schweregrad der Symptomatik (Abb. 2).
Bei milden Symptomen hilft die konservative Therapie. Dazu gehören Analgetika nach dem WHO Stufenschema und eine Physio-
therapie zur Stärkung der Rumpfmuskulatur und Haltungsschulung. Klare wissenschaftliche Evidenz dafür gibt es jedoch nicht. Auch scheint die Langzeitanwendung von Analgetika wenig zielführend (9). Epidurale Infiltrationen mit oder ohne Steroide können eine deutliche Schmerzlinderung für Wochen bis Monate erzielen (10).
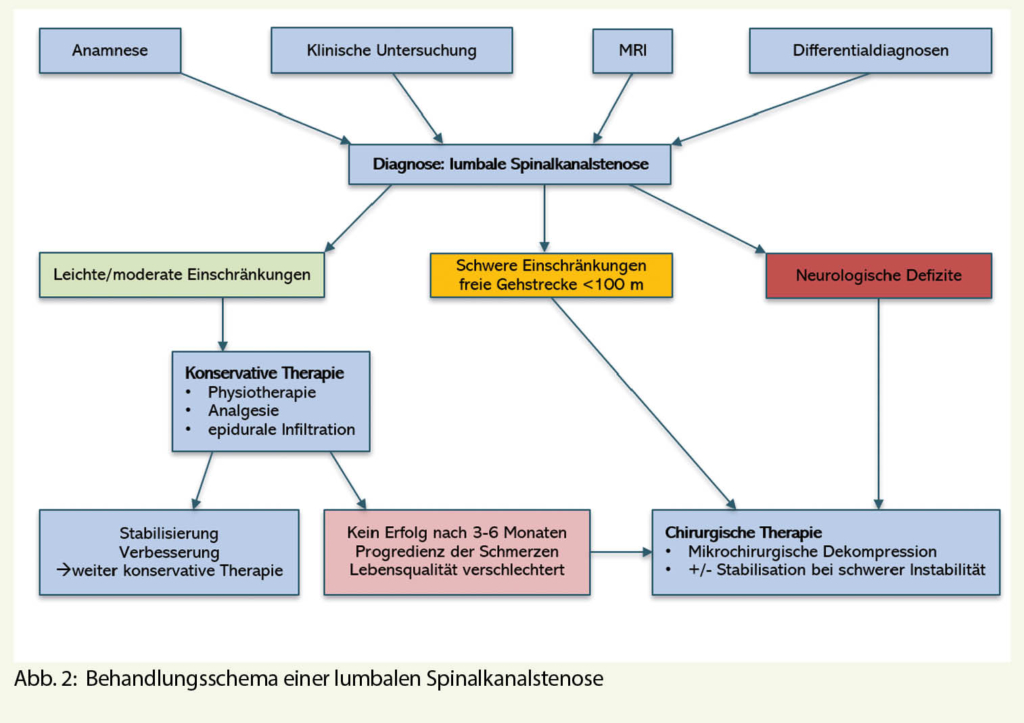
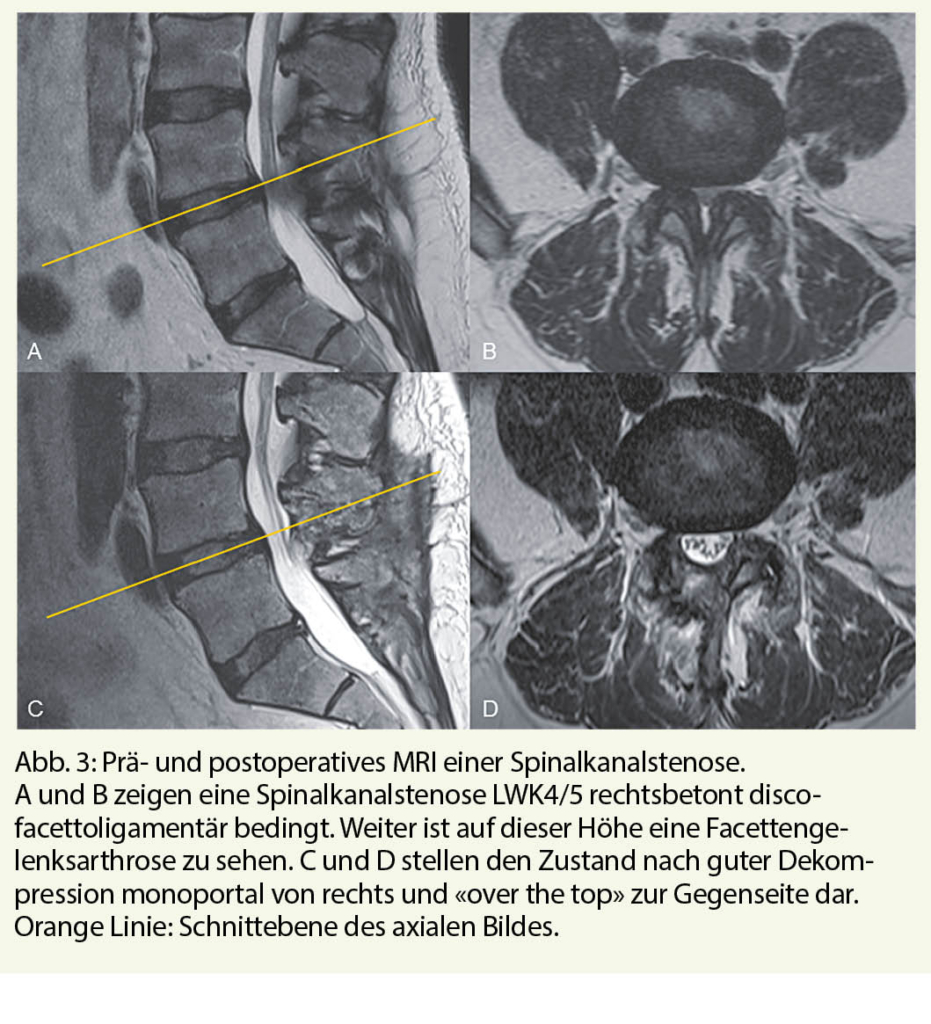
Die konservative Therapie vermag aber natürlich die zugrundeliegende Kompression nicht zu beheben. Deshalb hilft bei moderaten bis schweren Symptomen längerfristig meist nur noch die operative Dekompression (11, 12). Ziel ist es, den Spinalkanal chirurgisch zu erweitern (Abb. 3). Als technische Verfahren gibt es einerseits die Laminektomie und andererseits minimalinvasivere mikrochirurgische Verfahren, welche die Muskulatur schonen und die hintere Zuggurtung nicht unterbrechen. Dabei scheint die genaue Technik jedoch wenig Einfluss auf die Resultate zu haben (13). Untersuchungen zeigen auch, dass bei multi-level Spinalkanalstenosen die Dekompression einer einzigen Höhe möglicherweise ausreichend ist (14).
Interspinöse Spacer, welche indirekt einer Einengung entgegenwirken, erbringen zwar gute kurzfristige Resultate, jedoch hohe Reoperationsraten, weshalb solche nur sehr selektiv eingesetzt werden sollten (15).
Bei schwerer Instabilität, z.B. einer dynamischen Spondylolisthese, mit relevanten Rückenschmerzen sollte eine zusätzliche Spondylodese erfolgen. Bei der stabilen Olisthese, v.a. der leichtgradigen, gibt es unterschiedliche Datenlagen. Eine Spondylodese scheint jedoch nicht primär notwendig zu sein (11, 13, 16, 17). Dies vereinfacht die postoperative Rehabilitationsphase deutlich, was bei älteren Patienten ins Gewicht fällt.
Die einfache mikrochirurgische Dekompression ist mit einer sehr kleinen Risikorate verbunden und die Resultate sind exzellent (11, 13, 14). Schweizer Daten aus der LSOS Studie, an welcher die Schulthess Klinik als Tätigkeitsort der Autoren massgeblich beteiligt ist, belegen, dass die Dekompression eine signifikante Verbesserung der Symptome bei ca. 70% der Patienten (Follow up nach 3 Jahren) erreicht (18). Diese Daten werden unterstützt durch die Studie von Weinstein et al. mit einer Zufriedenheitsrate von 69.3% nach einem Jahr und noch 63.1% nach 4 Jahren gegenüber 28.3%, resp. 32.2%, bei der konservativen Therapie (11). Zudem ist auch auf der Kosten-
ebene die Effektivität belegt (19).
Copyright bei Aerzteverlag medinfo AG
Wirbelsäulenchirurgie/Neurochirurgie
Schulthess Klinik
Lengghalde 2
8008 Zürich
mario.ropelato@kws.ch
Wirbelsäulenchirurgie/Neurochirurgie
Schulthess Klinik
Lengghalde 2
8008 Zürich
francois.porchet@kws.ch
Die Autoren haben in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Die degenerative Spinalkanalstenose ist eine zunehmend häufige Erkrankung v.a. des höheren Alters, welche zu einer Gehstreckenverminderung und deutlichen Einschränkung der Lebensqualität führen kann.
- Die Diagnose wird durch die typische Symptomatik einer Claudicatio spinalis sowie MR-graphischem Nachweis gestellt.
- Bei mittel- bis schwergradigen Stenosen und Symptomen führt meist nur die chirurgische Therapie zu einem langfristigen Erfolg.
- Die mikrochirurgische Dekompression ist ein relativ kleiner Eingriff mit überschaubaren Risiken und sehr gutem Outcome für die meisten Patienten, auch im hohen Alter.
1. Verbiest H. [Primary stenosis of the lumbar spinal canal in adults, a new syndrome]. Ned Tijdschr Geneeskd. 1950;94(33):2415-33.
2. Kalichman L, Cole R, Kim DH, Li L, Suri P, Guermazi A, et al. Spinal stenosis prevalence and association with symptoms: the Framingham Study. Spine J. 2009;9(7):545-50.
3. Ishimoto Y, Yoshimura N, Muraki S, Yamada H, Nagata K, Hashizume H, et al. Prevalence of symptomatic lumbar spinal stenosis and its association with physical performance in a population-based cohort in Japan: the Wakayama Spine Study. Osteoarthritis Cartilage. 2012;20(10):1103-8.
4. Rubin DI. Epidemiology and risk factors for spine pain. Neurol Clin. 2007;25(2):353-71.
5. Choi YS. Pathophysiology of degenerative disc disease. Asian Spine J. 2009;3(1):39-44.
6. Rydevik B, Brown MD, Lundborg G. Pathoanatomy and pathophysiology of nerve root compression. Spine. 1984;9(1):7-15.
7. Steurer J, Roner S, Gnannt R, Hodler J, Porchet F, LumbSten Research C. Quantitative radiologic criteria for the diagnosis of lumbar spinal stenosis: a systematic literature review. BMC Musculoskelet Disord. 2011;12:175.
8. Schizas C, Theumann N, Burn A, Tansey R, Wardlaw D, Smith FW, et al. Qualitative grading of severity of lumbar spinal stenosis based on the morphology of the dural sac on magnetic resonance images. Spine. 2010;35(21):1919-24.
9. Kreiner DS, Shaffer WO, Baisden JL, Gilbert TJ, Summers JT, Toton JF, et al. An evidence-based clinical guideline for the diagnosis and treatment of degenerative lumbar spinal stenosis (update). Spine J. 2013;13(7):734-43.
10. Manchikanti L, Cash KA, McManus CD, Damron KS, Pampati V, Falco FJ. A randomized, double-blind controlled trial of lumbar interlaminar epidural injections in central spinal stenosis: 2-year follow-up. Pain Physician. 2015;18(1):79-92.
11. Weinstein JN, Tosteson TD, Lurie JD, Tosteson A, Blood E, Herkowitz H, et al. Surgical versus nonoperative treatment for lumbar spinal stenosis four-year results of the Spine Patient Outcomes Research Trial. Spine. 2010;35(14):1329-38.
12. Weinstein JN, Tosteson TD, Lurie JD, Tosteson AN, Blood E, Hanscom B, et al. Surgical versus nonsurgical therapy for lumbar spinal stenosis. N Engl J Med. 2008;358(8):794-810.
13. Thome C, Zevgaridis D, Leheta O, Bazner H, Pockler-Schoniger C, Wohrle J, et al. Outcome after less-invasive decompression of lumbar spinal stenosis: a randomized comparison of unilateral laminotomy, bilateral laminotomy, and laminectomy. J Neurosurg Spine. 2005;3(2):129-41.
14. Ulrich NH, Burgstaller JM, Held U, Winklhofer S, Farshad M, Porchet F, et al. The Influence of Single-level Versus Multilevel Decompression on the Outcome in Multisegmental Lumbar Spinal Stenosis: Analysis of the Lumbar Spinal Outcome Study (LSOS) Data. Clin Spine Surg. 2017;30(10):E1367-E75.
15. Moojen WA, Arts MP, Jacobs WC, van Zwet EW, van den Akker-van Marle ME, Koes BW, et al. Interspinous process device versus standard conventional surgical decompression for lumbar spinal stenosis: randomized controlled trial. BMJ. 2013;347:f6415.
16. Forsth P, Olafsson G, Carlsson T, Frost A, Borgstrom F, Fritzell P, et al. A Randomized, Controlled Trial of Fusion Surgery for Lumbar Spinal Stenosis. N Engl J Med. 2016;374(15):1413-23.
17. Lonne G, Fritzell P, Hagg O, Nordvall D, Gerdhem P, Lagerback T, et al. Lumbar spinal stenosis: comparison of surgical practice variation and clinical outcome in three national spine registries. Spine J. 2019;19(1):41-9.
18. Ulrich NH, Burgstaller JM, Gravestock I, Pichierri G, Wertli MM, Porchet F, et al. Outcome of unilateral versus standard open midline approach for bilateral decompression in lumbar spinal stenosis: is „over the top“ really better? A Swiss prospective multicenter cohort study. J Neurosurg Spine. 2019:1-10.
19. Aichmair A, Burgstaller JM, Schwenkglenks M, Steurer J, Porchet F, Brunner F, et al. Cost-effectiveness of conservative versus surgical treatment strategies of lumbar spinal stenosis in the Swiss setting: analysis of the prospective multicenter Lumbar Stenosis Outcome Study (LSOS). Eur Spine J. 2017;26(2):501-9.
der informierte @rzt
- Vol. 11
- Ausgabe 1
- Januar 2021