- GLP-1-Rezeptoragonisten: Zwischen Gewichtsverlust und Sarkopenierisiko
Glucagon-like Peptide-1-Rezeptoragonisten (GLP-1-RA) sind etablierte Wirkstoffe in der Therapie von Diabetes mellitus Typ 2 und gewinnen in der Adipositastherapie zunehmend an Bedeutung. Sie wirken sich nicht nur positiv auf die Gewichtsreduktion, sondern auch auf weitere adipositasassoziierte Erkrankungen aus. Jedoch kann der Einsatz von GLP-1-RA, insbesondere bei älteren Patient/-innen, das Sarkopenierisiko erhöhen. Da die Muskulatur sowohl essenzielle funktionelle als auch metabolische Funktionen erfüllt, ist der Erhalt von Muskelkraft, -masse und -funktion entscheidend. Ein frühzeitiges Assessment von Muskelgesundheit und Ernährungsstatus ist daher zentral. Die medikamentöse Therapie mit GLP-1-RA sollte individualisiert und interdisziplinär in Kombination mit Ernährungs- und Bewegungstherapie erfolgen, um Fettmasse zu reduzieren, die Muskelgesundheit zu erhalten und das Risiko einer sarkopenen Adipositas zu minimieren.
Glucagon-like peptide-1 receptor agonists (GLP-1-RA) are established agents in the treatment of diabetes mellitus type 2 and are becoming increasingly important in obesity therapy. They have beneficial effects not only on weight reduction but also on other obesity-associated comorbidities. However, the use of GLP-1-RA, especially in older patients, may increase the risk of sarcopenia. Since the skeletal muscle plays both essential functional and metabolic roles, preserving muscle strength, mass and function is critical. Early assessment of muscle health and nutritional status is therefore essential. Pharmacological therapy with GLP-1-RA should be individualized and implemented in an interdisciplinary approach, combined with nutritional and exercise interventions, to reduce fat mass, preserve muscle health and minimize the risk of sarcopenic obesity.
Keywords: GLP1 receptor agonists, diabetes mellitus, malnutrition, sarcopenia, sarcopenic obesity
Von der Blutzuckerkontrolle zur Gewichtsreduktion – Potenzial der GLP-1-RA
Neue Einsatzgebiete von GLP-1-Rezeptoragonisten
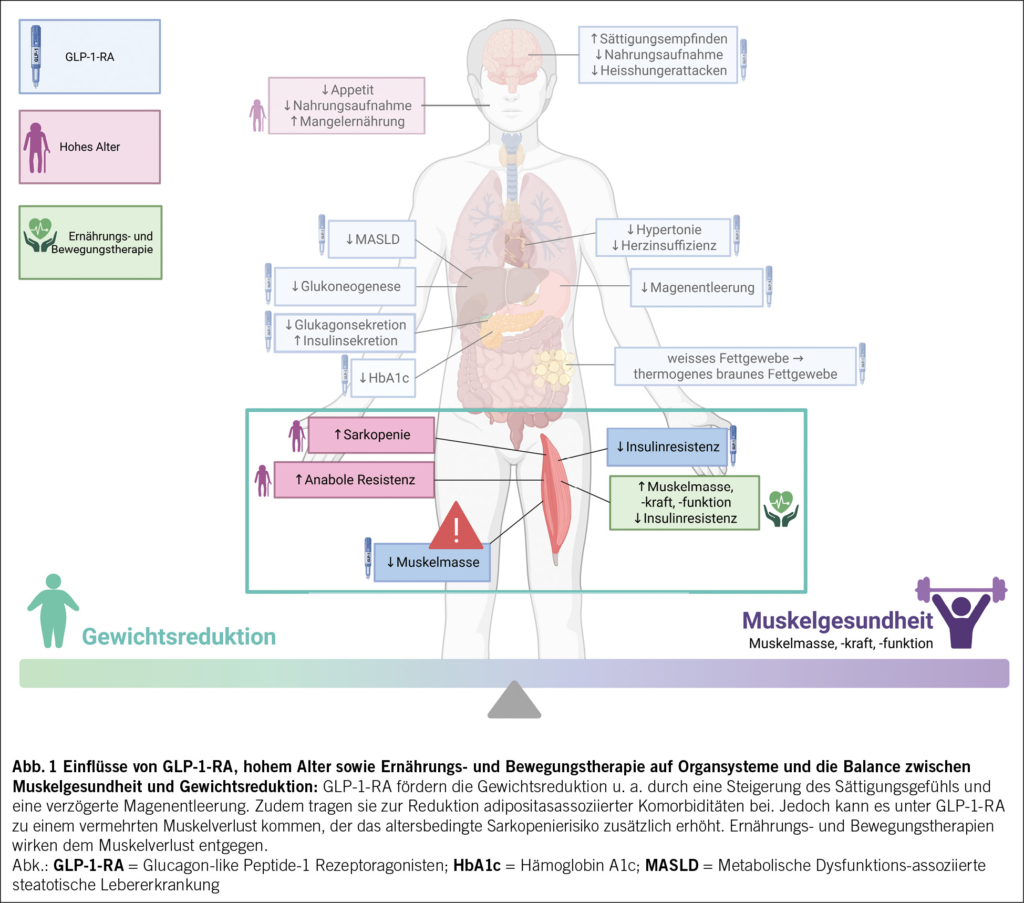
Glucagon-like Peptide-1-Rezeptoragonisten (GLP-1-RA) sind bei Patient/-innen mit Diabetes mellitus Typ 2 (T2DM) bereits ein etablierter Bestandteil der Therapie, insbesondere wenn gleichzeitig eine Gewichtsreduktion angestrebt wird (1). Mit der Zulassung der GLP-1-RA zur Behandlung von Adipositas hat deren Einsatz als Teil der multimodalen Therapie zur Gewichtsreduktion weiter an Bedeutung gewonnen. Aktuell sind in der Schweiz Semaglutid (Wegovy®) mit Vergütung aus der Grundversicherung bei entsprechender Indikation und der duale Rezeptoragonist Tirzepatid (Mounjaro®) ohne Kostendeckung durch die Krankenkasse zur Adipositastherapie zugelassen. Neben der Gewichtsreduktion und Verbesserung der glykämischen Kontrolle zeigen GLP-1-RA positive Effekte auf adipositasassoziierte Komorbiditäten (z. B. Hypertonie, Herzinsuffizienz, metabolische Dysfunktions-assoziierte steatotische Lebererkrankung) und sind mit einer Reduktion kardiovaskulärer Ereignisse und der Gesamtmortalität assoziiert (2–5). Im Rahmen der Gewichtsreduktion besteht jedoch das Risiko, nicht nur Fettmasse zu verlieren, sondern potenziell wertvolle Muskelmasse abzubauen – ein Aspekt, der insbesondere bei älteren Patient/-innen nachteilig ist, da hierdurch das Risiko für funktionelle Einschränkungen und für die Entwicklung einer Sarkopenie deutlich erhöht ist (Abb. 1) (6). Vor diesem Hintergrund rückt das Krankheitsbild der sarkopenen Adipositas – das gleichzeitige Vorliegen von Adipositas und Sarkopenie – zunehmend in den Fokus der Forschung.
Wirkung GLP-1-RA
GLP-1-RA sind synthetische Polypeptide, die die Wirkung des körpereigenen GLP-1 imitieren, indem sie an GLP-1-Rezeptoren in Organen wie u. a. Pankreas, Lunge, ZNS und Gastrointestinaltrakt binden (7). Der duale Agonist Tirzepatid wirkt zusätzlich am Glucose-dependent insulinotropic polypeptide (GIP)-Rezeptor. Die glukose- und gewichtsmodulierende Wirkung der GLP-1-RA beruht auf mehreren synergetischen Mechanismen. Zum einen inhibieren sie die Glukagonsekretion aus den α-Zellen des Pankreas und damit die hepatische Glukoneogenese. Zum anderen fördern sie die glukoseabhängige Insulinsekretion aus den β-Zellen, verbessern die Insulinresistenz und senken den HbA1c-Wert signifikant (8). Durch die Expression von GLP-1-Rezeptoren in verschiedenen Regionen des ZNS, u. a. im Hypothalamus, beeinflussen GLP-1-RA das zentrale Sättigungs- und Belohnungssystem. Dies führt zu einem gesteigerten Sättigungsempfinden, verminderter und besser kontrollierbarer Nahrungsaufnahme sowie einer Reduktion von Heisshungerattacken (sog. «Cravings») über eine Reduktion der emotionalen Koppelung (9). Begleitend zeigt sich eine Reduktion der Häufigkeit nahrungsassoziierter Gedanken und Impulse («food noise») (10). Darüber hinaus modulieren GLP-1-RA metabolische Signalwege; u. a. kommt es zu einer Umwandlung von viszeralem, weissem Fettgewebe in thermogenes braunes Fettgewebe, was mit einem erhöhten Energieverbrauch assoziiert ist (11). Ein weiterer relevanter Mechanismus ist die Verzögerung der Magenentleerung, wodurch die postprandiale Glukoseabsorption und somit die glykämische Kontrolle verbessert werden. Insgesamt resultieren diese Mechanismen in einer verminderten Nahrungsaufnahme, einem Kaloriendefizit und folglich einer klinisch relevanten Gewichtsreduktion (12).
Die Applikation erfolgt in der Regel einmal wöchentlich subkutan. Zu den häufigsten Nebenwirkungen zählen gastrointestinale Beschwerden wie Übelkeit, Erbrechen, Diarrhö und Obstipation. Darüber hinaus besteht ein leicht erhöhtes Risiko für akute Pankreatitis und Cholezystolithiasis (13). Um gastrointestinalen Nebenwirkungen vorzubeugen, wird eine schrittweise Titration der Dosis empfohlen (12).
Die Bedeutung von Mangelernährung, Sarkopenie und Muskelgesundheit im Rahmen der GLP-1-RA-Behandlung
Mangelernährung und Sarkopenie
Mit zunehmendem Alter steigt die Prävalenz von Mangelernährung, was vor dem Hintergrund der global alternden Bevölkerung eine zunehmende Herausforderung darstellt (14).
Mangelernährung bei älteren Patient/-innen resultiert aus einem komplexen Zusammenspiel von krankheitsassoziierten, inflammatorischen, endokrinologischen und sozioökonomischen Faktoren. Charakteristisch sind ein verminderter Appetit, eine reduzierte Nahrungsaufnahme, Energie- und Nährstoffdefizite, eine gesteigerte Katabolie sowie ein ungewollter Gewichtsverlust (15). Die Prävalenz der Mangelernährung bei älteren Patient/-innen variiert stark nach Versorgungssetting: Sie reicht von unter 5 % (selbstständig lebend) bis zu 50 % (Pflegeeinrichtungen, Spitäler) (14, 16). Mangelernährung ist zudem ein wichtiger Risikofaktor für die Entwicklung der häufig gleichzeitig auftretenden Sarkopenie.
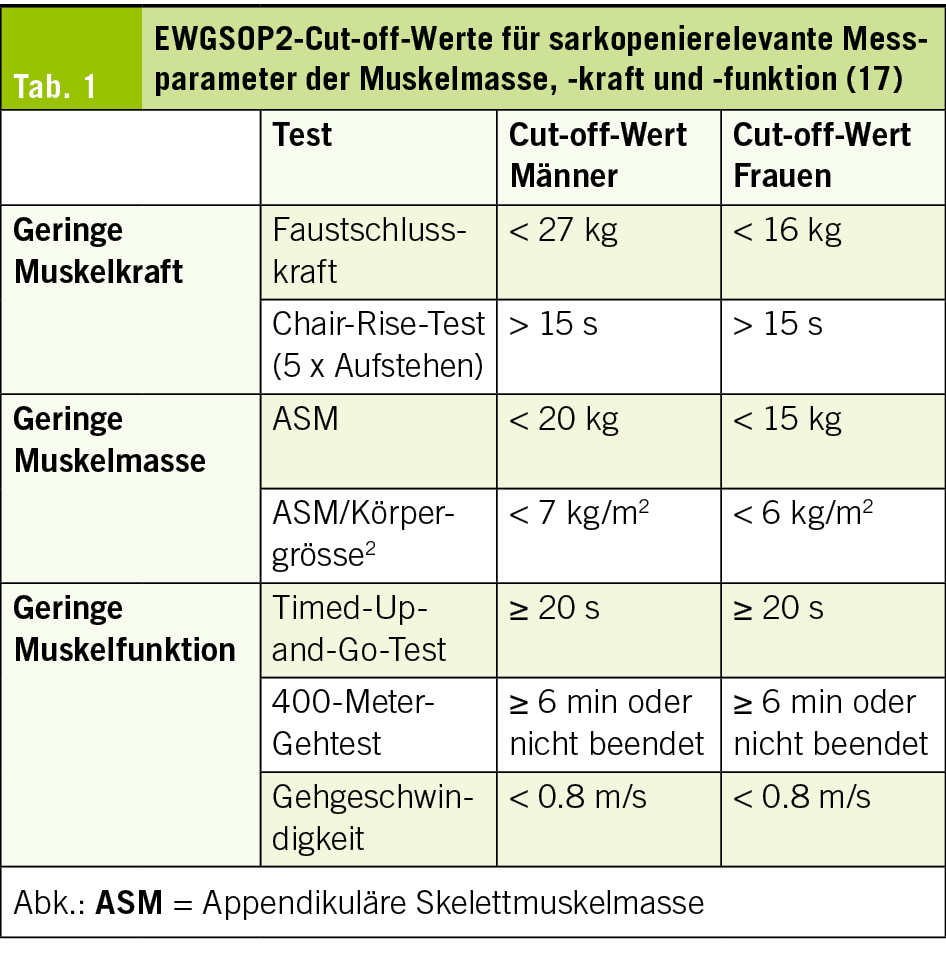
Gemäss der European Working Group on Sarcopenia in Older People (EWGSOP2) besteht bei reduzierter Muskelkraft der Verdacht auf Sarkopenie. Die Diagnose erfordert zusätzlich eine verminderte Muskelmasse oder -qualität. Eine schwere Sarkopenie liegt bei zusätzlich eingeschränkter körperlicher Leistungsfähigkeit vor (17). Patient/-innen mit Sarkopenie werden bei gleichzeitig bestehender Adipositas (sarkopene Adipositas) häufig nicht adäquat diagnostiziert, da die vermehrte Fettmasse Defizite im Ernährungs- und Muskelstatus maskieren kann (18, 19).
Mangelernährung und Sarkopenie sind sowohl im stationären als auch im ambulanten Setting mit ungünstigeren klinischen Verläufen sowie einer erhöhten Morbidität und Mortalität assoziiert (20–23). Darüber hinaus steigt das Risiko für Stürze, Infektionen und postoperative Komplikationen, während gleichzeitig die körperliche Leistungsfähigkeit, Selbstständigkeit sowie die Lebensqualität abnehmen (23, 24).
Bedeutung der Muskulatur
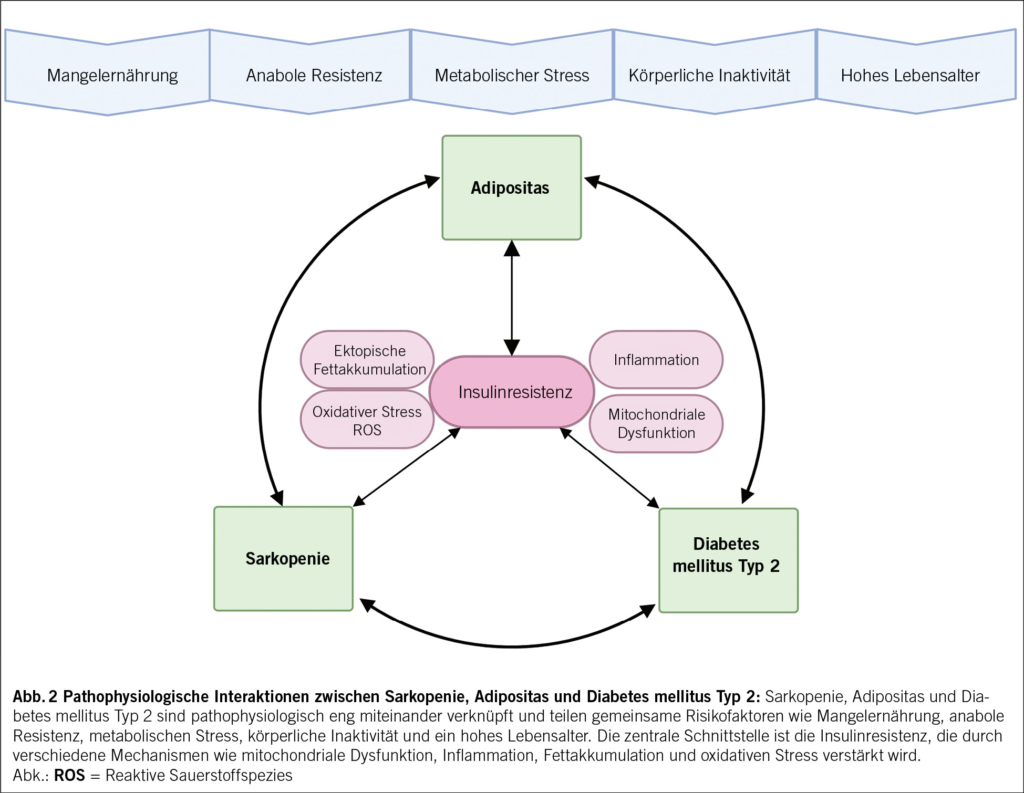
Die Muskulatur übernimmt zentrale Funktionen für Bewegung, Balance und Stabilität sowie die Unterstützung lebenswichtiger Organprozesse wie Atmung, Kreislauf und Verdauung. Darüber hinaus ist sie an metabolischen Prozessen, der interorganischen Kommunikation sowie an der Regulation des Immunsystems beteiligt (25). Insbesondere im höheren Lebensalter kommt der Skelettmuskulatur eine entscheidende Bedeutung für den Erhalt der funktionellen Kapazität und Selbstständigkeit zu (26). Sie fungiert als Speicher für Aminosäuren (Muskelprotein) und Glukose (Glykogen) und trägt damit wesentlich zur Aufrechterhaltung der Energie- und Nährstoffhomöostase bei (27, 28). Metabolischer Stress, eine unzureichende Energie- bzw. Nährstoffzufuhr sowie altersbedingte Faktoren wie anabole Resistenz, Bewegungsmangel und Muskelabbau fördern bei älteren Patient/-innen eine Dysbalance zwischen Muskelproteinsynthese und -degeneration und begünstigen so die Entstehung von Sarkopenie (17, 29).
Die Skelettmuskulatur spielt zudem eine Schlüsselrolle in der Glukosehomöostase: Sie ist verantwortlich für etwa 80 % der insulinvermittelten postprandialen Glukoseaufnahme und -verwertung. Damit zählt sie zu den bedeutendsten beeinflussbaren Faktoren im Kontext der Insulinresistenz und stellt ein zentrales therapeutisches Ziel sowohl bei T2DM als auch bei sarkopener Adipositas dar, wobei sich wesentliche pathophysiologische Mechanismen der Krankheitsbilder überschneiden (Abb. 2) (26). Die Insulinresistenz beeinträchtigt die Translokation der GLUT4-Transporter zur Zellmembran, wodurch die muskuläre Glukoseaufnahme limitiert wird. Parallel dazu führt die gestörte Aktivierung der insulinabhängigen Signaltransduktion – insbesondere der IRS-PI3K-Akt-mTOR-Achse – zur Suppression der Muskelproteinsynthese, während katabole Prozesse über den Ubiquitin-Proteasom-Weg verstärkt ablaufen (30). Zudem liegt bei der Sarkopenie und Insulinresistenz eine mitochondriale Dysfunktion vor, die sich in einer erhöhten Bildung reaktiver Sauerstoffspezies, gesteigertem oxidativem Stress und einer eingeschränkten ATP-Synthese äussert (31). Die mit der Insulinresistenz assoziierte gesteigerte Lipolyse und erhöhte zirkulierende Lipidkonzentrationen fördern eine ektope Fettakkumulation, insbesondere in der Leber und Muskulatur. Dies geht mit der Bildung lipotoxischer Metabolite (z. B. Diacylglycerole, Ceramide) sowie erhöhten Spiegeln proinflammatorischer Zytokine wie TNF-α, IL-6 und CRP einher, die katabole Prozesse in der Skelettmuskulatur verstärken und gleichzeitig anabole Signalwege hemmen (32, 33).
Assessment der Muskelgesundheit und des Ernährungszustandes
Ein frühzeitiges Assessment der Muskelgesundheit und des Ernährungszustandes ist entscheidend, um eine Verschlechterung detektieren und Interventionsmassnahmen initiieren zu können. Die Beurteilung der Muskelgesundheit erfordert sowohl die Bestimmung der Muskelmasse als auch die Erfassung der Muskelkraft und -funktion (17). Tab. 1 zeigt die von der EWGSOP2 festgelegten Grenzwerte zur diagnostischen Einordnung der Sarkopenie. Im klinischen Alltag gelten die Dual-Röntgen-Absorptiometrie (DXA) und die bioelektrische Impedanzanalyse (BIA) als bevorzugte Methoden zur Messung der Muskelmasse. Alternativ können bildgebende Verfahren wie Magnetresonanztomographie (MRT) oder Computertomographie (CT) eingesetzt werden (19). Im ambulanten bzw. hausärztlichen Setting kann die muskuläre Gesundheit durch einfache körperliche Untersuchungen, wie die Messung des Wadenumfangs in Kombination mit einer gezielten Anamnese (z. B. Schwierigkeiten beim Laufen, Aufstehen, Stürze), erfasst werden. Zudem kann der SARC-F-Fragebogen (Strength, assistance with walking, rising from a chair, climbing stairs, and falls) als Screening-Instrument eingesetzt werden (34). Zur funktionellen Beurteilung eignen sich die Messung der Gehgeschwindigkeit, der Faustschluss- oder Kniestreckkraft sowie standardisierte Tests wie der Chair-Rise-Test, der 400-Meter-Gehtest oder der Timed-Up-and-Go-Test (17).
Für das Assessment des Ernährungszustandes stehen verschiedene validierte Screening-Tools zur Verfügung, wie z. B. das Nutritional Risk Screening 2002 (NRS) (35) oder die Kurzversion des Mini Nutritional Assessment (MNA-SF) (36), das speziell für geriatrische Patient/-innen validiert wurde. Ergänzend dazu hat die Global Leadership Initiative on Malnutrition (GLIM) ein zweistufiges Diagnoseschema entwickelt, das an das Screening anschliesst und auch eine verminderte Muskelmasse als zentrales Kriterium erfasst (37).
Verlust der Muskelmasse durch GLP-1-RA
Bei älteren Patient/-innen geht eine Gewichtsreduktion häufig mit einem erhöhten Verlust von Muskelmasse und damit einem erhöhten Sarkopenie-Risiko einher (38). Ziel ist die Reduktion der Fettmasse bei gleichzeitigem Erhalt der fettfreien Masse (39). Es gibt Hinweise darauf, dass der Einsatz von GLP-1-RA im Rahmen der Gewichtsreduktion das Risiko für Sarkopenie potenziell erhöhen kann. Die Evidenzlage ist jedoch heterogen und methodisch limitiert, da viele Studien primär die Gewichtsreduktion betrachten und Parameter der Muskelmasse/-funktion nur selten systematisch erfassen. Zudem wird häufig die Veränderung der fettfreien Körpermasse erfasst, die vor allem aus Skelettmuskelmasse, aber auch aus Knochen- und Organmasse sowie Körperwasser besteht. Ohne standardisierte Messbedingungen können Hydratationsstatus, Ödeme oder körperliche Aktivität das Ergebnis verfälschen (6, 24). Einige Studien berichten über eine drastische Reduktion der fettfreien Masse von 25 bis 45 % des gesamten Gewichtsverlusts (13, 40, 41). Andere Studien zeigten, dass die Abnahme der Muskelmasse unter GLP-1-RA vergleichbar mit konventionellen nicht-medikamentösen Gewichtsreduktionsstrategien moderat ausfiel. Zudem deuteten diese Untersuchungen auch auf eine Verbesserung des Muskel-Fett-Verhältnisses und eine gesteigerte Muskelqualität hin, die durch eine verringerte intramuskuläre Fettinfiltration und verbesserte metabolische Funktion der Muskulatur bedingt waren (42, 43). Ein gewisser Verlust an Muskelmasse ist im Rahmen einer Gewichtsreduktion weitgehend unvermeidbar (44). Bei konventionellen Ansätzen durch Lebensstiländerungen liegt er allerdings moderat zwischen ca. 10 und 30 % des Gewichtsverlustes (45).
Nach dem Absetzen von GLP-1-RA, kommt es in der Regel zu einer relevanten Gewichtszunahme, wobei insbesondere die Fettmasse zunimmt. Im Vergleich zu konventionellen Massnahmen zur Gewichtsreduktion ist damit das Risiko für das sogenannte «Weight Cycling» erhöht, was langfristig die Entwicklung einer sarkopenen Adipositas begünstigen kann (25).
Ernährungs- und bewegungstherapeutische Interventionen
Bei älteren Patient/-innen ist eine ausgewogene, bedarfsgerechte Ernährung mit ca. 30 kcal/kg Körpergewicht/Tag und ≥ 1 g Protein/kg Körpergewicht/Tag anzustreben (39). Bei Patient/-innen mit Adipositas sollte zur Berechnung des Bedarfs anstelle des Ist-Gewichts das Referenzgewicht (entsprechend einem BMI von 25 kg/m2) oder das adjustierte Gewicht herangezogen werden (adjustiertes Gewicht = Referenzgewicht + 0,33 × [Ist-Gewicht – Referenzgewicht]) (46). Bei Patient/-innen, die im Screening ein Risiko oder eine manifeste Mangelernährung/Sarkopenie aufweisen, können weitere Massnahmen notwendig sein (Anreicherung der Nahrung, orale Trinknahrung, enterale/parenterale Ernährung) (47).
Eine individualisierte Nutzen-Risiko-Abwägung therapeutischer Massnahmen zur Gewichtsreduktion unter Berücksichtigung von Komorbiditäten und der Gesamtprognose ist essenziell. Wird eine Gewichtsreduktion als sinnvoll erachtet, sollte eine moderate Reduktion der Energiezufuhr um maximal 500 kcal pro Tag angestrebt werden, mit dem Ziel einer schrittweisen Gewichtsabnahme von etwa 0,25 bis 1 kg pro Woche (39). Eine Anbindung an eine:n gesetzlich anerkannte:n Ernährungsberater:in ist empfehlenswert.
Um die Muskelmasse und -funktion bestmöglich zu erhalten, ist ein kombinierter Therapieansatz aus ernährungs- und bewegungstherapeutischen Interventionen von zentraler Bedeutung (44, 48). Im Rahmen einer Behandlung mit GLP-1-RA kommt es häufig zu einer sehr starken Reduktion des Appetits, sodass die errechneten Ziele für Protein und Energie nicht erreicht werden. Dies ist bis zu einem gewissen Grad zu tolerieren, um die Gewichtsziele für die Kostendeckung durch die Krankenkassen zu sichern. Bei übermässigem Gewichtsverlust und erhöhtem Sarkopenierisiko sind Anpassungen der Therapie erforderlich, insbesondere hinsichtlich der Dosierung des GLP-1-RA, der Mahlzeitenzusammensetzung, der Portionsgrössen, des Mahlzeitenrhythmus sowie der körperlichen Aktivität.
Der Einfluss von körperlicher Aktivität auf den Gewichtsverlust ist gering, unabhängig von der Modalität (Krafttraining oder Ausdauertraining). Jedoch kann mit einem gezielten Training der Muskelabbau reduziert oder verhindert werden. Die körperliche Aktivität verbessert zudem die muskuläre Glukoseaufnahme, Inflammation und Insulinresistenz, welche mit Sarkopenie und T2DM einhergehen (49, 50). Ideal ist ein individuell adaptiertes Kraft- bzw. Resistenztraining, ergänzt durch Ausdauer-, Balance- und Flexibilitätsübungen zur Förderung von Funktionalität und kardiovaskulärer Gesundheit und unter Berücksichtigung der individuellen Voraussetzungen der Patient/-innen zeitgleich zum Behandlungsbeginn mit einem GLP-1-RA (18, 51, 52).
Valerie Haller 1
Dr. troph Carla Wunderle, PhD 1
Dr. med. Annic Baumgartner 1
Prof. Dr med. Philipp Schuetz, MD, MPH 1, 2
1 Medizinische Universitätsklinik, Kantonsspital Aarau, Tellstrasse 25, CH-5001 Aarau, Switzerland
2 University of Basel, Switzerland, Klingelbergstrasse 61, 4056 Basel, Switzerland
Copyright
Aerzteverlag medinfo AG
Medizinische Universitätsklinik, Kantonsspital Aarau
Tellstrasse 25
CH-5001 Aarau, Switzerland
Medizinische Universitätsklinik, Kantonsspital Aarau
Tellstrasse 25
CH-5001 Aarau, Switzerland
– Medizinische Universitätsklinik, Kantonsspital Aarau
Tellstrasse 25, CH-5001 Aarau, Switzerland
– University of Basel, Switzerland
Klingelbergstrasse 61
4056 Basel, Switzerland
Die Autorenschaft hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- GLP-1-RA sind ein neuer, wichtiger Baustein der multimodalen Therapie zur Gewichtsreduktion.
- Sie können insbesondere bei älteren Patient/-innen das Risiko für Sarkopenie erhöhen.
- Die Muskulatur ist für die funktionelle und metabolische Gesundheit essenziell.
- Entscheidend sind ein frühzeitiges Assessment des Ernährungsstatus und der Muskelgesundheit sowie eine interdisziplinäre Therapie aus Medikation, Ernährung und Bewegung.
1. SGED/SSED. Swiss Recommendations of the Society for Endocrinology and Diabetes (SGED/SSED) for the Treatment of Type 2 Diabetes Mellitus (2023). 2023.
2. Lincoff AM, Brown-Frandsen K, Colhoun HM, Deanfield J, Emerson SS, Esbjerg S, et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. New England Journal of Medicine. 2023;389(24):2221-32.
3. Krumholz HM, de Lemos JA, Sattar N, Linetzky B, Sharma P, Mast CJ, et al. Tirzepatide and blood pressure reduction: stratified analyses of the SURMOUNT-1 randomised controlled trial. Heart. 2024;110(19):1165-71.
4. Kosiborod MN, Verma S, Borlaug BA, Butler J, Davies MJ, Jon Jensen T, et al. Effects of Semaglutide on Symptoms, Function, and Quality of Life in Patients With Heart Failure With Preserved Ejection Fraction and Obesity: A Prespecified Analysis of the STEP-HFpEF Trial. Circulation. 2024;149(3):204-16.
5. Newsome PN, Sanyal AJ, Engebretsen KA, Kliers I, Østergaard L, Vanni D, et al. Semaglutide 2.4 mg in Participants With Metabolic Dysfunction-Associated Steatohepatitis: Baseline Characteristics and Design of the Phase 3 ESSENCE Trial. Aliment Pharmacol Ther. 2024;60(11-12):1525-33.
6. Neeland IJ, Linge J, Birkenfeld AL. Changes in lean body mass with glucagon-like peptide-1-based therapies and mitigation strategies. Diabetes Obes Metab. 2024;26 Suppl 4:16-27.
7. Sharma D, Verma S, Vaidya S, Kalia K, Tiwari V. Recent updates on GLP-1 agonists: Current advancements & challenges. Biomed Pharmacother. 2018;108:952-62.
8. Nauck MA, Petrie JR, Sesti G, Mannucci E, Courrèges JP, Lindegaard ML, et al. A Phase 2, Randomized, Dose-Finding Study of the Novel Once-Weekly Human GLP-1 Analog, Semaglutide, Compared With Placebo and Open-Label Liraglutide in Patients With Type 2 Diabetes. Diabetes Care. 2016;39(2):231-41.
9. Blundell J, Finlayson G, Axelsen M, Flint A, Gibbons C, Kvist T, et al. Effects of once-weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes, Obesity and Metabolism. 2017;19(9):1242-51.
10. Dhurandhar EJ, Maki KC, Dhurandhar NV, Kyle TK, Yurkow S, Hawkins MAW, et al. Food noise: definition, measurement, and future research directions. Nutrition & Diabetes. 2025;15(1):30.
11. Zhao X, Wang M, Wen Z, Lu Z, Cui L, Fu C, et al. GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects. Front Endocrinol (Lausanne). 2021;12:721135.
12. Nauck MA, Quast DR, Wefers J, Meier JJ. GLP-1 receptor agonists in the treatment of type 2 diabetes – state-of-the-art. Mol Metab. 2021;46:101102.
13. Wilding JPH, Batterham RL, Calanna S, Davies M, Van Gaal LF, Lingvay I, et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 2021;384(11):989-1002.
14. Cereda E, Pedrolli C, Klersy C, Bonardi C, Quarleri L, Cappello S, et al. Nutritional status in older persons according to healthcare setting: A systematic review and meta-analysis of prevalence data using MNA®. Clinical Nutrition. 2016;35(6):1282-90.
15. Schuetz P, Seres D, Lobo DN, Gomes F, Kaegi-Braun N, Stanga Z. Management of disease-related malnutrition for patients being treated in hospital. The Lancet. 2021;398(10314):1927-38.
16. Kaiser MJ, Bauer JM, Rämsch C, Uter W, Guigoz Y, Cederholm T, et al. Frequency of malnutrition in older adults: a multinational perspective using the mini nutritional assessment. J Am Geriatr Soc. 2010;58(9):1734-8.
17. Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31.
18. Salom Vendrell C, García Tercero E, Moro Hernández JB, Cedeno-Veloz BA. Sarcopenia as a Little-Recognized Comorbidity of Type II Diabetes Mellitus: A Review of the Diagnosis and Treatment. Nutrients. 2023;15(19).
19. Donini LM, Busetto L, Bischoff SC, Cederholm T, Ballesteros-Pomar MD, Batsis JA, et al. Definition and Diagnostic Criteria for Sarcopenic Obesity: ESPEN and EASO Consensus Statement. Obes Facts. 2022;15(3):321-35.
20. Felder S, Lechtenboehmer C, Bally M, Fehr R, Deiss M, Faessler L, et al. Association of nutritional risk and adverse medical outcomes across different medical inpatient populations. Nutrition. 2015;31(11-12):1385-93.
21. Hiura G, Lebwohl B, Seres DS. Malnutrition Diagnosis in Critically Ill Patients Using 2012 Academy of Nutrition and Dietetics/American Society for Parenteral and Enteral Nutrition Standardized Diagnostic Characteristics Is Associated With Longer Hospital and Intensive Care Unit Length of Stay and Increased In-Hospital Mortality. JPEN J Parenter Enteral Nutr. 2020;44(2):256-64.
22. Mijnarends DM, Luiking YC, Halfens RJG, Evers S, Lenaerts ELA, Verlaan S, et al. Muscle, Health and Costs: A Glance at their Relationship. J Nutr Health Aging. 2018;22(7):766-73.
23. Bianchi L, Ferrucci L, Cherubini A, Maggio M, Bandinelli S, Savino E, et al. The Predictive Value of the EWGSOP Definition of Sarcopenia: Results From the InCHIANTI Study. J Gerontol A Biol Sci Med Sci. 2016;71(2):259-64.
24. Prado CM, Landi F, Chew STH, Atherton PJ, Molinger J, Ruck T, et al. Advances in muscle health and nutrition: A toolkit for healthcare professionals. Clin Nutr. 2022;41(10):2244-63.
25. Prado CM, Phillips SM, Gonzalez MC, Heymsfield SB. Muscle matters: the effects of medically induced weight loss on skeletal muscle. Lancet Diabetes Endocrinol. 2024;12(11):785-7.
26. Lopez-Pedrosa JM, Camprubi-Robles M, Guzman-Rolo G, Lopez-Gonzalez A, Garcia-Almeida JM, Sanz-Paris A, et al. The Vicious Cycle of Type 2 Diabetes Mellitus and Skeletal Muscle Atrophy: Clinical, Biochemical, and Nutritional Bases. Nutrients. 2024;16(1).
27. Meyer C, Dostou JM, Welle SL, Gerich JE. Role of human liver, kidney, and skeletal muscle in postprandial glucose homeostasis. American Journal of Physiology-Endocrinology and Metabolism. 2002;282(2):E419-E27.
28. Wolfe RR. The underappreciated role of muscle in health and disease2. The American Journal of Clinical Nutrition. 2006;84(3):475-82.
29. Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L. Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease. J Am Med Dir Assoc. 2016;17(9):789-96.
30. Hong SH, Choi KM. Sarcopenic Obesity, Insulin Resistance, and Their Implications in Cardiovascular and Metabolic Consequences. Int J Mol Sci. 2020;21(2).
31. Liao T, Xiong L, Wang X, Yang S, Liang Z. Mitochondrial disorders as a mechanism for the development of obese Sarcopenia. Diabetology & Metabolic Syndrome. 2023;15(1):224.
32. Bandet CL, Tan-Chen S, Ali-Berrada S, Campana M, Poirier M, Blachnio-Zabielska A, et al. Ceramide analog C2-cer induces a loss in insulin sensitivity in muscle cells through the salvage/recycling pathway. Journal of Biological Chemistry. 2023;299(6):104815.
33. Perry BD, Caldow MK, Brennan-Speranza TC, Sbaraglia M, Jerums G, Garnham A, et al. Muscle atrophy in patients with Type 2 Diabetes Mellitus: roles of inflammatory pathways, physical activity and exercise. Exerc Immunol Rev. 2016;22:94-109.
34. Malmstrom TK, Miller DK, Simonsick EM, Ferrucci L, Morley JE. SARC-F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes. J Cachexia Sarcopenia Muscle. 2016;7(1):28-36.
35. Kondrup J, Rasmussen HH, Hamberg O, Stanga Z. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr. 2003;22(3):321-36.
36. Rubenstein LZ, Harker JO, Salvà A, Guigoz Y, Vellas B. Screening for undernutrition in geriatric practice: developing the short-form mini-nutritional assessment (MNA-SF). J Gerontol A Biol Sci Med Sci. 2001;56(6):M366-72.
37. Cederholm T, Jensen GL, Correia MITD, Gonzalez MC, Fukushima R, Higashiguchi T, et al. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clinical Nutrition. 2019;38(1):1-9.
38. Sargeant JA, Henson J, King JA, Yates T, Khunti K, Davies MJ. A Review of the Effects of Glucagon-Like Peptide-1 Receptor Agonists and Sodium-Glucose Cotransporter 2 Inhibitors on Lean Body Mass in Humans. Endocrinol Metab (Seoul). 2019;34(3):247-62.
39. Volkert D, Beck AM, Cederholm T, Cruz-Jentoft A, Hooper L, Kiesswetter E, et al. ESPEN practical guideline: Clinical nutrition and hydration in geriatrics. Clin Nutr. 2022;41(4):958-89.
40. Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B, et al. Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med. 2022;387(3):205-16.
41. McCrimmon RJ, Catarig AM, Frias JP, Lausvig NL, le Roux CW, Thielke D, et al. Effects of once-weekly semaglutide vs once-daily canagliflozin on body composition in type 2 diabetes: a substudy of the SUSTAIN 8 randomised controlled clinical trial. Diabetologia. 2020;63(3):473-85.
42. Pandey A, Patel KV, Segar MW, Ayers C, Linge J, Leinhard OD, et al. Effect of liraglutide on thigh muscle fat and muscle composition in adults with overweight or obesity: Results from a randomized clinical trial. J Cachexia Sarcopenia Muscle. 2024;15(3):1072-83.
43. Neeland IJ, Marso SP, Ayers CR, Lewis B, Oslica R, Francis W, et al. Effects of liraglutide on visceral and ectopic fat in adults with overweight and obesity at high cardiovascular risk: a randomised, double-blind, placebo-controlled, clinical trial. Lancet Diabetes Endocrinol. 2021;9(9):595-605.
44. Chomentowski P, Dubé JJ, Amati F, Stefanovic-Racic M, Zhu S, Toledo FGS, et al. Moderate Exercise Attenuates the Loss of Skeletal Muscle Mass That Occurs With Intentional Caloric Restriction–Induced Weight Loss in Older, Overweight to Obese Adults. The Journals of Gerontology: Series A. 2009;64A(5):575-80.
45. Chaston TB, Dixon JB, O‘Brien PE. Changes in fat-free mass during significant weight loss: a systematic review. Int J Obes (Lond). 2007;31(5):743-50.
46. Bischoff SC, Ockenga J, Eshraghian A, Barazzoni R, Busetto L, Campmans-Kuijpers M, et al. Practical guideline on obesity care in patients with gastrointestinal and liver diseases – Joint ESPEN/UEG guideline. Clinical Nutrition. 2023;42(6):987-1024.
47. Cederholm T, Bosaeus I. Malnutrition in Adults. N Engl J Med. 2024;391(2):155-65.
48. Manning KM, Hall KS, Sloane R, Magistro D, Rabaglietti E, Lee CC, et al. Longitudinal analysis of physical function in older adults: The effects of physical inactivity and exercise training. Aging Cell. 2024;23(1):e13987.
49. Kadoglou NP, Iliadis F, Angelopoulou N, Perrea D, Ampatzidis G, Liapis CD, et al. The anti-inflammatory effects of exercise training in patients with type 2 diabetes mellitus. Eur J Cardiovasc Prev Rehabil. 2007;14(6):837-43.
50. Conn VS, Koopman RJ, Ruppar TM, Phillips LJ, Mehr DR, Hafdahl AR. Insulin Sensitivity Following Exercise Interventions: Systematic Review and Meta-Analysis of Outcomes Among Healthy Adults. J Prim Care Community Health. 2014;5(3):211-22.
51. Batsis JA, Villareal DT. Sarcopenic obesity in older adults: aetiology, epidemiology and treatment strategies. Nat Rev Endocrinol. 2018;14(9):513-37.
52. Aguirre LE, Villareal DT. Physical Exercise as Therapy for Frailty. Nestle Nutr Inst Workshop Ser. 2015;83:83-92.
der informierte @rzt
- Vol. 15
- Ausgabe 9
- September 2025