- Hausärztliche Betreuung bei altersabhängiger Makuladegeneration
Die altersabhängige Makuladegeneration (AMD) ist eine der häufigsten Ursachen für einen schweren Sehverlust im Alter. Da viele Patient/-innen erst spät Symptome wahrnehmen, kommt der Früherkennung durch ophthalmologische Untersuchungen eine besondere Bedeutung zu. Hausärzt/-innen können hier einen entscheidenden Beitrag leisten, indem sie Screening-Termine anregen, modifizierbare Risikofaktoren wie Rauchen oder Bluthochdruck behandeln und Betroffene im Verlauf psychosozial begleiten. Auch das Home Monitoring – etwa durch das Amsler-Gitter oder digitale Tools wie Alleye (Oculocare medical Inc) – kann helfen, eine Form der AMD, welche zum Erhalt der Sehkraft regelmässige Injektionen erfordert, frühzeitig zu erkennen. Die AMD ist eine chronische Erkrankung, die nicht nur augenärztliche Therapie, sondern auch Motivation, Edukation und interdisziplinäre Koordination erfordert. Die enge Zusammenarbeit zwischen Hausarztpraxis und Ophthalmologie ist daher zentral, um Patient/-innen langfristig zu unterstützen und die Lebensqualität zu erhalten. Ein strukturierter Call to Action soll darüber hinaus die Rolle der Hausärzt/-innen durch gezielte Fortbildung, Delegation von Versorgungsaufgaben und Integration digitaler Gesundheitslösungen weiter stärken. Innovative Modelle wie das Schweizer Telemedizin-Projekt Augenmobil zeigen exemplarisch, wie eine verbesserte augenärztliche Versorgung hochaltriger und mobilitätseingeschränkter Patient/-innen umgesetzt werden kann.
Age-related macular degeneration (AMD) is one of the most prevalent causes of severe vision loss in the elderly. Due to its often asymptomatic onset and gradual progression, early detection through regular ophthalmological examinations is of particular importance. General practitioners are well positioned to contribute significantly by promoting screening, addressing modifiable risk factors such as smoking and cardiovascular disease, and offering psychosocial support over the course of the disease. Home monitoring strategies—such as the use of Amsler grids or validated digital tools like Alleye (Oculocare medical Inc) —can facilitate the early identification of neovascular AMD, for which timely initiation of intravitreal anti-angiogenic therapy is critical to preserving visual function. As a chronic and multifactorial condition, AMD requires not only ophthalmological treatment but also sustained patient engagement, education, and interdisciplinary coordination. Effective collaboration between primary care and ophthalmology is essential to ensure comprehensive, long-term support and to help maintain patients’ quality of life. A structured Call to Action aims to further strengthen the role of general practitioners through targeted education, delegation of care tasks, and integration of digital health solutions. Innovative initiatives such as the Swiss telemedical program Augenmobil exemplify how improved ophthalmic care can be delivered to elderly and mobility-impaired patients.
Keywords: Age-related macular degeneration (AMD), general practice, home monitoring, vision loss, interdisciplinary care
Sehen bedeutet Teilhabe: Warum AMD auch ein Thema für die Hausarztpraxis ist
Die altersabhängige Makuladegeneration (AMD) ist eine der häufigsten Ursachen für einen schweren Sehverlust im höheren Lebensalter (1). In der Schweiz ist sie für rund ein Drittel aller Erblindungen im Alter verantwortlich (2). Epidemiologische Studien zeigen, dass etwa 15–20 % der über 70-Jährigen und über 30 % der über 80-Jährigen von einer AMD betroffen sind (3, 4).
Die Erkrankung betrifft die zentrale Netzhaut (Makula) und beeinträchtigt zahlreiche alltagsrelevante Fähigkeiten: Lesen, das Erkennen von Gesichtern und Farben, das Zuordnen von Gegenständen (z.B. Speisen auf dem Teller) sowie feinmotorische Tätigkeiten wie Nähen oder Bastelarbeiten. Viele Patient/-innen berichten zudem über verlängerte Adaptionszeiten bei wechselnden Lichtverhältnissen, insbesondere beim Übergang in dunkle Umgebungen. In fortgeschrittenen Stadien ist auch das sichere Führen eines Fahrzeugs häufig nicht mehr möglich. Diese funktionellen Einschränkungen sind nicht selten für einen wesentlichen Verlust der Lebensqualität und Selbstständigkeit verantwortlich. Da die visuelle Autonomie gerade im höheren Lebensalter eine entscheidende Voraussetzung für soziale Teilhabe und psychisches Wohlbefinden darstellt, rückt die AMD zunehmend auch als psychosoziales Thema in den Fokus. Studien belegen eine erhöhte Prävalenz depressiver Symptome bei AMD-Betroffenen, insbesondere im Zusammenhang mit drohendem Autonomieverlust (5).
In der hausärztlichen Versorgung begegnet man täglich älteren Patient/-innen mit schleichender Sehverschlechterung. Symptome wie verzerrtes Sehen (Metamorphopsien) oder subjektive Leseschwierigkeiten sollten Anlass für eine zeitnahe ophthalmologische Abklärung sein. Hausärzt/-innen übernehmen hier eine wichtige Lotsenfunktion in der Früherkennung – niedrigschwellig, alltagsnah und im Vertrauen der Patient/-innen verankert.
Früherkennung beginnt in der Hausarztpraxis
Viele chronische Augenerkrankungen verlaufen initial asymptomatisch, weshalb sie häufig erst in einem fortgeschrittenen Stadium diagnostiziert werden. Auch die AMD wird von Betroffenen oftmals erst dann bemerkt, wenn bereits irreversible Schädigungen des zentralen Sehens eingetreten sind (6). Daher empfiehlt sich eine erste augenärztliche Untersuchung ab dem 50. Lebensjahr, gefolgt von regelmässigen Kontrollen in individuell festzulegenden Intervallen. Hausärzt/-innen können hier einen wichtigen Beitrag leisten, indem sie Patient/-innen proaktiv auf augenärztliche Vorsorgeuntersuchungen hinweisen. Dies gilt nicht nur für die AMD, sondern auch für andere chronisch-progrediente Augenerkrankungen wie das Glaukom oder die diabetische Retinopathie (7).
Ein besonderes Augenmerk sollte auf modifizierbare Risikofaktoren gelegt werden, die mit dem Fortschreiten der AMD assoziiert sind. Evidenz besteht insbesondere für das Rauchen, die arterielle Hypertonie, Fettstoffwechselstörungen, Schlafapnoe sowie eine unausgewogene Ernährung (8, 9). Durch gezielte Beratung können Hausärzt/-innen einen signifikanten präventiven Einfluss ausüben. Besonders effektiv sind Interventionen zum Rauchstopp sowie die Förderung einer mediterranen Ernährung – beides Massnahmen, die in Studien mit einer verzögerten Progression der Erkrankung assoziiert wurden (10).
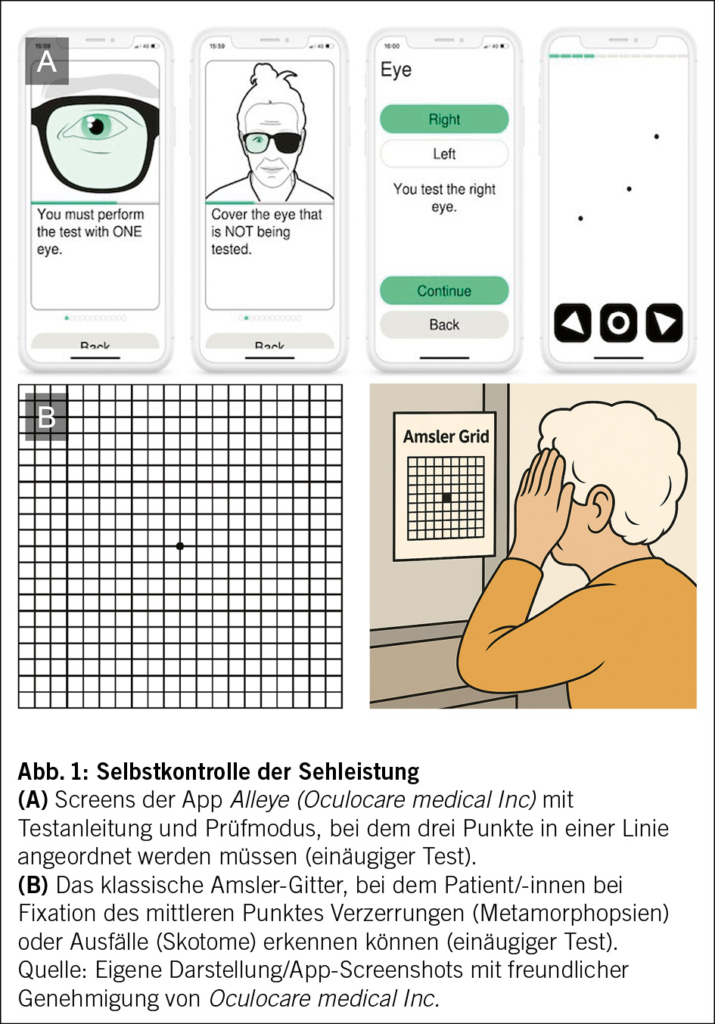
Auch im frühen Stadium der Erkrankung – in dem aktuell keine kausale Therapie zur Verfügung steht – ist die Verlaufskontrolle wichtig. Neben der Anpassung von Lebensstilfaktoren und der Einnahme von Nahrungsergänzungsmitteln auf Basis der AREDS-2-Formel kann insbesondere das frühzeitige Erkennen einer exsudativen Neovaskularisation (ehemals «feuchte» AMD) entscheidend für den Erhalt der Sehkraft sein. (11) Da das Auftreten einer exsudativ neovaskulären AMD mitunter asymptomatisch erfolgt und der Seheindruck vom gesunden Partnerauge manchmal kompensiert wird, kommt dem sogenannten «Home Monitoring» eine hohe Bedeutung zu. Mithilfe einfacher Instrumente wie
dem Amsler-Gitter oder validierter digitaler Lösungen wie der App Alleye (Oculocare medical Inc) können Patient/-innen ihre Sehleistung regelmässig selbst überprüfen – idealerweise wöchentlich und jedes Auge einzeln (Abb. 1) (12). Hausärzt/-innen können diesen Aspekt aktiv ansprechen und zur kontinuierlichen Selbstbeobachtung motivieren.
Chronische Erkrankung mit komplexem Verlauf
Die AMD ist eine chronisch-progrediente, derzeit nicht heilbare Erkrankung der zentralen Netzhaut. Sie beginnt mit zunehmenden Ablagerungen von Lipoproteinen zwischen der Netzhaut und ihrem versorgenden Kapillarbett der Aderhaut im frühen Erwachsenenalter. Im höheren Alter können sich bei einem Teil der Patient/-innen exsudativ neovaskuläre Veränderungen ausbilden (ehemals «feuchte» AMD genannt). Dabei kommt es infolge lokaler Hypoxie aufgrund der Lipidbarriere und inflammatorischen Reaktionen zur pathologischen Angiogenese mit Einwachsen fragiler Gefässe aus der Aderhaut in die Retina. Diese neovaskulären Gefässe neigen zu Leckagen und Blutungen und verursachen irreversible Schäden an der Makula. Die zugrundeliegenden pathophysiologischen Prozesse – Lipidablagerungen, chronische Entzündung und angiogene Signalwege – weisen Parallelen zu arteriosklerotischen Prozessen auf (13, 14).
Die exsudativ neovaskuläre (feuchte) AMD ist heute medikamentös behandelbar, jedoch ausschliesslich durch wiederholte Injektionen von VEGF-Inhibitoren in den Glaskörper. Diese intravitrealen Injektionen müssen in individuell angepassten Intervallen – oft alle vier bis acht Wochen – verabreicht werden, um eine Stabilisierung der Sehleistung zu erreichen. Trotz nachgewiesener Wirksamkeit kommt es in der Praxis jedoch häufig zu Therapieabbrüchen. Versorgungsforschungsdaten aus der Schweiz zeigen, dass bis zu 40 % der Patient/-innen die Behandlung innerhalb der ersten zwei Jahre abbrechen. Häufige Ursachen sind Therapiefrustration, logistischer Aufwand, Mobilitätsprobleme und mangelndes Verständnis für die Notwendigkeit einer kontinuierlichen Langzeitbehandlung. Ein zusätzlicher Faktor für Frustration kann darin liegen, dass bei vielen Patient/-innen mit exsudativ neovaskulärer (feuchter) AMD gleichzeitig Zeichen einer trockenen AMD fortbestehen, die trotz erfolgreicher Behandlung der feuchten Komponente im weiteren Verlauf zu einem progredienten Sehverlust führen können. Früher wurde die trockene Form als prognostisch günstiger angesehen; heute weiss man, dass auch diese Form unabhängig vom Ansprechen auf die VEGF-Therapie weiter fortschreiten kann. Hier können Hausärzt/-innen als erste Ansprechpersonen durch gezielte Edukation einen entscheidenden Beitrag leisten: Sie erklären den Krankheitsverlauf, verdeutlichen den Nutzen der Therapie und motivieren Patient/-innen zum konsequenten Wahrnehmen augenärztlicher Kontrollen und zur Nutzung von Home Monitoring. Ein frühzeitiges, empathisches Gespräch kann Therapieängste abbauen und die Therapietreue verbessern.
Ein typisches Fallbeispiel: Eine 82-jährige Patientin lebt allein, ist in ihrer Mobilität eingeschränkt und soll alle vier Wochen eine Injektionstherapie erhalten. Nach mehreren Terminen bricht sie die Therapie ab. Erst durch das gezielte Nachfragen ihres Hausarztes – der ihre Ängste und ihr begrenztes Verständnis für die Erkrankung erkennt – wird eine erneute augenärztliche Konsultation organisiert. In der Folge kann ein Transportdienst vermittelt und die Behandlung wieder aufgenommen werden.
Integrierte Versorgung für chronische Augenerkrankungen
Am Kantonsspital Winterthur (KSW) arbeiten wir an neuen Versorgungsansätzen, um AMD-Patient/-innen umfassender zu unterstützen. Neben der rein augenärztlichen Betreuung sind Dienstleistungen wie eine Low Vision Beratung, Alltagstraining bei Seheinschränkungen und spezielle Sprechstunden für Nebenwirkungen wie das trockene Auge integriert. Wichtig ist auch die Einbindung des sozialen Umfelds der meist hochbetagten Patient/-innen. Gerade in der medizinischen Betreuung älterer Menschen durch Hausärzt/-innen oder geriatrisch tätige Ärzt/-innen kommt der kontinuierlichen Begleitung und Koordination zwischen den Disziplinen eine besondere Bedeutung zu. Ein innovatives Beispiel für die Verbesserung der augenärztlichen Versorgung älterer, oft immobiler Patient/-innen ist das Schweizer Projekt Augenmobil. (Abb. 2) (16) Durch eine telemedizinisch unterstützte mobile Augenuntersuchung in Pflegeheimen ermöglicht das interprofessionelle Team eine frühzeitige Diagnostik und Therapieempfehlung direkt vor Ort und trägt so zur Schliessung bestehender Versorgungslücken bei.
Gerade die Schulung von Angehörigen – etwa zum Umgang mit Sehverlust im Alltag oder zu Hilfsmitteln – kann durch koordinierte Zusammenarbeit mit der Hausarztpraxis erleichtert werden. Eine interdisziplinäre Kommunikation auf Augenhöhe hilft, Brücken zu schlagen und Versorgungslücken zu schliessen.
Psychische Belastung erkennen und ansprechen
Die psychische Belastung bei fortgeschrittenen Formen der AMD ist erheblich: Studien zufolge entwickeln über 20 % der Betroffenen depressive Symptome, etwa 15 % erfüllen die Kriterien für eine Angststörung (17). Besonders gefährdet sind Patient/-innen mit signifikanter Einschränkung der Alltagskompetenz und dem drohenden Verlust ihrer Autonomie – etwa durch Wegfall des Lesens, Mobilitätsverlust oder soziale Isolation. Die psychischen Begleiterscheinungen stehen in engem Zusammenhang mit der wahrgenommenen Kontrolle über die Erkrankung und beeinflussen wiederum die Adhärenz zur Therapie sowie das subjektive Krankheitsverständnis (18).
Ein besonderes klinisches Phänomen ist das Charles-Bonnet-Syndrom: Es handelt sich um visuelle Halluzinationen, die im Zusammenhang mit stark eingeschränkter Sehleistung auftreten, bei gleichzeitig erhaltener Realitätsprüfung. Die Halluzinationen sind meist nicht angstbesetzt, reichen jedoch von einfachen geometrischen Mustern bis zu komplexen Szenen. Viele Patient/-innen sprechen das Phänomen aus Scham oder Angst vor einer psychiatrischen Fehldiagnose nicht von sich aus an (19). Eine proaktive ärztliche Ansprache kann hier entlastend wirken und zur Normalisierung beitragen.
Am KSW führen wir systematische Screenings mithilfe validierter Kurzfragebögen durch, um affektive Symptome frühzeitig zu erkennen und gezielt weiterzuleiten. Eine vergleichbare Sensibilität kann auch in der hausärztlichen Praxis etabliert werden – häufig genügt bereits ein kurzes, empathisches Nachfragen im Gespräch, um einen Dialog über psychisches Befinden anzuregen und weitere Hilfen in die Wege zu leiten.
Was Hausärzt/-innen konkret tun können
Neben der frühzeitigen Identifikation typischer Symptome wie Sehverlust, Verzerrungen (Metamorphopsien) oder Leseschwierigkeiten durch gezielte Anamnese können Hausärzt/-innen wesentlich zur Prävention und Verlangsamung des Fortschreitens der AMD beitragen. Im Mittelpunkt stehen dabei modifizierbare Risikofaktoren:
• Rauchstoppberatung
• Behandlung kardiovaskulärer Risikofaktoren (z. B. Blutdruck, Dyslipidämie, obstruktive Schlafapnoe)
• Ernährungsberatung: Förderung einer mediterranen Diät und ggf. Information zu Nahrungsergänzungsmitteln mit AREDS-2-Basis (z. B. Vitalux®, ICaps®, Ocuvite®, MacuShield®)
Darüber hinaus sollten Hausärzt/-innen das Thema Home Monitoring aktiv adressieren. Bereits ein kurzes Nachfragen – etwa: «Testen Sie Ihre Augen regelmässig zu Hause?» – kann Patient/-innen motivieren, einfache Selbsttests wie das Amsler-Gitter oder digitale Anwendungen wie Alleye wöchentlich durchzuführen. Diese Massnahmen ermöglichen eine frühzeitige Erkennung der Umwandlung in eine feuchte AMD, oft noch vor dem Auftreten subjektiver Symptome (20).
Ein erhöhtes Risiko für psychische Komorbiditäten bei AMD-Patient/-innen ist gut dokumentiert. Beeinträchtigungen des Sehens gehen häufig mit Ängsten, Depressionen und einem Verlust an Selbstwirksamkeit einher. Umgekehrt können depressive Symptome die Therapietreue und damit auch den Behandlungserfolg negativ beeinflussen. Hausärzt/-innen sind durch ihre kontinuierliche Betreuung in einer idealen Position, um psychische Belastungen frühzeitig zu erkennen und geeignete Unterstützungsangebote zu vermitteln (21).
Auch die Adhärenz zur intravitrealen Injektionstherapie profitiert von der hausärztlichen Begleitung. Eine niederschwellige Ansprache möglicher Hürden – sei es Angst, Erschöpfung, Unverständnis oder logistische Belastung – kann helfen, Therapieabbrüche zu vermeiden.
Call to Action: Handlungsempfehlungen für die Hausärztliche Praxis
Hausärzt/-innen spielen eine Schlüsselrolle in der Betreuung von Patient/-innen mit AMD. Um diese Rolle noch besser auszufüllen, sind gezielte Massnahmen erforderlich. Ein zentraler Ansatzpunkt liegt in der Verankerung geriatrisch-ophthalmologischer Inhalte in Fortbildungsangeboten für Hausärzt/-innen. So könnten praxisnahe, interdisziplinäre Weiterbildungsreihen entwickelt werden, die Aspekte wie Früherkennung, Home Monitoring, Motivation zur Injektionstherapie und psychosoziale Begleitung vermitteln (22).
Darüber hinaus kann die Integration neuer Rollen in der Primärversorgung die Versorgungssituation verbessern. Speziell geschultes Praxispersonal, etwa medizinische Praxisassistent/-innen mit Zusatzausbildung in der Augenvorsorge oder im geriatrischen Fallmanagement, könnte Ärzt/-innen gezielt entlasten und eine kontinuierliche Patientenbegleitung sicherstellen (23). Studien zeigen, dass dies gerade in der Betreuung multimorbider älterer Menschen einen wichtigen Beitrag leisten kann.
Schliesslich bietet auch die gezielte Nutzung digitaler Anwendungen grosse Chancen. Durch Einbettung in hausärztliche Prozesse, klare Verantwortlichkeiten und die Anbindung an bestehende Praxissoftware kann das AMD-Monitoring effektiv unterstützt werden (24). Langfristig sollte zudem die Entwicklung entsprechender Kompetenzen in die medizinische Ausbildung integriert werden (22). Die aktive Einbindung von Patient/-innen selbst als Partner/-innen in der Versorgung gilt dabei als zentraler Erfolgsfaktor für eine nachhaltige, patientenzentrierte Versorgung (25).
Fazit
Die altersabhängige Makuladegeneration ist eine chronische, multifaktorielle Erkrankung mit hoher Prävalenz und tiefgreifenden Auswirkungen auf das Leben älterer Menschen. Die Rolle der Hausarztpraxis geht über die reine Früherkennung hinaus: Sie kann Brücken schlagen zwischen medizinischer Therapie, psychosozialer Begleitung und alltagspraktischer Unterstützung. Durch gezielte Ansprache von Risikofaktoren, Förderung von Selbstmanagement (z. B. Home Monitoring) und psychosoziale Aufmerksamkeit können Hausärzt/-innen wesentlich zur Stabilisierung der Sehleistung und zur Lebensqualität beitragen. Eine enge, interdisziplinäre Zusammenarbeit mit der Ophthalmologie ist dabei zentral. Wer sieht, bleibt selbstbestimmt – und wer begleitet, stärkt diesen Erhalt an Autonomie.
Copyright
Aerzteverlag medinfo AG
Augenklinik – Kantonsspital Winterthur KSW
Brauerstrasse 15
8400 Winterthur
Chefarzt und Klinikleiter
Augenklinik Kantonsspital Winterthur
Brauerstrasse 15
8400 Winterthur
Augenmobil AG
Engelstrasse 6
8004 Zürich
Lucas M. Bachmann ist CEO und Verwaltungsratspräsident von Oculocare und Verwaltungsrat bei Augenmobil.
- AMD ist häufig: Rund ein Drittel der über 80-Jährigen ist betroffen.
- Frühes ophthalmologisches Screening ab dem 50. Lebensjahr sollte aktiv empfohlen werden.
- Home Monitoring (Amsler-Gitter, Alleye) unterstützt die frühzeitige Erkennung therapiebedürftiger Veränderungen.
- Die AMD ist eine chronische, progrediente Erkrankung, die eine kontinuierliche medizinische Betreuung sowie psychosoziale und edukative Begleitmassnahmen erfordert.
- Hausärzt/-innen können durch Gespräche und Unterstützung die Therapietreue bei intravitrealer Injektionstherapie fördern.
- Das Charles-Bonnet-Syndrom sowie psychische Begleiterkrankungen wie Depressionen und Angststörungen sollten frühzeitig und gezielt von medizinischem Fachpersonal thematisiert werden.
- Ein strukturierter Call to Action empfiehlt, die Rolle der Hausärzt/-innen durch gezielte Fortbildungsangebote, delegierbare Versorgungsaufgaben und digitale Lösungen weiter zu stärken.
1. Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health. 2014;2(2):e106–116.
2. Schweizerische Stiftung für blinde und sehbehinderte Menschen (SZBLIND). Jahresbericht 2023.
3. Rudnicka AR, Kapetanakis VV, Jarrar Z, et al. Incidence of late-stage age-related macular degeneration in European populations: the European Eye Epidemiology (E³) Consortium. Ophthalmology. 2015;122(7):1480–1488.
4. Holz FG, Strauss EC, Schmitz-Valckenberg S, van Lookeren Campagne M. Geographic atrophy: clinical features and potential therapeutic approaches. Ophthalmology. 2014;121(5):1079–1091.
5. Casten RJ, Rovner BW. Depression in age-related macular degeneration. J Vis Impair Blind. 2008;102(10):591–599.
6. García-Layana A, Cabrera-López F, García-Arumí J, Arias-Barquet L, Ruiz-Moreno JM. Early and intermediate age-related macular degeneration: update and clinical review. Clin Interv Aging. 2017;12:1579–1587.
7. Jonas JB, Aung T, Bourne RR, et al. Glaucoma. Lancet. 2017;390(10108):2183–2193.
8. Chakravarthy U, Wong TY, Fletcher A, et al. Clinical risk factors for age-related macular degeneration: a systematic review and meta-analysis. BMC Ophthalmol. 2010;10:31.
9. Alshaikhsalama AM, Alsoudi AF, Wai KM, et al. Association between Obstructive Sleep Apnea and Age-related Macular Degeneration Development and Progression. Ophthalmology Retina. 2024.
10. Merle BMJ, Silver RE, Rosner B, et al. Dietary patterns and risk of age-related macular degeneration: a review. JAMA Ophthalmol. 2019;137(3):275–281.
11. Chew EY, Clemons TE, Agrón E, et al. Long-term Outcomes of Adding Lutein/Zeaxanthin and w-3 Fatty Acids to the AREDS Supplements on Age-Related Macular Degeneration Progression: AREDS2 Report 28. JAMA Ophthalmol. 2022;140(7):692–698.
12. Faes L, Bachmann LM, Sim DA, et al. Mobile health application for self-monitoring of vision in age-related macular degeneration: a validation study. Clin Exp Ophthalmol. 2019;47(4):581–588.
13. Curcio CA, Johnson M, Huang JD, et al. Aging, age-related macular degeneration, and the response-to-retention of apolipoprotein B-containing lipoproteins. Prog Retin Eye Res. 2009;28(6):393–422.
14. Bhutto I, Lutty G. Understanding age-related macular degeneration (AMD): relationships between the photoreceptor/retinal pigment epithelium/Bruch’s membrane/choriocapillaris complex. Mol Aspects Med. 2012;33(4):295–317.
15. Finger RP, Wiedemann P, Blumhagen F, et al. Treatment patterns, visual acuity and quality of life outcomes of the WAVE study – a non-interventional study of ranibizumab treatment for neovascular age-related macular degeneration in Germany. Acta Ophthalmol. 2013;91(6):540–546.
16. Bachmann BC, Bachofner M, Mickan S, et al. Frequency of Eye Diseases in Residents of Nursing Homes – 1-Year Results of a Novel Telemedicine Service in Switzerland. Klin Monbl Augenheilkd. 2022;239(4):610–614. doi:10.1055/a-1778-4782.
17. Tran E, Maher A, Basilious A, Malvankar-Mehta M. Prevalence of anxiety and depression symptoms in age-related macular degeneration patients: A systematic review and meta-analysis. Arch Ment Health. 2025;10.4103/amh.amh_80_24.
18. Rovner BW, Casten RJ. Neuropsychiatric aspects of age-related macular degeneration. Int Rev Psychiatry. 2002;14(1):67–75.
19. Teunisse RJ, Cruysberg JR, Hoefnagels WH, et al. Visual hallucinations in psychologically normal people: Charles Bonnet’s syndrome. Lancet. 1996;347(9004):794–797.
20. AREDS2-HOME Study Research Group. Randomized trial of a home monitoring system for early detection of choroidal neovascularization home monitoring of the Eye (HOME) study. Ophthalmology. 2014;121(2):535–544.
21. van der Aa HP, van Rens GH, Comijs HC, et al. Stepped-care to prevent depression and anxiety in visually impaired older adults: a randomized controlled trial. Psychol Med. 2015;45(1):143–155.
22. Masud T, et al. A scoping review of the changing landscape of geriatric medicine in undergraduate education. European Geriatric Medicine. 2021.
23. Phi NTT, et al. Cumulative burden of digital health technologies for patients with multimorbidity. JAMA Network Open. 2025;8(4):e257288.
24. Kowatsch T, et al. Success factors and measures for scaling patient-facing digital health technologies. BMC Health Serv Res. 2025;25:632.
25. Bourke S, et al. The power of public and patient involvement in healthcare innovation. Nat Rev Bioeng. 2025.
der informierte @rzt
- Vol. 15
- Ausgabe 6
- Juni 2025