- Herzinsuffizienz und Eisenmangel
In diesem Beitrag möchten wir nach einer kurzen Einleitung die Pathophysiologie und eine Definitions-Präzisierung des Eisenmangels besprechen, dies allgemein und bei der Herzinsuffizienz (HI). Zudem werden wir eine kurze Literaturübersicht zur intravenösen Eisentherapie bei der HI wiedergeben. Die Diagnosekriterien des Eisenmangels bei kardiovaskulären Erkrankungen stehen nicht final fest. In einem weiteren Abschnitt wird die Frage behandelt: «Besser keine Eisensubstitution unter einem SGLT2-Hemmer?» Das Thema des Eisenmangels ist bei der Betreuung von HI-Patienten in der hausärztlichen und kardiologischen Sprechstunde wichtig.
In this article, after a brief introduction, we would like to discuss the pathophysiology and a definitional specification of iron deficiency, both in general and in heart failure (HF). We will also provide a brief literature review on intravenous iron therapy in HI. The diagnostic criteria for iron deficiency in cardiovascular disease have not been finalised. In a further section the question will be addressed: ‘Is it better not to use iron substitution with an SGLT2 inhibitor?’ The topic of iron deficiency is important in the care of HI patients in GP and cardiological consultations.
Key words: Heart failure, iron deficiency, ferritin, transferrin saturation, intravenous iron, SGLT2-Inhibitor and iron
Einleitung, Grundlagen
Die Herzinsuffizienz (HI) ist eine chronische Erkrankung, von der schätzungsweise 1 bis 2 % der Weltbevölkerung und bis zu 10 % der Patienten ab 65 Jahren betroffen sind. Bei Patienten mit HI hat ein Eisenmangel eine geschätzte Prävalenz von 30–83%, oft ohne begleitende Anämie. Der Eisenmangel ist die häufigste Mangelerkrankung der Menschen und weltweit die häufigste Ursache einer Anämie. Eisen ist essentiell für die Funktion von: Hämoglobin, Myoglobin, Mitochondrien, Immunsystem, Enzymen und Hormonen. Ein Eisenmangel verstärkt die HI-Symptome, erhöht die HI-Hospitalisationsrate, verschlechtert die Nierenfunktion und die Gesamtmortalität; dies mit und ohne begleitende Anämie. Letztere tritt mit einer Verzögerung von 6-8 Wochen in 30-50% der Patienten mit Eisenmangel auf (1-3).
Diagnose/Differentialdiagnose:
Die Diagnosestellung und Therapie eines Eisenmangels bei einer HI sind leider im Alltag immer noch selten. Nach einer retrospektiven Studie im Jahre 2019 wurden bei 10 381 Klinikeinweisungen wegen HI (HFrEF, HFpEF) nur 158 Patienten bez. Eisenmangel abgeklärt: davon 109x Eisenmangel nach Leitlinien und letztendlich 23 Patienten intravenös behandelt (3). Im Schwedischen HI-Register wurde diese Untersuchung 2021 bei 21 496 Patienten nur bei ¼ der Patienten durchgeführt, von diesen hatte ca. 50 % einen Eisenmangel; nur 1 von 5 erhielt eine Substitution (4).
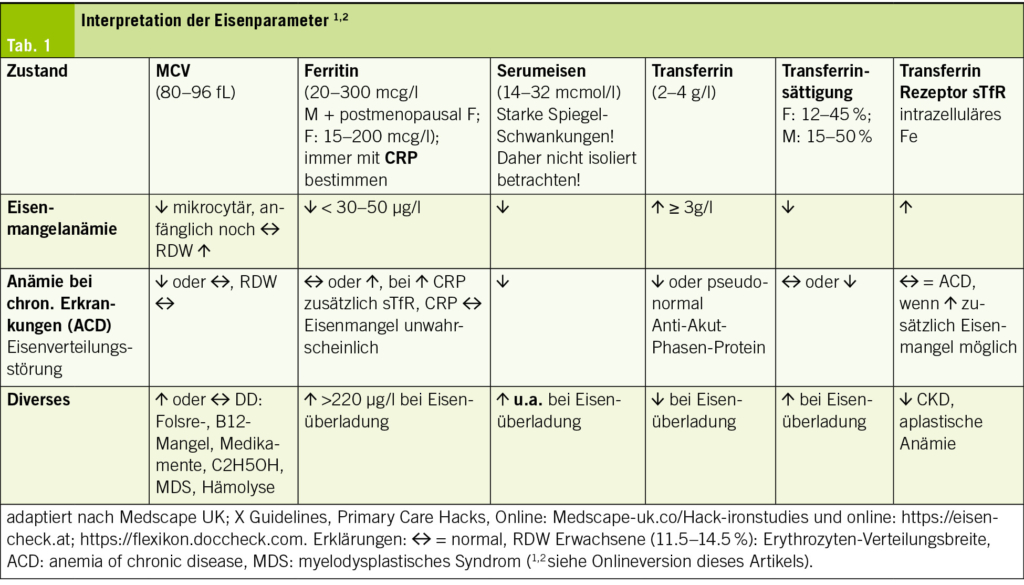
Neben einem Diff.-Blutbild mit Hb, Hkt, inkl. Ec-Indizes (MCV, MCH, MCHC), dem Serum-Ferritin und der Transferrinsättigung (TSAT), gehört ein CRP zur primären Abklärung. Bei einer Anämie können zusätzlich die Retikulozytenzahl, die RDW (Ec-Verteilungsbreite) sowie das Ret-Hb bestimmt werden. Die RDW kann zusammen mit dem MCV zur DD der Anämie genutzt werden: Eisenmangelanämie (MCV↓, RDW↑). Das Ret-Hb ist ein früher Marker eines funktionellen Eisenmangels. Bei Unklarheit kann die Bestimmung des Transferrin-Rezeptors (sTfR) bestimmt werden (Tab. 1) – vgl. Onlineversion des Artikels.
Primär ist diese hyporegenerative Anämie normochrom, normozytär, später bei defizienter Erythropoese hypochrom, mikrozytär (MCV, MCH). Die Retikulozyten sind vermindert. Zusätzlich findet man als Ausdruck einer ineffektiven Erythropoese eine Anisozytose (RDW), eine Poikilozytose und Anulozyten. Evtl. kein Eisen im Knochenmark. Das Serumferritin ist bei der Eisenmangelanämie erniedrigt – vgl. dazu funktionellen und absoluten Eisenmangel.
Zur DD einer hyporegenerativen Anämie bedarf es weiterer Laborparameter wie: Kreatinin, e-GFR, Leberwerte, Vit. B12 mit Holo-Transcobalamin und Folsäure (makrozytäre hyperchrome Anämie: MCV↑, MCH n -↑, RDW↑). Sind diese Vitamine normal oder erhöht, so bedarf es einer hämatologischen Abklärung (Myelodysplastisches Syndrom, schwerer Leberschaden). Sind die Ec-Indizes, Ferritin, Vit.B12 u. Folsäure normal, so ist die DD gross: renale Anämie bei CKD, Anämie bei chron. Erkrankungen (ACD), Knochenmarkserkrankungen, Leukämie, Multiples Myelom, Lymphom, Tumoranämie, endokrine Störungen, Leberleiden.
Tabelle 1 vermittelt die verschiedenen wichtigen Labor-Parameter, welche bei der Frage nach einer Eisenstoffwechselstörung primär abgeklärt werden. Dafür sollte die Blutentnahme morgens nüchtern durchgeführt werden, kann doch eine Nahrungsaufnahme kurzfristig die Transferrinsättigung (TSAT) erhöhen. Auch sollte man diese Parameter nicht während einer akuten Erkrankung bestimmen, so könnte die TSAT falsch tief sein.
Bei einer hyperregenerativen Anämie mit erhöhten Retikulozyten muss primär eine Hämolyse (LDH↑, indirektes Bilirubin↑, Haptoglobin↓) und eine akute Blutungsanämie ausgeschlossen werden. Man findet diese auch in einer Therapie-Erholungsphase. Die Anamnese ist auch hier besonders wichtig. Man unterscheidet einen funktionellen von einem absoluten Eisenmangel – vgl. www.onkopedia.com/de/onkopedia/guidelines/eisenmangel-und-eisenmangelanaemie/@@guideline/html/index.html
Funktioneller Eisenmangel: Die Eisenreserve des Körpers ist hier nicht aufgebraucht, aber die Freisetzung des Eisens aus dem Speicher ist beeinträchtigt.
Einen solchen findet man bei Patienten mit Infektionen, chronischen Entzündungen, autoimmunen Erkrankungen, CKD, Leberleiden, fortgeschrittenen Tumorleiden, Alkoholexzess = Anämie bei chronischen Erkrankungen (ACD). Diese ist bei einem Teil der Patienten hypochrom, oft jedoch normochrom, normozytär ohne Anisozytose (MCV+MCH normal, RDW normal). Die Ursache ist multifaktoriell und führt zu einer verminderten Erythrozytenproduktion, d. h. die Zahl der Retikulozyten ist niedrig. Zytokine (Interleukin 1, TNF-α, γ-Interferon) werden im Rahmen chronischer Erkrankungen verstärkt freigesetzt und führen zur reduzierten Empfindlichkeit der Erythropoesevorläuferzellen auf Erythropoetin.
Da bei einer Herzinsuffizienz (HI) eine systemische Entzündung besteht, wird vor allem durch Interleukin-6 vermehrt Hepcidin in der Leber gebildet. Dies bewirkt eine Eisenresorptionsstörung im Duodenum und oberen Jejunum durch eine blockierte Freisetzung aus den Enterozyten und den retikulo-endothelialen Makrophagen – «Hepcidin-Block» – z.B. aus Leber und Milz. Kann die Entzündung gemildert werden, so wird im Serum Hepcidin und Ferritin wieder gesenkt. Dies führt zu einer Erhöhung des bioreaktiven zytosolischen Fe2+ und einer Verbesserung des funktionellen Eisenmangels. Es besteht dabei keine Erythropoetin-Resistenz und eine Eisensubstitution ist nicht erforderlich. Diese Eisenverteilungsstörung bewirkt trotz ausreichendem Depoteisen einen Eisenmangel an der erythropoetischen Vorläuferzelle.
Ferritin ist ein Akutphasen-Protein und kann bei Infekten bzw. einer akuten oder chronischen Erkrankung mit Entzündung (hsCRP↑), CKD, HI, Lebererkrankung, Alkohol-Exzess, Krebs pseudonormal bis erhöht sein, obwohl die Eisenspeicher vermindert bis leer sind. Ferritinwerte > 300ug/l schliessen auch bei einer chronischen Entzündung einen Eisenmangel aus. Bei akuten und chronischen Entzündungen kann die Transferrinsättigung trotz normaler Eisenspeicher erniedrigt sein. Der sTfR, der lösliche Transferrinrezeptor, hat eine der Transferrinsättigung (TSAT,TfS) vergleichbare diagnostische Wertigkeit, ist aber im Unterschied zur TfS auch bei der ACD ein Indikator des Funktionseisens, da er nicht durch eine Entzündung beeinflusst wird. Besteht bei der ACD ein Mangel an Funktionseisen, so ist der sTfR erhöht; ebenso bei einer gesteigerten Erythropoese.
Ein funktioneller Eisenmangel reagiert auf eine intravenöse Eisen (Fe³+)-Substitution; nicht aber auf eine orale Substitution (1, 2).
Absoluter Eisenmangel: Die Eisenreserve des Körpers ist aufgebraucht. Dies findet man u.a. bei einer okkulten GI-Blutung unter Plättchenhemmern oder Antikoagulanzien; einer langen Einnahme eines Protonenhemmers/Antazida – die Eisen-Resorption ist durch den pH-Anstieg gestört; chronisch hoher Schwarztee- oder Kaffee-Konsum – die Polyphenole hemmen die Resorption im Duodenum; Kalziumantagonisten – blockieren die Transportkanäle in den Membranen von Enterozyten; Eisenmangel in der Ernährung (kein Fleisch, viel Soja u.a.) und gastrointestinale Neoplasien mit Sickerblutungen (1,2). Hepcidin wird herunterreguliert und der Transferrin-Rezeptor 1 (transmembranöses Transportprotein für Transferrin) hochreguliert, um die Eisenaufnahme in eine Zelle zu erleichtern; gleichzeitig wird Ferritin abgebaut, wodurch sequestriertes Eisen aus intrazellulären Speichern freigesetzt wird. Niedriges Hepcidin und Ferritin und hohe Spiegel des Transferrins und Transferrin-Receptor 1 (TfR1) bei einer tiefen Transferrinsättigung (TSAT) im zirkulierenden Blut werden als verlässliche Parameter für einen Eisenmangel angesehen (Tab. 1). Ein Ferritinwert <15ug/l bestätigt den totalen Eisenmangel. Es besteht eine mikrozytäre hypochrome Anämie (MCV↓, MCH↓), die Erythropoese ist hypoproliferativ mit tiefen Retikulozyten.
Beim absoluten Eisenmangel kann eine Verbesserung durch eine orale (Fe²+)- oder intravenösen Eisen (Fe³+)- Substitution erfolgen, wobei letztere deutlich rascher wirksam ist. Die Resorptionsrate bei oralen Fe²+-Salzen beträgt lediglich 10%. Oral wird bei einer einmal täglichen Einnahme ≥60mg/die, diese nüchtern alle 2 Tage empfohlen, dies wegen kurzfristigem Hepcidin-Anstieg/Abfall. Eine gleichzeitige Einnahme von Vitamin C (Orangensaft) fördert, eine gleichzeitige Kalziumtablette verzögert die Resorption. Auch dürfen nicht zeitgleich Kaffee, Tee, Milch, Antazida, Oxalate und Phosphate eingenommen werden.
Eine orale Eisensubstitution ist bei einer HI mit einer LV-EF ≤50% wegen erwähnter Mechanismen und dem funktionellen Eisenmangel nach der sehr kleinen IRON-HF Studie betreffend Leistungsverbesserung nicht effektiv. Die intravenöse Eisenzufuhr ist bei der Verbesserung der Funktionsfähigkeit (VO2max) überlegen. Die Korrektur der Anämie schien jedoch zwischen der Eisengabe in Tablettenform und der iv. Eisengabe ähnlich zu sein (5). In der IRONOUT-HF Studie – der einzigen grossen randomisierten kontrollierten Studie bei Patienten mit HFrEF und Eisenmangel – verbesserte orales Eisenpolysaccharid die körperliche Leistungsfähigkeit nicht und erreichte in dieser Publikation bei der Mehrheit der Patienten über 16 Wochen keine Eisenrepletion (6). Bei einem funktionellen Eisenmangel wird oral aufgenommenes Eisen sehr langsam resorbiert, da es durch den «Hepcidinblock» abgefangen wird, bevor es an die Zielorgane gelangt. Eine optimale Therapie-Antwort auf eine orale Gabe liegt vor bei: Anstieg der Transferrinsättigung, der Retikulozyten und der sTfR, dann Zunahme des Hb-Werts, dann Normalisierung des Ferritins (>100ug/l).
Klinik
Neben einer Herzinsuffizienz haben Schwangere, Hochleistungssportler und alte Leute häufig einen Eisenmangel. Anamnestisch spielen bei Letzteren mögliche Blutungen die wichtigste Rolle. Weitere Möglichkeiten sind die Ernährung, gewisse Medikamente, Alkoholismus, Infekte und verschiedene chron. Erkrankungen. Klinisch kommt es bei einem Eisenmangel zu multiplen Symptomen wie z.B. Müdigkeit, Abgeschlagenheit, Dyspnoe, Infektanfälligkeit, Schwindel, Kopfschmerzen, Schlafstörung, Depression. Ein Eisenmangel ist prognostisch ungünstig, dies unabhängig von einer Anämie, und führt zu einer schlechten Lebensqualität.
Aktuelle Guidelines
Gemäss den ESC HI-Guidelines 2021 besteht ein Eisenmangel bei einer HI bei einem Ferritin <100ug/l oder einem Ferritin von 100-299ug/l und einer Transferrin Sättigung <20%. Bei einem Infekt mit erhöhtem CRP ist das Ferritin als Akut-Phasenprotein, wie bereits erläutert, erhöht und die Aussage betreffend Ferritin somit eingeschränkt. Bei HI-Patienten sollte nach den Leitlinien eine regelmässige Kontrolle (alle 2-3 Monate) auf das Vorliegen eines potenziellen Eisenmangels und einer Anämie erfolgen (IC-Indikation) (7). Dieses Screening (Blutbild, Serumferritin, TSAT) sollte bei einer HI auch vor nicht kardialen Eingriffen durchgeführt werden (Tab. 1).
Die iv. Eisen-Therapie hat nach den 2023 Focused Update ESC HI-Guidelines bei der symptomatischen HI (LVEF <50%) mit Eisenmangel zur Verbesserung der Symptome und Erhöhung der Lebensqualität neu eine IA-Indikation (8). Eine iv.-Eisen(III)-Carboxymaltose (FCM) oder Eisen(III)-Derisomaltose (FDI) Therapie bei symptomatischen Patienten mit HFrEF und HFmrEF sowie Eisenmangel sollte in Betracht gezogen werden, um das Risiko einer HI-Hospitalisation zu verringern (IIa A) (8).
Die Transferrinsättigung (TSAT, TfS), ein Marker für Eisenmangel, spiegelt sowohl die Serumkonzentrationen von Eisen als auch von Transferrin wider. TSAT ist anfällig für Veränderungen in jedem dieser Biomarker. Kürzlich publizierte Daten legen allerdings nahe, dass gerade Patienten mit einer chronischen HI oft niedrige Transferrin- und Serumeisenwerte haben, obwohl die TSAT >20% und das Serumferritin >100ng/ml betragen. Solche Patienten haben eine hohe Prävalenz einer Anämie und eine schlechte Prognose und könnten an Eisenmangel leiden, sind aber derzeit von klinischen Studien zur Eisenergänzung ausgeschlossen (9). Die Diagnosekriterien des Eisenmangels bei kardiovaskulären Erkrankungen stehen nicht final fest; im klinischen Alltag sind diese brauchbar, jedoch noch nicht perfekt (10).
Nach einer aktuellen Arbeit im EHJ nimmt das Herz Eisen aus intravenöser Eisencarboxymatose (FCM) über einen nicht der Regel entsprechenden neuen Weg auf, der unabhängig von retikuloendothelialen Makrophagen ist. Diese myokardiale Akkumulation von nicht-transferringebundenem Eisen ist möglicherweise klinisch relevant. Die Persistenz des Eisens im Myokard und in labiler Form birgt die Gefahr, dass wiederholte Gaben zu einer kumulativen Anreicherung und Toxizität führen (11).
Neudefinition Eisenmangel bei HI
In einer lesenswerten Publikation von M. Packer im Circulation Mai 2024 wird die bisherige Definition eines Eisenmangels in den Guidelines von internationalen Experten unter Beteiligung der Charité in Berlin hinterfragt. Die Autoren fordern: «Die aktuelle auf Ferritinkonzentration beruhende Definition eines Eisenmangels bei HI-Patienten aufzugeben und durch eine auf der Hypoferrämie (TSAT <20%) basierenden Definition zu ersetzen». Der Grund ist der erwähnte funktionelle Eisenmangel durch die systemische Entzündung und der erhöhte zentralvenöse Druck bei einer HI, welche das Hepcidin in der Leber erhöhen und dadurch die Eisenfreisetzung hemmen. Ferritin wird, wie erwähnt, bei einer Entzündung vermehrt synthetisiert und freigesetzt; die Synthese von Tranferrinrezeptoren gehemmt. So werden nach den Autoren oft Ferritinwerte beobachtet, welche im Normbereich zwischen 20 -300ug/l liegen. So würde dann ohne die Berücksichtigung der TSAT nach der aktuellen Definition in den ESC-HI-Guidelines fälschlicherweise keine Eisentherapie veranlasst werden. «Die hypoferrämischen Patienten mit einer TSAT <20% haben in der Regel auch in einer Knochenmarks-Untersuchung einen Eisenmangel; nach intravenöser Eisentherapie verbessert sich ihre funktionelle Kapazität und das Risiko eines cv Ereignisses sinkt beträchtlich» (12). Bei einer TSAT >20% und einem Serumferritin von 20-100mg/l besteht eine gute Prognose ohne Eisenersatztherapie. Eine solche wäre dann ungünstig – proinflammatorische Wirkung, Förderung eines Tu-Wachstums. Daher schlagen die Autoren vor, die derzeitige auf Ferritin basierende Definition von Eisenmangel bei HI aufzugeben und eine auf Hypoferrämie (TSAT< 20%) basierende Definition zu übernehmen.
Studien zur iv.-Eisen-Therapie bei einer chronischen Herzinsuffizienz
Seit 2009 wurden insgesamt zehn unterschiedliche Studien und zwei Metaanalysen zur Eisentherapie bei HI publiziert. Die in den letzten Jahren publizierten Doppelblinden Placebo-kontrollierten Studien: CONFIRM-HF (13), AFFIRM-AHF (14) und zwei Metaanalysen 2018 u. 2023 (15,16) ergaben durch eine konsequente iv. Eisencarboxymaltose (FCM) Therapie einen besseren Outcome bei HI-Patienten (HFrEF, HFmrEF) mit Eisenmangel. In der grossen AFFIRM-AHF Studie (RCT) mit 1082 Patienten nach einer akuten HI-Episode konnten bei einer LVEF <50% durch eine solche Therapie die HI-Hospitalisationsrate und der cv-Tod über 52 Wochen nicht ganz signifikant um 21% gesenkt werden, NNT von 7. Betrachtet man die Endpunkte einzeln, wird offensichtlich, dass sich die Eisengabe alleinig auf die HI bedingte Hospitalisierungsrate ausgewirkt hat, das Risiko für eine Klinikeinweisung war unter der Therapie um 26% signifikant geringer (RR: 0,74; p=0,013). Auf die kardiovaskuläre Mortalität hatte die Eisengabe vs. Placebo keinen Einfluss (14).
Bei einem breiten Spektrum von 1137 älteren Patienten (median 73j.) mit HI in der IRONMAN-Studie (17) mit einer LVEF ≤45%, einem Eisenmangel (TSAT <20%, Serumferritin <100ug/l) und einem Hb unter dem Normwert von 13g/dl bei Frauen resp. 14g/dl bei Männern war die wiederholte iv. Verabreichung von Eisen³+-Derisomaltose (FDI) mit einem geringeren Risiko von Krankenhaus-einweisungen wegen HI und einer Leistungssteigerung über 2.7 Jahre verbunden, ohne dass die cv Todesrate oder der Gesamttod signifikant zurückging. Die Hazard Ratio für den kardiovaskulären Tod (0,86; 95 % CI, 0,67 bis 1,10) war ähnlich hoch wie die HR in der negativ ausgefallenen HEART-FID, der bisher grössten iv. Eisengabe Studie. Bei 3065 ambulanten Patienten mit HI mit reduzierter Auswurffraktion von ≤40% und einem Eisenmangel (nach Guidelines) und einer HI-Hospitalisation in den vergangenen 12 Monaten oder ein erhöhtes NT-pro-BNP zeigte letztere keinen offensichtlichen Unterschied zwischen Eisencarboxymaltose und Placebo in Bezug auf den primären Endpunkt: Tod, Klinikaufenthalten wegen HI oder einer Veränderung im 6-Minuten-Gehtest. Die durchschnittliche TSAT betrug 23.9% (18).
Eine aktuelle Metaanalyse aus: HEART-FID, CONFIRM und AFFIRM-AHF ergab bezüglich cv Tod und cv Hospitalisation zwar eine Risikoreduktion von 14% (HR 0.86), dies jedoch getrieben durch die Klinikeinweisungen, ohne erkennbare Auswirkungen auf die Sterblichkeit. In einer Subanalyse zeigte eine TSAT <15% einen deutlich vorhersehbaren Nutzen einer Eisensubstitution mit FCM. Die Risikoreduktion für den cv Tod oder die Hospitalisation betrug hier 28%. Potenziell ungünstige Auswirkungen bei Patienten mit einem TSAT-Wert von ≥24 % (19).
In der ersten HFpEF Studie mit Eisenmangel: FAIR-HFpEF, bei älteren Patienten mit einer HFpEF ( ≥50%) verbesserte die intravenöse FCM-Therapie die 6-Minuten-Gehstrecke (+49m) und war mit weniger schwerwiegenden unerwünschten Ereignissen verbunden. Die Studie war jedoch wegen der kleinen Teilnehmerzahl (n=39) nicht aussagekräftig genug, um Auswirkungen auf die Symptome oder die Lebensqualität festzustellen oder zu widerlegen. Die Gründe für die positiven Wirkungen der intravenösen Verabreichung von Eisen sind etwas klarer geworden und gehen weit über die Eisenversorgung bei der Erythropoese hinaus (20). Der potenzielle Nutzen von intravenösem Eisen bei HFpEF mit einem Eisenmangel sollte in einer grösseren Kohorte weiter untersucht werden.
Bei einer iv.-Eisentherapie ist zu beachten: cave Flush bei zu schneller iv.-Gabe, akute Überempfindlichkeitsreaktion vom Soforttyp (anaphylaktische Reaktion), Betreuung und Nachbetreuung (mind. 30 Min.) des Patienten; Abwägung Risiko-Nutzen einer Infusionstherapie. Dosierung je nach Hb und Körpergewicht.
Einsatz von SGLT2-H. bei einer iv. Eisentherapie
In einer Arbeit von M. Packer im JACC Januar 2023 wird die Interaktion der iv. Eisengabe (Fe³+) mit der gleichzeitigen Gabe eines SGLT2-Hemmers kritisch hinterfragt (21). Es werden im Artikel zwei Hypothesen diskutiert: die «zytosolische Eisenmangel Hypothese» und die «zytosolische Eisenauffüllungs Hypothese». Bei Letzterer bewirken SGLT2-H. über den Sirtuin-1-Signalweg und über eine Reduktion der Entzündung einen Abfall von Ferritin, Hepcidin in den Hepatozyten und Makrophagen und einen Anstieg von Erythropoetin und der Transferrinrezeptoren unabhängig von der Erythropoese. Der Autor geht davon aus, dass die Eisen-Biomarker Veränderungen unter SGLT2-H. keinen intrazellulären Eisenmangel anzeigen. Das Eisen 2+ ist im Zytosol nach seiner Überlegung erhöht, mit einer erhöhten Nutzung, erhaltener Erythropoese und erhaltener Kardioprotektion verbunden.
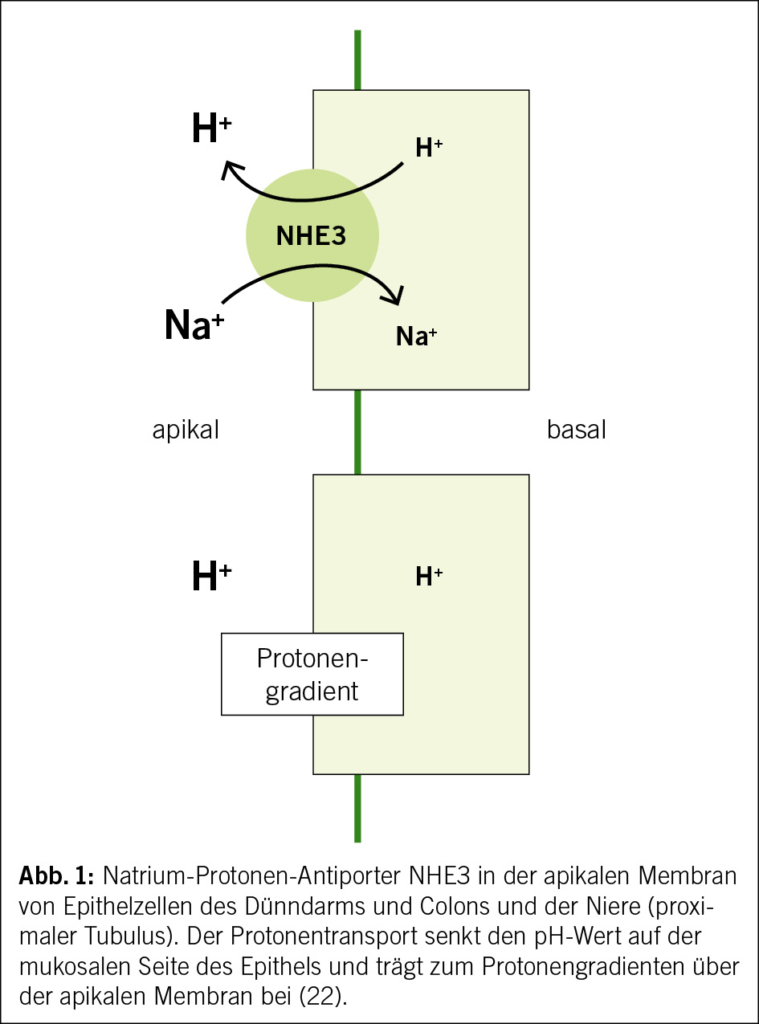
Bei einer HI werden auch der renale Sympathikus, Angiotensin II, Neprilysin und die α-Receptoren aktiviert. Dies führt zu einer Expression von NHE3 – NHE3 ist ein Na+/H+-Antiporter 3, dies ist ein Membrantransportprotein, welches im Darm und im proximalen Tubulus der Niere vorkommt und durch den Protonentransport den pH-Wert in den Zellen reguliert (Abb. 1).
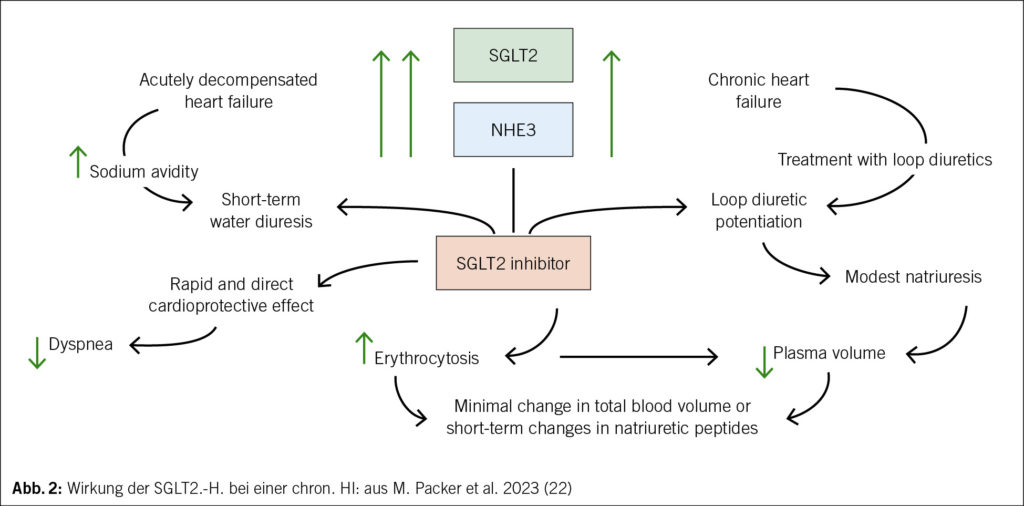
Eine weitere Expression bei einer HI ist SGLT2. Dieses führt zu einer Natrium- und Wasserretention mit Anstieg des Volumens im Interstitium und Plasma. Dies wiederum verschlechtert die HI. SGLT2-H. blockieren nach M. Packer den renalen Sympathikus und die Expression von NHE3 und SGLT2 (22).
SGLT2-Hemmer vermindern die Entzündung und die Fibrose, senken den oxidativen Stress; sie sind organoprotektiv. Sie erhöhen neben dem Erythropoetin auch die Erythrozytose (Hkt↑) mit einem Anstieg der O2-Freisetzung, die Gluconeogenese und die Fettsäure Oxidation. Diese Mechanismen führen über die Sauerstofferhöhung und die Synthese von Ketonkörpern zu einer erhöhten ATP-Produktion in den Mitochondrien der Kardiozyten und Nierenzellen. Bekannte osmotische Diurese (Potenzierung der Schleifendiuretika) mit Abnahme des Plasmavolumens und die erwähnte direkte kardioprotektive Wirkung mit Verbesserung der Dyspnoe; Senkung der Harnsäure (22) (Abb. 2).
Nach klinischen Daten der DAPA-HF wird diese «zytosolische Eisenauffüllungs Hypothese» favorisiert. «Die intravenöse Eisentherapie könnte daher unnötig und theoretisch schädlich (Entzündung/ Ferroptose) sein, bei HI-Patienten, welche unter SGLT2-H. Eisendefizient erscheinen». Weiter Studien zu dieser Kombinationstherapie sind daher nach dem Autor notwendig, bevor eine solche breit empfohlen wird (22,23). So hatten in der IRONMAN Studie lediglich 3%, in der bez. primärem Endpunkt negativen grossen HEART-FID Studie 7.7% einen SGLT2-H (24,25). Bisherige Daten deuten nicht daraufhin, dass ein zugrunde liegender Eisenmangel den grossen Nutzen dieser Medikamentenklasse beeinträchtigt.
Eisenmangel war bei DAPA-HF in einer post hoc Analyse häufig (43,7%) und mit schlechteren Ergebnissen verbunden. Dapagliflozin schien den Eisenverbrauch zu erhöhen, verbesserte jedoch die Ergebnisse, unabhängig vom Eisenstatus zu Studienbeginn. TSAT, Ferritin und Hepcidin wurden reduziert und die Gesamteisenbindungskapazität und der lösliche Transferrinrezeptor mit Dapagliflozin im Vergleich zu Placebo erhöht. Die Wirkung von Dapagliflozin auf den primären Endpunkt war bei Patienten mit Eisenmangel im Vergleich zu Patienten mit genügend Eisen konsistent (Hazard Ratio, 0,74). Ähnliche Ergebnisse wurden für kardiovaskuläre Todesfälle, Krankenhausaufenthalte bei HI und Gesamtmortalität beobachtet (23). Die Feststellung eines konsistenten Nutzens von Dapagliflozin bedeutet, dass ein vorbestehender absoluter Eisenmangel nicht als Hindernis für den Beginn der Behandlung mit Dapagliflozin oder die Entwicklung eines absoluten Eisenmangels während der Behandlung, nicht als Grund für ein Absetzen der Behandlung angesehen werden sollte. Diese Studien-Beobachtungen erhöhen das Potenzial für eine therapeutische Synergie zwischen Eisenauffüllung und SGLT2-Hemmung bei Patienten mit HFrEF/HFmrEF nicht nur um Eisenmangel zu vermeiden, sondern vielleicht auch um eine Anämie zu behandeln. Zur definitiven Beurteilung dieser Interaktion sind weitere Studien erforderlich.
Copyright Aerzteverlag medinfo AG
Zelglistrasse 17
8127 Forch
u.n.duerst@ggaweb.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Bei einer symptomatischen Herzinsuffizienz mit einer EF ≤50% muss ein Eisenmangel regelmässig gesucht und allenfalls durch eine intravenöse Eisengabe behandelt werden. Ein Eisenmangel ist prognostisch ungünstig, dies unabhängig von einer Anämie, und führt zu einer schlechten Lebensqualität und vermehrten HI-Hospitalisationen.
- Definition des Eisenmangels bei der HI nach ESC 2023 (Männer&Frauen):
- Absoluter Eisenmangel: Ferritin <100ng/ml allein oder
- Funktioneller Eisenmangel: Ferritin 100-299ng/ml bei TSAT <20%
- Einige Autoren halten die Bestimmung der TSAT als alleiniges Kriterium für einen Eisenmangel bei der HI als ausreichend mit einem Wert <20%.
- Das Akut-Phasen Protein Ferritin ist bei einer chron. Erkrankung mit einer Anämie (ACD) wegen des funktionellen Eisenmangels pseudonormal oder erhöht. Die Bestimmung von Ferritin und der Transferrinsättigung ist hier ungenügend. Der sTfR kann zwischen Eisenmangel und ACD unterscheiden und ist bei Letzterer normal, bei zusätzlichem Eisenmangel erhöht – vgl. Tab.1.
- Durch die intravenöse Eisengabe bei funktionellem und absolutem Eisenmangel und einer HI mit reduzierter (HFrEF ≤40%) und leicht reduzierter (HFmrEF 41-49%) Ejektions-fraktion kommt es zu einer Verbesserung der Symptome, der Leistungsfähigkeit und der Lebensqualität mit einer Risikoreduktion für HI-Hospitalisationen.
- Ausstehend sind grössere Studien bei einer HFpEF (≥50%) mit Eisenmangel.
- SGLT2-H. lindern den Eisenmangel (entzündungsbedingter Veränderungen der Eisenhomöostase) und haben u.a. die Fähigkeit, die Erythrozytose und die Produktion von ATP in den Kardiomyozyten und Nierenzellen zu fördern. Sie sind organoprotektiv.
- Die bisherigen klinischen Daten zeigen bei einer HI mit einem Eisenmangel eine günstige Wirkung der SGLT2-Hemmer. Weitere Studien zu diesem Thema sind notwendig.
1. Gattermann N. et al., Abklärung von Eisenmangel und Eisenüberladung, Dtsch Ärztebl Int 2021;118:847-56
2. Onkopedia.com: Leitlinien, Hämatologische Erkrankungen: Eisenmangel- und Eisen-mangelanämie
3. Mistry R. et al., Iron deficiency in heart failure, an underdiagnosed and undertreated condition during hospitalization, Annals of Hematology 2019;98 (10):2293-2297
4. Becher P.M. et al, Phenotyping heart failure patients for iron deficiency and use of intravenous iron therapy: data from the Swedish Heart Failure Registry, Eur J Heart Fail, 2021 Nov;23(11):1844-1854. doi: 10.1002/ejhf.2338. Epub 2021 Sep 14.
5. Beck-da-Silva L. et al., IRON-HF study: a randomized trial to assess the effects of iron in heart failure patients with anemia, Int J Cardiol 2013 Oct 9;168 (4):3439-42
6. Lewis GD. et al, Effect of Oral Iron Repletion on Exercise Capacity in Patients With Heart Failure With Reduced Ejection Fraction and Iron Deficiency: The IRONOUT HF Randomized Clinical Trial, JAMA 2017 May 16;317(19):1958-1966
7. McDonagh T. A. et al., 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC, European Heart Journal, Volume 42, Issue 36, 21 September 2021, Pages 3599–3726.
8. McDonagh T. A. et al.,2023 Focused Update of the 2021 ESC-Guidelines for the diagnosis and treatment of acute and chronic heart failure, ESC Clinical Practice Guidelines, European Heart Journal, Volume 44, Issue 37, 1 October 2023, Pages 3627–3639
9. Graham F.J. et al., Influence of serum transferrin concentrationon diagnostic criteria for iron deficiency in chronic heart failure, ESC Heart Fail. 2023 10 (5) : 2826-2836
10. Von Haehling S., Eisenmangel bei kardiovaskulären Erkrankungen, Innere Medizin https://doi.org/10.1007/s00108-024-01783-3
11. Vera-Aviles M. et al., Intravenous iron therapy results in rapid and sustained rise in myocardial iron content through a novel pathway, European Heart Journal (2024) 45, 4497–4508
12. Packer M. et al., Redefining Iron Deficiency in Patients with Chronic Heart Failure, Circulation 2024; https://doi.org/10.1161/CIRCULATIONAHA.124.068883
13. Ponikowski P. etal, Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency, CONFIRM, Eur Heart J, Volume 36, Issue 11, 14 March 2015, Pages 657–668
14. Ponikowski P et al. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial, AFFIRM-AHF, The Lancet 2020, DOI: https://doi.org/10.1016/S0140-6736(20)32339-4
15. Anker SD. Et al, Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis, Eur J Heart Fail 2018 Jan;20(1):125-133
16. Ponikowski P. et al, Efficacy of ferric carboxymaltose in heart failure with iron deficiency: an individual patient data meta-analysis, European Heart Journal, Volume 44, Issue 48, 21 December 2023, Pages 5077–5091
17. Kalra PR et al., Intravenous ferric derisomaltose in patients with heart failure and iron deficiency in the UK (IRONMAN): an investigator-initiated, prospective, randomised, open-label, blinded-endpoint trial. Lancet 2022; 400:2199-2209
18. Mentz RJ. et al., Ferric Carboxymaltose in Heart Failure with Iron Deficiency, HEART-FID, N Engl J Med 2023;389:975-986
19. Ponikowski P. et al., Efficacy of ferric carboxymaltose in heart failure with iron deficiency: an individual patient data meta-analysis, Eur Heart J. 2023 Dec 21; 44(48): 5077–5091
20. Von Haehling S. et al., Ferric carboxymaltose and exercise capacity in heart failure with preserved ejection fraction and iron deficiency: the FAIR-HFpEF trial, European Heart Journal (2024) 45, 3789–3800
21. Packer M., Potential Interactions When Prescribing SGLT2 Inhibitors and Intravenous Iron in Combination in Heart Failure, JACC HF 2023 Vol.11, No.1: 106-114
22. Packer M. et al., Critical Reanalysis of the Mechanisms Underlying the Cardiorenal Benefits of SGLT2 Inhibitors and Reaffirmation of the Nutrient Deprivation Signaling/Autophagy Hypothesis, Circulation 2022;146:1383-1405
23. Docherty K.F. et al., Iron Deficiency in heart failure and effect of dapagliflozin: findings from DAPA-HF. Circulation 2022; 146: 980-994
24. Kalra PR et al., Intravenous ferric derisomaltose in patients with heart failure and iron deficiency in the UK (IRONMAN): an investigator-initiated, prospective, randomised, open-label, blinded-endpoint trial. Lancet 2022; 400:2199-2209
25. Mentz RJ. et al., Ferric Carboxymaltose in Heart Failure with Iron Deficiency, HEART-FID, N Engl J Med 2023;389:975-986
der informierte @rzt
- Vol. 14
- Ausgabe 12
- Dezember 2024








