- Kolorektale Lebermetastasen
Weltweit und in der Schweiz ist das kolorektale Karzinom die dritthäufigste Krebserkrankung. Jährlich erkranken alleine in der Schweiz ca. 4300 Menschen am kolorektalen Karzinom (1). Zum Zeitpunkt der Diagnose zeigen 15 - 25% der Patienten eine Metastasierung in der Leber (synchrone Metastasen). Bei weiteren 15 - 30% der Patienten treten Lebermetastasen im späteren Erkrankungsverlauf auf (metachrone Metastasen) (2 - 4). Die Leber ist dabei der häufigste Manifestationsort kolorektaler Metastasierung. Gründe hierfür sind neben der anatomisch bedingten portalvenösen Drainage des Darmes in die Leber auch ein metastasierungsfreudiges Mikromilieu (5). Und obschon zwei Drittel der Patienten mit hepatisch metastasiertem kolorektalem Karzinom auch eine extrahepatische Ausbreitung zeigen, so sind regionale Behandlungsansätze in der Leber in Kombination mit einer systemischen Therapie mittlerweile Standard geworden und gerechtfertigt, da sie signifikante Überlebensvorteile bis hin zur Heilung zeigen (6). In diesem ersten Teil des Artikels werden Abklärungswege und Möglichkeiten der chirurgischen Standardbehandlung aufgezeigt, in einem zweiten Teil werden ergänzende chirurgische Möglichkeiten und aktuelle systemische Therapien vorgestellt werden.
Zu den verfügbaren regionalen Behandlungen für Lebermetastasen eines kolorektalen Karzinoms zählen die chirurgische Resektion, die thermische und nicht-thermische Ablation, die regionale hepatische intraarterielle Chemotherapie, Chemoembolisation, Radioembolisation sowie die stereotaktische Strahlentherapie. In individuellen Fällen einer hepatisch nicht-resektablen Situation kann auch eine Lebertransplantation bei ausschliesslichem Leberbefall evaluiert werden (7). Von all diesen möglichen Behandlungen ist die chirurgische Resektion der Lebermetastasen in Kombination mit einer Systemtherapie der aktuelle Goldstandard (8).
Die Resektion eingebettet in eine multimodale Therapie bietet die grösste Heilungschance für Patienten mit hepatisch metastasiertem kolorektalem Karzinom. In chirurgischen Fallserien liegen die Überlebensraten fünf Jahre nach Resektion zwischen 35 - 58% bei gleichzeitigen niedrigen Mortalitätsraten von unter 5 Prozent in ausgewiesenen Zentren (9). Langfristig kann so einem Teil der Patienten ein Rezidiv-freies Überleben ermöglicht werden. Nach hepatischer Metastasektomie erleidet etwa ein Drittel der 5-Jahres-Überlebenden einen krebsbedingten Tod, während diejenigen, die 10 Jahre überleben, als geheilt gelten (10). In einer Analyse von 612 aufeinanderfolgenden Patienten, die sich einer Resektion von Lebermetastasen bei metastasiertem kolorektalen Karzinom unterzogen und mindestens 10 Jahre lang beobachtet wurden, gab es 102 Patienten, welche 10 Jahre überlebten. Nur ein Patient erlitt nach 10 Jahren einen krankheitsspezifischen Tod (11).
Mit dieser Übersichtsarbeit möchten wir auf die multimodalen Therapiemöglichkeiten von Resektion und systemischer Chemotherapie bei Patienten mit potentiell resektablen kolorektalen Lebermetastasen hinweisen. Dabei möchten wir die optimale Patientenselektion und Diagnostik besprechen sowie das Timing einer Resektion, die Behandlungssequenz, wie auch die verschiedenen Operationstechniken bei multiplem Leberbefall und schliesslich die Herausforderungen bei rezidivierenden Lebermetastasen aufzeigen.
Wie sollte bei Verdacht einer Lebermetastasierung abgeklärt werden?
Eine gründliche und komplette Diagnostik bei Verdacht auf eine Lebermetastasierung eines kolorektalen Karzinoms ist entscheidend zur Festlegung der weiteren Therapie.
Als sogenannte «Screening»-Untersuchung» dient zunächst der abdominale Ultraschall. Mit hochauflösenden Sonographiegeräten und zusätzlicher Kontrastverstärkung mittels eines für den Ultraschall entwickelten Kontrastmittels können auch kleinere Tumore in der Leber detektiert werden (12). Für eine genaue Charakterisierung des Tumors ist weiterführend eine Magnetresonanztomographie (MRT) mit Kontrastmittel sinnvoll. Dabei wird ein «leberspezifisches» (hepatobiliäres) Kontrastmittel eingesetzt, das primär nur von gesunden Leberzellen aufgenommen wird, nicht aber von kolorektalen Metastasen. Neben der Charakterisierung der Lebertumore bietet die MRT umfassende Informationen für die Planung einer Leberoperation, wie die genaue Anzahl der Tumore, ihre Lagebeziehung zu den Gefässen und Gallengängen sowie auch die Lebervolumina, welche im Falle einer Resektion übrigbleiben. Mehrere Studien konnten zeigen, dass die MRT eine höhere Sensitivität bei äquivalenter Spezifität im Vergleich zur Computertomographie (CT) aufweist (13 - 15). Darum ist die MRT die bevorzugte Bilddiagnostik für die Charakterisierung kolorektaler Lebermetastasen. Der Stellenwert eines PET-CTs in der präoperativen Abklärung von Patienten mit kolorektalen Lebermetastasen zeigt sich in erster Linie im Detektieren von extrahepatischen Metastasen, welche dann das Tumorstadium und somit auch das therapeutische Management beeinflussen (16). Wir verwenden PET-CT standardmässig in unserer Abklärung, obschon dies in der Literatur nicht unbedingt gefordert wird. Dabei ist zu erwähnen, dass das PET-CT nicht innerhalb von 4 Wochen nach Gabe einer systemischen Chemotherapie oder Antikörpertherapie durchgeführt werden sollte, da ansonsten die Sensitivität deutlich reduziert ist (17).
Zur weiteren Abklärung gehört die Bestimmung des Tumormarkers wie das Carcinoembryonale Antigen (CEA), welcher diagnostische und prognostische Wertigkeit beim kolorektalen Karzinom hat. Die Überexpression von CEA steht in engem Zusammenhang mit Lebermetastasen (18). CEA ist einer der am weitesten verbreiteten Tumormarker, welcher zur Überwachung eines Tumorrezidivs nach chirurgischer Resektion oder zum Ansprechen auf eine Chemotherapie eingesetzt wird. Der histologische Nachweis von Lebermetastasen mittels Biopsie ist bei sonst klarer Konstellation wie PET/CT und Tumormarker nicht notwendig, es sei denn, dass die Biopsie für ein molekulares Tumorscreening bei der Planung der Chemotherapie benötigt wird. Häufig können jedoch molekulare Untersuchungen am Material des Primärtumors durchgeführt werden.
Was ist bei der Planung einer chirurgischen Behandlung zu beachten?
Eine geeignete Patientenselektion ist der entscheidende Faktor, um den bestmöglichen perioperativen Verlauf und langfristig Tumorfreiheit zu erreichen. Die Selektion eines für die Resektion geeigneten Patienten umfasst die folgenden drei Faktoren:
- Patientenfaktoren: Signifikante medizinische Komorbiditäten, welche den perioperativen Verlauf beeinflussen können.
- Tumorfaktoren: Bei einer systemischen Tumorerkrankung wie dem metastasierten Karzinom, sollte eine neoadjuvante Systemtherapie immer in die Behandlung eingebettet werden (19, 20). Dadurch kann die Tumorbiologie vor der Resektion besser beurteilt werden (d.h. Patienten mit progressiven Metastasen der Leber während systemischer Chemotherapie zeigen eine aggressive Tumorbiologie und sollten nicht operiert werden)(21). Des Weiteren gibt es auch molekulare Tumormarker wie KRAS und BRAF, welche Aufschluss über die zu erwartende Tumorbiologie und Prognose geben können (22 - 24).
- Anatomische Faktoren: Anatomische Faktoren müssen ebenfalls berücksichtigt werden.
Der moderne multidisziplinäre Konsens resektabler Lebermetastasen wird definiert als Tumore, welche vollständig reseziert werden können und gleichzeitig eine ausreichende Leberrestmasse zurücklassen (25). Darin eingeschlossen sind auch komplexe Mehr-Schritt-Operationen wie z.B. die ALPPS-Operation. Die Beurteilung der Resektabilität von Lebermetastasen sollte immer durch einen hepatobiliären Chirurgen erfolgen. Wichtig erscheint hier, dass sofern eine vollständige Metastasektomie durchgeführt werden kann und dabei ein funktionelles Restlebervolumen erhaltet werden kann, andere negative prognostische Faktoren eine Operation nicht ausschliessen sollten (26) (Abb. 1). Wenn die zu verbleibende Restleber ein zu kleines Volumen hat (< 30%), kann eine Parenchym-Augmentation der Restleber durch eine Pfortader- und eventuell zusätzliche Lebervenenembolisation der zu entfernenden Leberhälfte durchgeführt werden oder durch eine Zwei-Schritt-Leberresektion erreicht werden. Welches Verfahren am besten geeignet ist, richtet sich nach der individuellen Anzahl und Verteilung der Lebermetastasen und sollte von einem hepatobiliären Chirurgen beurteilt werden.
Was bestimmt den Zeitpunkt und das Ausmass der Leberchirurgie?
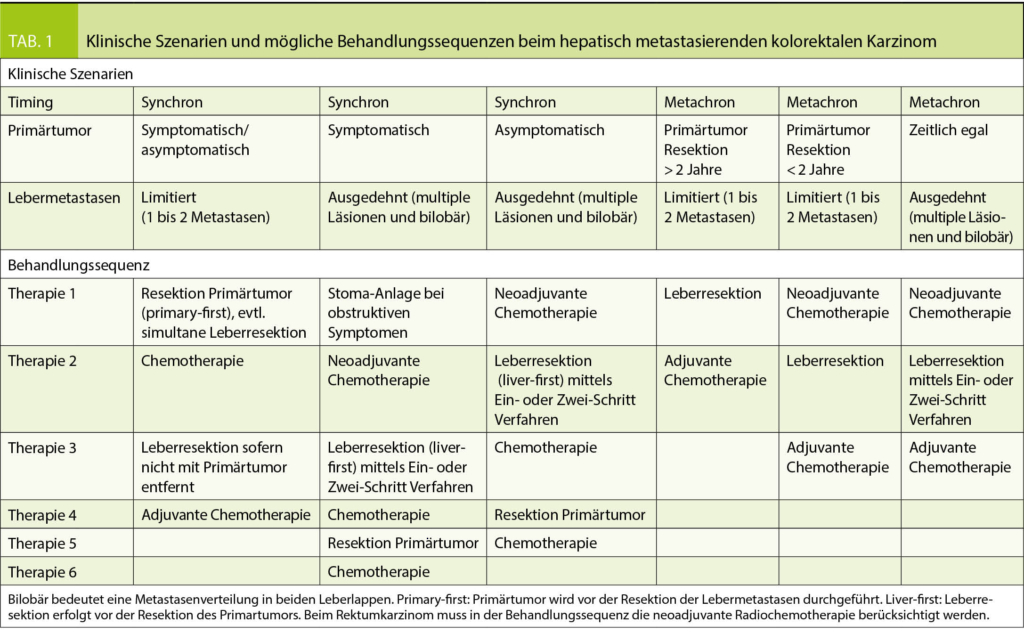
Prinzipiell muss bei der chirurgischen Therapieplanung zwischen synchronen und metachronen Lebermetastasen unterschieden werden. Während bei metachronen Lebermetastasen primär die hepatische Tumorerkrankung angegangen werden kann, ist bei der synchronen Metastasierung der zusätzliche Faktor des Primärtumors in die Therapieplanung einzubeziehen (Tab. 1).
Die Operationsstrategie bei synchronen Lebermetastasen richtet sich nach der individuellen Tumorausprägung und Symptomen von Primärtumor und Metastasen. Patienten mit einem symptomatischen obstruierenden Kolonkarzinom werden meistens einer primären Kolonresektion oder bei ausgedehntem Kolonbefall einer Anlage eines entlastenden Stomas zugeführt. Anschliessend folgt die systemische Chemotherapie, gefolgt von einem Restaging und erneuter Evaluation der Leberresektion. Im Fall eines Rektumkarzinoms wird zusätzlich abhängig vom individuellen Fall eine lokale Langzeit- oder Kurzzeitbestrahlung durchgeführt. Sollte jedoch bei symptomatischem Primärtumor eine ausgedehnte Lebermetastasierung beider Leberlappen vorliegen, kann primär eine Stoma-Anlage mit anschliessender Chemotherapie erfolgen. In diesen Szenarien wird häufig ein sogenannter «Liver-first Approach» angewandt, bei dem zuerst die chirurgische Resektion der Lebermetastasen und sekundär die Resektion des Primärtumors erfolgt (Tab. 1). Der Hintergrund dieser Behandlungsstrategie ist, dass die primäre Überlebensprognose von der Lebermetastasierung und weniger vom Primärtumor bestimmt wird. Die gleiche Strategie wird bei ausgeprägter Lebermetastasierung und asymptomatischem Primärtumor angewandt. An unserem Zentrum wird die chirurgische Therapieplanung zwischen hepatobiliären und kolorektalen Chirurgen eng im Konsensus koordiniert.
Das Festlegen der genauen Therapieplanung bei Patienten mit fortgeschrittener Erkrankung und ausgedehntem Tumorbefall in beiden Leberlappen sollte in einem interdisziplinären Konzept mit neoadjuvanter und adjuvanter Systemtherapie eingebettet sein (27). Mit Hilfe des neoadjuvantes Konzeptes können ungünstige Tumorverläufe so selektioniert werden. Tumore, welche mittels Systemtherapie nicht kontrolliert werden und weiter fortschreiten, sollten vorerst keiner Chirurgie zugeführt werden.
Operationsmethoden
Bei limitierten Metastasenbefall der Leber kann häufig der Tumor aus der Leber mit einer Parenchym-sparenden Operation komplett entfernt werden. Eventuell muss bei einem zu knappen Leberrestvolumen (<30%) eine präoperative Parenchym-Augmentation der Restleber häufig mittels Pfortaderembolisation erfolgen. Bei ausgedehntem bilobärem Leberbefall können die Metastasen oft nicht mit einer einzigen Operation entfernt werden. Wegen eines zu kleinen Leberestvolumens erfolgt die Resektion in zwei Schritten mit dem Ziel, in der ersten Operation die zu verbleibende Restleber zu befreien und gleichzeitig eine Gewebeaugmentierung der Restleber zu erreichen. Wichtig ist dabei die Berücksichtigung des zeitlichen Auftretens der Metastasen (synchron oder metachron), die Ausdehnung und Verteilung der Lebermetastasen sowie das Vorhandensein zusätzlicher extrahepatischer Läsionen (meist Lunge) (6). Resektable Lungenmetastasen stellen heute keine Kontraindikation für eine ausgedehnte Leberresektion dar, müssen aber individuell und interdisziplinär im Therapiekonzept berücksichtigt werden. Meist werden pulmonale Läsionen nach erfolgter Leberresektion und adjuvanter Systemtherapie chirurgisch oder lokal behandelt (28). Es ist noch zu erwähnen, dass rezidivierende Lebermetastasen immer für eine Re-Resektion evaluiert werden sollten, da die Prognose nach Re-Resektion derer nach einer primären Leberresektion entspricht (29).
Bei ausgedehnten Lebermetastasen, welche sich nicht durch eine Ein-Schritt Operation entfernen lassen, gibt es aktuell zwei verschiedene Operationsverfahren: die «TSH» (Two-Stage Hepatectomy) und die «ALPPS» (Associating Liver Partition and Portal vein ligation for Staged hepatectomy) Operation. Beiden gemeinsam ist die Resektion in zwei Schritten, um Tumorfreiheit zu erreichen und genügend funktionelles Lebergewebe zu erhalten. Bei der TSH werden in der ersten Operation Metastasen in der zu verbleibenden Leberhälfte entfernt, sowie die Portalvene zur anderen Leberhälfte mit den verbleibenden Metastasen ligiert oder embolisiert. Dies triggert ein Leberwachstum und führt zur Hypertrophie der tumorfreien Seite. Nach 6 - 8 Wochen ist in der Regel eine ausreichende Hypertrophie der von den Metastasen befreiten Leberhälfte und suffiziente Leberfunktion erreicht und es kann dann die verbleibende, noch mit Metastasen befallene Leberhälfte in einer zweiten Operation (Komplettierungshepatektomie) sicher entfernt werden (30).
Die ALPPS-Operation ist der TSH sehr ähnlich, wobei während des ersten Eingriffes zusätzlich noch eine Leberteilung (Transsektion) durchgeführt wird. Dabei werden Shuntgefässe zwischen den Leberhälften durchtrennt, was zu einem beschleunigten Wachstum des tumorbefreiten Leberanteiles führt (27, 31). So kann bereits nach 1 - 2 Wochen ein funktionell ausreichendes Lebervolumen erreicht werden, welches die zweite Operation mit Resektion der noch tumorbefallenen Leberseite bereits nach 1 - 2 Wochen sicher ermöglicht.
Obschon die «beste» chirurgische Strategie dieser etablierten Methoden noch Gegenstand von Diskussionen ist, so zeigte sich in Publikationen, dass bei der TSH die zweite Operation häufiger nicht durchgeführt werden kann, da es zwischen den beiden Schritten zu einem neuen Tumorwachstum gekommen ist. So bietet aktuell die ALPPS Operation aus unserer Sicht einen klaren Vorteil, da eine höhere Anzahl an Patienten beide Operationsschritte durchlaufen und so eine Tumorfreiheit in der Leber innerhalb einer sehr kurzen Zeitspanne erzielt werden kann.
PD Dr. med. Christian E. Oberkofler 1,2,6
Dr. med. Ralph Fritsch 3,6,7
Prof. Dr. med. Thomas Pfammatter 4,6
Dr. med. Helena I. Garcia Schüler 5,7
PD Dr. med. Michelle de Oliveira 1,2
Prof. Dr. med. Philipp Dutkowski 1,2
Prof. Dr. med. Matthias Turina 2,7
Prof. Dr. med. Pierre-Alain Clavien 1,2,6
Prof. Dr. med. Henrik Petrowsky 1,2,6
1 Swiss Hepato-Pancreato-Biliary Center,
2 Klinik für Viszeral und Transplantationschirurgie,
3 Klinik für Medizinische Onkologie und Hämatologie,
4 Institut für Interventionelle Radiologie,
5 Klinik für Radio-Onkologie,
6 Liver and Pancreas Tumor Center, Comprehensive Cancer Center Zürich
7 Colorectal Cancer Center, Comprehensive Cancer Center Zürich
UniversitätsSpital Zürich, Rämistrasse 100, 8091 Zürich
henrik.petrowsky@usz.ch
Copyright bei Aerzteverlag medinfo AG
Swiss Hepato-Pancreato-Biliary Center
Klinik für Viszeral und Transplantationschirurgie
Liver and Pancreas Tumor Center, Comprehensive Cancer Center Zürich
Klinik für Medizinische Onkologie und Hämatologie
Universität und Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Swiss Hepato-Pancreato-Biliary (HPB) Center
Klinik für Viszeral- und Transplantationschirurgie
Liver and Pancreas Tumor Center, Comprehensive Cancer Center Zürich
Rämistrasse 100
8091 Zürich
henrik.petrowsky@usz.ch
Die Autoren haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Die Integration moderner Operationstechniken und wirksamer medikamentöser Tumortherapien haben im letzten Jahrzehnt zu einer kontinuierlichen Weiterentwicklung der Behandlung kolorektaler Lebermetastasen geführt.
- So lassen sich durch diese multimodalen Therapien auch bei einer primär nicht resektablen Lebermetastasierung onkologische Komplettremissionen erreichen.
- Voraussetzungen für einen derartigen Therapieerfolg sind eine adäquate Patientenselektion, die Individualisierung der Therapie sowie eine optimale Abstimmung der Therapiesequenz.
1. Krebsliga, Krebs in der Schweiz: wichtige Kennzahlen. 2018.
2. Vera, R., et al., Multidisciplinary management of liver metastases in patients with colorectal cancer: a consensus of SEOM, AEC, SEOR, SERVEI, and SEMNIM. Clin Transl Oncol, 2020. 22(5): p. 647-662.
3. Manfredi, S., et al., Epidemiology and management of liver metastases from colorectal cancer. Ann Surg, 2006. 244(2): p. 254-9.
4. Hackl, C., et al., Treatment of colorectal liver metastases in Germany: a ten-year population-based analysis of 5772 cases of primary colorectal adenocarcinoma. BMC Cancer, 2014. 14: p. 810.
5. Riihimaki, M., et al., Patterns of metastasis in colon and rectal cancer. Sci Rep, 2016. 6: p. 29765.
6. Chow, F.C. and K.S. Chok, Colorectal liver metastases: An update on multidisciplinary approach. World J Hepatol, 2019. 11(2): p. 150-172.
7. Petrowsky, H., et al., Modern therapeutic approaches for treatment of malignant liver tumours. Nature Reviews Gastroenterology & Hepatology, 2020, doi: 10.1038/s41575-020-0314-8.
8. Rajakannu, M., et al., Is Cure Possible After Sequential Resection of Hepatic and Pulmonary Metastases From Colorectal Cancer? Clin Colorectal Cancer, 2018. 17(1): p. 41-49.
9. Ubink, I., et al., Surgical and Oncologic Outcomes After Major Liver Surgery and Extended Hemihepatectomy for Colorectal Liver Metastases. Clin Colorectal Cancer, 2016. 15(4): p. e193-e198.
10. Pulitano, C., et al., What defines ‚cure‘ after liver resection for colorectal metastases? Results after 10 years of follow-up. HPB (Oxford), 2010. 12(4): p. 244-9.
11. Creasy, J.M., et al., Actual 10-year survival after hepatic resection of colorectal liver metastases: what factors preclude cure? Surgery, 2018. 163(6): p. 1238-1244.
12. Leoni, S., et al., Contrast-enhanced ultrasound in liver cancer. Hepat Oncol, 2015. 2(1): p. 51-62.
13. Niekel, M.C., S. Bipat, and J. Stoker, Diagnostic imaging of colorectal liver metastases with CT, MR imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment. Radiology, 2010. 257(3): p. 674-84.
14. Floriani, I., et al., Performance of imaging modalities in diagnosis of liver metastases from colorectal cancer: a systematic review and meta-analysis. J Magn Reson Imaging, 2010. 31(1): p. 19-31.
15. Lincke, T. and C.J. Zech, Liver metastases: Detection and staging. Eur J Radiol, 2017. 97: p. 76-82.
16. Lake, E.S., et al., The influence of FDG PET-CT on the detection of extrahepatic disease in patients being considered for resection of colorectal liver metastasis. Ann R Coll Surg Engl, 2014. 96(3): p. 211-5.
17. Agrawal, A. and V. Rangarajan, Appropriateness criteria of FDG PET/CT in oncology. Indian J Radiol Imaging, 2015. 25(2): p. 88-101.
18. Lee, J.H. and S.W. Lee, The Roles of Carcinoembryonic Antigen in Liver Metastasis and Therapeutic Approaches. Gastroenterol Res Pract, 2017. 2017: p. 7521987.
19. Van Cutsem, E., et al., ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol, 2016. 27(8): p. 1386-422.
20. Benoist, S. and B. Nordlinger, The role of preoperative chemotherapy in patients with resectable colorectal liver metastases. Ann Surg Oncol, 2009. 16(9): p. 2385-90.
21. Adam, R., et al., Tumor progression while on chemotherapy: a contraindication to liver resection for multiple colorectal metastases? Ann Surg, 2004. 240(6): p. 1052-61; discussion 1061-4.
22. Karagkounis, G., et al., Incidence and prognostic impact of KRAS and BRAF mutation in patients undergoing liver surgery for colorectal metastases. Cancer, 2013. 119(23): p. 4137-44.
23. Richman, S.D., et al., Intra-tumoral heterogeneity of KRAS and BRAF mutation status in patients with advanced colorectal cancer (aCRC) and cost-effectiveness of multiple sample testing. Anal Cell Pathol (Amst), 2011. 34(1-2): p. 61-6.
24. Tosi, F., et al., Effect of KRAS and BRAF Mutations on Survival of Metastatic Colorectal Cancer After Liver Resection: A Systematic Review and Meta-Analysis. Clin Colorectal Cancer, 2017. 16(3): p. e153-e163.
25. Kow, A.W.C., Hepatic metastasis from colorectal cancer. J Gastrointest Oncol, 2019. 10(6): p. 1274-1298.
26. Mattar, R.E., et al., Preoperative selection of patients with colorectal cancer liver metastasis for hepatic resection. World J Gastroenterol, 2016. 22(2): p. 567-81.
27. Linecker, M., et al., Dealing with insufficient liver remnant: Associating liver partition and portal vein ligation for staged hepatectomy. J Surg Oncol, 2019. 119(5): p. 604-612.
28. Gallinger, S., et al., Liver resection for colorectal cancer metastases. Curr Oncol, 2013. 20(3): p. e255-65.
29. Petrowsky, H., et al., Second liver resections are safe and effective treatment for recurrent hepatic metastases from colorectal cancer: a bi-institutional analysis. Ann Surg, 2002. 235(6): p. 863-71.
30. Clavien, P.A., et al., Strategies for safer liver surgery and partial liver transplantation. N Engl J Med, 2007. 356(15): p. 1545-59.
31. Schnitzbauer, A.A., et al., Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings. Ann Surg, 2012. 255(3): p. 405-14.
32. Chan, A.K.C., et al., The OSLO-COMET Randomized Controlled Trial of Laparoscopic Versus Open Resection for Colorectal Liver Metastases. Ann Surg, 2018. 268(6): p. e69.
33. Fruscione, M., et al., Robotic-assisted versus laparoscopic major liver resection: analysis of outcomes from a single center. HPB (Oxford), 2019. 21(7): p. 906-911.
34. Hagness, M., et al., Liver transplantation for nonresectable liver metastases from colorectal cancer. Ann Surg, 2013. 257(5): p. 800-6.
35. Heinrich, S. and H. Lang, Neoadjuvante Chemotherapie oder primäre Chirurgie bei kolorektalen Lebermetastasen. Der Chirurg, 2014. 85(1): p. 17-23.
36. Lordick, F., et al., Neoadjuvante Chemotherapie oder primäre Chirurgie bei kolorektalen Lebermetastasen. Der Chirurg, 2014. 85(1): p. 11-16.
37. Schmiegel, W., et al., S3-Leitlinie – Kolorektales Karzinom. Z Gastroenterol, 2017. 55(12): p. 1344-1498.
38. Tejpar, S., et al., ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Annals of Oncology, 2016. 27(8): p. 1386-1422.
39. Tsai, M.S., et al., Clinicopathological features and prognosis in resectable synchronous and metachronous colorectal liver metastasis. Ann Surg Oncol, 2007. 14(2): p. 786-94.
40. Adam, R., et al., Managing synchronous liver metastases from colorectal cancer: A multidisciplinary international consensus. Cancer Treatment Reviews, 2015. 41(9): p. 729-741.
41. de Jong, M.C., et al., Repeat curative intent liver surgery is safe and effective for recurrent colorectal liver metastasis: results from an international multi-institutional analysis. J Gastrointest Surg, 2009. 13(12): p. 2141-51.
42. Fong, Y., et al., Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg, 1999. 230(3): p. 309-18; discussion 318-21.
43. Adam, R., et al., The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus. Oncologist, 2012. 17(10): p. 1225-39.
44. Primrose, J., et al., Systemic chemotherapy with or without cetuximab in patients with resectable colorectal liver metastasis: the New EPOC randomised controlled trial. Lancet Oncol, 2014. 15(6): p. 601-11.
45. Adam, R., Chemotherapy and surgery: new perspectives on the treatment of unresectable liver metastases. Ann Oncol, 2003. 14 Suppl 2: p. ii13-6.
46. Cremolini, C., et al., FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol, 2015. 16(13): p. 1306-15.
47. Gruenberger, T., et al., Bevacizumab plus mFOLFOX-6 or FOLFOXIRI in patients with initially unresectable liver metastases from colorectal cancer: the OLIVIA multinational randomised phase II trial. Ann Oncol, 2015. 26(4): p. 702-8.
48. Geissler, M., et al., mFOLFOXIRI + panitumumab versus FOLFOXIRI as first-line treatment in patients with RAS wild- type metastatic colorectal cancer m(CRC): A randomized phase II VOLFI trial of the AIO (AIO- KRK0109). Journal of Clinical Oncology, 2018. 36(15_suppl): p. 3509-3509.
49. Cremolini, C., et al., Activity and Safety of Cetuximab Plus Modified FOLFOXIRI Followed by Maintenance With Cetuximab or Bevacizumab for RAS and BRAF Wild-type Metastatic Colorectal Cancer: A Randomized Phase 2 Clinical TrialCetuximab Plus Modified FOLFOXIRI for RAS and BRAF Wild-type Metastatic Colorectal CancerCetuximab Plus Modified FOLFOXIRI for RAS and BRAF Wild-type Metastatic Colorectal Cancer. JAMA Oncology, 2018. 4(4): p. 529-536.
50. Folprecht, G., et al., Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial. Lancet Oncol, 2010. 11(1): p. 38-47.
51. Ye, L.C., et al., Randomized controlled trial of cetuximab plus chemotherapy for patients with KRAS wild-type unresectable colorectal liver-limited metastases. J Clin Oncol, 2013. 31(16): p. 1931-8.
52. Heinemann, V., et al., Early tumour shrinkage (ETS) and depth of response (DpR) in the treatment of patients with metastatic colorectal cancer (mCRC). European Journal of Cancer, 2015. 51(14): p. 1927-1936.
53. Dienstmann, R., R. Salazar, and J. Tabernero, Molecular Subtypes and the Evolution of Treatment Decisions in Metastatic Colorectal Cancer. American Society of Clinical Oncology Educational Book, 2018(38): p. 231-238.
54. Arnold, D., et al., Prognostic and predictive value of primary tumour side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials. Ann Oncol, 2017. 28(8): p. 1713-1729.
55. Le, D., et al., O-021Safety and antitumor activity of pembrolizumab in patients with advanced microsatellite instability–high (MSI-H) colorectal cancer: KEYNOTE-164. Annals of Oncology, 2018. 29(suppl_5).
56. Lenz, H.-J.J., et al., LBA18_PRDurable clinical benefit with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line therapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). Annals of Oncology, 2018. 29(suppl_8).
57. Kopetz, S., et al., Updated results of the BEACON CRC safety lead-in: Encorafenib (ENCO) + binimetinib (BINI) + cetuximab (CETUX) for BRAFV600E-mutant metastatic colorectal cancer (mCRC). Journal of Clinical Oncology, 2019. 37(4_suppl): p. 688-688.
58. Corcoran, R.B., et al., Combined BRAF, EGFR, and MEK Inhibition in Patients with BRAFV600E-Mutant Colorectal Cancer. Cancer Discovery, 2018: p. CD-17-1226.
59. AWMF, S3 Leitlienie Kolorektales Karzinom. 2019.
60. Liu, S.L. and W.Y. Cheung, Role of surveillance imaging and endoscopy in colorectal cancer follow-up: Quality over quantity? World J Gastroenterol, 2019. 25(1): p. 59-68.
der informierte @rzt
- Vol. 10
- Ausgabe 8
- August 2020