- Polyzystische Erkrankungen des Pankreas
Aufgrund verbesserter Diagnostik stellen Polyzystische Erkrankungen des Pankreas eine zunehmend häufiger diagnostizierte Entität dar. Die Bandbreite reicht von benignen Pseudozysten über prämaligne Läsionen wie intraduktal papilläre muzinöse Neoplasien (IPMN) bis hin zu potenziell malignen Neoplasien wie der muzinösen zystischen Neoplasie (MCN) oder der solid-pseudopapillären Neoplasie (SPN). Die Magnetresonanz-Cholangiopankreatikographie (MRCP) gilt neben endoskopischen Verfahren, Blutuntersuchungen und genetischen Analysen als Goldstandard in der Diagnostik. Der Therapieentscheid basiert auf Malignitätsrisiken, klinischer Symptomatik sowie morphologischen Merkmalen und bedingt meist die Resektion oder Überwachung. Die Betreuung dieser Patient/-innen gehört in spezialisierte Referenzzentren.
Due to improved diagnostic techniques, polycystic diseases of the pancreas are being diagnosed with increasing frequency. The spectrum ranges from benign pseudocysts to premalignant lesions such as intraductal papillary mucinous neoplasms (IPMN), and potentially malignant neoplasms like mucinous cystic neoplasms (MCN) or solid pseudopapillary neoplasms (SPN). Magnetic resonance cholangiopancreatography (MRCP), along with endoscopic procedures, blood tests, and genetic analyses, is considered the gold standard in diagnostics. Therapeutic decisions are based on malignancy risk, clinical symptoms, and morphological features, and typically involve either surgical resection or surveillance. The management of these patients should take place in specialized centers.
Keywords: PCL, IPMN, MCN, Pseudozysten, Pankreas
Einleitung
Die Inzidenz der diagnostizierten polyzystischen Erkrankungen des Pankreas hat in den letzten Jahren aufgrund der verbesserten und gehäuften Diagnostik (insbesondere Sonographie- und CT-Untersuchung) stark zugenommen (1). So wird zwar in der Literatur zwischen sehr niedrigen bis relativ hohen Inzidenzen (0.2–44%) von zystischen Läsionen des Pankreas berichtet, durch den jedoch immer breiteren Einsatz von Magnetresonanztomographien (MRT) steigt die Inzidenz zusätzlich (1). Es sollte bei allen Patient/-innen eine sorgfältige Diagnostik durch Spezialist/-innen durchgeführt werden, da es eine grosse Bandbreite zwischen benignen, prämalignen und malignen zystischen Läsionen gibt (2). Durch eine sorgfältige und fachgerechte initiale Abklärung kann ein individueller Überwachungs- und/oder Behandlungsplan mit den Patient/-innen ausgearbeitet werden.
Die wichtigsten zu kennenden polyzystischen Erkrankungen des Pankreas, ihre Diagnostik und Therapie werden in den folgenden Zeilen näher erläutert.
Entitäten
Die mit Abstand häufigste und zum Glück meist harmlose zystische Erkrankung des Pankreas ist die als Folge einer akuten Entzündung entstandene Pseudozyste. Sie macht ungefähr 75 % aller zystischen Läsionen des Pankreas (PCL) aus (3). Einer der Schwerpunkte eines Pankreaszentrums besteht heute in der Abklärung und Beurteilung zystischer Tumore der Bauchspeicheldrüse, die mit unterschiedlichen Prävalenzen in vier Typen aufgeteilt werden. Die intraduktal papilläre muzinöse Neoplasie (IPMN), die serös zystische Neoplasie (SCN), die muzinös zystische Neoplasie (MCN) und die solid pseudopapilläre Neoplasie (SPN) (4).
Als seltene Differentialdiagnose, vor allem bei multifokalen zystischen Pankreaspathologien, muss zudem eine zystische neuroendokrine Neoplasie zum Beispiel im Rahmen eines MEN-Syndroms im Hinterkopf behalten werden (5).
Pseudozysten
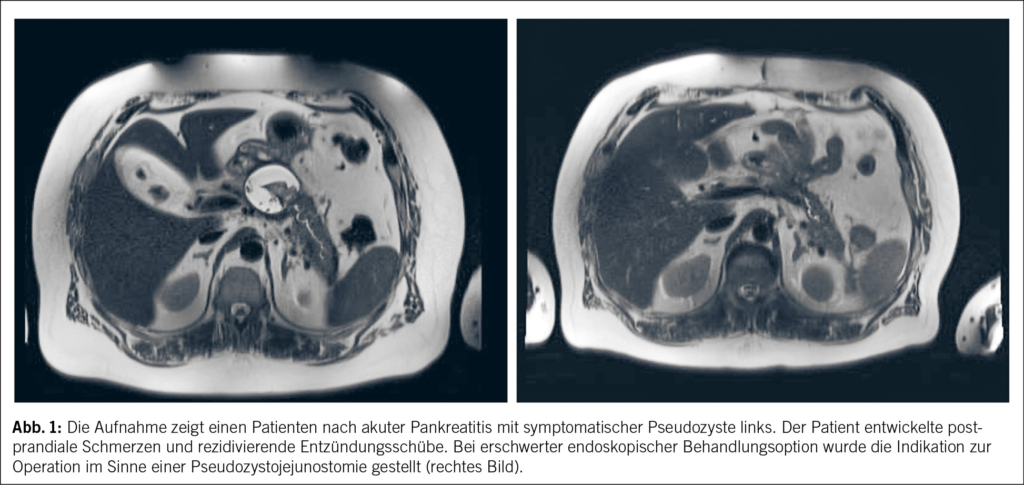
Pseudozysten entstehen als Folge einer Pankreatitis und können definitionsgemäss frühestens 4 Wochen nach einer akuten Entzündung des Pankreas als solche klassifiziert werden. Sie sind gewöhnlich peripankreatisch lokalisiert und bestehen aus einer soliden entzündlichen Wand und Flüssigkeit unterschiedlicher Dichte. Solide Anteile können Nekrosen entsprechen, die ein höheres Komplikationsrisiko mit sich bringen und deshalb engmaschiger überwacht werden müssen. Die enthaltene Flüssigkeit innerhalb der Zyste hat einen hohen Gehalt an Pankreasenzymen und entsteht als Folge der Ruptur eines Pankreasganges im Rahmen der akuten meist schweren Entzündung mit zumindest lokalisierter Nekrose eines Nebenganges erster oder zweiter Ordnung (6). Obwohl mittels Sonographie und Computertomographie eine Pseudozyste diagnostiziert werden kann, gilt die Magnetresonanztomographie (MRCP) als Goldstandard (7). Bei der MRCP helfen insbesondere die T2-haste Sequenzen das pankreatobiliäre System darzustellen und die Pseudozysten zu diagnostizieren (8). Sofern bei den Patient/-innen keine Beschwerden (Schmerzen, Druck, postprandiale Schmerzen, Fieber etc.) und keine Komplikationen wie Ruptur, Hämorrhagie, Infektion oder Obstruktion gastrointestinaler oder vaskulärer Strukturen bestehen oder drohen zu entstehen, so gilt es keine Massnahme zu verfolgen (9, 10). Im Falle von Symptomen oder (drohenden) Komplikationen kommt es in der Regel zur endoskopischen (transgastrisch, transduodenal) perkutanen oder operativen Drainageneinlage (11), zur konservativen Behandlung (supportive care) (9) oder, wenn auch heute eher seltener, zur Operation. Im Falle einer Operation gibt es verschiedene Möglichkeiten die Zyste zu entlasten (Abb. 1). Dazu gehört einerseits die meist minimal invasiv operativ durchgeführte Draineinlage oder die Durchführung einer inneren Stomie/Verbindung, welche in der Regel über den Magen (Gastrozystostomie) oder den Dünndarm (Enterozystostomie) geschieht (10, 12). Gleichzeitig sollte die in der Regel ursächliche Gewebsnekrose möglichst vollständig entfernt werden (Nekrosektomie) (13).
Intraduktal papilläre muzinöse Neoplasie (IPMN)
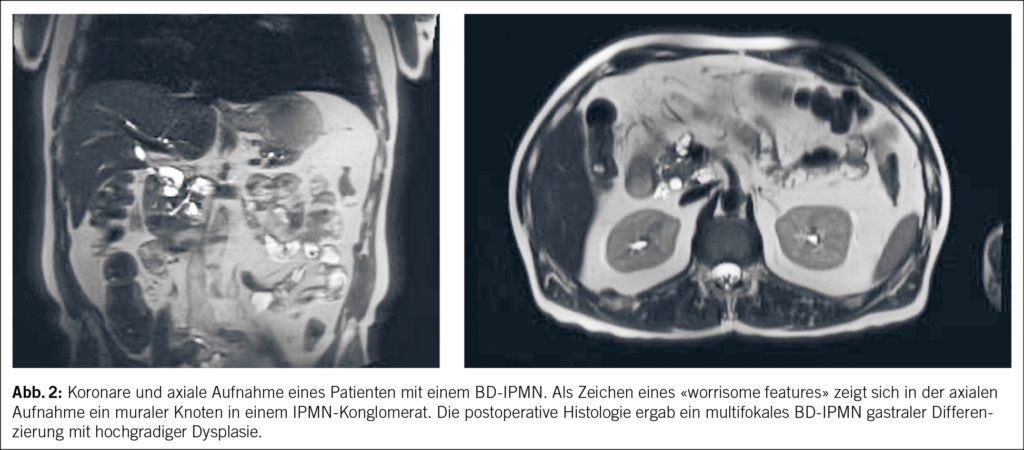
Die IPMNs treten neben den Pseudozysten am häufigsten auf und müssen als prämaligne Läsionen angesehen werden. Es sind schleimbildende zystische Tumore, welche aufgrund ihres Bezugs zum Pankreasgangsystem in Hauptgangs- (MD-), Nebengangs- (BD-) und Mixed-type-IPMNs unterteilt werden (14). Die Inzidenz beträgt bei uns ungefähr 2.6 % und sie werden, weil zu 80 % asymptomatisch, meist zufällig diagnostiziert. In rund 80 % der Fälle handelt es sich um BD-IPMNs (15, 16) (Abb. 2) . Die morphologischen Subtypen der IPMNs sind der gastrische, intestinale, pankreatobiliäre und onkozytäre Typ und sie werden zusätzlich zwischen low-grade dysplastischen, high-grade dysplastischen und karzinomatös entarteten Entitäten unterschieden (17-20). Dabei hat der pankreatobiliäre Typ die grösste Wahrscheinlichkeit für eine maligne Entartung (18).
Nach einer obligaten MRCP wird oft zusätzlich eine Gastroduodenoskopie mit Endosonographie durchgeführt. Bei grosser Expertise des Untersuchers/Untersucherin kann eine EUS-gezielte Biopsie mit Gewebe-/Flüssigkeitsgewinnung erfolgen. Sie gibt bei genügendem Material Aufschluss über die genaue Entität sowie das Genmutationsmuster, was uns hilft, den Patient/-innen individuelle Therapie- und Überwachungspläne vorzuschlagen.
Dies ist eine alltägliche Herausforderung bei Patienten mit IPMNs, da vor allem bei betagten Menschen je nach biologischem/chronologischem Alter zusätzlich medizinische, sozioökonomische und ethische Faktoren in der Surveillance berücksichtigt werden müssen.
Verschiedene Guidelines helfen bei der Orientierung (14, 21, 22). Die bekannteste ist die erst kürzlich revidierte Fukuoka-Guideline, welche nun als Kyoto-Guideline bezeichnet wird. Als Hilfestellung kommen hierbei die sogenannten «high-risk-stigmata» (HRS) und «worrisome features» (WF) zum Zug. Hierbei werden radiologische Zeichen, welche in der Dysplasie- und Karzinomentwicklung typisch sind, als auch demographische Angaben der Patient/-innen beurteilt. Zu den Risikoformationen gehören beispielsweise Gangdilatationen (MPD >5mm), murale Knoten, Pankreatitiden, erhöhte Tumormarker (CA19-9) oder eine verdickte und meist auch unregelmässige Zystenwand. Auf der Basis dieser Erkenntnisse wird anschliessend ein Beobachtungsalgorithmus und/oder Behandlungsplan erstellt.
Durch die immer breitere Anwendung des Next Generation Sequencing (NGS) können durch Gewebe- und/oder Flüssigkeitsgewinnung die IPMNs genauer differenziert werden. In verschiedenen Studien konnte somit gezeigt werden, dass Mutationen in den Genen KRAS oder GNAS früh in der Dysplasie – Karzinom Entwicklung auftreten können und sich über die Zeit Mutationen in TP53, TP16/CDKN2 oder SMAD4 dazugesellen, die dann bei high-grade Dysplasien oder invasiven Karzinomen typischerweise vorkommen (23).
Grundsätzlich liegt das maligne Transformationspotenzial bei MD-IPMNs (40-60 %) deutlich über demjenigen von BD-IPMNs (19-30 %) und muss aufgrund dessen bereits dadurch entsprechend unterschiedlich überwacht werden. Eine in der jüngsten Vergangenheit neue Betrachtung sind die IPMNs aus dem Pankreasgang des Processus uncinatus. Es wird darüber diskutiert, diese aufgrund ihres Ursprungs (dorsale Anlage) nicht als BD sondern als MD oder zumindest als zusätzlicher Risikofaktor anzusehen (24).
Das Ziel einer Surveillance muss sein, die Patient/-innen nicht zu früh, aber dennoch im prämalignen Stadium zu operieren. Aus IPMN entstandene Adenokarzinome des Pankreas weisen die gleich triste Prognose auf wie die «üblichen» Bauchspeicheldrüsenkrebse, sind zu 80% fernmetastasiert und kurativ behandelbare Patienten werden multimodal onkologisch und chirurgisch therapiert. Der Aufwand und insbesondere die Belastung perioperativ und in der Erholungsphase ist für den Patienten bei einer Operationsindikation bei einem IPMN-Dysplasiestadium unvergleichlich geringer. Pankreatektomien können limitiert werden, lokale Resektionen oder Enukleationen sind Optionen. Das perationstrauma und –ausmass ist deutlich reduziert und entsprechend kann die Lebensqualität gesteigert werden (25). In vereinzelt kleineren Studien sind auch minimal invasivere Therapiemethoden wie beispielsweise endoskopisch gesteuerte Radiofrequenzablationen (RFA) oder Kryoablationen mit Überlebensvorteil und Lebensqualitätsverbesserung beschrieben. Dies sollte jedoch nur bei Patient/-innen angewendet werden, die kontraindiziert für eine Resektion sind (26, 27).
Serös zystische Neoplasie (SCN)
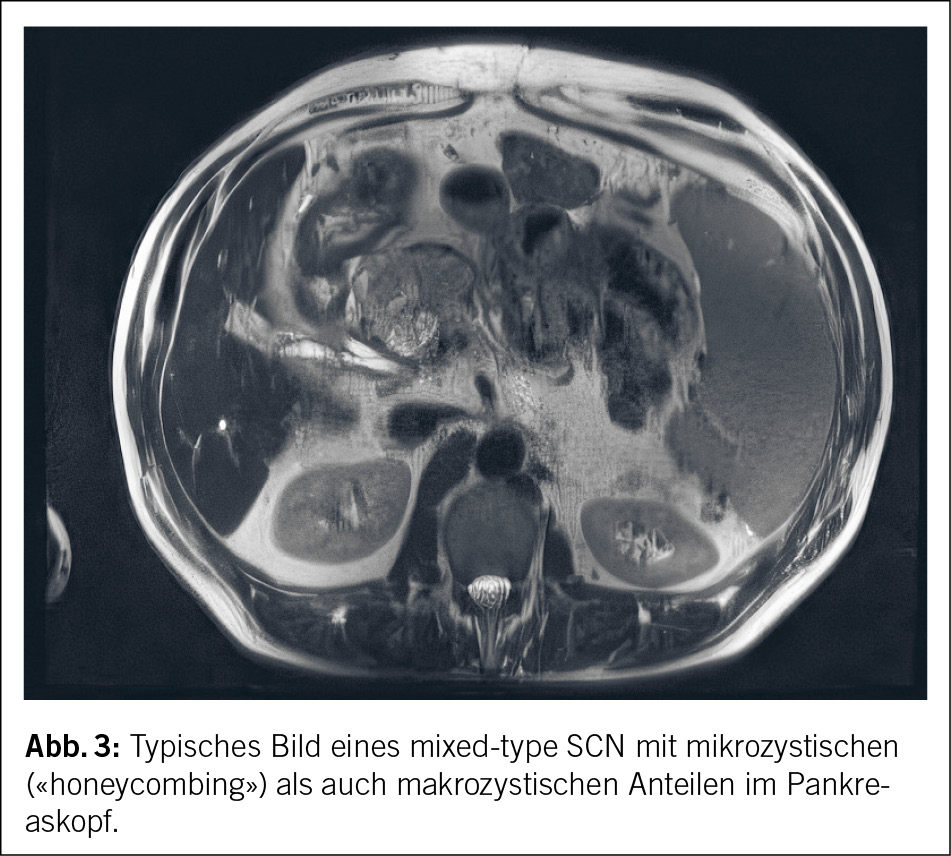
Die serösen Zystadenome werden gehäuft bei Frauen im 60. Lebensjahrzehnt diagnostiziert (28). Nicht selten ist zudem bei Patienten mit einem von-Hippel-Lindau Syndrom (VHL) ein SCN zu finden. Die SCN können grob in mikrozystische, makrozystische, mixed type und solide Typen unterschieden werden, wobei die mikrozystische Variante am häufigsten vorkommt (28). In der Bildgebung stellen sie sich je nach Variante als ein Zystenkonglomerat mit vielen kleinen und dünnwandigen Zystenwänden dar (Abb. 3). In bis zu 30 % kann in der Computertomographie eine Verkalkung gesehen werden. Charakteristisch ist eine zentrale Narbe. Bei SCN kommt es in der Regel eher selten zu einer Gangdilatation oder zur Parenchymatrophie (29). Analog zum IPMN wird die SCN in der Regel mittels MRCP, CT und/oder Endosonographie diagnostiziert. Im Vergleich zu den IPMNs ist per Definition kein Verbindungsgang zum Pankreashauptgang zu finden. Durch eine Flüssigkeitsanalyse mittels einer Feinnadelaspiration (FNA) können verschiedene Marker wie Carcinoembryonic antigen (CEA), Amylase oder Glucose bestimmt und so Ausschlussdiagnosen gestellt werden. Typischerweise ist bei der SCN die Amylase und das CEA tief.
Maligne Transformationen bei SCNs wurden bis anhin nur in vereinzelten case studies beschrieben, kommen aber vor und das Risiko wurde auf Grund einer Literaturanalyse in den Bereich 2–3 % beziffert (30). Dadurch sind sie in der Regel nur bei Symptomen (ca. 20–30 %), einer Grösse >4cm oder bei (drohenden) Komplikationen zu entfernen (31, 32).
Muzinös zystische Neoplasie (MCN)
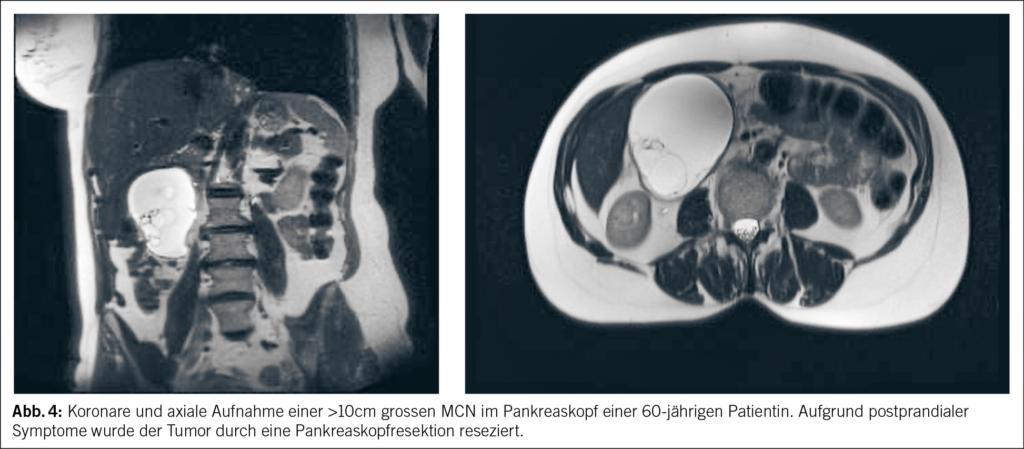
Die muzinös zystische Neoplasie bildet wie es der Name impliziert Schleim und ist somit den IPMNs sehr ähnlich. MCNs bestehen aus einem Ovar-ähnlichen Stroma und kommen beinahe nur bei Frauen vor. Gehäuft tritt sie im Alter zwischen 40–60 Jahren auf und befindet sich in der Regel im Pankreaskorpus oder -schwanz (33). Die MCN können groteske Grössen annehmen und können somit gemäss Literatur und in der eigenen Erfahrung über 30cm gross werden. Im Vergleich zu den IPMNs besitzen die MCNs wie auch die SCN’s keine Verbindung zum Pankreasgang. Somit kann auch keine erhöhte Konzentration an Lipase und Amylase in einer FNA-Probe aus der Zystenflüssigkeit beobachtet werden (33). Zur Standardabklärung gehört jedoch wie praktisch immer bei zystischen Tumoren des Pankreas die Durchführung einer MRCP, Laborkontrollen (insbesondere CEA und CA19-9) und gegebenenfalls eine Endosonographie (33, 34). Aufgrund des Risikos einer malignen Entartung wird die Indikation zur Resektion im Vergleich zur SCN grosszügiger gestellt. Die in der Literatur jedoch berichtete Malignitätsrate liegt klar tiefer als die der IPMNs (35). Als grober Cut-off für eine Resektion gilt der Durchmesser von >4cm. Ab dieser Grösse steigt das Entartungs- und Rupturrisiko klar. Zusätzlich muss bedacht werden, dass es bei Frauen im gebärfähigen Alter im Rahmen einer Schwangerschaft zur Grössenprogredienz kommen kann (33, 36) (Abb.4).
Solid pseudopapilläre Neoplasie (früher Frantz-Tumor)
Die Eigenheit dieser seltensten zystischen Neoplasie des Pankreas ist, dass die Pathogenese bis heute unklar ist. Sie machen ungefähr 2 % aller Pankreastumoren aus und zeigen grösstenteils eine low-grade Dysplasie mit langsamer Progredienz (37). Sie können allerdings metastasieren – dann typischerweise in die Leber. Ein hauptsächliches Vorkommen bei jüngerem weiblichen Geschlecht legt jedoch nahe, dass chromosomale und karyotypische Faktoren eine entscheidende Rolle in der Entwicklung dieser Neoplasie spielen (38, 39).
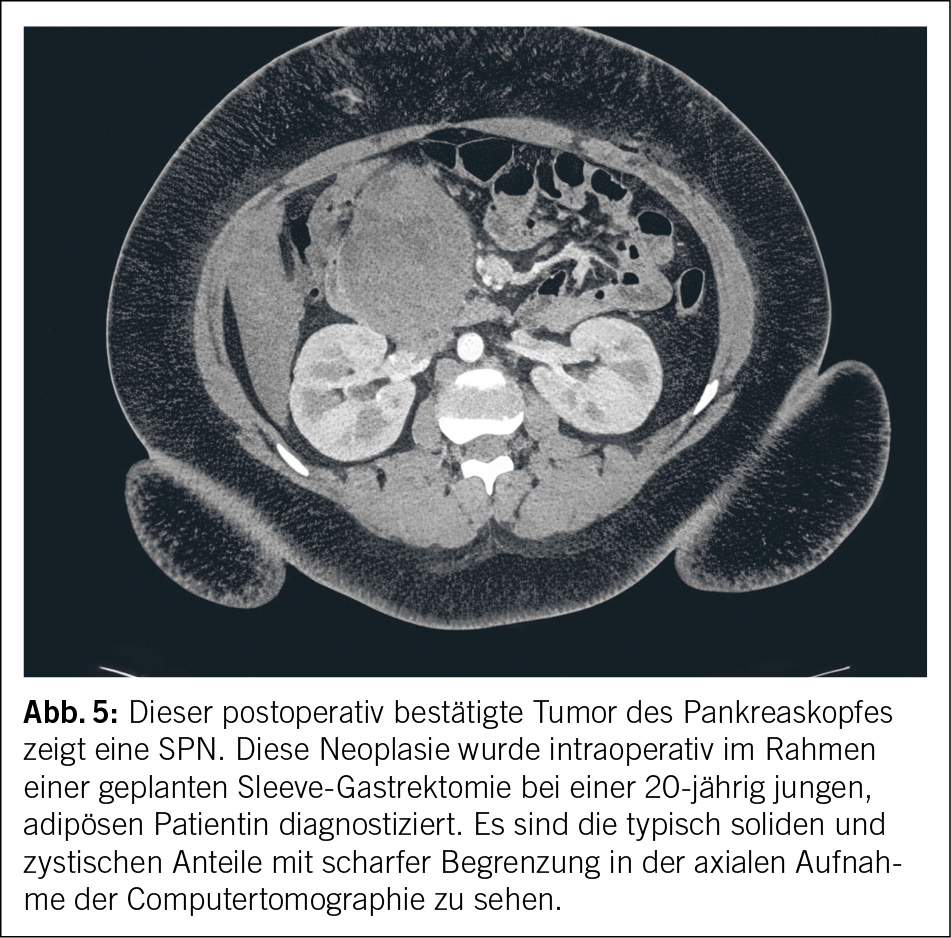
Histopathologisch zeigen sich SPNs in der Regel als solid und gut definiert, mit entsprechend verschiedenen hämorrhagischen, nekrotischen und pseudozystischen Anteilen (40) (Abb. 5).
Diagnostiziert werden SPNs in der Regel mittels CT und MRI. Dort sieht man typischerweise einen Tumor mit zystischen und soliden Anteilen mit klarer Abkapselung. Kalzifikationen im Randbereich können auftreten (41). Zur Bestätigung der Diagnose erfolgt anschliessend eine Endosonographie mit einer FNA (42). SPNs können die ganze Drüse befallen, werden jedoch hauptsächlich im Körper- oder Schwanzbereich vorgefunden. Vereinzelt sind auch extrapankreatische SPNs in der Literatur beschrieben (43). Die Therapie der Wahl ist die minimal invasive (laparoskopisch, Roboter-assistiert) Resektion. Obwohl ein Lymphknotenbefall selten ist, gibt es in der Literatur Hinweise dafür, dass es zu einem lymphatischen Rezidiv kommen kann, auch wenn initial keiner beschrieben wurde (44). Auch im metastasierten Stadium ist eine Resektion des Primärtumors mit, sofern möglicher, synchroner Resektion der Metastasen indiziert (45).
Artificial intelligence in der Radiologie
Der technologische Fortschritt macht logischerweise auch vor der Medizin nicht Halt und so kommen neuartige Hilfsmittel immer mehr zum Einsatz. Ein Beispiel dabei ist auch die Künstliche Intelligenz (AI). So konnte bereits in Studien aus dem Jahr 2001 gezeigt werden, dass AI eine bessere Sensitivität und Spezifität in der Unterscheidung zwischen fokaler benigner Pankreatitis und Malignität im Gegensatz zu erfahrenen Endoskopierern aufweist. Auch in der Risikostratifizierung von IPMNs zeigte AI deutlich bessere und verlässlichere Aussagen als Endoskopiererinnen und Endoskopierer. Analog zu der AI bei der Endosonografie kommen bei MRI- und CT- Untersuchungen sogenannte Radiomics zum Einsatz. In der Zukunft wird vermutlich aus den verfügbaren Daten eines Patienten mit Hilfe von Machine learning Algorithmen eine Diagnose und darauf aufbauend ein Behandlungsplan erstellt und somit Guidelines entsprechend ergänzt (46).
Fazit
Polyzystische Erkrankungen des Pankreas umfassen viele verschiedene Entitäten. In diesem Übersichtsartikel sind die wichtigsten beschrieben, die in einer spezialisierten Pankreassprechstunde einen wichtigen Platz einnehmen und wesentliche Ressourcen binden. Die Diagnosen dieser Erkrankungen bedürfen diverser Abklärungen in einem sehr erfahrenen multidisziplinären Team wie Radiolog/-innen, Gastroenterolog/-innen, Genetiker/-innen, Internist/-innen, Onkolog/-innen und Chirurg/-innen. Zusätzlich wird die AI eine zunehmend wichtige Rolle in der Diagnostik und dem Behandlungsalgorithmus spielen und in Zukunft können wir vermutlich anhand von prätherapeutischen Gewebeuntersuchungen das Dysplasiestadium deutlich genauer einteilen. Entscheidend dabei ist allerdings ein sich verantwortlich fühlendes häufig eher kleines Team an Pankreasspezialisten (Aficionados). Nur durch die Erfahrung und der gemeinsamen multidisziplinären Behandlung können diese Patient/-innen fachgerecht beraten, überwacht und therapiert werden. Wenn immer eine zystische Erkrankung diagnostiziert wurde, so ist dieser Patient oder diese Patientin in ein Referenzzentrum zuzuweisen.
Copyright
Aerzteverlag medinfo AG
Chefarzt Pankreas Klinik Schwei
Pankreas Klinik Schweiz
& Berner Viszeral Chirurgie,
Schänzlihalde 1
3013 Bern
Assitenzarzt Chirurgie
Pankreas Klinik Schweiz
& Berner Viszeral Chirurgie,
Schänzlihalde 1
3013 Bern
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Die häufigste zystische Erkrankung des Pankreas ist die Pseudozyste, gefolgt von den IPMNs.
- Bei einer polyzystischen Erkrankung des Pankreas sollte in der Regel immer ein MRCP durchgeführt werden.
- Nicht selten bedürfen polyzystische Erkrankungen keiner weiteren Therapie und können überwacht werden. Je nach Malignitätspotenzial, Symptomen oder Komplikationsrisiken sollte jedoch früh genug therapiert werden.
- Die Abklärung und Behandlung einer polyzystischen Erkrankung des Pankreas gehört durch ein interdisziplinäres Team in einem spezialisierten Referenzzentrum durchgeführt.
1. Moris M, Bridges MD, Pooley RA, Raimondo M, Woodward TA, Stauffer JA, et al. Association Between Advances in High-Resolution Cross-Section Imaging Technologies and Increase in Prevalence of Pancreatic Cysts From 2005 to 2014. Clinical Gastroenterology and Hepatology. 2016;14(4):585-93.e3.
2. Zerboni G, Signoretti M, Crippa S, Falconi M, Arcidiacono PG, Capurso G. Systematic review and meta-analysis: Prevalence of incidentally detected pancreatic cystic lesions in asymptomatic individuals. Pancreatology. 2019;19(1):2-9.
3. Gupta A, Chennatt JJ, Mandal C, Gupta J, Krishnasamy S, Bose B, et al. Approach to Cystic Lesions of the Pancreas: Review of Literature. Cureus. 2023;15(3):e36827.
4. Khan A, Khosa F, Eisenberg RL. Cystic Lesions of the Pancreas. American Journal of Roentgenology. 2011;196(6):W668-W77.
5. Caglià P, Cannizzaro MT, Tracia A, Amodeo L, Tracia L, Buffone A, et al. Cystic pancreatic neuroendocrine tumors: To date a diagnostic challenge. International Journal of Surgery. 2015;21:S44-S9.
6. Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, et al. Classification of acute pancreatitis—2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62(1):102-11.
7. Morgan DE, Baron TH, Smith JK, Robbin ML, Kenney PJ. Pancreatic fluid collections prior to intervention: evaluation with MR imaging compared with CT and US. Radiology. 1997;203(3):773-8.
8. Habashi S, Draganov PV. Pancreatic pseudocyst. World J Gastroenterol. 2009;15(1):38-47.
9. Koo JG, Liau MYQ, Kryvoruchko IA, Habeeb TA, Chia C, Shelat VG. Pancreatic pseudocyst: The past, the present, and the future. World J Gastrointest Surg. 2024;16(7):1986-2002.
10. Gurusamy KS, Pallari E, Hawkins N, Pereira SP, Davidson BR. Management strategies for pancreatic pseudocysts. Cochrane Database Syst Rev. 2016;4(4):Cd011392.
11. Elfert K, Chamay S, Santos LD, Mohamed M, Beran A, Jaber F, et al. Increasing trend of endoscopic drainage utilization for the management of pancreatic pseudocyst: insights from a nationwide database. Clin Endosc. 2024;57(1):105-11.
12. Xiao NJ, Cui TT, Liu F, Li W. Current status of treatments of pancreatic and peripancreatic collections of acute pancreatitis. World J Gastrointest Surg. 2021;13(7):633-44.
13. Sata N, Koizumi M, Lefor AK. Pseudocysts and Walled-Off Necrosis After Acute Pancreatitis. The Pancreas2023. p. 288-93.
14. Ohtsuka T, Fernandez-del Castillo C, Furukawa T, Hijioka S, Jang J-Y, Lennon AM, et al. International evidence-based Kyoto guidelines for the management of intraductal papillary mucinous neoplasm of the pancreas. Pancreatology. 2024;24(2):255-70.
15. Kromrey M-L, Bülow R, Hübner J, Paperlein C, Lerch MM, Ittermann T, et al. Prospective study on the incidence, prevalence and 5-year pancreatic-related mortality of pancreatic cysts in a population-based study. Gut. 2018;67(1):138-45.
16. Tanaka S, Tsujimae M, Masuda A, Inoue J, Inomata N, Uemura H, et al. Metabolic Syndrome Accelerates the Age-Related Increase of Intraductal Papillary Mucinous Neoplasm of the Pancreas. Pancreas. 2024;53(1):e9-e15.
17. Basturk O, Esposito I, Fukushima N, Furukawa T, Hong S, Kloppel G. Tumours of the pancreas. WHO classification of tumours: digestive system. 2019.
18. Hruban RH, Takaori K, Klimstra DS, Adsay NV, Albores-Saavedra J, Biankin AV, et al., editors. An illustrated consensus on the classification of pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms. American Journal of Surgical Pathology; 2004.
19. Furukawa T. Mechanisms of development and progression of pancreatic neoplasms. Pathology International. 2022;72(11):529-40.
20. Wood LD, Adsay NV, Basturk O, Brosens LAA, Fukushima N, Hong S-M, et al. Systematic review of challenging issues in pathology of intraductal papillary mucinous neoplasms. Pancreatology. 2023;23(7):878-91.
21. Vege SS, Ziring B, Jain R, Moayyedi P, Adams MA, Dorn SD, et al. American Gastroenterological Association Institute Guideline on the Diagnosis and Management of Asymptomatic Neoplastic Pancreatic Cysts. Gastroenterology. 2015;148(4):819-22.
22. Pancreas TESGoCTot. European evidence-based guidelines on pancreatic cystic neoplasms. Gut. 2018;67(5):789-804.
23. Omori Y, Ono Y, Tanino M, Karasaki H, Yamaguchi H, Furukawa T, et al. Pathways of Progression From Intraductal Papillary Mucinous Neoplasm to Pancreatic Ductal Adenocarcinoma Based on Molecular Features. Gastroenterology. 2019;156(3):647-61.e2.
24. AlMasri SS, Zenati MS, Dasyam A, Singhi AD, Lee KK, Bartlett DL, et al. Significance of Uncinate Duct Dilatation in IPMNs: A New High-risk Criterion? Annals of Surgery. 2022;275(6):e789-e95.
25. Hirono S, Yamaue H. Surgical strategy for intraductal papillary mucinous neoplasms of the pancreas. Surgery Today. 2020;50(1):50-5.
26. Karaisz FG, Elkelany OO, Davies B, Lozanski G, Krishna SG. A Review on Endoscopic Ultrasound-Guided Radiofrequency Ablation (EUS-RFA) of Pancreatic Lesions. Diagnostics (Basel). 2023;13(3).
27. Kongkam P, Peng Teng ML, Cañones A, Tantitanawat K, Tiankanon K, Angsuwatcharakon P, et al. Long-term survival and quality of life improvement in patients with large unresectable malignant main-duct IPMN treated with EUS-guided RFA (with video). Pancreatology. 2025.
28. Kimura W, Moriya T, Hanada K, Abe H, Yanagisawa A, Fukushima N, et al. Multicenter Study of Serous Cystic Neoplasm of the Japan Pancreas Society. Pancreas. 2012;41(3):380-7.
29. Lopes Vendrami C, Hammond NA, Escobar DJ, Zilber Z, Dwyer M, Moreno CC, et al. Imaging of pancreatic serous cystadenoma and common imitators. Abdominal Radiology. 2024;49(10):3666-85.
30. Strobel O, Z’graggen K, Schmitz-Winnenthal FH, Friess H, Kappeler A, Zimmermann A, et al. Risk of Malignancy in Serous Cystic Neoplasms of the Pancreas. Digestion. 2003;68(1):24-33.
31. Jais B, Rebours V, Malleo G, Salvia R, Fontana M, Maggino L, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas). Gut. 2016;65(2):305-12.
32. Tseng JF, Warshaw AL, Sahani DV, Lauwers GY, Rattner DW, Castillo CF-d. Serous Cystadenoma of the Pancreas: Tumor Growth Rates and Recommendations for Treatment. Annals of Surgery. 2005;242(3):413-21.
33. Nilsson LN, Keane MG, Shamali A, Millastre Bocos J, Marijinissen van Zanten M, Antila A, et al. Nature and management of pancreatic mucinous cystic neoplasm (MCN): A systematic review of the literature. Pancreatology. 2016;16(6):1028-36.
34. Duffy MJ, Sturgeon C, Lamerz R, Haglund C, Holubec VL, Klapdor R, et al. Tumor markers in pancreatic cancer: a European Group on Tumor Markers (EGTM) status report. Annals of Oncology. 2010;21(3):441-7.
35. Crippa S, Salvia R, Warshaw AL, Domínguez I, Bassi C, Falconi M, et al. Mucinous cystic neoplasm of the pancreas is not an aggressive entity: Lessons from 163 resected patients. Annals of Surgery. 2008;247(4):571-9.
36. Naganuma S, Honda K, Noriki S, Kimura S, Murakami M, Koneri K, et al. Ruptured mucinous cystic neoplasm with an associated invasive carcinoma of pancreatic head in a pregnant woman: Report of a case and review of literature. Pathology International. 2011;61(1):28-33.
37. Zalatnai A, Kis-Orha V. Solid-pseudopapillary Neoplasms of the Pancreas is still an Enigma: a Clinicopathological Review. Pathol Oncol Res. 2020;26(2):641-9.
38. Lam KY, Lo CY, Fan ST. Pancreatic solid-cystic-papillary tumor: Clinicopathologic features in eight patients from Hong Kong and review of the literature. World Journal of Surgery. 1999;23(10):1045-50.
39. Grant LD, Lauwers GY, Meloni AM, Stone JF, Betz JL, Vogel S, et al. Unbalanced chromosomal translocation, der(17)t(13;17)(q14;p11) in a solid and cystic papillary epithelial neoplasm of the pancreas. American Journal of Surgical Pathology. 1996;20(3):339-45.
40. Din NU, Rahim S, Abdul-Ghafar J, Ahmed A, Ahmad Z. Clinicopathological and immunohistochemical study of 29 cases of solid-pseudopapillary neoplasms of the pancreas in patients under 20 years of age along with detailed review of literature. Diagn Pathol. 2020;15(1):139.
41. Choi J-Y, Kim M-J, Kim JH, Kim SH, Lim JS, Oh YT, et al. Solid Pseudopapillary Tumor of the Pancreas: Typical and Atypical Manifestations. American Journal of Roentgenology. 2006;187(2):W178-W86.
42. Reddy S, Cameron JL, Scudiere J, Hruban RH, Fishman EK, Ahuja N, et al. Surgical Management of Solid-Pseudopapillary Neoplasms of the Pancreas (Franz or Hamoudi Tumors): A Large Single-Institutional Series. Journal of the American College of Surgeons. 2009;208(5):950-7.
43. Mazzarella G, Muttillo EM, Coletta D, Picardi B, Rossi S, Rossi Del Monte S, et al. Solid pseudopapillary tumor of the pancreas: A systematic review of clinical, surgical and oncological characteristics of 1384 patients underwent pancreatic surgery. Hepatobiliary & Pancreatic Diseases International. 2024;23(4):331-8.
44. Kim MJ, Choi DW, Choi SH, Heo JS, Sung J-Y. Surgical treatment of solid pseudopapillary neoplasms of the pancreas and risk factors for malignancy. British Journal of Surgery. 2014;101(10):1266-71.
45. Zhang C, Liu F, Chang H, Li H, Zhou X, Lu J, et al. Less Aggressive Surgical Procedure for Treatment of Solid Pseudopapillary Tumor: Limited Experience from a Single Institute. PLOS ONE. 2015;10(11):e0143452.
46. Rangwani S, Ardeshna DR, Rodgers B, Melnychuk J, Turner R, Culp S, et al. Application of Artificial Intelligence in the Management of Pancreatic Cystic Lesions. Biomimetics (Basel). 2022;7(2).
der informierte @rzt
- Vol. 15
- Ausgabe 9
- September 2025