- Direkte orale Antikoagulantien (DOAK)
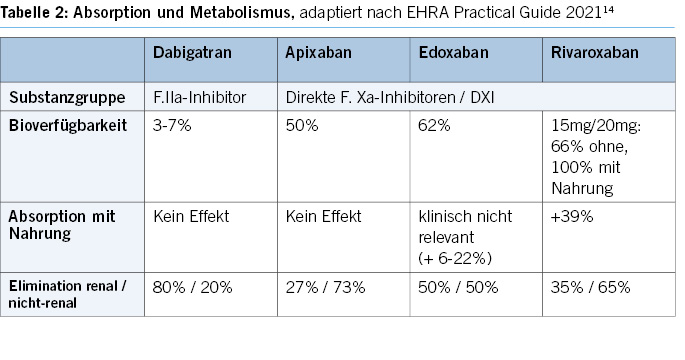
Direkte orale Antikoagulantien (DOAKs) werden aufgrund ihres vorteilhaften Nutzen-Risiko-Profils gegenüber Vitamin-K-Antagonisten bevorzugt empfohlen zur Schlaganfallprophylaxe bei Vorhofflimmern sowie Therapie und Sekundärprävention der venösen Thromboembolie. Die vorliegende Leitlinie gibt Hinweise zum praktischen Einsatz der DOAKs, deren Vor- und Nachteilen und Limitationen. Sie basiert auf Empfehlungen internationaler Guidelines (ESC, EHRA, DGA) und adaptiert diese für das hausärztliche Setting in der Schweiz.
1. DOAK-Substanzen im Überblick 1-11
Vorteile von DOAK:
- Feste Dosis, kein Therapiemonitoring
- Rascher Wirkbeginn (innerhalb 2–4 h) und rasches Ende der Wirksamkeit, damit
- günstig bei zu erwartender kurzer Therapiedauer (z.B. bei VTE mit Antikoagulation ≤ 3 Monate) sowie für Patienten, bei denen wegen anderer Interventionen häufige Therapieunterbrüche nötig sind
- kein perioperatives Bridging erforderlich
- Im Vergleich zu VKA weniger Medikamenteninteraktionen
- Keine Wechselwirkung mit Nahrungsmitteln
- Weniger zerebrale Hämorrhagien.
Nachteile von DOAK:
- Im Gegensatz zu VKA keine Zulassung zum Einsatz bei künstlichen Herzklappen
- Hoher Preis
- Limitierter Einsatz bei Niereninsuffizienz
- Im Fall von Complianceproblemen: schon wenige Stunden nach einer vergessenen Einnahme steigt das Thromboserisiko stark an.6
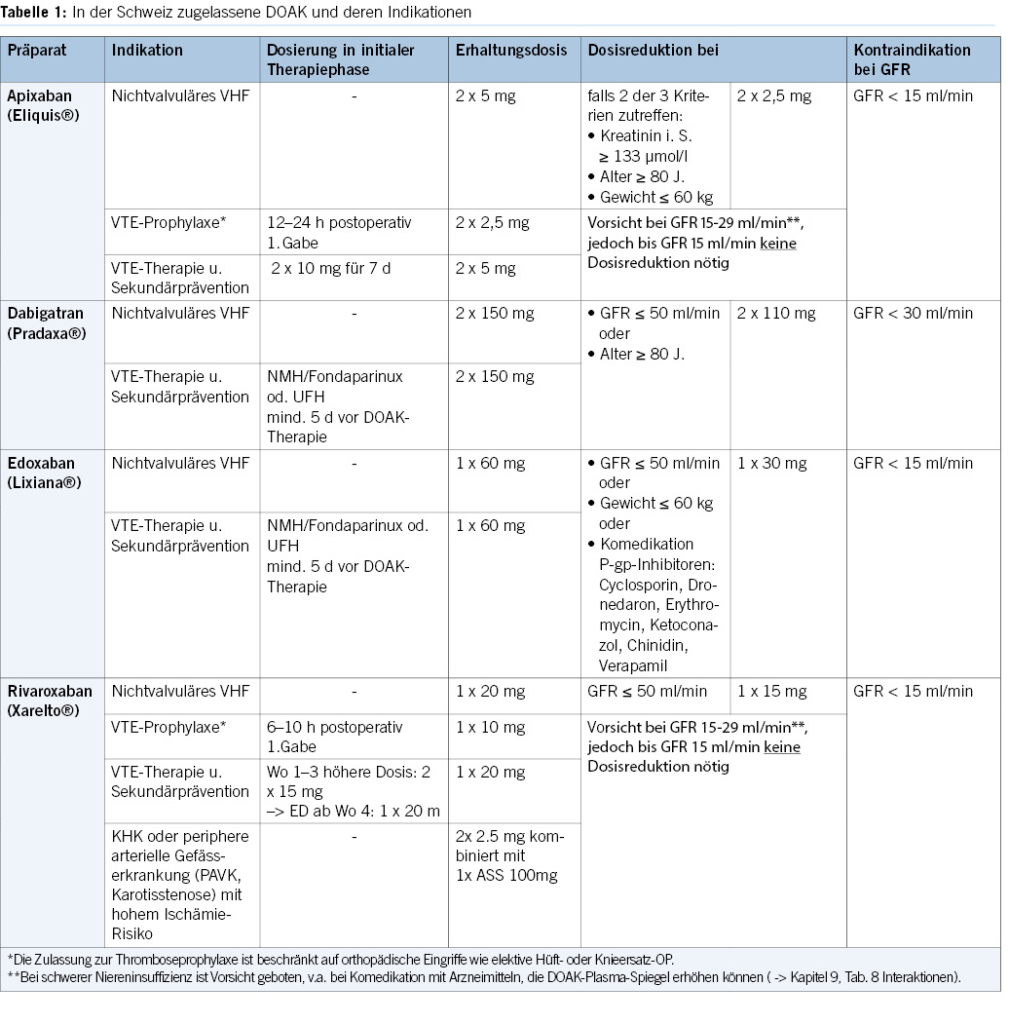
2. Pharmakoniketik und DOAK-Einsatz bei Niereninsuffizienz und Lebererkrankung
Hinweis zur Tabletten-Einnahme:
- Rivaroxaban 15 mg bzw. 20 mg Tabletten sind zur Verbesserung der Bioverfügbarkeit zusammen mit einer Mahlzeit einzunehmen, in der 2.5- und 10 mg-Dosierung kann die Einnahme unabhängig von den Mahlzeiten erfolgen.
- Für alle anderen DOAK ist keine Mahlzeitenabhänige Einnahme zu berücksichtigen.
DOAK und Niereninsuffizienz12-14
- Bei terminaler Niereninsuffizienz (GFR <15 ml/min) sind sämtliche DOAKs nicht empfohlen, da dieses Patientenkollektiv in den Zulassungsstudien ausgeschlossen war und hierüber keine Daten vorliegen.
- Der Thrombininhibitor Dabigatran ist bereits bei einer GFR <30 ml/min kontraindiziert, bedingt durch seine vorwiegend renale Ausscheidung. Da es bei mittelschwerer Niereninsuffizienz im Rahmen einer akuten Erkrankung oder Polypharmazie rasch zu einem Abfall der Kreatininclearance kommen kann, verzichten viele Schweizer Gerinnungsspezialisten bereits bei einer GFR <40 ml/min auf den Einsatz von Dabigatran. Eine GFR <50 ml/min bedarf einer Dosisreduktion von 2×150 auf 2x110mg bis zum Erreichen o.g. Limitatio bei weiterer Einschränkung der Nierenfunktion.
- Direkte F. Xa-Inhibitoren (DXI) können auch bei schwerer Niereninsuffizienz (GFR 15-29 ml/min) eingesetzt werden, zu beachten gilt
- Dosisreduktion von/bei
- Apixaban von 2x5mg auf 2×2.5mg, bei Indikation Vorhofflimmern mit Kreatinin i.S ≥133µmol/l + ein weiteres Kriterium (Alter ≥80 J. und/oder Gewicht ≤60 kg)
- Edoxaban von 1x60mg auf 1x30mg, bei Indikation Vorhofflimmern oder VTE-Therapie mit GFR ≤50 ml/min
- Rivaroxaban von 1x20mg auf 1x15mg, bei Indikation Vorhofflimmern mit GFR ≤50 ml/min.
- Dosisreduktion von/bei
- In der Indikation VTE-Therapie und -Prophylaxe ist bei Behandlung mit Apixaban und Rivaroxaban bei schwerer Niereninsuffizienz keine Dosisreduktion nötig, es ist jedoch erhöhte Vorsicht geboten. Die Patienten müssen sorgfältig auf Anzeichen von Blutungen und Anämie überwacht werden, insbesondere bei Komedikation mit Arzneimittel, die zu erhöhten DOAK-Plasma-Spiegeln führen (-> Kapitel 9, Tab. 6 Interaktionen).
DOAK und Lebererkrankung
- Lebererkrankungen können die hepatische Clearance beeinträchtigen und sind mit einem erhöhten Blutungsrisiko verbunden.
- Vor Beginn einer DOAK-Therapie wird eine Baseline-Bewertung14 empfohlen mit der Evaluation von
- Vorgeschichte von oder Risikofaktoren für Blutungen und Thromboembolien
- relevanten Komedikationen
- Leber- und Nierenfunktion, Hämatogramm, INR, aPTT.
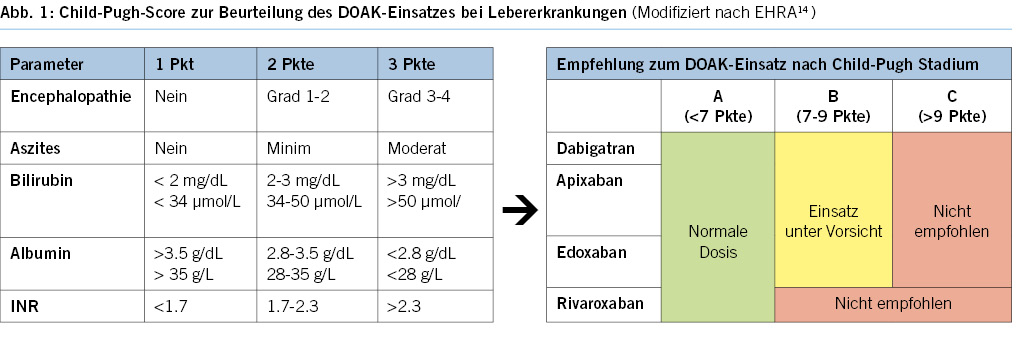
- Der Child-Pugh-Score, validiert zur Stadieneinteilung der Leberzirrhose15 und deren Prognose, wird zur Beurteilung des Einsatzes von DOAKs bei Leberfunktionseinschränkung verwendet (Abb. 1). Bei einer fortgeschrittenen Lebererkrankung, die mit einer klinisch manifesten Koagulopathie sowie klinisch relevanten Blutungsrisiken wie bei einer Leberzirrhose im Child Pugh-Stadium C vergesellschaftet ist, ist eine DOAK-Behandlung kontraindiziert, bei Rivaroxaban wird bereits im Child-Pugh-Stadium B vom Einsatz abgeraten.
3. DOAK und Vorhofflimmern
- Eine Antikoagulation mit VKA bei Vorhofflimmern (VHF) kann das relative Schlaganfallrisiko gegenüber Plazebo um 64 % verringern und das absolute Risiko pro Jahr um 2,7 % senken – das entspricht einer relativ niedrigen NNT von 37 pro Jahr, um einen Schlaganfall zu verhindern16.
- DOAK erwiesen sich in den grossen randomisierten Studien (RCTs) ARISTOTLE (Apixaban), RE-LY (Dabigatran), ENGAGE AF-TIMI 48 (Edoxaban) und ROCKET AF (Rivaroxaban) gegenüber VKA als mindestens gleichwertig bis überlegen bezüglich Schlaganfall und systemischer Embolie. Das günstigere Nutzen-Risiko-Profil mit Reduktion von zerebrovaskulären Ereignissen um 19 % (absolute Risikoreduktion = 0,8 %) entsprechend einer grossen Metaanalyse bei insgesamt 71’683 Patienten17, ist v.a. durch die Verhinderung von hämorrhagischen Schlaganfällen (p < 0,0001) zu erklären.
- DOAKs wird zur Antikoagulation bei VHF in den aktuellen Guidelines12 gegenüber VKA der Vorzug gegeben (IA).
- Wichtig ist dabei eine adäquate Dosierung der DOAKs. «Real-World»-Daten weisen darauf hin, dass im Versorgungsalltag Fehldosierungen, zumeist Unterdosierungen (z.B. aus Angst vor einer Blutung) häufig sind und dadurch die in den Zulassungsstudien belegte Überlegenheit nicht erreicht wird18,19. Off-Label-Unterdosierungen erhöhen das Risiko für Schlaganfälle, systemische Embolien, Hospitalisation und Mortalität, jedoch ohne Benefit hinsichtlich Abnahme des Blutungsrisikos12.
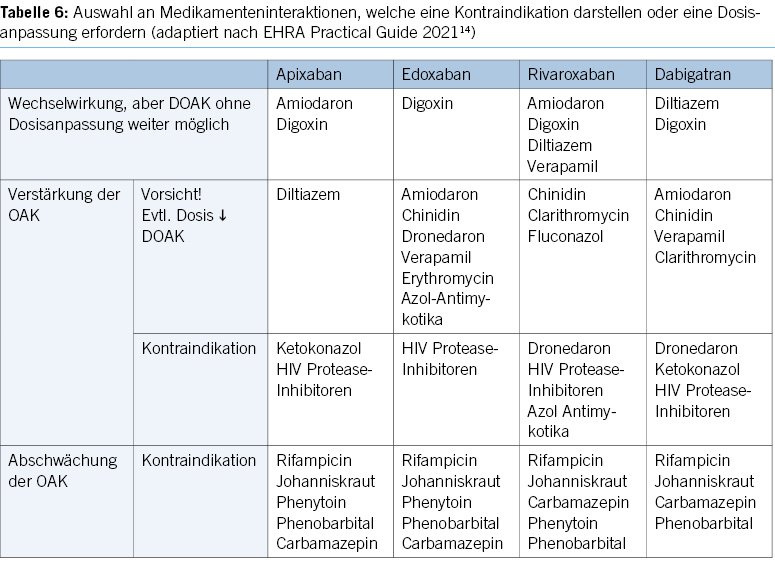
Eine Metaanalyse aus über 100 Beobachtungsstudien im Zusammenhang mit einer unangemessenen DOAK-Dosierung bei Vorhofflimmern18 zeigte, dass die Off-Label-Unterdosierung mit einem Nulleffekt auf die Schlaganfallergebnisse und Blutungsraten verbunden war, jedoch die Gesamtmortalität signifikant erhöhte (HR=1,28, 95%-KI 1,10-1,49; p=0,006). Eine Überdosierung führte zu erhöhtem Risiko für schwere Blutungen (HR=1,41, 95%-KI 1,07-1,85; p=0,013). Eine Dosisreduktion sollte daher nur aufgrund objektivierbarer Kriterien wie eingeschränkte Nierenfunktion, Alter, Gewicht oder Komedikation (Tab. 1) erfolgen, nicht unbegründet aus Bedenken vor Nebenwirkungen.
- VHF @ Klappenvitien bzw. Kardiomyopathie:14
- Kontraindiziert sind DOAK bei mittlerer und schwerer Mitralstenose und mechanischen Klappenprothesen, für diese Indikation werden VKA empfohlen (IB)12.
- Keine Kontraindikation besteht hingegen für DOAK
- nach bioprothetischem Klappenersatz oder Klap-penrekonstruktion (nach >3 Monaten postoperativ)
- TAVI
- Hypertrophe Kardiomyopathie
- schwere Aortenstenose: hierfür liegen nur limitiert Daten vor, es gibt aber keine pathophysiologische Rationale für eine geringere Wirksamkeit oder Sicherheit bei DOAK-Anwendung.
- Rheumatisches VHF: In der INVICTUS-Studie20 wurde im Vergleich von Rivaroxaban mit Phenprocoumon bei VHF und rheumatischem Mitralvitium oder echokardiographischem Hinweis auf erhöhtes Thromboserisiko in der DOAK-Gruppe eine höhere jährliche Inzidenz von (ischämischen) Schlaganfällen und insbesondere eine signifikant höhere Rate von Todesfällen in der Form von plötzlichem Herztod oder in Verbindung mit einem Pumpversagen beobachtet. Der VKA zeigte sich überlegen ohne erhöhte Blutungsrate. VKA gelten nach aktueller Datenlage in dieser Indikation als Antikoagulation der Wahl.
4. DOAK und Prävention/Therapie venöser Thromboembolien21-25
- Zur Behandlung einer akuten tiefen Beinvenenthrombose und Lungenembolie wird eine Antikoagulation in volltherapeutischer Dosierung über 3-6 Monate empfohlen (Dosierungsangaben der einzelnen DOAKs zur Initial- und Erhaltungstherapie, Tabelle 1).
- Nach dieser Therapiephase soll eine Reevaluation erfolgen, um unter Abwägung des Rezidiv- und Blutungsrisikos sowie der Patientenpräferenz über eine verlängerte Sekundärprophylaxe oder Beendigung der Antikoagulation zu entscheiden.
- Bei hohem Rezidivrisiko mit persistierend starken Risikofaktoren (z.B. aktive Tumorerkrankung, schwere Thrombophilie oder Rezidiv-VTE ohne starken/reversiblen RF) wird eine (soweit vertretbar) unbefristete Antikoagulation in volltherapeutischer Dosis empfohlen.
- Bei moderatem Rezidivrisiko (z.B. bei schwachen persistierenden Risikofaktoren oder spontanem VTE-Ereignis ohne eruierbaren Trigger) wird eine prolongierte Antikoagulation in reduzierter Dosis bevorzugt. Gemäss Zulassungsstudien der für diese Indikation verfügbaren DOAKs kann nach Abschluss einer mindestens 6-monatigen Behandlung einer TVT oder Lungenembolie Apixaban auf 2 x 2.5mg bzw. Rivaroxaban auf 1 x 10mg reduziert werden, mit nachweislich im Vergleich zur fortgeführten therapeutischen Dosierung gleich effizienter VTE-Rezidivprophylaxe und niedrigerem Blutungsrisiko28, 29.
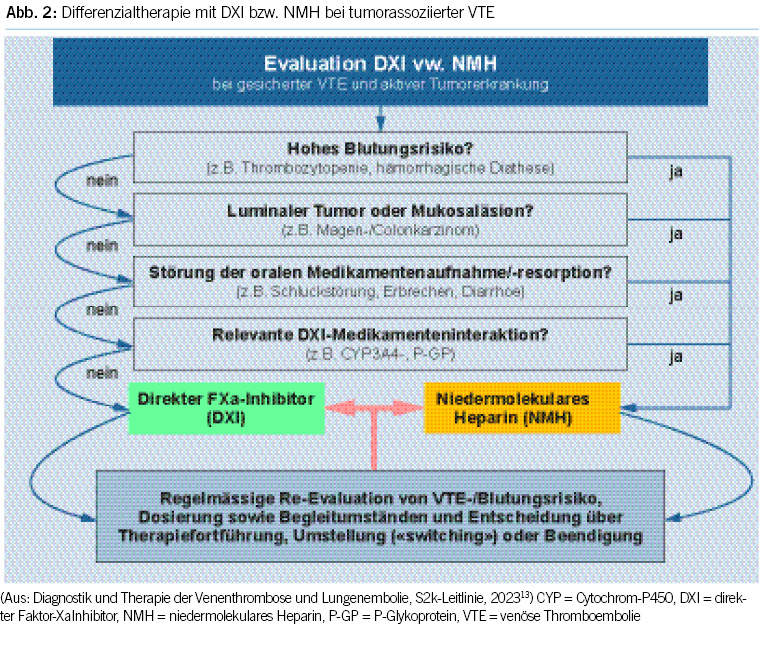
5. DOAK und Tumorpatienten25,30
- Viele Patienten mit VTE weisen eine onkologische Grunderkrankung auf, verglichen mit Thrombosepatienten ohne Malignom besteht zudem ein erhöhtes Rezidiv- und Blutungsrisiko.
- Lange galten NMH als Standardtherapie bei malignomassoziierter VTE. Gegenüber der früher etablierten sequentiellen Therapie mit NMH/VKA konnte unter NMH-Monotherapie das Rezidiv-VTE-Risiko halbiert werden bei weitgehend unverändertem Blutungsrisiko. 31
- Vergleichsstudien mit direkten F. Xa-Inhibitoren (DXI) belegen eine bessere Therapietreue und Nicht-Unterlegenheit bis zu signifikanter Abnahme der VTE-Rezidive der DOAK im Vergleich zu NMH, bei nicht-signifikanter Zunahme von schweren oder klinisch relevanten Blutungen32-36. Für den Thrombininhibitor Dabigatran liegen keine Daten zur Wirksamkeit für die Behandlung Tumor-assoziierter VTE im Vergleich zu NMH vor.
- Aktualisierte internationale Guidelines empfehlen direkte F. Xa-Inhibitoren (DXI) zur Behandlung bei tumorassoziierter VTE als mindest gleichwertige und kostengünstigere Alternative zu NMH. 37, 38
Bei der Substanzwahl sind individuell neben Blutungsrisiken und Aspekten der Tumorerkrankung (Tumorentität und -ausdehnung, Antitumortherapie) auch die klinische Situation und Praktikabilität einer oralen vs. parenteralen Therapie und die Therapiepräferenz des Patienten zu berücksichtigen sowie im Verlauf in regelmässigen Intervallen zu überprüfen (Abb. 2). Aufgrund des unter DOAK im Vergleich erhöhten Blutungsrisikos, insbesondere im gastrointestinalen Bereich, sind NMH weiterhin die Therapie der Wahl bei Patienten mit hohem Blutungsrisiko und gastrointestinalen Tumoren.
- Bei DXI muss im Gegensatz zu den NMH das Interak-tionspotenzial mit einer laufenden oder geplanten Antitumortherapie berücksichtigt werden (Prüfmöglichkeit unter www.drugs.com).
- Therapiedauer: Nach einer Therapiephase von 3 bis 6 Monaten wird bei fortbestehend aktiver Tumorerkrankung meist eine volltherapeutische Dosierung zur Sekundärprophylaxe empfohlen, wenngleich prospektive, unterschiedliche Intensitäten der Antikoagulation vergleichende Studiendaten fehlen. Im Einzelfall kann in Anlehnung an die Studiendaten bei Nichttumorpatienten28,29 zur prolongierten Prophylaxe nach individueller Nutzen-Risiko-Abwägung eine reduzierte DOAK-Dosis von Apixaban (2 x 2,5 mg/d) oder Rivaroxaban (1 x 10 mg/d) erwogen werden13.
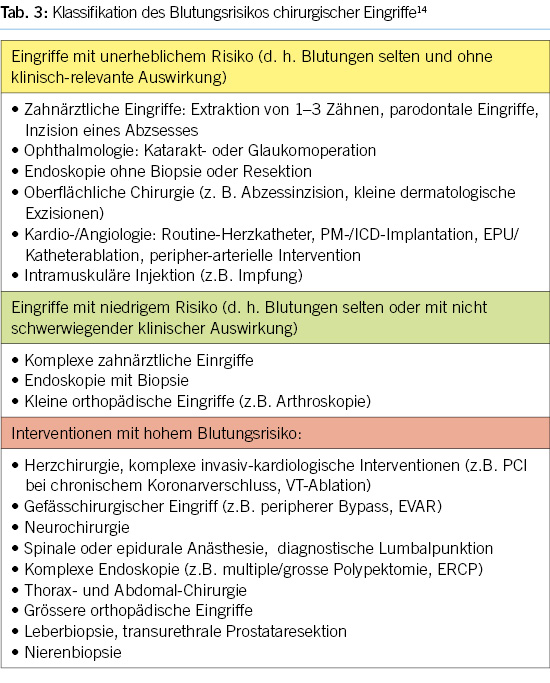
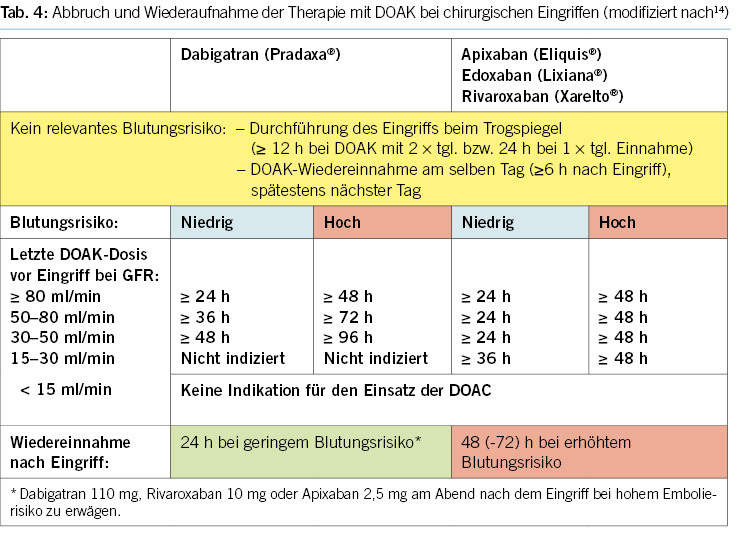
6. Perioperatives Management
7. Blutungskomplikationen unter DOAK14
- Das Risiko schwerer Blutungen liegt in VHF-Studien fürDOAK bei 1,4–3,6 % verglichen mit 3,4 % /Jahr für VKA.
- Thrombozytenaggregationshemmer (TAH) und Nichtsteroidale Antirheumatika (NSAR) erhöhen das Risiko schwerer Blutungen bei Patienten unter DOAK und VKA in vergleichbarer Weise.
- Niereninsuffizienz erhöht das Blutungsrisiko unter DOAK-Therapie, insbesondere bei Dabigatran aufgrund der überwiegend renalen Elimination. Bei mehr als 50 % der Patienten, die unter Dabigatran eine schwere Hämorrhagie entwickeln, liegt eine mässige oder schwere Niereninsuffizienz vor.
Massnahmen bei Blutungen
- Leichte Blutung unter DOAK:
- Nächste DOAK-Dosis später verabreichen oder Behandlung abbrechen, je nach Notwendigkeit
- Blutungsrisiken evaluieren und begünstigende Faktoren behandeln (z. B. Hypertonie-Einstellung optimieren, keine zusätzlichen TAH oder NSAR wenn nicht indiziert).
- Mittelschwer bis schwere Blutung, wie oben, ergänzend:
- I. Basis-Massnahmen der Blutstillung: individuell angepasst an den Schweregrad und die Lage der Blutung:
- Mechanische Kompression, chirurgischer/interventioneller Eingriff
- Flüssigkeitsersatz und hämodynamische Unterstützung
- Blutprodukte oder Transfusion von Blutkomponenten.
-
- Dabigatran ist dialysierbar. Eine Hämodialyse kann daher nützlich sein, speziell wenn die Blutung mit akuter Niereninsuffizienz einhergeht
- Prokoagulantien bei lebensbedrohender oder trotz intensiver lokaler Blutstillungsmassnahmen nicht zu stoppender Blutung: Konzentrate der Faktoren II, VII, IX und X (z. B. Prothromplex®), aktivierter Faktor VII (Novoseven®) oder Konzentrate aktivierter Faktoren (Feiba®)
- Spezifisches Antidot:
- Der Einsatz der Antidots beschränkt sich auf nicht kontrollierbare oder lebensbedrohliche Blutungen. Die Verabreichung erfolgt intravenös und ist spezialisierten Zentren vorbehalten.
- Für den F IIa-Inhibitor Dabigatran steht mit Idarucizumab (Praxbind®) bereits seit längerem ein Antidot zur Verfügung.
- In 2022 wurde Andexanet alfa (Ondexxya®) als Antidot für die DIX Apixaban und Rivaroxaban die Zulassung in der Schweiz erteilt. In der Zulassungsstudie ANNEXA439 zur Anwendung von Andexanet bei kritischen Blutungen unter FXa-Hemmern war die Mehrheit der Patienten mit Apixaban und Rivaroxaban behandelt und führte bei diesen zu einer gegenüber Placebo hochsignifikanten Senkung der Anti-FXa-Aktivität innerhalb weniger Minuten. Nur ca. 10 % standen unter Therapie mit den F Xa-Hemmern Edoxaban oder dem NMH Enoxaparin, sodass die Anwendung hier zwar möglich, aufgrund unzureichender Fallzahl aber nicht empfohlen ist.
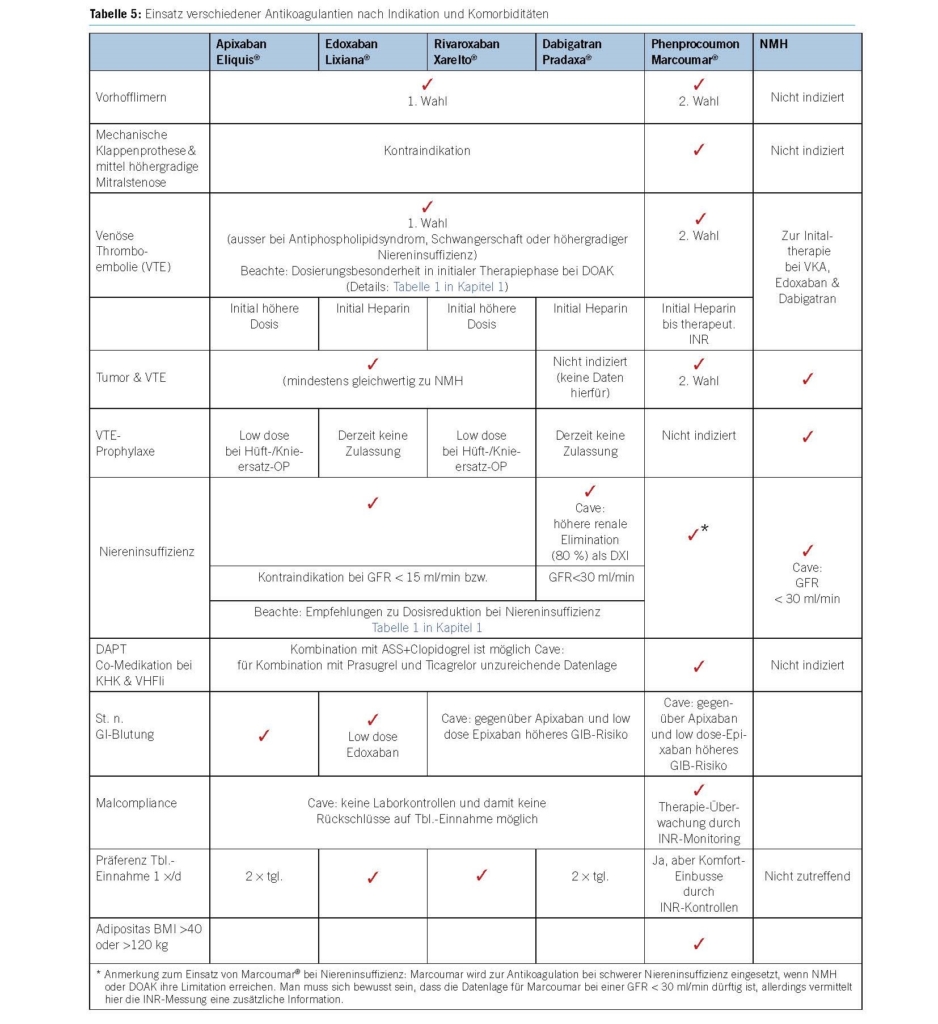
8. Antikoagulantien-Wahl nach Indikation und Komorbiditäten40-44
Wann können DOAK eingesetzt werden?
- Bei Vorhoflimmern Antikoagulation der 1. Wahl.
- Zur Behandlung akuter tiefer Venenthrombosen und/oder Lungenembolien bevorzugt VKA.
- Primärprophylaxe VTE bei orthopädischen Eingriffen Als Thromboseprophylaxe bei „internistischen“ Patienten oder zur Sekundärprophylaxe von VTEs bei Reisen haben die DOAK keine Zulassung. Anmerkung zur Reiseprophylaxe: In dem Bewusstsein, dass der Einsatz von NMH zur Prophylaxe im nicht-chirurgischen Setting nur die Zulassung für Patienten mit eingeschränkter Mobilität hat, werden zur Reiseprophylaxe mit vergleichbarer „Datenlage“ immer öfter auch DOAK eingesetzt, z.B. in Analogie zum „Innere Medizin-Trial“ Rivaroxaban 10 mg. Wichtig: Der Patient ist über den Off-label-use aufzuklären, die Kosten werden nicht von der Krankenkasse übernommen.
- Rivaroxaban als Xarelto vascular® in der Dosis 2 x 2,5 mg in Kombination mit ASS 1 x1 00mg kann zur Prävention schwerer atherothrombotischer Ereignisse bei KHK oder peripherer arterieller Gefässerkrankung (PAVK, Karotisstenose) mit hohem Risiko für ischämische Ereignisse eingesetzt werden45, wenn keine Indikation mehr für eine DAPT besteht.
- Umstellung von Marcoumar, wenn Patient mit VKA schlecht einzustellen ist (< 2/3 im therapeutischen INR-Bereich) und/oder ein erhöhtes Risiko für Medikamenteninteraktionen hat.
Wann sollen DOAK nicht verwendet werden?
- Es ist davon auszugehen, dass der Benefit eines Wechsels auf DOAK bei schlecht eingestellten Patienten am grössten ist41. Eine jahrelang gut mit VKA eingestellte OAK (z. B. TTR > 75 %) sollte nicht umgestellt werden. Die open-label Frail-AF-Studie46 hatte die Fragestellung, ob bei älteren (≥75 J.), gebrechlichen Patienten mit VHF und guter INR-Einstellung unter VKA das Blutungsrisiko durch Wechsel auf ein DOAK (alle 4 Substanzen waren vertreten) reduziert werden kann. Die Studie wurde vorzeitig wegen hochsignifikant erhöhter Blutungsraten abgebrochen (unter VKA 9.4% versus DOAK 15.3%, HR=1,69, 95%-KI 1,23-2.32; p=0,00112; dabei schwere Blutungen unter VKA 2.4% zu 3.6% unter DOAK). Zu beachten gilt, dass die Studie nicht die beiden Medikamente zueinander vergleicht, sondern zwei Behandlungsstrategien – einen Therapiewechsel gegenüber Fortführung der VKA-Therapie.
- Bei Malcompliance ist von einer Therapieumstellung ebenfalls abzuraten, weil dadurch die Möglichkeit eines INR-Monitorings entfällt und bei Auslassen einzelner Tabletten das Embolierisiko rasch ansteigen kann.
- Schwangerschaft/Stillzeit
- DOAKs sind hier kontraindiziert, aufgrund fehlender Daten für die Anwendung
- DOAKs sollten bei Frauen in gebärfähigem Alter nur mit einer sicher wirksamen Kontrazeption angewendet werden.
- Antikoagulation bei Adipositas
- Übergewichtige, insbesondere schwer Adipöse waren in den DOAK-Zulassungsstudien unterrepräsentiert. Trotz limitierter Daten zu Wirksamkeit und Sicherheit in dieser Population gibt die Fachinformation (Compendium) – anders als bei niedrigem Körpergewicht – keine Empfehlung zur Dosisanpassung oder Restriktion bei Übergewichtigen. Bei einem BMI >40 kg/m2 oder Gewicht > 120 kg empfehlen die Internationale Gesellschaft für Thrombose und Hämostase (ISTH) und die European Heart Rhythm Association (EHRA) anstelle der DOAK den Einsatz von VKA oder (im klinischen Alltag schwer praktikabel) substanzspezifische Spiegelmessungen zur Überprüfung der Wirksamkeit47,48.
-
- Bariatrische/Darm(teil)resezierte Patienten: Auch bei dieser Patientengruppe gibt es nur begrenzte Daten – es bleibt fraglich, ob trotz Malabsorption bei verkleinerter intestinaler Austauschoberfläche ausreichende Wirkspiegelprofile erreicht werden, harte Endpunktstudien fehlen49-51.
- Aufgrund unzureichender Studiendaten sollte bei einem BMI > 40 kg/m2 oder Gewicht >120 kg sowie bei bariatrischen – oder aus anderer Indikation Darm(teil)resezierten – Patienten den VKA gegenüber den DOAK der Vorzug gegeben w erden. Das INR-Monitoring ermöglicht eine Anpassung auf verändertes Körpergewicht respektive intestinale Absorption.
- DOAKs sind bei Antiphospholipid-Syndrom (APS) nicht empfohlen Eine multizentrische Studie mit Rivaroxaban bei Patienten mit St. n. Thrombose und Diagnose eines APS wurde aufgrund einer erhöhten Rate thromboembolischer Ereignisse im Vergleich zu Warfarin vorzeitig beendet52. Für die anderen DOAKs gibt es keine abgeschlossenen klinischen Studien bei Patienten mit APS, weshalb Swissmedic die Anwendung von DOAKs (betrifft alle „-xabane“ und den Thrombininhibitor Dabigatran) bei APS nicht empfiehlt und bei Indikation zur fortgesetzten Sekundärprophylaxe bei diesen Patienten zur Umstellung auf VKA rät (www.swissmedicinfo).
Auswahl des «passenden» DOAK
- Da es keine randomisierten kontrollierten head-to-head Studien der verschiedenen DOAK untereinander gibt, kann man keines der Präparate speziell empfehlen.
- Die Auswahl sollte individuell auf den Patienten, seine Komorbiditäten und Begleitmedikation abgestimmt sein:
- Patienten mit eingeschränkter Nierenfunktion
- Bei Substanzen mit einer hohen renalen Clearance wie Dabigatran (> 80 %) ist Vorsicht geboten.
- Hier bieten F Xa-Hemmer (DXI) einen grösseren Sicherheits-Korridor (ca. 30 % renale Ausscheidung), wenn bei diesen Patienten eine weitere Verschlechterung der Nierenfunktion eintritt z. B. bei interkurrenter Erkrankung, Co-Medikation (NSAR!) oder Dehydratation mit entsprechender Akkumulation der Substanz.
- Gastrointestinales Blutungsrisiko (GIB)
- DOAKs erhöhen das Risiko für GIB. Bei hohem Risiko für GIB ( z.B. bei Ulcus ventriculi/duodeni, chronisch entzündlicher Darmerkrankung, Divertikulitis, intestinalen Tumoren) ist der Einsatz von DOAK kritisch zu überdenken.
- Dabei scheinen sich die Wirkstoffe in ihrem Risikoprofil zu unterscheiden mit erhöhten Blutungsraten bei Rivaroxaban sowie in deren Standarddosis Dabigatran und Edoxaban.Aus den Zulassungsstudien, Metaanalysen und Beobachtungsstudien der DOAKs zusammengetragene Daten53 deuten darauf hin, dass die Einnahme von Rivaroxaban, Dabigatran (2x150mg/d) sowie Edoxaban (1x60mg/d) im Vergleich zu Warfarin mit einem erhöhten Risiko für GIB verbunden ist. In der niedrigeren Dosierung von Dabigatran (2x110mg/d) und Edoxaban (1x30mg/d) sowie für Apixaban wurden im Vergleich zum VKA keine erhöhten Blutungsraten beobachtet. Diese Daten sind aber unter dem Vorbehalt eines nicht-randomisierten Vergleichs der Substanzen und Heterogenität der Patientenpopulationen zu sehen. Der mittlere CHADS2-Score als Korrelat für die Patientenvulnerabilität war in den Zulassungsstudien zur Thromboembolie-Prophylaxe bei VHF unterschiedlich: bei ARISTOTLE (Apixaban) und RE-LY (Dabigatran) 2,1, bei ENGAGE AF-TIMI 48 (Edoxaban) 2,8, bei ROCKET AF (Rivaroxaban) wurden noch kränkere Patienten mit 3,5 eingeschlossen.
- Patienten mit eingeschränkter Nierenfunktion
-
-
- Durch die zusätzliche Gabe eines Protonenpumpeninhibitors (PPI) können Blutungskomplikationen verringert werden (v.a. bei Komedikation mit TAH, NSAR, Kortison)54.
-
9. Klinisch praktische Aspekte in der DOAK-Anwendung55-58
Checkliste für Erst- und Follow-up-Termine mit DOAK behandelter Patienten (modifiziert nach14 )
- Abgabe eines Antikoagulantien-Ausweises für das DOAK (analog Marcoumar-Pass) zur Patientensicherheit
- Patienteninstruktion
- Korrekte Medikamenteneinnahme: Rivaroxaban-Einnahme soll in der Dosierung 15 oder 20 mg mit der Mahlzeit erfolgen (in der Dosierung 10 mg sowie alle anderen DOAK mit/ohne Nahrung möglich)
- Aufklärung über Anzeichen von Blutung mit Hinweis zur Rückmeldung
- Je schlechter die Nierenfunktion und je ausgeprägter die Polypharmazie, desto engmaschiger muss die Kreatininclearance (Nierenrechner https://nierenrechner.de) gemessen werden, v.a. unter Dabigatran, bei alten Patienten oder eingeschränkter Nierenfunktion mindestens alle 3–6 Monate, plus zusätzlich bei kritischen Medikamentenumstellungen oder akuten Erkrankungen
- Laborkontrollen unter DOAK
- Gerinnungstests sind nicht notwendig!
- Jährlich: Hb, Nieren- und Leberfunktion
- Bei CrCl 30–60 ml/min, > 75 J., oder gebrechlich: 6-monatlich Nierenfunktion
- Bei CrCl 15–30 ml/min: 3-monatlich Nierenfunktion
- Bei passageren einflussnehmenden Ereignissen: Nieren- und/oder Leberfunktion
- Medikamentenanamnese
- Neuverordnungnen durch Kollegen im Intervall? Over-the-counter Medikamente (auch nach temporärer Medikation fragen, z.B. NSAR)
- Obwohl es bei den DOAK weniger Medikamenten-interaktionen gibt als unter VKA, sind einige wichtige Ausnahmen zu beachten (Tab. 6) und ggfs. Dosisadjustierungen angezeigt. Ein Interaktionscheck findet sich bei dem bereits vorgestellten online-DOAK-Tool easyDOAC (www.easydoac.de).
- Blutungsrisiken überprüfen und wenn möglich modifizieren
- Unkontrollierte Hypertonie (systolisch > 160 mmHg)
- Für Blutung prädisponierende Medikation (e.g. ASS, NSAR, Kortison)
- Excessiver Alkoholkonsum
- Stürze
- Reevaluation des Schlaganfallrisikos → CHA2DS2-VASc Score12
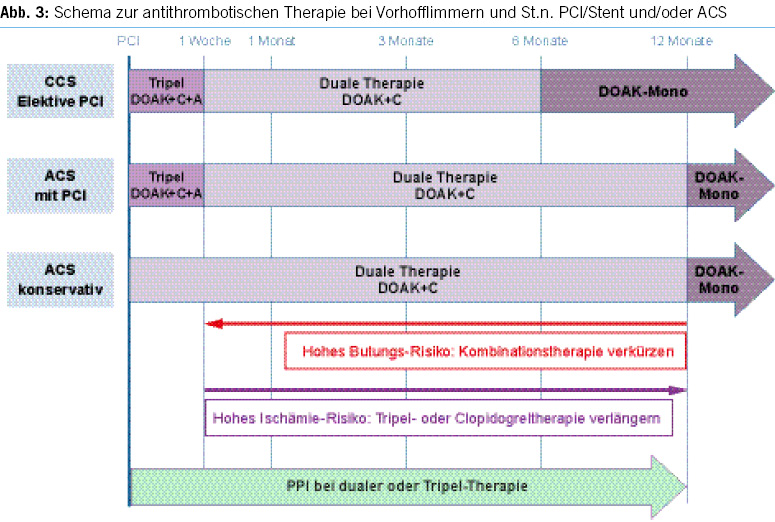
DOAK und Komedikation mit Plättchenhemmern bei KHK und Vorhofflimmern
- Bei Patienten mit Indikation zur Antikoagulation bei VHF und PCI und/oder akutem Coronarsyndrom (ACS) kann durch den Einsatz von DOAKs anstelle von VKA in Kombination zur erforderlichen antithrombotischen Therapie das Blutungsrisiko reduziert werden. 59-63
- Nach ACS bzw. CCS @ PCI @ VHF empfehlen die ESC-Guidelines für VHF11, ACS64, CCS65 (Abb. 3)
- Standardschema:
- Tripeltherapie mit (D)OAK+ dualer Plättchenhemmung (DAPT) für 1 Woche (für ACS IA-, für CCS IIa-Empfehlung), dabei DAPT mit ASS+P2Y12-Inhibitor (i.d.R. Clopidogrel)
- zur Antikoagulation DOAK bevorzugt zu VKA, in der zur Strokeprophylaxe regulären Dosis (IA)
- danach duale Therapie mit DOAK und einfacher Plättchenhemmung (SAPT, bevorzugt Clopidogrel) bei CCS bis 6 Monate (IB), nach ACS bis 12 Monate (IA) nach jeweils unkomplizierter PCI, dann DOAK-Monotherapie
- bei hohem atherothrombotischem Risiko (nach komplexer PCI oder St.n. Stentthrombose): prolongierte Tripeltherapie nach PCI für ACS oder CCS bis 1 Monat (IIa)
- bei hohem Blutungsrisiko: Rivaroxaban statt 1×20mg reduziert auf 1× 15mg bzw. Dabigatran statt 2×150mg auf 2×110 mg (IIa) für die Dauer der begleitenden einfachen oder dualen Plättchenhemmung; für die übrigen DOAK wird keine Stellung zu einer Dosisanpassung bezogen
- Standardschema:
- bei nicht-interventionell, medikamentös behandeltem ACS genügt eine duale Therapie mit einem DOAK + SAPT bis zu 1 Jahr (IIa).
- PPIs werden unter der antithombotischen Kombinationstherapie routinemässig empfohlen.
- Aufgrund der Komplexität und Vielzahl möglicher Szenarien ist eine Rücksprache mit dem behandelnden Kardiologen oder dem Herzkatheterlabor im Zweifelsfall ratsam.

Was tun bei Dosierungsirrtümern?11
- Wurde eine Dosis verpasst, soll bei der nächsten regulären Einnahme keine doppelte Dosis genommen werden. Ein Nachholen der verpassten Dosis ist bis zur Hälfte des Dosierungsintervalls jedoch erlaubt, also bis zu 6 h bei 2 x (Apixaban, Dabigatran) bzw. bis 12 h bei 1 x tgl. Verabreichung (Edoxaban, Rivaroxaban). Ist das nicht mehr möglich, soll auf die Dosis ganz verzichtet werden
- Wurde irrtümlich die doppelte Dosis eingenommen, kann bei DOAK mit 2 x tgl. Einnahme die nächste geplante Dosis ausgelassen werden, und mit der übernächsten Dosis normal weitergeführt werden. Bei 1 x tgl. Dosierung sollte einfach der normale Zyklus weitergeführt werden
- Weiss der Patienten nicht sicher, ob er die letzte Dosis eingenommen hat, kann man bei einem DOAK mit 2 x tgl. Einnahme raten, mit dem regulären Schema nach 12 h normal weiterzufahren (also keine weitere Dosis zu nehmen). Bei einem DOAK mit 1 x tgl. Einnahme wird empfohlen, die fraglich ausgelassene Dosis nachzunehmen, da ansonsten eine potentiell längere Periode ohne relevanten Schutz besteht.
Was tun bei vermuteter Überdosierung ohne Blutung*?
- Angesichts der kurzen Halbwertszeit der DOAK ist bei fehlender Blutung in den meisten Fällen eine abwartende Strategie vertretbar.
- Bei kurz zurückliegender Einnahme einer Überdosis kommt bei allen DOAK Aktivkohle infrage.
Anhang

Institut für Hausarztmedizin Universitätsspital Zürich (IHAMZ)
Pestalozzistrasse 24
8091 Zürich
andrea.rosemann@usz.ch
Es bestehen keine Interessenskonflikte.
Historie
Manuskript eingereicht: 10.11.2023
Manuskript angenommen: 21.11.2023
Literatur
1. European Society of Cardiology (ESC), www.escardio.org.
2. Asmis L. Die neuen Antikoagulantien – Was muss der Praktiker wissen? Praxis 2011;100(16):971-976. DOI: 10.1024/1661-8157/a000627.
3. Steurer J. [Rivaroxaban as therapy of deep venous thrombosis equally as effective as current anticoagulation with heparin and vitamin K antagonist]. Praxis (Bern 1994) 2011;100(16):989-90. DOI: 10.1024/1661-8157/a000631.
4. Beer JH. «Xa-tra-xa»: Chancen und offene Fragen bei neuen Antikoagulantien. Praxis 2011;100(16):947. DOI: 10.1024/1661-8157/a000626.
5. Gerber B, Senn O. Moderne Schlaganfallprophylaxe bei Vorhofflimmern. Praxis 2011;100(19):1161-1172. DOI: 10.1024/1661-8157/a000668.
6. Bausch J. Paradigmenwechsel in der Thrombose- und Schlaganfall-Prophylaxe. Arzneiverordnung in der Praxis 2011;38(3):50-51. (https://www.akdae.de/fileadmin/user_upload/akdae/Arzneimitteltherapie/AVP/Ausgaben/2003-2014/20113.pdf).
7. Steffel J, Braunwald E. Novel oral anticoagulants: focus on stroke prevention and treatment of venous thrombo-embolism. Eur Heart J 2011;32(16): 1968-76a. DOI: 10.1093/eurheartj/ehr052.
8. Steffel J. Die neuen Antikoagulanzien: Praktische Aspekte in der Anwendung. LEADING OPINIONS Kardiologie & Gefässmedizin 2012;2:12-17.
9. Mannucci PM, Franchini M. Old and new anticoagulant drugs: a miniriew. Ann Med 2011;43(2):116-23. DOI: 10.3109/07853890.2010.539250.
10. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS: The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2016;37(38):2893-2962. DOI: 10.1093/eurheartj/ehw210.
11. Heidbuchel H, Verhamme P, Alings M, et al. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015;17(10):1467-507. DOI: 10.1093/europace/euv309.
12. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021;42(5):373-498. DOI: 10.1093/eurheartj/ehaa612.
13. Linnemann BB, W.; Doenst, T.; Erbel, C.; Isfort, P.; Janssens, U.; Kalka, C.; Klamroth, R.; Kotzerke, J.; Ley, S.; Meyer, J.; Mühlberg, K.; Müller, O. J.; Noppe-ney, T.; Opitz, C.; Riess, H.; Solomayer, E.-F.; Volk, T.; Beyer-Westendorf, J. The S2k guideline on the diagnosis and treatment of venous thrombosis and pulmonary embolism. Vasa 2023;52(S111):1-146. DOI: 10.1024/0301-1526/a001089.
14. Steffel J, Collins R, Antz M, et al. 2021 European Heart Rhythm Association Practical Guide on the Use of Non-Vitamin K Antagonist Oral Anticoagulants in Patients with Atrial Fibrillation. Europace 2021;23(10):1612-1676. DOI: 10.1093/europace/euab065.
15. Child CG, Turcotte JG. Surgery and portal hypertension. Major Probl Clin Surg 1964;1:1-85. (https://www.ncbi.nlm.nih.gov/pubmed/4950264).
16. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146(12):857-67. DOI: 10.7326/0003-4819-146-12-200706190-00007.
17. Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014;383(9921):955-62. DOI: 10.1016/S0140-6736(13)62343-0.
18. Caso V, de Groot JR, Sanmartin Fernandez M, et al. Outcomes and drivers of inappropriate dosing of non-vitamin K antagonist oral anticoagulants (NOACs) in patients with atrial fibrillation: a systematic review and meta-analysis. Heart 2023;109(3):178-185. DOI: 10.1136/heartjnl-2022-321114.
19. Camm AJ, Cools F, Virdone S, et al. Mortality in Patients With Atrial Fibrillation Receiving Nonrecommended Doses of Direct Oral Anticoagulants. J Am Coll Cardiol 2020;76(12):1425-1436. DOI: 10.1016/j jacc.2020.07.045.
20. Connolly SJ, Karthikeyan G, Ntsekhe M, et al. Rivaroxaban in Rheumatic Heart Disease-Associated Atrial Fibrillation. N Engl J Med 2022;387(11): 978-988. DOI: 10.1056/NEJMoa2209051.
21. Bauersachs R, Berkowitz SD, Brenner B, et al. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010;363(26):2499-510. DOI: 10.1056/NEJMoa1007903.
22. Büller HR, Prins MH, Lensin AW, et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med 2012;366(14):1287-97. DOI: 10.1056/NEJMoa1113572.
23. Agnelli G, Büller HR, Cohen A, et al. Oral apixaban for the treatment of acute venous thromboembolism. N Engl J Med 2013;369(9):799-808. DOI: 10. 1056/ NEJMoa1302507.
24. Schulman S, Kearon C, Kakkar AK, et al. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med 2013;368(8): 709-18. DOI: 10.1056/NEJMoa1113697.
25. van der Hulle T, den Exter PL, Kooiman J, van der Hoeven JJ, Huisman MV, Klok FA. Meta-analysis of the efficacy and safety of new oral anticoagulants in patients with cancer-associated acute venous thromboembolism. J Thromb Haemost 2014;12(7):1116-20. DOI: 10.1111/jth.12605.
26. van der Hulle T, Kooiman J, den Exter PL, Dekkers OM, Klok FA, Huisman MV. Effectiveness and safety of novel oral anticoagulants as compared with vitamin K antagonists in the treatment of acute symptomatic venous thromboembolism: a systematic review and meta-analysis. J Thromb Haemost 2014;12(3):320-8. DOI: 10.1111/jth.12485.
27. van Es N, Coppens M, Schulman S, Middeldorp S, Buller HR. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood 2014;124(12):1968-75. DOI: 10.1182/blood-2014-04-571232.
28. Agnelli G, Buller HR, Cohen A, et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med 2013;368(8):699-708. DOI: 10. 1056/NEJMoa1207541.
29. Weitz JI, Lensing AWA, Prins MH, et al. Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism. N Engl J Med 2017;376(13): 1211-1222. DOI: 10.1056/NEJMoa1700518.
30. Wharin C, Tagalakis V. Management of venous thromboembolism in cancer patients and the role of the new oral anticoagulants. Blood Rev 2014;28(1): 1-8. DOI: 10.1016/j.blre.2013.11.001.
31. Carrier M, Cameron C, Delluc A, Castellucci L, Khorana AA, Lee AY. Efficacy and safety of anticoagulant therapy for the treatment of acute cancer-associated thrombosis: a systematic review and meta-analysis. Thromb Res 2014;134(6): 1214-9. DOI: 10.1016/j.thromres.2014.09.039.
32. Agnelli G, Becattini C, Meyer G, et al. Apixaban for the Treatment of Venous Thromboembolism Associated with Cancer. N Engl J Med 2020;382(17): 1599-1607. DOI: 10.1056/NEJMoa1915103.
33. Young AM, Marshall A, Thirlwall J, et al. Comparison of an Oral Factor Xa Inhibitor With Low Molecular Weight Heparin in Patients With Cancer With Venous Thromboembolism: Results of a Randomized Trial (SELECT-D). J Clin Oncol 2018;36(20):2017-2023. DOI: 10.1200/JCO.2018.78.8034.
34. Raskob GE, van Es N, Verhamme P, et al. Edoxaban for the Treatment of Cancer-Associated Venous Thromboembolism. N Engl J Med 2018;378(7): 615-624. DOI: 10.1056/NEJMoa1711948.
35. Schrag Dea. Direct Oral Anticoagulants vs Low-Molecular-Weight Heparin and Recurrent VTE in Patients With CancerA Randomized Clinical Trial. 2023 Jun 13;329(22):1924-1933.
36. Moik F, Posch F, Zielinski C, Pabinger I, Ay C. Direct oral anticoagulants compared to low-molecular-weight heparin for the treatment of cancer-associated thrombosis: Updated systematic review and meta-analysis of randomized controlled trials. Res Pract Thromb Haemost 2020;4(4):550-561. DOI: 10.1002/rth2.1
37. Stevens SM, Woller SC, Kreuziger LB, et al. Antithrombotic Therapy for VTE Disease: Second Update of the CHEST Guideline and Expert Panel Report. Chest 2021;160(6):e545-e608. DOI: 10.1016/j.chest.2021.07.055.
38. Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv 2021;5(4):927-974. DOI: 10. 1182/bloodadvances.2020003442.
39. Connolly SJ, Crowther M, Eikelboom JW, et al. Full Study Report of Andexanet Alfa for Bleeding Associated with Factor Xa Inhibitors. N Engl J Med 2019;380(14):1326-1335. DOI: 10.1056/NEJMoa1814051.
40. Wagner H-O, Liesenfeld A. DEGAM S1-Leitlinie: Neue orale Antikoagulantien (bei nicht valvulärem Vorhofflimmern). AWMF-Registernr. 053/031. Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin, 2013. (https://www.degam.de/files/Inhalte/Leitlinien-Inhalte/Dokumente/DEGAM-S1-Handlungs-
empfehlung/053-031%20Neue%20orale%20Antikoagulantien/053-031_NOAK_Langfassung_redakt%20Hinweis_02%2002%202017.pdf).
41. Wallentin L, Yusuf S, Ezekowitz MD, et al. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE-LY trial. Lancet 2010;376(9745):975-83. DOI: 10.1016/S0140-6736(10)61194-4.
42. Eikelboom JW, Connolly SJ, Brueckmann M, et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med 2013;369(13): 1206-14. DOI: 10.1056/NEJMoa1300615.
43. Yao X, Abraham NS, Sangaralingham LR, et al. Effectiveness and Safety of Dabigatran, Rivaroxaban, and Apixaban Versus Warfarin in Nonvalvular Atrial Fibrillation. J Am Heart Assoc 2016;5(6). DOI: 10.1161/JAHA.116. 003725.
44. Hohnloser SH, Basic E, Nabauer M. Comparative risk of major bleeding with new oral anticoagulants (NOACs) and phenprocoumon in patients with atrial fibrillation: a post-marketing surveillance study. Clin Res Cardiol 2017;106(8):618-628. DOI: 10.1007/s00392-017-1098-x.
45. Bhatt DL, Eikelboom JW, Connolly SJ, et al. Role of Combination Antiplatelet and Anticoagulation Therapy in Diabetes Mellitus and Cardiovascular Disease: Insights From the COMPASS Trial. Circulation 2020;141(23):1841-1854. DOI: 10.1161/CIRCULATIONAHA.120.046448.
46. Joosten LPT, van Doorn S, van de Ven PM, et al. Safety of Switching from a Vitamin K Antagonist to a Non-Vitamin K Antagonist Oral Anticoagulant in Frail Older Patients with Atrial Fibrillation: Results of the FRAIL-AF Randomized Controlled Trial. Circulation 2023. DOI: 10.1161/CIRCULATIONAHA.123.066485.
47. Martin K, Beyer-Westendorf J, Davidson BL, Huisman MV, Sandset PM, Moll S. Use of the direct oral anticoagulants in obese patients: guidance from the SSC of the ISTH. J Thromb Haemost 2016;14(6):1308-13. DOI: 10.1111/jth.13323.
48. Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018;39(16): 1330-1393. DOI: 10.1093/eurheartj/ehy136.
49. Martin KA, Lee CR, Farrell TM, Moll S. Oral Anticoagulant Use After Bariatric Surgery: A Literature Review and Clinical Guidance. Am J Med 2017;130 (5):517-524. DOI: 10.1016/j.amjmed.2016.12.033.
50. Hakeam HA, Al-Sanea N. Effect of major gastrointestinal tract surgery on the absorption and efficacy of direct acting oral anticoagulants (DOACs). J Thromb Thrombolysis 2017;43(3):343-351. DOI: 10.1007/s11239-016-1465-x.
51. American Society for M, Bariatric Surgery Clinical Issues C. ASMBS updated position statement on prophylactic measures to reduce the risk of venous thromboembolism in bariatric surgery patients. Surg Obes Relat Dis 2013;9(4):493-7. DOI: 10.1016/j.soard.2013.03.006.
52. Pengo V, Denas G, Zoppellaro G, et al. Rivaroxaban vs warfarin in high-risk patients with antiphospholipid syndrome. Blood 2018;132(13):1365-1371. DOI: 10.1182/blood-2018-04-848333.
53. Zappulla P, Calvi V. Gastrointestinal Bleeding and Direct Oral Anticoagulants among Patients with Atrial Fibrillation: Risk, Prevention, Management, and Quality of Life. TH Open 2021;5(2):e200-e210. DOI: 10.1055/s-0041- 1730035.
54. Ray WA, Chung CP, Murray KT, et al. Association of Oral Anticoagulants and Proton Pump Inhibitor Cotherapy With Hospitalization for Upper Gastrointestinal Tract Bleeding. JAMA 2018;320(21):2221-2230. DOI: 10.1001/ jama.2018.17242.
55. Cappato R, Ezekowitz MD, Klein AL, et al. Rivaroxaban vs. vitamin K antagonists for cardioversion in atrial fibrillation. Eur Heart J 2014;35(47):3346-55. DOI: 10.1093/eurheartj/ehu367.
56. Gouin-Thibault I, Flaujac C, Delavenne X, et al. Assessment of apixaban plasma levels by laboratory tests: suitability of three anti-Xa assays. A multicentre French GEHT study. Thromb Haemost 2014;111(2):240-8. DOI: 10.1160/TH13-06-0470.
57. Chin PK, Patterson DM, Zhang M, et al. Coagulation assays and plasma fibrinogen concentrations in real-world patients with atrial fibrillation treated with dabigatran. Br J Clin Pharmacol 2014;78(3):630-8. DOI: 10.1111/bcp. 12366.
58. Adcock DM, Gosselin R, Kitchen S, Dwyre DM. The effect of dabigatran on select specialty coagulation assays. Am J Clin Pathol 2013;139(1):102-9. DOI: 10.1309/AJCPY6G6ZITVKPVH.
59. Cannon CP, Bhatt DL, Oldgren J, et al. Dual Antithrombotic Therapy with Dabigatran after PCI in Atrial Fibrillation. N Engl J Med 2017;377(16):1513-1524. DOI: 10.1056/NEJMoa1708454.
60. Gibson CM, Mehran R, Bode C, et al. Prevention of Bleeding in Patients with Atrial Fibrillation Undergoing PCI. N Engl J Med 2016;375(25):2423-2434. DOI: 10.1056/NEJMoa1611594.
61. Lopes RD, Heizer G, Aronson R, et al. Antithrombotic Therapy after Acute Coronary Syndrome or PCI in Atrial Fibrillation. N Engl J Med 2019;380(16): 1509-1524. DOI: 10.1056/NEJMoa1817083.
62. Vranckx P, Valgimigli M, Eckardt L, et al. Edoxaban-based versus vitamin K antagonist-based antithrombotic regimen after successful coronary stenting in patients with atrial fibrillation (ENTRUST-AF PCI): a randomised, open-label, phase 3b trial. Lancet 2019;394(10206):1335-1343. DOI: 10.1016/ S0140-6736(19) 31872-0.
63. Windecker S, Lopes RD, Massaro T, et al. Antithrombotic Therapy in Patients With Atrial Fibrillation and Acute Coronary Syndrome Treated Medically or With Percutaneous Coronary Intervention or Undergoing Elective Percutaneous Coronary Intervention: Insights From the AUGUSTUS Trial. Circulation 2019;140(23):1921-1932. DOI: 10.1161/CIRCULATIONAHA.119. 043308.
64. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J Acute Cardiovasc Care 2023. DOI: 10.1093/ehjacc/zuad107.
65. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020;41(3): 407-477. DOI: 10.1093/eurheartj/ehz425.
PRAXIS
- Vol. 112
- Ausgabe 13
- Dezember 2023