- Grossesse et abdomen aigu
L’ abdomen aigu pendant la grossesse est une situation rare mais potentiellement grave, tant pour la mère que pour le fœtus. Moins de 1 % des femmes enceintes nécessitent une chirurgie non-obstétricale au cours de la grossesse. Le diagnostic étiologique peut s’ avérer complexe en raison des modifications physiologiques induites par la grossesse. Les examens complémentaires, en particulier l’ imagerie, ne doivent pas être retardés du seul fait de la grossesse, car une prise en charge précoce est essentielle afin de limiter les complications maternelles et fœtales. Lorsque la chirurgie est indiquée, la laparoscopie est privilégiée car elle a montré son innocuité sur le fœtus. Cependant, dans certaines situations, la laparotomie peut s’ avérer nécessaire. L’ abord laparoscopique est possible jusqu’ au 3ème trimestre de la grossesse mais doit suivre un ensemble de règles de sécurité strictes afin de limiter l’ impact fœto-maternel et de garantir la sécurité de l’ intervention: position en décubitus latéral gauche, technique de création du pneumopéritoine et placement des trocarts adaptés au volume utérin, limitation de la pression intra-abdominale.
Acute abdomen during pregnancy is a rare but potentially serious condition for both the mother and the fetus. Fewer than 1% of pregnant women require non-obstetric surgery during gestation. Determining the etiology can be challenging because of the physiological changes associated with pregnancy. Complementary investigations, particularly imaging, should not be delayed solely due to pregnancy, as early management is crucial for reducing maternal and fetal complications. When surgery is indicated, laparoscopy is preferred, as it has been shown to be safe for the fetus. However, in certain cases, laparotomy may be necessary. Laparoscopic approaches can be performed up to the third trimester, provided strict safety measures are observed to minimize maternal–fetal risks. These include left lateral decubitus positioning, appropriate techniques for pneumoperitoneum creation and trocar placement according to uterine size, and limitation of intra-abdominal pressure.
Keywords: pregnancy, emergency, acute abdominal pain, surgery
Introduction: douleurs et abdomen aigu
Certaines douleurs sont considérées comme physiologiques durant la grossesse, mais d’ autres, notamment aiguës, peuvent indiquer une urgence, justifiant une évaluation médico-chirurgicale rapide et systématique.
La douleur aiguë est définie comme «une expérience sensorielle et émotionnelle désagréable associée à une lésion tissulaire réelle ou potentielle» (1), d’ apparition récente (2).
Le terme d’ «abdomen aigu» sous-entend une urgence immédiate, et qu’ une indication chirurgicale est potentiellement envisagée (3).
Nous proposons dans cet article de discuter la stratégie diagnostique et thérapeutique de l’ abdomen aigu pendant la grossesse.
I. Abdomen aigu pendant la grossesse: diagnostic
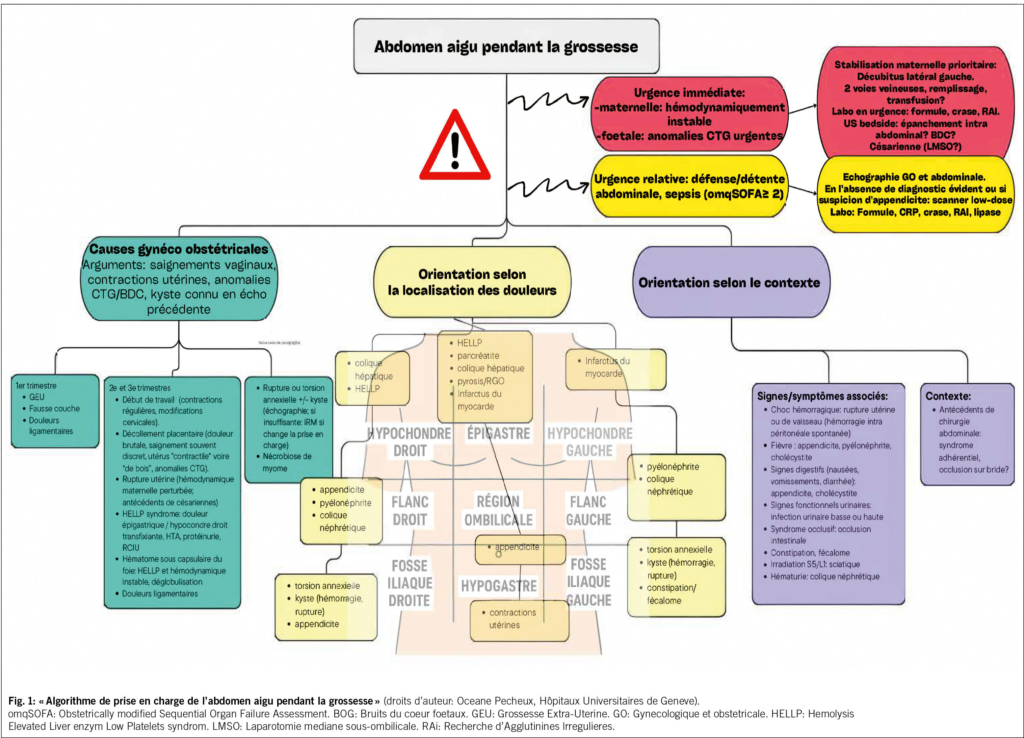
Première étape: diagnostic de gravité
(voir Fig. 1, «Algorithme de prise en charge de l’ abdomen aigu pendant la grossesse»). L’ état de choc chez la femme enceinte doit prendre en compte ses particularités physiologiques: l’ hypotension survient souvent tardivement et la tachycardie modérée est parfois physiologique (4). Il faut rester attentif aux autres signes d’ hypoperfusion tels que nausées, vomissements, lipothymies, marbrures et augmentation de temps de recoloration cutanée. En cas de choc hémorragique, l’ utilisation de l’ «indice de choc» (fréquence cardiaque divisée par la pression artérielle systolique) peut être plus informative que la pression artérielle systolique seule (5), alors que pour le sepsis, l’ omQSOFA (obstetrically modified Sequential Organ Failure Assessment (omSOFA)) est utilisé (6). De plus, la défense et/ou la détente abdominale, qui signent l’ urgence chirurgicale, peuvent être absentes pendant la grossesse, notamment en raison de la relaxation des muscles abdominaux et de l’ éloignement des feuillets péritonéaux.
Enfin, l’ évaluation fœtale (mouvements, bruits du cœur ou cardiotocogramme (CTG)) doit être systématiquement prise en compte dans le diagnostic de gravité.
Deuxième étape: diagnostic étiologique
(voir Fig. 1, «Algorithme de prise en charge de l’ abdomen aigu pendant la grossesse»).
La connaissance des modifications physiologiques au cours de la grossesse peut éviter de retarder le diagnostic et la prise en charge, et ainsi minimiser les complications potentiellement graves (perforation digestive, sepsis, etc…). Par exemple, le déplacement anatomique progressif de l’ appendice jusqu’ au flanc droit au cours de la grossesse est un phénomène physiologique à prendre en compte (7). Autre exemple, devant un tableau d’ «hyperémèse gravidique» survenant durant la seconde moitié de la grossesse, une occlusion intestinale sur bride doit être évoquée, surtout en cas d’ antécédents de chirurgie abdominale (8).
Les modifications hormonales rendent plus fréquents les calculs biliaires en échographie (9), mais le risque de maladie lithiasique reste faible, autour de 0,2 % (10). L’ augmentation de l’ incidence de la pancréatite aiguë au cours du troisième trimestre pourrait être liée à l’ augmentation de la pression intra-abdominale sur les voies biliaires (11), ou à la position fœtale.
La grossesse entraîne une fragilité vasculaire et une augmentation de la pression artérielle notamment au 3e trimestre, or ces facteurs sont contributifs des anévrismes. La rupture utérine et l’ hémorragie intrapéritonéale spontanée («SHIP» en anglais) sont exceptionnelles, mais à risque de mortalité maternelle et foetale (12–14). Leurs facteurs de risque principaux sont les antécédents de cicatrice utérine (notamment après myomectomie) et l’ endométriose profonde (21). La grossesse entraîne une fragilité vasculaire et une augmentation de la pression artérielle notamment au 3e trimestre, or ces facteurs sont contributifs des anévrismes. La SHIP est liée le plus souvent à des ruptures vasculaires (anévrisme de l’ artère splénique, varices utéro-ovariennes (15–17), vaisseaux du ligament ovarien (18), vaisseau de myome utérin (19,20), ou des ligaments larges), notamment au moment de l’ accouchement. Les facteurs de risque principaux sont les antécédents de cicatrice utérine (notamment après myomectomie) et l’ endométriose profonde (21).
Examens complémentaires: laboratoire
Les examens biologiques doivent être interprétés en prenant en compte la grossesse, qui confère une hémodilution (22), alors que le volume sanguin est augmenté, d’ où des signes tardifs en cas de déplétion sanguine. Le syndrome inflammatoire peut être masqué ou surdiagnostiqué du fait de l’ augmentation physiologique des globules blancs (23), davantage marquée après cure de corticoïdes dans le contexte de prématurité (24).
Examens complémentaires: imagerie
L’ échographie abdominale reste l’ examen de 1ère intention car il n’ est pas irradiant et facilement accessible, même si sa sensibilité diminue avec l’ avancée de l’ âge gestationnel et s’ il est opérateur-dépendant (25). De manière générale, si un examen d’ imagerie est indiqué et peut modifier le diagnostic et la prise en charge, il ne doit pas être différé du fait de la grossesse.
Concernant les rayonnements liés au scanner, les effets décrits sur le fœtus sont de deux types: les effets déterministes ou réactions tissulaires, qui apparaissent au-delà d’ un seuil de dose et peuvent entraîner malformations ou avortement, et les effets stochastiques, sans seuil, dont la probabilité augmente avec la dose, pouvant provoquer cancers ou maladies héréditaires. La période la plus sensible aux radiations se situe entre la 3e et la 15e semaine de grossesse. La dose d’ irradiation lors d’ un scanner reste bien inférieure à 50 mGy (dose fœtale en moyenne de 8 mGy lors d’ une acquisition abdominopelvienne), seuil en-dessous duquel les effets déterministes n’ existent pas. Le risque de développer une tumeur fœtale en cas d’ irradiation est environ deux fois plus élevé au premier trimestre qu’ au cours des deux trimestres suivants (RR = 3.2 contre 1.3) (26, 27). Le risque théorique d’ hypothyroïdie chez le nouveau-né en cas d’ injection de produits de contraste iodés n’ a pas été démontré (24–26), mais il est recommandé de vérifier la fonction thyroïdienne chez le nouveau-né au cours de la première semaine de vie (ESUR 2018) (27).
L’ IRM abdominale ≤ 1.5 Tesla (26) peut être utilisée. Les indications d’ injection de gadolinium sont rares, à discuter uniquement si l’ examen modifie la prise en charge, comme par exemple pour certaines lésions hépatiques ou ovariennes suspectes de malignité (28). La plus petite dose possible peut alors être administrée. Aucun effet mutagène ou tératogène n’ a été décrit sur la base de données limitées disponibles (29), donc aucun test néonatal supplémentaire n’ est nécessaire, mais les données au 1er trimestre sont insuffisantes (30, 31).
A noter que la cholangiographie per-opératoire est sans effet néfaste démontré (32). Dans tous les cas à risque potentiel, une discussion en concertation entre l’ équipe d’ obstétrique et celle de radiologie est indispensable.
II. Abdomen aigu pendant la grossesse: prise en charge
Prise en charge antalgique
Une prise en charge multimodale de l’ antalgie est encouragée. Les anti-inflammatoires sont à éviter au 1er trimestre et à partir de 20 semaines d’ aménorrhée (SA) (33, 34). En l’ absence d’ alternative, l’ utilisation des morphiniques est possible quel que soit le terme de la grossesse, en limitant la durée au strict nécessaire (35).
Chirurgie pendant la grossesse: informations et bonnes pratiques
Modalités d’ hospitalisation
Lorsqu’ une chirurgie non obstétricale est pratiquée, un obstétricien doit être prévenu et disponible, et l’ opération doit être effectuée dans un établissement disposant d’ un service de néonatalogie adapté au terme de la grossesse. Après l’ intervention, la patiente est préférentiellement hospitalisée dans le service de chirurgie dédié, avec la visite quotidienne d’ une sage-femme ou d’ un obstétricien, comprenant évaluation maternelle et fœtale. En cas de risque d’ accouchement imminent, l’ hospitalisation en maternité avec passage quotidien du chirurgien est une alternative.
Informations des patientes en cas de chirurgie pendant la grossesse
Moins de 1 % des femmes enceintes nécessitent une chirurgie non-obstétricale au cours de la grossesse, le plus souvent abdominale (36).
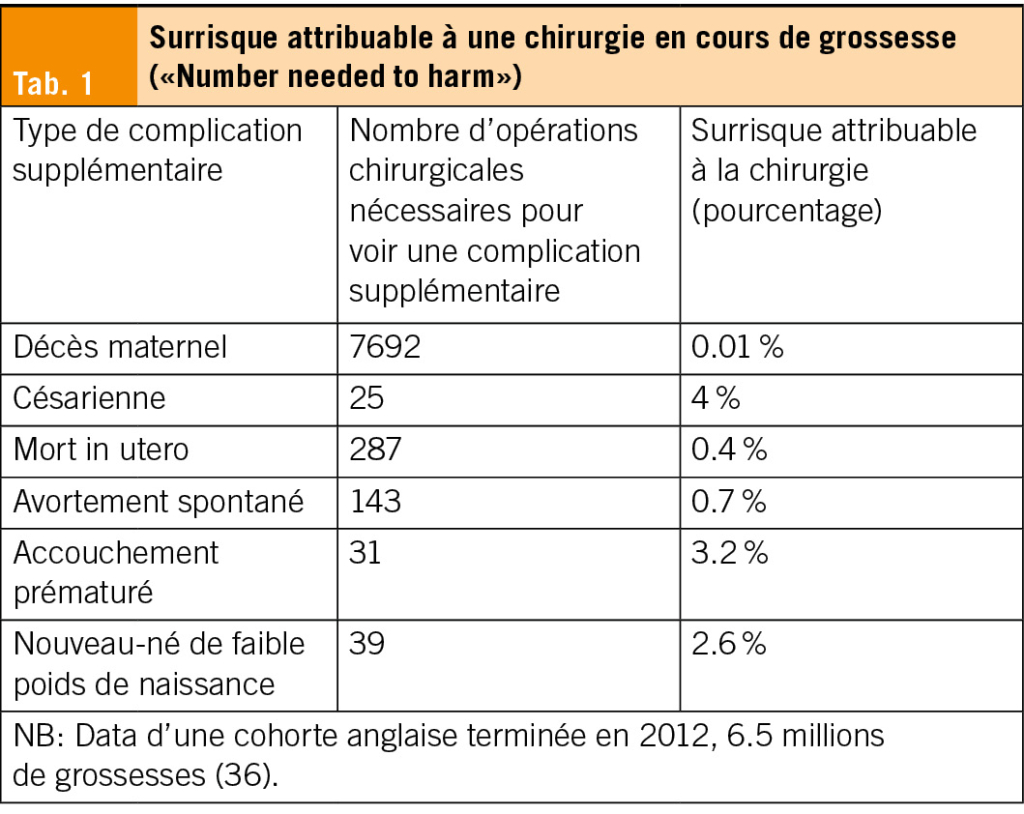
Des données historiques ou de pays à faibles revenus indiquent que la chirurgie pendant la grossesse entraînerait des risques accrus, notamment de fausse couche, de mort in utero, et d’ accouchement prématuré (37–40). Ces risques sont néanmoins limités avec les protocoles actuels: un surrisque spécifique reste faible (Tab. 1) (36). La chirurgie est sûre quel que soit le trimestre, alors que le retard de prise en charge chirurgicale peut mener à des complications sévères (41). Cependant, toute intervention chirurgicale non urgente doit être reportée après l’ accouchement (28).
Voie d’ abord et position de la patiente
Pendant la grossesse, la laparoscopie doit être privilégiée (28, 42), sauf si une césarienne est indiquée au même moment. Cependant, en cas de choc hémorragique avec hémopéritoine massif, la laparotomie est indiquée d’ emblée, et peut être médiane pour permettre l’ accès aux vaisseaux parfois mis en cause dans ce contexte (anévrisme splénique).
A partir de 18 SA, la patiente est positionnée en décubitus latéral gauche de 15 ° pendant la chirurgie afin de réduire la compression aorto-cave (43), et donc l’ effet d’ hypotension en décubitus dorsal (44).
Laparoscopie: bonnes pratiques
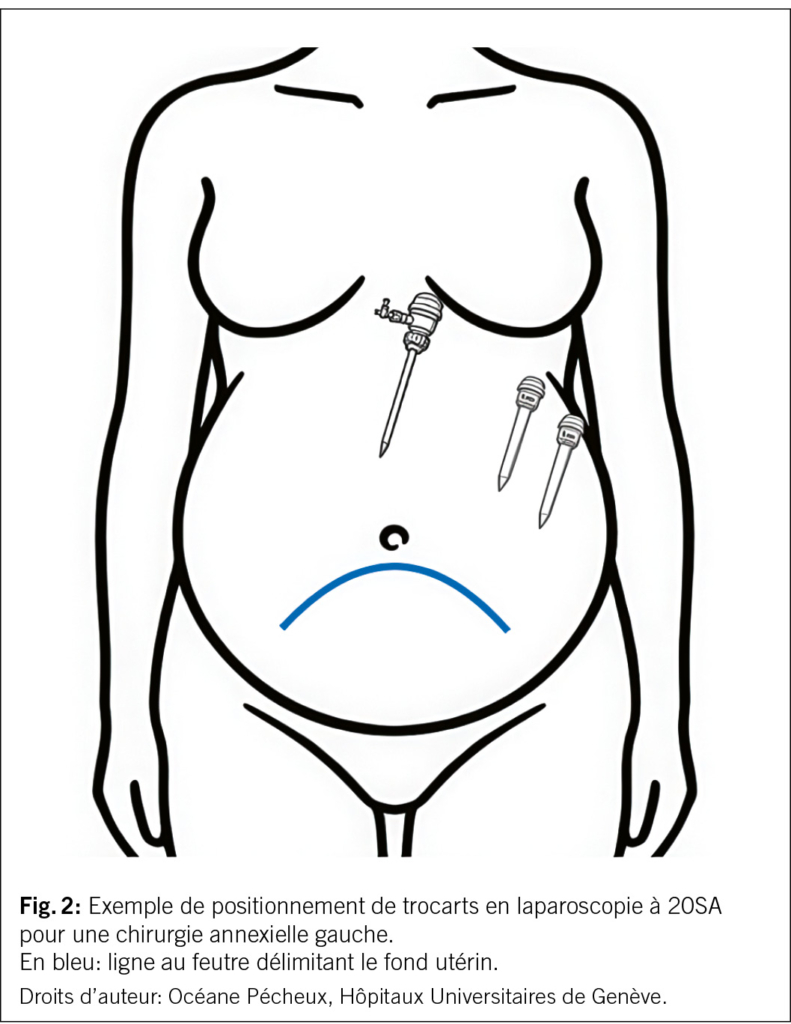
Une démarcation du fond utérin aidée par une échographie abdominale est conseillée avant la création du pneumopéritoine. Même si de multiples techniques d’ entrée (aiguille de Veres, trocart optique) peuvent être utilisées (45), l’ open-laparoscopy, abord chirurgical sous contrôle de la vue, est privilégiée surtout après 16SA, afin de limiter les risque de lésion utérine. Le positionnement des trocarts doit impérativement prendre en compte le volume utérin. Notamment, le trocart ombilical peut être placé en sus-ombilical, et les autres trocarts peuvent être tous placés du côté de l’ abord prévu afin de garantir un espace de travail suffisant (Fig. 2). Des trocarts atraumatiques (sans lame) sont utilisés et introduits sous contrôle endoscopique visuel strict, jamais en direction de l’ utérus gravide, pour éviter tout traumatisme et saignement de l’ utérus.
Nous recommandons par ailleurs de limiter au maximum la manipulation de l’ utérus et des anses digestives.
Même si les recommandations considèrent qu’ une pression intra-abdominale de CO2 entre 10 et 15 mmHg peut être utilisée en toute sécurité chez la patiente enceinte (32), nous préconisons une pression de 12 mmHg lors de l’ introduction des trocarts (atraumatiques), puis 10 mmHg pendant l’ intervention. En dépit des craintes liées à une éventuelle diminution du flux sanguin utérin en raison de l’ augmentation de la pression intra-abdominale liée à l’ insufflation, et à l’ absorption fœtale éventuelle de dioxyde de carbone (46), des modèles animaux (47) puis l’ expérience internationale acquise depuis la première cholécystectomie par laparoscopie durant la grossesse en 1991, ont apporté des données rassurantes.
Concernant la réhabilitation post-opératoire, le sondage urinaire est à éviter et la mobilisation et la réalimentation précoces sont à favoriser.
Traitements médicamenteux péri-opératoires spécifiques ou adaptés à la grossesse
La laparoscopie n’ est pas considérée comme un événement à risque d’ allo-immunisation fœto-maternelle et l’ administration d’ immunoglobuline anti-D n’ est donc pas systématique (28), mais reste à effectuer pour les cas d’ hémorragie intra-abdominale par exemple. De même, les tocolytiques ou la cure de maturation pulmonaire par corticoïdes ne sont pas systématiques, le surrisque de prématurité lié à la chirurgie en elle-même étant faible, et ces traitements représentant des risques spécifiques (48, 49). Ils restent à discuter dans les cas d’ infection et de dégradation rapide de l’ état maternel avant 34 SA (chirurgies cardio-vasculaires, état de choc, etc).
Les protocoles de choix en anesthésie sont adaptés à l’ état de grossesse, et l’ anticoagulation prophylactique post-opératoire d’ indication large du fait de l’ état d’ hypercoagulabilité, alors que l’ indication à l’ antibioprophylaxie n’ est en général pas modifiée du fait de la grossesse (50, 51).
Surveillance fœtale péri-opératoire
A partir de 24–26 SA, la surveillance fœtale par CTG pré- et post-opératoire est recommandée de principe et pour rassurer la patiente. Elle n’ est basée cependant que sur des niveaux de preuves faible (32). En période post-opératoire, le CTG doit être interprété en fonction de l’ utilisation de morphiniques et d’ autres médications spécifiques (diminution fréquente de la variabilité et du rythme de base) (52).
Dans les situations les plus à risque de souffrance fœtale, notamment les chirurgies cardio-vasculaires et les perforations digestives, le CTG per-opératoire continu peut être justifié, et réalisé stérilement en protégeant les capteurs dans des sacs plastique, à distances des incisions cutanées (11). Le CTG doit alors être interprété en fonction du contexte péri-opératoire, c’ est-à-dire que les anomalies du rythmes cardiaque fœtal sont fréquentes mais souvent résolutives (53).
Dre Océane Pécheux
Dre Catherine McCarey
Dre Sarah Belin
Dre Elena Tonsigh
Dre Elena Scorrano
Dre Sara de Oliveira
Dr Jean Dubuisson
Département de Pédiatrie Gynécologie et d’ Obstétrique
Hôpitaux Universitaires de Genève
1205 Genève, Suisse
ORCID 0000-0002-4450-2534
Remerciements:
Marta Sans Merce (Physicienne médicale, PhD) et Pr Poletti (radiologue).
Copyright
Aerzteverlag medinfo AG
Département de Pédiatrie Gynécologie et d’ Obstétrique
Hôpitaux Universitaires de Genève
1205 Genève, Suisse
Département de Pédiatrie Gynécologie et d’ Obstétrique
Hôpitaux Universitaires de Genève
1205 Genève, Suisse
Département de Pédiatrie Gynécologie et d’ Obstétrique
Hôpitaux Universitaires de Genève
1205 Genève, Suisse
Les auteurs n’ ont pas déclaré de conflit d’ intérêts en rapport avec cet article.
- L’ évaluation anamnestique et clinique d’ un abdomen aigu au cours de la grossesse doit prendre en compte les modifications physiologiques liées à la grossesse, tant pour l’ appréciation du degré de gravité que pour l’ orientation étiologique, parfois complexe. Les examens d’ imagerie ou une exploration chirurgicale en urgence
ne doivent pas être différés du fait de la grossesse, afin de prévenir l’ apparition de complications materno-fœtales potentiellement sévères. - Les traitements antalgiques et l’ utilisation des produits de
contraste pour l’ imagerie doivent être adaptés en fonction du terme de la grossesse et de la «balance bénéfices – risques». - Les bonnes pratiques en cas de laparoscopie sont: position de décubitus latéral gauche de 15°; délimitation pré-opératoire du fond utérin au deuxième et troisième trimestre avant la création du pneumopéritoine; open-laparoscopy avec trocart sus-ombilical; évitement de toute manipulation utérine; pression intraabdominale de CO2 à 12 mmHg lors de l’ introduction des trocarts atraumatiques puis 10 mmHg au cours de l’ opération; éviter le sondage urinaire post-opératoire; favoriser la mobilisation et la réalimentation précoces.
1. Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The Revised IASP definition of pain: concepts, challenges, and compromises. Pain. 1 sept 2020;161(9):1976‑82.
2. Treede RD, Rief W, Barke A, Aziz Q, Bennett MI, Benoliel R, et al. A classification of chronic pain for ICD-11. Pain. juin 2015;156(6):1003‑7.
3. Stedman’ s Medical Dictionary, 27th Edition Deluxe [Internet]. [cité 28 avr 2025]. Disponible sur: https://www.alibris.com/Stedmans-Medical-Dictionary-27th-Edition-Deluxe-Stedmans/book/30000738
4. Green LJ, Mackillop LH, Salvi D, Pullon R, Loerup L, Tarassenko L, et al. Gestation-Specific Vital Sign Reference Ranges in Pregnancy. Obstet Gynecol. mars 2020;135(3):653‑64.
5. Jenkins PC, Stokes SM, Fakoyeho S, Bell TM, Zarzaur BL. Clinical indicators of hemorrhagic shock in pregnancy. Trauma Surg Acute Care Open. 7 nov 2017;2(1):e000112.
6. Yahya FB, Yousufuddin M, Gaston HJ, Fagbongbe E, Rangel Latuche LJ. Validating the performance of 3 sepsis screening tools in patients with clinical chorioamnionitis. AJOG Glob Rep. 3 oct 2023;3(4):100271.
7. BAER JL, REIS RA, ARENS RA. APPENDICITIS IN PREGNANCY: WITH CHANGES IN POSITION AND AXIS OF THE NORMAL APPENDIX IN PREGNANCY. J Am Med Assoc. 16 avr 1932;98(16):1359‑64.
8. Almulhim Z, Othman S, Alarfaj M, Hamadah N, Bamalan O, Alanazi F. A Rare Case of Small Bowel Obstruction in Pregnancy Due to Adenocarcinoma. Cureus. 16(1):e53124.
9. Schirmer BD, Winters KL, Edlich RF. Cholelithiasis and cholecystitis. J Long Term Eff Med Implants. 2005;15(3):329‑38.
10. Swisher SG, Schmit PJ, Hunt KK, Hiyama DT, Bennion RS, Swisher EM, et al. Biliary disease during pregnancy. Am J Surg. déc 1994;168(6):576‑9; discussion 580-581.
11. Sharp HT. The acute abdomen during pregnancy. Clin Obstet Gynecol. juin 2002;45(2):405‑13.
12. Aung YYM, Berry C, Jayaram PR, Woon EV. Splenic artery aneurysm in pregnancy: A systematic review. Int J Gynaecol Obstet Off Organ Int Fed Gynaecol Obstet. janv 2023;160(1):1‑11.
13. Sadat U, Dar O, Walsh S, Varty K. Splenic artery aneurysms in pregnancy–a systematic review. Int J Surg Lond Engl. juin 2008;6(3):261‑5.
14. Caillouette JC, Merchant EB. Ruptured splenic artery aneurysm in pregnancy. Twelfth reported case with maternal and fetal survival. Am J Obstet Gynecol. juin 1993;168(6 Pt 1):1810‑1; discussion 1811-1813.
15. Díaz-Murillo R, Tobías-González P, López-Magallón S, Magdaleno-Dans F, Bartha JL. Spontaneous Hemoperitoneum due to Rupture of Uterine Varicose Veins during Labor Successfully Treated by Percutaneous Embolization. Case Rep Obstet Gynecol. 2014;2014:580384.
16. Doger E, Cakiroglu Y, Yildirim Kopuk S, Akar B, Caliskan E, Yucesoy G. Spontaneous rupture of uterine vein in twin pregnancy. Case Rep Obstet Gynecol. 2013;2013:596707.
17. Dubuisson J, Pennehouat G, Rudigoz RC. Rupture spontanée du pédicule utérin en cours de grossesse: à propos de trois cas. Gynécologie Obstétrique Fertil. 1 sept 2006;34(9):711‑5.
18. Munir SI, Lo T, Seaton J. Spontaneous rupture of utero-ovarian vessels in pregnancy. BMJ Case Rep. 30 mai 2012;2012:bcr0220125904.
19. Ekane GH, Tebeu PM, Obinchemti TE, Njamen TN, Nguefack CT, Kamgaing JT, et al. Postpartum hemoperitoneum due to rupture of a blood vessel on a uterine pseudo tumor: a case report. Pan Afr Med J. 2013;16:57.
20. Doerga-Bachasingh S, Karsdorp V, Yo G, van der Weiden R, van Hooff M. Successful myomectomy of a bleeding myoma in a twin pregnancy. JRSM Short Rep. févr 2012;3(2):13.
21. Lier MCI, Malik RF, Ket JCF, Lambalk CB, Brosens IA, Mijatovic V. Spontaneous hemoperitoneum in pregnancy (SHiP) and endometriosis – A systematic review of the recent literature. Eur J Obstet Gynecol Reprod Biol. déc 2017;219:57‑65.
22. Pavord S, Daru J, Prasannan N, Robinson S, Stanworth S, Girling J, et al. UK guidelines on the management of iron deficiency in pregnancy. Br J Haematol. 2020;188(6):819‑30.
23. Chandra S, Tripathi AK, Mishra S, Amzarul M, Vaish AK. Physiological Changes in Hematological Parameters During Pregnancy. Indian J Hematol Blood Transfus. sept 2012;28(3):144‑6.
24. Bauer ME, Price LK, MacEachern MP, Housey M, Langen ES, Bauer ST. Maternal leukocytosis after antenatal corticosteroid administration: a systematic review and meta-analysis. J Obstet Gynaecol J Inst Obstet Gynaecol. févr 2018;38(2):210‑6.
25. Wang Z, Bao F, Liang W, Wu H, Lin Z, Xu J, et al. Appendicitis in pregnant women: A systematic review and meta-analysis of the diagnostic performance of ultrasonography. J Clin Ultrasound. 2023;51(9):1492‑501.
26. Chen MM, Coakley FV, Kaimal A, Laros RK. Guidelines for computed tomography and magnetic resonance imaging use during pregnancy and lactation. Obstet Gynecol. août 2008;112(2 Pt 1):333‑40.
27. Confédération suisse. Recommandations CPR : Radioprotection de la femme enceinte. 2021 [cité 20 mai 2025]; Disponible sur: https://www.bag.admin.ch/dam/bag/de/dokumente/str/kommission-strahlenschutz/stellungnahmen-medizin/20210520_medizin_schwangere.pdf.download.pdf/2021-05-27_Empfehlungen %20KSR-Strahlenschutz %20Schwangere.pdf
28. Ball E, Waters N, Cooper N, Talati C, Mallick R, Rabas S, et al. Evidence-Based Guideline on Laparoscopy in Pregnancy. Facts Views Vis ObGyn. 11(1):5‑25.
29. Webb JAW, Thomsen HS, Morcos SK, Members of Contrast Media Safety Committee of European Society of Urogenital Radiology (ESUR). The use of iodinated and gadolinium contrast media during pregnancy and lactation. Eur Radiol. juin 2005;15(6):1234‑40.
30. ESUR Guidelines on Contrast Agents European Society of Urogenital Radiology 10.0. mars 2018 [cité 29 avr 2015]; Disponible sur: https://adus-radiologie.ch/files/ESUR_Guidelines_10.0.pdf
31. Alghamdi SA. Gadolinium-Based Contrast Agents in Pregnant Women: A Literature Review of MRI Safety. Cureus. 15(5):e38493.
32. SAGES [Internet]. 2023 [cité 29 avr 2025]. Guidelines for the Use of Laparoscopy during Pregnancy – A SAGES Publication. Disponible sur: https://www.sages.org/publications/guidelines/guidelines-for-diagnosis-treatment-and-use-of-laparoscopy-for-surgical-problems-during-pregnancy/
33. Research C for DE and. FDA recommends avoiding use of NSAIDs in pregnancy at 20 weeks or later because they can result in low amniotic fluid. FDA [Internet]. 20 févr 2025 [cité 28 avr 2025]; Disponible sur: https://www.fda.gov/drugs/drug-safety-and-availability/fda-recommends-avoiding-use-nsaids-pregnancy-20-weeks-or-later-because-they-can-result-low-amniotic
34. Choi EY, Jeong HE, Noh Y, Choi A, Yon DK, Han JY, et al. Neonatal and maternal adverse outcomes and exposure to nonsteroidal anti-inflammatory drugs during early pregnancy in South Korea: A nationwide cohort study. PLOS Med. 27 févr 2023;20(2):e1004183.
35. Le CRAT. Utilisation des morphiniques pendant la grossesse. [cité 9 mai 2025]; Disponible sur: https://www.lecrat.fr/4552/
36. Balinskaite V, Bottle A, Sodhi V, Rivers A, Bennett PR, Brett SJ, et al. The Risk of Adverse Pregnancy Outcomes Following Nonobstetric Surgery During Pregnancy: Estimates From a Retrospective Cohort Study of 6.5 Million Pregnancies. Ann Surg. août 2017;266(2):260‑6.
37. Rosen MA. Management of anesthesia for the pregnant surgical patient. Anesthesiology. oct 1999;91(4):1159‑63.
38. Duncan PG, Pope WD, Cohen MM, Greer N. Fetal risk of anesthesia and surgery during pregnancy. Anesthesiology. juin 1986;64(6):790‑4.
39. Cohen-Kerem R, Railton C, Oren D, Lishner M, Koren G. Pregnancy outcome following non-obstetric surgical intervention. Am J Surg. sept 2005;190(3):467‑73.
40. Fu PH, Yu CH, Chen YC, Chu CC, Chen JY, Liang FW. Risk of adverse fetal outcomes following nonobstetric surgery during gestation: a nationwide population-based analysis. BMC Pregnancy Childbirth. 13 mai 2022;22:406.
41. Tolcher MC, Fisher WE, Clark SL. Nonobstetric Surgery During Pregnancy. Obstet Gynecol. août 2018;132(2):395‑403.
42. Takami T, Yamaguchi T, Yoshitake H, Hatano K, Kataoka N, Tomita M, et al. A clinical comparison of laparoscopic versus open appendectomy for the treatment of complicated appendicitis: historical cohort study. Eur J Trauma Emerg Surg Off Publ Eur Trauma Soc. août 2020;46(4):847‑51.
43. Krywko DM, King KC. Aortocaval Compression Syndrome. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 [cité 28 avr 2025]. Disponible sur: http://www.ncbi.nlm.nih.gov/books/NBK430759/
44. Zeleke ME, Chekol WB, Kasahun HG, Mekonnen ZA, Filatie TD, Melesse DY, et al. Perioperative management of surgical procedure during pregnancy: a systematic review. Ann Med Surg. 16 avr 2024;86(6):3432‑41.
45. Chohan L, Kilpatrick CC. Laparoscopy in pregnancy: a literature review. Clin Obstet Gynecol. déc 2009;52(4):557‑69.
46. Fatum M, Rojansky N. Laparoscopic surgery during pregnancy. Obstet Gynecol Surv. janv 2001;56(1):50‑9.
47. Cruz AM, Southerland LC, Duke T, Townsend HG, Ferguson JG, Crone LA. Intraabdominal carbon dioxide insufflation in the pregnant ewe. Uterine blood flow, intraamniotic pressure, and cardiopulmonary effects. Anesthesiology. déc 1996;85(6):1395‑402.
48. Ninan K, Liyanage SK, Murphy KE, Asztalos EV, McDonald SD. Evaluation of Long-term Outcomes Associated With Preterm Exposure to Antenatal Corticosteroids. JAMA Pediatr. juin 2022;176(6):e220483.
49. Hill WC. Risks and complications of tocolysis. Clin Obstet Gynecol. déc 1995;38(4):725‑45.
50. Zachariah SK, Fenn M, Jacob K, Arthungal SA, Zachariah SA. Management of acute abdomen in pregnancy: current perspectives. Int J Womens Health. 8 févr 2019;11:119‑34.
51. J A Jayalal, Sheeba A Sarasam, Jerlin priya. Role of Laparoscopy in the Management of Acute Abdomen in Pregnancy. [cité 30 avr 2025]; Disponible sur: https://www.ijss-sn.com/uploads/2/0/1/5/20153321/ijss_jun_oa11.pdf
52. Petrie RH, Yeh SY, Murata Y, Paul RH, Hon EH, Barron BA, et al. The effect of drugs on fetal heart rate variability. Am J Obstet Gynecol. 1 févr 1978;130(3):294‑9.
53. Higgins MF, Pollard L, McGuinness SK, Kingdom JC. Fetal heart rate monitoring in nonobstetric surgery: a systematic review of the evidence. Am J Obstet Gynecol MFM. 1 nov 2019;1(4):100048.
info@gynäkologie
- Vol. 15
- Ausgabe 5
- Oktober 2025