- Präzisionsmedizin beim Endometriumkarzinom
Das Endometriumkarzinom (EC) ist das häufigste gynäkologische Malignom in Industrieländern mit steigender Inzidenz. Die traditionelle binäre Einteilung in Typ I und II EC ist veraltet und reicht zur präzisen Risikoeinschätzung nicht mehr aus. Einen entscheidenden Fortschritt stellt die molekulare Klassifikation dar, die erstmals im Rahmen des The Cancer Genome Atlas (TCGA)-Projekts beschrieben wurde und eine differenzierte prognostische und prädiktive Einschätzung ermöglicht. Die Integration molekularer Marker in die überarbeitete FIGO Klassifikation von 2023 sowie die ESGO/ESTRO/ESP Risikostratifikation von 2025 erlaubt individualisierte Therapieentscheidungen. Neue prädiktive Biomarker eröffnen zudem vielversprechende Perspektiven für zielgerichtete Behandlungsansätze. Dieser Beitrag bietet einen praxisorientierten Überblick über die klinische Relevanz molekularer Marker beim EC.
Endometrial cancer (EC) is the most common gynecological malignancy in industrialized countries, with a steadily increasing incidence. The traditional binary classification into type I and II EC is now considered outdated and insufficient for accurate risk assessment. A major advancement has been the introduction of molecular classification by The Cancer Genome Atlas (TCGA) project, allowing more precise prognostic and predictive stratification. The integration of molecular markers in to the revised FIGO classification in 2023 and the ESGO/ESTRO/ESP risk stratification in 2025 facilitates personalized treatment planning. Additionally, novel predictive biomarkers offer promising opportunities for targeted therapies. This article provides a practical overview of the clinical application of molecular markers in EC.
Key words: Endometrial cancer, molecular biomarkers, FIGO classification, personalized therapy, risk stratification
Epidemiologische Entwicklung: Eine wachsende Herausforderung
Steigende Inzidenz und Mortalität
Das Endometriumkarzinom (EC) ist das häufigste gynäkologische Malignom in Industrieländern. Das lebenslange Erkrankungsrisiko beträgt etwa 3 %, das mittlere Alter bei Diagnosestellung liegt bei 61 Jahren. Während die Mortalität vieler Tumoren sinkt, steigen Inzidenz und Sterblichkeit beim EC weiter an, es hat inzwischen das Ovarialkarzinom als führende Todesursache unter den gynäkologischen Malignomen abgelöst (1).
In den letzten drei Jahrzehnten ist die EC-Inzidenz in den USA um 132 % gestiegen. Diese Entwicklung ist vor allem auf den Anstieg von Adipositas, metabolischen Erkrankungen und die demografische Alterung zurückzuführen. Die höchsten Erkrankungsraten finden sich aktuell in Nordamerika, gefolgt von Osteuropa und Zentraleuropa. Besonders besorgniserregend ist der Zuwachs bei jungen Frauen: Bei 20–29-Jährigen hat sich die Inzidenz seit 2001 um 137 %, bei 30–39-Jährigen um rund 72 % erhöht (2, 3).
Adipositas: stille Pandemie mit onkologischer Relevanz
Adipositas ist ein unabhängiger Risikofaktor für EC. Pro fünf BMI-Einheiten steigt das Erkrankungsrisiko um etwa 50 % (4). Besonders bei jungen Frauen ist die Korrelation zwischen Körpergewicht und Erkrankungsausprägung deutlich. Laut aktuellen Prognosen werden im Jahr 2050 rund 59 % der Weltbevölkerung übergewichtig oder adipös sein, mit weitreichenden Auswirkungen auch auf die EC-Epidemiologie. Besonders betrifft dies jüngere Altersgruppen, von denen ein Drittel der unter 25-Jährigen voraussichtlich von Übergewicht und Adipositas betroffen sein wird. Konsekutiv dürfte die EC-Inzidenz weiter deutlich zunehmen (5).
Molekulare Klassifikation: ein Paradigmenwechsel
Die Diagnostik und Therapie des EC befinden sich im Wandel. Fortschritte in der molekularen Tumorbiologie haben die traditionelle Risikostratifikation revolutioniert und den Weg zu personalisierten Therapien geebnet. Obwohl EC meist in frühen Stadien diagnostiziert wird – oft durch Blutungsbeschwerden – gewinnen molekulare Marker zunehmend an Bedeutung für die klinische Entscheidungsfindung.
Die klassische Zweiteilung in Typ I (östrogenabhängig, endometrioid) und Typ II (östrogenunabhängig, serös) reicht nicht mehr aus, um die biologische und prognostische Vielfalt des EC adäquat abzubilden. Einen Meilenstein setzte 2013 das TCGA-Projekt (The Cancer Genome Atlas), das durch umfassende molekulargenetische Analysen vier klar differenzierbare Subgruppen identifizierte, mit spezifischem molekularem Profil und prognostischer Aussagekraft (6).
Praxisgerechter Algorithmus zur molekularen Subtypisierung
Da umfassende Genomsequenzierungen in der klinischen Routine kaum umsetzbar sind, wurden Surrogatmarker etabliert. Ein praktikabler diagnostischer Algorithmus kombiniert:
• Gezielte Sequenzierung zur Detektion von POLE-Mutationen
• Immunhistochemie für p53 sowie die Mismatch-Repair (MMR) Proteine (MLH1, PMS2, MSH2, MSH6)
Ein Expressionsverlust bei MMR-Proteinen weist auf eine MMR-Defizienz (MMRd) hin, welche ein Surrogat für die Mikrosatelliten-Instabile-(MSI-H)-Gruppe ist. Pathologische p53-Expressionsmuster definieren die p53-abnorme Subgruppe, die weitgehend mit den «Copy-number high»-Tumoren des TCGA korreliert (2).
Diese diagnostischen Schritte ermöglichen eine robuste molekulare Einteilung im klinischen Alltag und sind eine Grundlage für differenzierte Prognose und individualisierte Therapie.
Die vier molekularen Subtypen – klinische Bedeutung
POLE-ultramutiert (POLEmut)
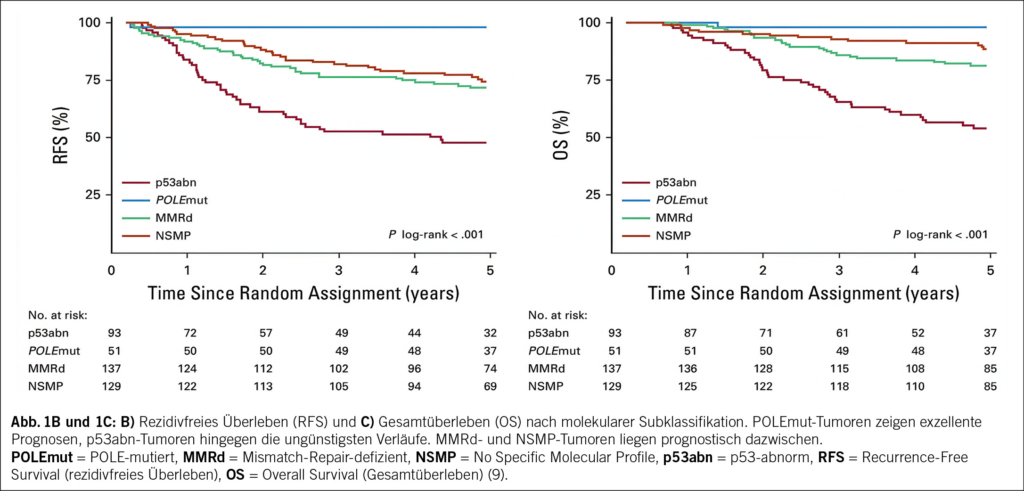
Typisch sind pathogene POLE-Mutationen mit extrem hoher Mutationslast («ultramutiert») bei meist jungen, metabolisch unauffälligen Patientinnen. Die Tumoren sind überwiegend endometrioid und zeigen selbst bei fortgeschrittenem Stadium eine exzellente Prognose mit < 1 % krankheitsspezifischer Mortalität. Eine adjuvante Therapie ist oft verzichtbar.
Häufigkeit: 5–10 %
Mismatch-Repair-Defizienz (MMRd / MSI-H)
Mismatch-Reparaturdefekte führen zu hoher Mutationslast. Ursachen sind Keimbahnmutationen (z. B. Lynch-Syndrom) oder epigenetische MLH1-Silenzierung. Die Tumoren treten in allen Altersgruppen auf. Die Prognose ist intermediär und abhängig von Zusatzfaktoren wie LVSI (Lymphovascular Space Invasion). MMRd-Tumoren sprechen gut auf Immuntherapie an.
Häufigkeit: 25–30 %
p53-abnorm (p53abn / copy-number high / serös-like)
Geprägt durch p53-Veränderungen, hohe genomische Instabilität und niedrige Mutationsraten. Diese aggressiven Tumoren (u. a. seröse und Karzinosarkome) verursachen einen Grossteil der EC-assoziierten Mortalität. Auch endometrioide Histologien können betroffen sein.
Prognose: ungünstig, hohe Rezidiv- und Metastasierungsrate
Häufigkeit: 15–20 %
NSMP (No Specific Molecular Profile)
Grösste, molekular unspezifische Gruppe. Hauptsächlich endometrioide Karzinome ohne definierende Marker. Die Prognose ist überwiegend günstig, aber stark abhängig von Grading, ER-(Estrogen Receptor) Status und LVSI. Besonders ER-negative Tumoren verhalten sich aggressiver.
Häufigkeit: 40–50 %
Ein Tumor kann aufgrund seines molekularen Profils in mehr als eine Subgruppe fallen. Diese «multiple classifiers» (ca. 4 % der EC) wurden in mehreren Studien untersucht und scheinen die Prognose der jeweils günstigeren Subgruppe zu behalten.
Prognostische Marker
Klassische Kriterien behalten ihren Stellenwert
Trotz aller Fortschritte in der molekularen Diagnostik bleiben klassische histopathologische Parameter wie Tumorstadium, Grading, histologischer Subtyp und LVSI zentrale prognostische Faktoren im Management des EC. Insbesondere das Ausmass der LVSI korreliert eng mit dem Risiko für Lymphknotenmetastasen und Fernrezidive und beeinflusst die Therapieplanung massgeblich (7).
Molekulare Marker verbessern die Risikostratifikation
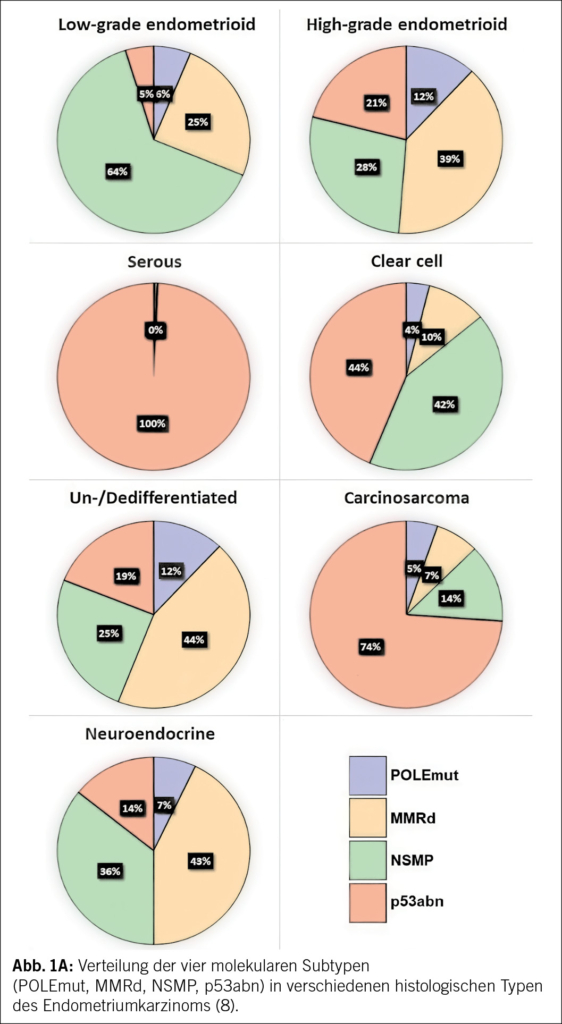
Histologische Merkmale allein reichen jedoch nicht aus, um das Rückfallrisiko verlässlich einzuschätzen. Die Integration molekularer Marker in die Risikoeinschätzung verbessert die prognostische Genauigkeit erheblich – erfordert aber ein Umdenken und eine Re-Klassifikation vieler Tumoren (Abb. 1A). Dies wurde eindrucksvoll durch die retrospektive Analyse der PORTEC-Studien belegt: Innerhalb der histologisch als «high-grade» klassifizierten endometrioiden Karzinome fand sich eine relevante Subgruppe mit POLE-Mutationen, die trotz ungünstiger Histologie eine exzellente Prognose aufwies (8). Ohne molekulare Typisierung wurden diese Patientinnen möglicherweise übertherapiert.
Solche Analysen zeigen, wie heterogen vermeintlich einheitliche Risikogruppen tatsächlich sind und dass molekulare Merkmale die klassischen Kriterien nicht nur ergänzen, sondern in vielen Fällen übertreffen (Abb. 1B und 1C) (9).
Klinische Konsequenzen: Neue Standards in der Risikoevaluierung
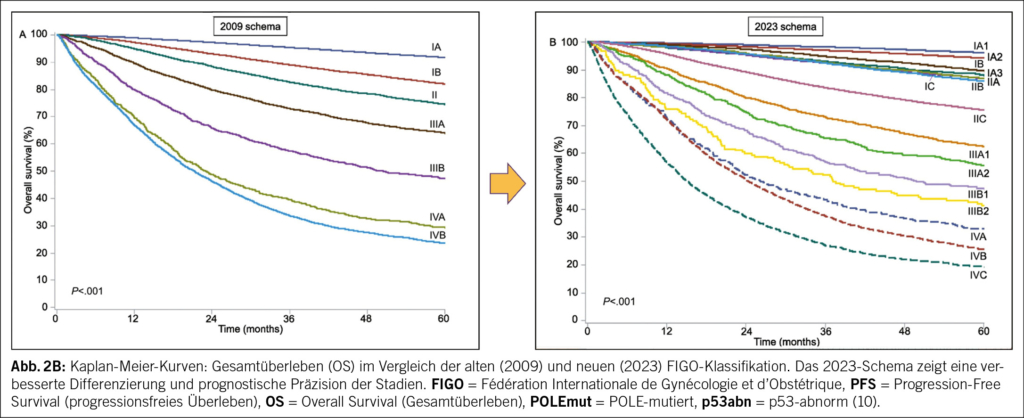
Die Kombination histopathologischer und molekularer Merkmale markiert den neuen Standard in der Prognosebeurteilung des EC. Dies spiegelt sich in der überarbeiteten FIGO-Klassifikation 2023 wider, die molekulare Marker systematisch einbezieht. In einer multizentrischen Vergleichsstudie mit der FIGO-Version von 2009 führte die molekulare Einteilung bei rund 25 % der Patientinnen zu einer Änderung des Tumorstadiums (23.7 % wurden auf-, 3.9 % abgestuft) (Abb. 2A) (10). Die neue Klassifikation erlaubt damit eine deutlich präzisere Einschätzung des Rückfallrisikos und hat direkte Konsequenzen für die Therapieplanung (Abb. 2B) (11).
Auch die aktualisierte Risikogruppen-Stratifizierung orientiert sich nun an molekularen Subtypen – mit konkreten Implikationen: von Therapie-Deeskalation bei POLEmut bis zur Eskalation bei p53abn.
Neue FIGO Klassifikation and Risikostratifikation
FIGO-Klassifikation 2023 – Integration molekularer Subtypen
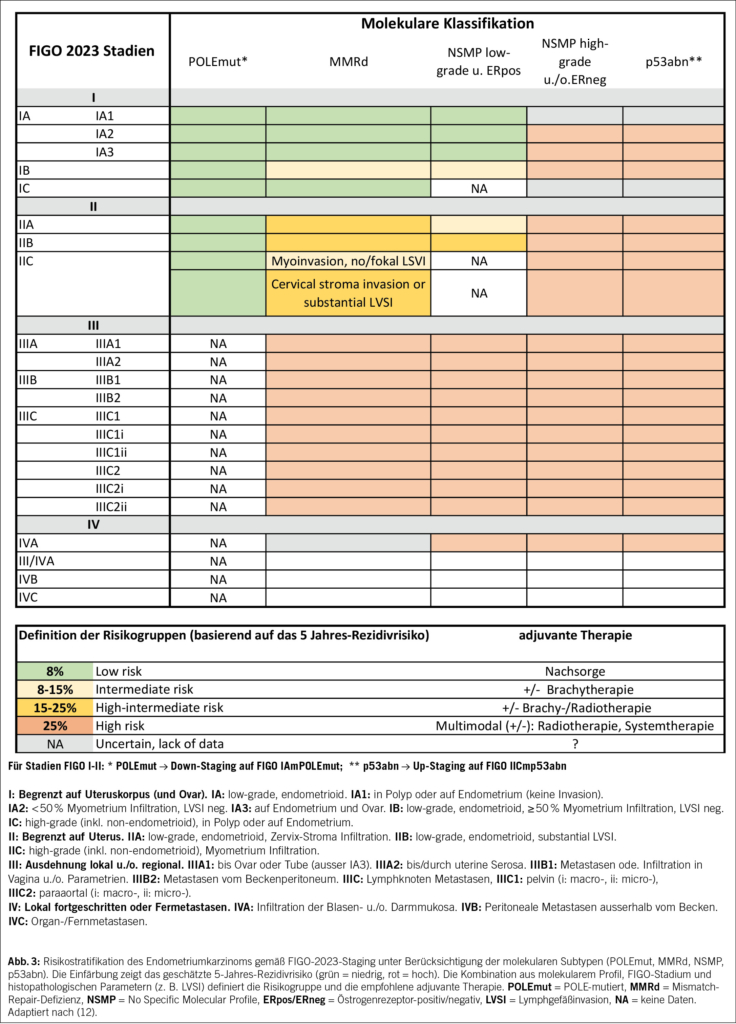
Die überarbeitete FIGO-Klassifikation 2023 berücksichtigt erstmals molekulare Subgruppen (POLEmut, MMRd, NSMP, p53abn) in der Stadieneinteilung (12). Neben dem anatomischen Tumor-ausmass fliessen nun auch biologische Merkmale und prognostisches Risiko ein (Abb. 3). Ziel ist eine präzisere, klinisch relevante Klassifikation.
Wichtige Neuerungen:
• Molekulare Marker sollten frühzeitig bestimmt werden, möglichst bereits am Kürettagematerial, sofern qualitativ verwertbar.
• Die molekulare Testung wird für alle Patientinnen empfohlen.
• Bekannte Subtypen werden durch den Zusatz «m» und eine spezifische Kennung (z. B. FIGO IAmPOLEmut) im Stadium benannt.
• Zwei Subtypen beeinflussen das Stadium unabhängig von der Tumorinfiltration in den Uterus oder in die Zervix:
– POLEmut → Down-Staging auf FIGO IAmPOLEmut
– p53abn → Up-Staging auf FIGO IICMp53abn
– Dies hat direkte therapeutische Konsequenzen – von Deeskalation bis zur Indikation für Radiochemotherapie.
NSMP – Differenzierung durch Östrogenrezeptorstatus
Die NSMP-Gruppe ist heterogen. Jedoch beeinflusst der ER die Prognose wesentlich:
• ER-negativ und/oder Grad 3: ungünstiges Verhalten, ähnlich p53-abnorm
• ER-positiv: günstigerer Verlauf, insbesondere bei high-risk NSMP
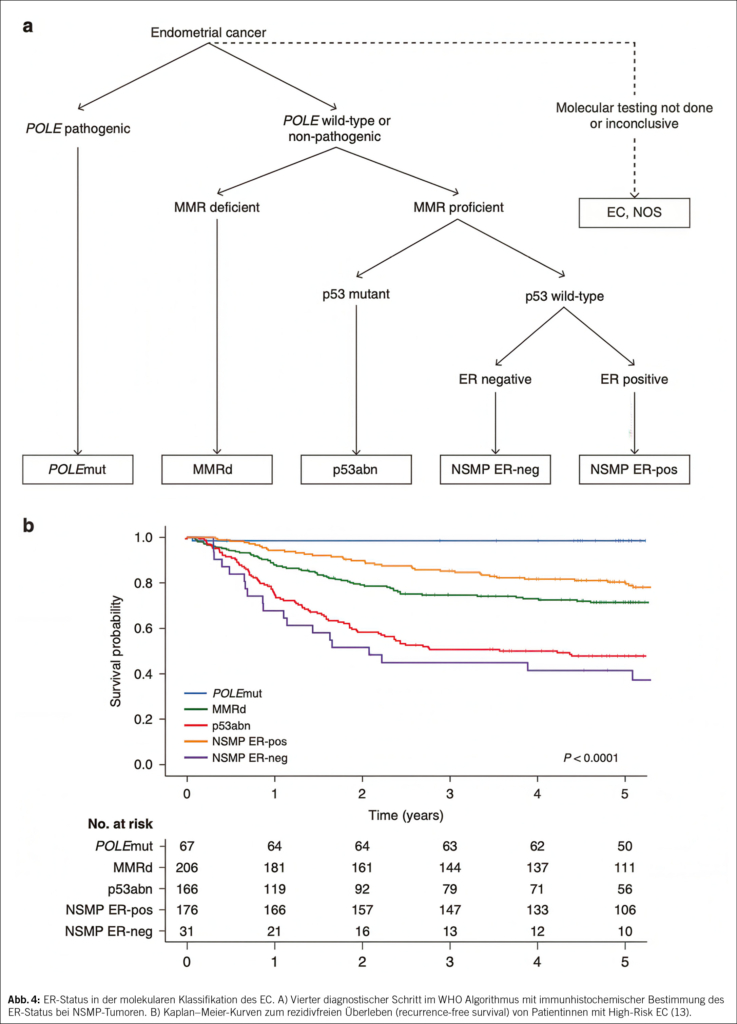
Diese Erkenntnisse wurden in die neue Risikostratifikation übernommen. Ergänzend empfiehlt die WHO einen vierten Diagnoseschritt mit immunhistochemischer Bestimmung des ER-Status bei NSMP-Tumoren (13). (Abb. 4)
ESGO/ESTRO/ESP-Risikogruppen 2025 – neuer Standard für Therapieplanung
Die ESGO/ESTRO/ESP-Leitlinie 2025 verknüpft molekulare Marker, klassische histopathologische Merkmale und den ER-Status zu einer differenzierten Risikostratifikation. Daraus ergeben sich klar definierte Empfehlungen für die adjuvante Therapie, individuell abgestimmt auf das Rückfallrisiko.
Die überarbeitete Guideline wurde erstmals im Februar 2025 beim ESGO-Kongress in Rom präsentiert und im Juli 2025 veröffentlicht (18) (Abb. 3).
Molekulare Biomarker als therapeutisches Target
Die Kombination aus Carboplatin und Paclitaxel bleibt Standard in der Erstlinie (ORR ca. 50 %), verliert aber in der Zweitlinie deutlich an Wirksamkeit (< 10 %). Es besteht Bedarf an individualisierten, wirksameren Systemtherapien. Moderne Therapiekonzepte orientieren sich zunehmend an molekularen Merkmalen statt am Tumorursprung. Prädiktive Biomarker ermöglichen gezielten Einsatz spezifischer Substanzen, unabhängig vom Organbefall.
Wichtige molekulare Targets beim EC
• MMRd/MSI-H: Hohe Mutationslast und somit hohe Immuntherapie-Ansprechrate. Kombination mit Chemotherapie (z. B. RUBY, NRG-GY018) verlängert PFS (HR 0.28 resp. 0.45) und OS (HR 0.32 resp. 0.55) deutlich (14, 15).
• HER2: Besonders bei p53abn EC relevant. Trastuzumab (± Chemotherapie) sowie T-DXd zeigen hohe Wirksamkeit (z. B. DESTINY-PanTumor02: ORR 85 %) (16).
• Hormonrezeptoren (ER/PR): Grundlage für endokrine Therapie. Kombinationen mit CDK4/6-Inhibitoren + Aromatasehemmer oder Fulvestrant zeigen vielversprechende Phase-II-Daten (17).
Zukünftige Entwicklung in der Behandlung des EC
Die Zukunft der EC-Therapie liegt in der präzisen, biomarkerbasierten Patientenselektion. Ziel der Forschung ist es, molekulare Tumoreigenschaften gezielter für die Individualisierung von Therapien zu nutzen, prädiktive Marker besser einzusetzen und Behandlungsstrategien weiter zu verfeinern.
Copyright
Aerzteverlag medinfo AG
Frauenklinik, Universitätsspital Basel
Spitalstrasse 21
4031 Basel
Frauenklinik, Universitätsspital Basel
Spitalstrasse 21
4031 Basel
Die Autorenschaft hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Steigende Inzidenz: Das Endometriumkarzinom nimmt weltweit zu – besonders bei Frauen < 40 Jahren, begünstigt durch zunehmende Adipositas.
- Molekulare Subtypen: Die Einteilung in POLEmut, MMRd, NSMP und p53abn bietet eine verbesserte prognostische und therapeutische Grundlage.
- Individualisierte Risikoeinschätzung: FIGO-Klassifikation 2023 und ESGO/ESTRO/ESP Risikostratifikation 2025 integrieren molekulare Marker systematisch und beeinflussen konsekutiv die Therapieplanung.
- Therapiestratifizierung: ER-Status, HER2-Status und MMRd sind entscheidend für zielgerichtete Behandlungsstrategien.
1. Siegel RL, Kratzer TB, Giaquinto AN, Sung H, Jemal A. Cancer statistics, 2025. CA Cancer J Clin. 2025;75(1):10-45.
2. Crosbie EJ, Kitson SJ, McAlpine JN, Mukhopadhyay A, Powell ME, Singh N. Endometrial cancer. Lancet. 2022;399(10333):1412-28.
3. Francoeur AA, Liao CI, Chang J, Johnson CR, Clair K, Tewari KS, et al. Associated Trends in Obesity and Endometrioid Endometrial Cancer in the United States. Obstet Gynecol. 2025;145(3):e107-e16.
4. Onstad MA, Schmandt RE, Lu KH. Addressing the Role of Obesity in Endometrial Cancer Risk, Prevention, and Treatment. J Clin Oncol. 2016;34(35):4225-30.
5. Collaborators GBDAB. Global, regional, and national prevalence of adult overweight and obesity, 1990-2021, with forecasts to 2050: a forecasting study for the Global Burden of Disease Study 2021. Lancet. 2025;405(10481):813-38.
6. Cancer Genome Atlas Research N, Kandoth C, Schultz N, Cherniack AD, Akbani R, Liu Y, et al. Integrated genomic characterization of endometrial carcinoma. Nature. 2013;497(7447):67-73.
7. Bosse T, Peters EE, Creutzberg CL, Jurgenliemk-Schulz IM, Jobsen JJ, Mens JW, et al. Substantial lymph-vascular space invasion (LVSI) is a significant risk factor for recurrence in endometrial cancer–A pooled analysis of PORTEC 1 and 2 trials. Eur J Cancer. 2015;51(13):1742-50.
8. Santoro A, Angelico G, Travaglino A, Inzani F, Arciuolo D, Valente M, et al. New Pathological and Clinical Insights in Endometrial Cancer in View of the Updated ESGO/ESTRO/ESP Guidelines. Cancers (Basel). 2021;13(11).
9. Leon-Castillo A, de Boer SM, Powell ME, Mileshkin LR, Mackay HJ, Leary A, et al. Molecular Classification of the PORTEC-3 Trial for High-Risk Endometrial Cancer: Impact on Prognosis and Benefit From Adjuvant Therapy. J Clin Oncol. 2020;38(29):3388-97.
10. Schwameis R, Fanfani F, Ebner C, Zimmermann N, Peters I, Nero C, et al. Verification of the prognostic precision of the new 2023 FIGO staging system in endometrial cancer patients – An international pooled analysis of three ESGO accredited centres. Eur J Cancer. 2023;193:113317.
11. Matsuo K, Klar M, Song BB, Roman LD, Wright JD. Validation of the 2023 FIGO staging schema for advanced endometrial cancer. Eur J Cancer. 2023;193:113316.
12. Berek JS, Matias-Guiu X, Creutzberg C, Fotopoulou C, Gaffney D, Kehoe S, et al. FIGO staging of endometrial cancer: 2023. Int J Gynaecol Obstet. 2023;162(2):383-94.
13. Vermij L, Jobsen JJ, Leon-Castillo A, Brinkhuis M, Roothaan S, Powell ME, et al. Prognostic refinement of NSMP high-risk endometrial cancers using oestrogen receptor immunohistochemistry. Br J Cancer. 2023;128(7):1360-8.
14. Powell MA, Bjorge L, Willmott L, Novak Z, Black D, Gilbert L, et al. Overall survival in patients with endometrial cancer treated with dostarlimab plus carboplatin-paclitaxel in the randomized ENGOT-EN6/GOG-3031/RUBY trial. Ann Oncol. 2024;35(8):728-38.
15. Eskander RN, Sill MW, Beffa L, Moore RG, Hope JM, Musa FB, et al. Pembrolizumab plus chemotherapy in advanced or recurrent endometrial cancer: overall survival and exploratory analyses of the NRG GY018 phase 3 randomized trial. Nat Med. 2025;31(5):1539-46.
16. Fader AN, Roque DM, Siegel E, Buza N, Hui P, Abdelghany O, et al. Randomized Phase II Trial of Carboplatin-Paclitaxel Compared with Carboplatin-Paclitaxel-Trastuzumab in Advanced (Stage III-IV) or Recurrent Uterine Serous Carcinomas that Overexpress Her2/Neu (NCT01367002): Updated Overall Survival Analysis. Clin Cancer Res. 2020;26(15):3928-35.
17. Green AK, Zhou Q, Iasonos A, Zammarrelli WA, 3rd, Weigelt B, Ellenson LH, et al. A Phase II Study of Fulvestrant plus Abemaciclib in Hormone Receptor-Positive Advanced or Recurrent Endometrial Cancer. Clin Cancer Res. 2025;31(11):2088-96.
18. ESGO–ESTRO–ESP guidelines for the management of patients with endometrial carcinoma: update 2025. Concin, Nicole et al. The Lancet Oncology, Volume 26, Issue 8, e423 – e435
info@gynäkologie
- Vol. 15
- Ausgabe 6
- Dezember 2025