- Suche nach Fernmetastasen beim neudiagnostizierten Mammakarzinom
Jahrzehntelang waren bei der Diagnose eines Mammakarzinoms Stagingabklärungen zur Suche nach Fernmetastasen etabliert, üblicherweise wurde hierfür neben einem Röntgen des Thorax eine Oberbauchsonographie und eine Skelettszintigraphie durchgeführt. Dies mit der Intention, bei metastasierten Patientinnen, welche keine Chance auf Heilung haben, eine Übertherapie zu vermeiden. Im Weiteren sollen die aktuelle Studienlage und die Empfehlungen der internationalen Guidelines (1-3) zur Frage, welche Patientin welche Abklärungen zum Staging erhalten sollte, diskutiert werden.
Pendant des décennies, lors d’un diagnostic de cancer du sein, un bilan d’ extension était effectué avec radiographie des poumons, échographie de l’abdomen supérieur et scintigraphie osseuse. L’objectif était d’exclure un état métastatique déjà présent, sans chance de guérison, afin d’éviter un sur-traitement. L’article examinera l’état actuel des recherches et recommandations dans les guide-lines internationaux (1-3) pour le bilan d’extension (« staging ») en termes de pertinence et contenu (quels examens pour quelle patiente ?).
Wie häufig werden Fernmetastasen bei der Erstdiagnose entdeckt?
Nicht überraschend ist die Tatsache, dass die Detektionsraten von Fernmetastasen mit dem Tumorstadium bei der Primärdiagnose korrelieren. In Frühstadien ist die Detektionsrate sehr gering, sie beträgt beispielsweise in einer aktuellen Metaanalyse beim konventionellen Routine-Staging bei Patientinnen im Tumor-Stadium I lediglich ca. 1,0% und im Stadium II 1,9% (4). Bei höheren Tumorstadien ist die Rate nachweisbarer Fernmetastasen wesentlich höher, in der erwähnten Metaanalyse fand sich bei asymptomatischen Patientinnen mit einer Erkrankung im Stadium III eine mediane Prävalenz von 21%.
Falsch positive Raten (FPR)
Die Rate von falsch positiven Befunden bei Staging-Untersuchungen ist hoch. Aus älteren Studien wissen wir, dass diese je nach Untersuchungsmethode variieren von FPR bei der Sklettszintigraphie von 10-22%, bei der Oberbauchsonographie von 33-66% und beim Thorax Röntgen von 0-23% (5). Auch das Staging mittels CT bringt keine Verbesserung mit ebenfalls hohen FPR bis zu 26% (6).
Im Rahmen eines Routine-Stagings muss aufgrund der hohen Rate falsch positiver Befunde damit gerechnet werden, dass ungefähr jede zehnte Frau weitere teils invasive Abklärungen benötigt und unnötige belastende Zeit mit Angst vor einer potentiellen metastasierten Erkrankung erfahren muss ohne dass sich die Verdachtsdiagnose bestätigen lässt (7).
Welchen Einfluss hat die Tumorbiologie auf die Detektionsrate?
Einige Studien geben Hinweise, dass eine ungünstige Tumorbiologie (triple-negativ und Her2-positiv) ein unabhängiger Risikofaktor für das Vorliegen für Fernmetastasen zum Zeitpunkt der Erstdiagnose ist (8, 9). Andere Studien konnten diesen Zusammenhang nicht nachweisen (10, 11).
Relevant kann dies v.a. im Stadium II sein, welches nur aufgrund des klinischen Tumorstadiums keinem Staging zugeführt würde und so bei ungünstiger Tumorbiologie evtl. metastasierte Patientinnen verpasst würden.
18FDG-PET-CT versus konventionelles Staging
Die Bildgebung mit 18FDG-PET-CT zeigt besonders bei Patientinnen im klinischen Stadium III häufiger Fernmetastasen und periklavikuläre Lymphknotenmetastasen als das konventionelle Staging (12, 13). Im Vergleich zum konventionellen Staging zeigt sich nicht nur eine bessere Sensitivität (97% PET versus 85% konventionellen Staging) sondern auch in der Spezifität (91% PET versus 67% konventionellen Staging) (14).
Der Therapieplan ändert sich durch ein PET-CT bei etwa 15-30% der Patientinnen im Sinne einer veränderten adjuvanten Radiotherapie oder eines Wechsels von einem adjuvanten zu einem palliativen Therapiekonzept (15). Ob sich die Behandlung der Patienten dadurch verbessert ist unklar, prospektive Daten dazu sind nicht vorhanden. Diskutiert wird hier auch die Gefahr einer allfälligen Untertherapie. Da aktuell unklar ist ab wann Mammakarzinomerkrankungen nicht mehr kurativ behandelbar sind (Vorhandensein von Tumorzellen, Mikrometastasen, Oligometastasen) bekommt auch die Definition von cM0 eine neue Bedeutung.
Im Kontext der aktuellen immer wirksameren adjuvanten Therapien ist es vorstellbar, dass eine Überdiagnose von Fernmetastasen durch ein sensitiveres Staging (inkl. PET-CT) nicht vor Übertherapie bei unheilbarer Krankheit schützt, sondern zu Untertherapie bei potentiell heilbaren Patienten führt (16). Diese Erkenntnisse werden durch die aktuellen Guidelines Staging beim Lokalrezidiv.
Etwa ein Drittel der Patienten mit einem Lokalrezidiv haben zum Zeitpunkt ihres lokoregionären Ereignisses eine synchrone Fernmetastasierung und dies ist bereits in Frühstadien der Fall (in 23% bei T1 N0, in kürzlich publizerten Basler Daten (17)).
Aus diesem Grund ist die routinemässige Umgebungsabklärung eine wichtige Voraussetzung für die Planung einer weiteren Therapie.
Kosten des Stagings
Die modernen Abklärungsmethoden (CT, PET) sind in den letzten Jahren günstiger und besser verfügbar geworden und haben sich dem Preisniveau dem konventionellen Staging angenähert. Momentan sind die ungefähren Kosten für das konventionelle Staging-Paket (Rx, US, Szinti) mit ca. CHF 670 im ähnlichen Bereich wie ein CT Thorax/Oberbauch 630 CHF. Ein PET-CT hat weiterhin höhere Kosten im Bereich von ca. CHF 2500.
Was sagen die Guidelines?
Alle Richtlinien empfehlen Anamnese und klinische Untersuchung als Basis und bei Symptomen weitere Abklärungen zu indizieren. Die vielerorts noch immer angewandte Praxis, bei allen Patientinnen präoperativ ein «laborchemisches Screening» mit dem Tumormarker CA 15-3 durchzuführen, sollte wegen erwiesener Ineffizienz (18) verlassen werden und wird in keiner Guideline empfohlen. Alle Guidelines empfehlen im Stadium I keine bildgebende Metastasensuche, ausser beim klinischen Verdacht. In den NCCN (1) wird erst ein Staging ab Stadium III, in den S3 Leitlinie (2) und ESMO (3) wird ab Stadium II ein Staging empfohlen falls Risikofaktoren vorliegen (d.h. ungünstige Tumorbiologie). Gemäss der S3 Leitlinie soll das Ganzkörperstaging generell mittels CT Thorax/Abdomen und Skelettszintigraphie erfolgen. Das PET CT wird in den NCCN Guidelines nur bei spezieller Fragestellung bezüglich dem Lymphknotenstatus und gemäss ESMO als alternative Bildgebung in fortgeschrittenen Stadien oder vor neoadjuvanter Therapie erwähnt (Tab. 1).
Wie werden Staging Untersuchungen in der Schweiz angewendet?
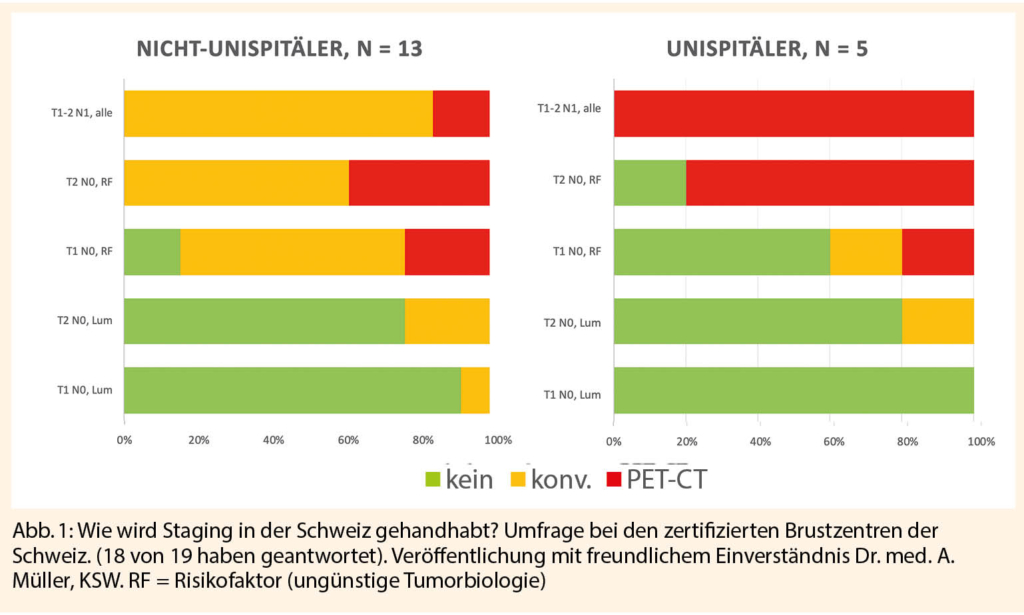
Die teils erheblich unterschiedlichen Guidelines widerspiegeln sich auch in der Tatsache, dass diese sehr unterschiedlich angewendet werden. Eine Umfrage von Dr. Andreas Müller (Onkologie KSW) von 2017 zeigte, dass die tägliche Routine in den Schweizer Brustzentren unterschiedlich aussieht und sich deutlich unterscheidet von den universitären- zu den nichtuniversitären Zentren, welche zwar in Frühstadien konsequenter gänzlich auf Staging verzichten, jedoch bei höheren Tumorstadien das PET-CT deutlich häufiger einsetzen (Abb. 1).
Bei diesem Artikel handelt es sich um einen Zweitabdruck des in «info@onkologie» 07-2020 erschienen Originalartikels.
Copyright bei Aerzteverlag medinfo AG
Stv. Leiterin Brustchirurgie
FMH Gynäkologie und Gebursthilfe
Brustzentrum Ostschweiz
Schuppisstrasse 10
9016 St. Gallen
Die Autorin hat im Zusammenhang mit diesem Artikel keine Interessenkonflikte bekundet.
◆ Obwohl geeignete Staging-Untersuchungen bei Patienten mit neu diagnostiziertem Mammakarzinom bei der Planung einer angepassten Behandlung helfen können, kann eine übermässige Verwendung zu unnötigen invasiven Biopsien, unnötiger Exposition gegenüber potenziell schädlicher Strahlung durch die Bildgebung, psychischer Not, erhöhter Angst und möglichen Verzögerungen bei der Behandlung führen.
◆ Staginguntersuchungen sollen deswegen bei asymptomatischen Patientinnen im Stadium I auch bei ungünstiger Tumorbiologie aufgrund der geringen Inzidenz von Fernmetastasen nicht durchgeführt werden.
◆ Ab Stadium II können Risikofaktoren (Tumorbiologie) mitberücksichtigt werden.
◆ Ab Stadium III ist ein generelles Staging empfohlen, ein PET CT kann bei lokal fortgeschrittenem oder inflammatorischem Mammakarzinom oder vor neoadjuvanter Chemotherapie alternativ eingesetzt werden.
◆ Generell gibt es keine Daten mit der Fragestellung ob sich durch Stagingabklärungen die Behandlung von Brustkrebspatientinnen verbessern lässt oder ein positiver Effekt auf das Overall-Survival erzielt werden kann.
Messages à retenir
◆ D’une part, un staging de départ adéquat chez une patiente avec un diagnostic de cancer du sein peut contribuer à planifier un traitement adapté. Mais d’autre part, un staging surdimensionné peut aboutir à des prélèvements invasifs non-nécessaires, exposer inutilement la patiente à des rayons potentiellement nocifs dus à l’imagerie, générer un stress psychologique et une angoisse augmentée et éventuellement retarder le début du traitement.
◆ Par conséquent, chez les patientes avec un cancer du sein au stade I, par ailleurs asymptomatiques, un bilan d’extension ne devrait plus être effectué, même en cas de biologie tumorale défavorable (HER2-pos, triple négatif), car le risque de métastases à distance est très faible.
◆ Dès le stade II, des facteurs de risque (biologie tumorale) peuvent être pris en compte pour proposer un staging.
◆ Dès le stade III un staging traditionnel (« conventionnel » dans l’article) est en principe recommandé. En cas de cancer localement avancé ou inflammatoire ou avant une chimiothérapie néo-adjuvante, un PET-CT offre une alternative intéressante.
◆ Il n’existe pas de données examinant la question de savoir si les procédures de staging améliorent effectivement le traitement des patientes avec un cancer du sein ou obtiennent un effet positif sur la survie globale.
- National Comprehensive Cancer Network. Breast Cancer. Version 1.2018. Download am 20.11.2018: https://www.nccn.org/professionals/physician_gls/default.aspx #breast.
- Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Mammakarzinoms, Version September 2020. Download am 20.09.2020. http://www.leitlinienprogrammonkologie. de/leitlinien/mammakarzinom/.
- Cardoso, F. et al. Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann. Oncol. 30, 1194–1220 (2019).
- Arnaout, A. et al. Baseline staging imaging for distant metastasis in women with stages I, II, and III breast cancer. Curr. Oncol. Tor. Ont 27, e123–e145 (2020).
- Myers, R. E. et al. Baseline staging tests in primary breast cancer: a practice guideline. CMAJ Can. Med. Assoc. J. J. Assoc. Medicale Can. 164, 1439–1444 (2001).
- James, J. J., McMahon, M. A., Tennant, S. L. & Cornford, E. J. CT staging for breast cancer patients with poor prognostic tumours. Breast Edinb. Scotl. 21, 735–738 (2012).
- Gerber, B. et al. Perioperative screening for metastatic disease is not indicated in patients with primary breast cancer and no clinical signs of tumor spread. Breast Cancer Res. Treat. 82, 29–37 (2003).
- Chen, X. et al. Baseline staging tests based on molecular subtype is necessary for newly diagnosed breast cancer. J. Exp. Clin. Cancer Res. CR 33, 28 (2014).
- Güth, U., Vetter, M., Huang, D. J. & Heinzelmann-Schwarz, V. Staging for distant metastases in operable breast cancer: a suggested expansion of the ESMO guideline recommendation for staging imaging of node-negative, hormonal receptor-negative disease. Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 24, 555–557 (2013).
- Groheux, D. et al. Prognostic impact of (18)FDG-PET-CT findings in clinical stage III and IIB breast cancer. J. Natl. Cancer Inst. 104, 1879–1887 (2012).
- McCartan, D. P. et al. Role of bone scan in addition to CT in patients with breast cancer selected for systemic staging. Br. J. Surg. 103, 839–844 (2016).
- Garg, P. K. et al. Staging PET-CT Scanning Provides Superior Detection of Lymph Nodes and Distant Metastases than Traditional Imaging in Locally Advanced Breast Cancer. World J. Surg. 40, 2036–2042 (2016).
- Groheux, D. et al. The yield of 18F-FDG PET/CT in patients with clinical stage IIA, IIB, or IIIA breast cancer: a prospective study. J. Nucl. Med. Off. Publ. Soc. Nucl. Med. 52, 1526–1534 (2011).
- Niikura, N. et al. FDG-PET/CT compared with conventional imaging in the detection of distant metastases of primary breast cancer. The Oncologist 16, 1111–1119 (2011).
- Klaeser, B. et al. Therapeutic impact of 2-[fluorine-18]fluoro-2-deoxy-D-glucose positron emission tomography in the pre- and postoperative staging of patients with clinically intermediate or high-risk breast cancer. Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 18, 1329–1334 (2007).
- Aebi, S., Davidson, T., Gruber, G. & Cardoso, F. Reply to ‘Staging for distant metastases in operable breast cancer: a suggested expansion of the ESMO guideline recommendation for staging imaging of node-negative, hormonal receptor-negative disease’ by U. Gueth et al. Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 24, 557 (2013).
- Elfgen, C., Schmid, S. M., Tausch, C. J., Montagna, G. & Güth, U. Radiological Staging for Distant Metastases in Breast Cancer Patients with Confirmed Local and/or Locoregional Recurrence: How Useful are Current Guideline Recommendations? Ann. Surg. Oncol. 26, 3455–3461 (2019).
- Harris, L. et al. American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 25, 5287–5312 (2007).
info@gynäkologie
- Vol. 11
- Ausgabe 2
- April 2021