- Steroidale und nicht-steroidale Mineralokortikoidrezeptor-Antagonisten in der Herz- und Gefässmedizin
Steroidale Mineralokortikoidrezeptor-Antagonisten verbessern bei Patienten mit Herzinsuffizienz mit reduzierter Pumpfunktion die Prognose und werden deshalb von den Herzinsuffizienz-Leitlinien empfohlen. Zusätzlich begünstigen sie den Verlauf einer chronischen Nierenerkrankung und können eine Proteinurie reduzieren. Da steroidale Mineralokortikoidrezeptor-Antagonisten nicht selektiv an den Mineralokortikoidrezeptoren, sondern auch an Androgen- und Progesteronrezeptoren binden, können sie zu unerwünschten Wirkungen wie Gynäkomastie oder Amenorrhoe führen. Ferner verteilen sich steroidale Mineralokortikoidrezeptor-Antagonisten nicht nur im Herzen und den Gefässen, sondern auch zu hohen Teilen in den Nieren, was über eine Steigerung der Hyperfiltration zum Abfall der Filtrationsrate der Nieren führen kann. Aus diesen Gründen ist der Einsatz von steroidalen Mineralokortikoidrezeptor-Antagonisten häufig limitiert. Um diese Probleme zu lösen, wurden neue selektive, nicht-steroidale Mineralokortikoidrezeptor-Antagonisten entwickelt, wie zum Beispiel Finerenon. Finerenon konnte bisher in Outcome-Studien bei Patienten mit chronischer Nierenerkrankung und Typ-2-Diabetes mellitus im Vergleich zu Placebo zu einer Reduktion von renalen Endpunkten wie dem Auftreten von Nierenversagen und einem Nierenfunktionsverlust beitragen. Zusätzlich senkt Finerenon bei Patienten mit Typ-2-Diabetes mellitus und einer chronischen Nierenerkrankung die Häufigkeit von Hospitalisierungen infolge einer Herzinsuffizienz im Vergleich zu Placebo. Kürzlich wurde zudem gezeigt, dass Finerenon bei Patienten mit einer linksventrikulären Pumpfunktion ≥40 % die Hospitalisierungsrate infolge einer Herzinsuffizienz sowie weitere Herzinsuffizienzevents reduzieren und die Lebensqualität verbessern kann.
Steroidal minearalocorticoid receptor antagonists improve the prognosis of patients with heart failure with reduced ejection fraction and are therefore recommended by the heart failure guidelines. In addition, they favor the course of chronic kidney disease and can reduce proteinuria. As steroidal mineralocorticoid receptor antagonists do not bind selectively to the mineralocorticoid receptors but also to androgen and progesterone receptors, they can lead to undesirable effects such as gynecomastia or amenorrhea. Furthermore, steroidal mineralocorticoid receptor antagonists are not only distributed in the heart and blood vessels, but also to a large extent in the kidneys, which can lead to a decrease in the filtration rate of the kidneys by increasing hyperfiltration. For these reasons, the use of steroidal mineralocorticoid receptor antagonists is often limited. To solve these problems, new selective, non-steroidal mineralocorticoid receptor antagonists have been developed, such as finerenone. Finerenone has been shown in outcome studies in patients with chronic kidney disease and type 2 diabetes mellitus to reduce renal endpoints such as renal failure and renal function loss compared to placebo. In addition, finerenone reduces the incidence of hospitalization for heart failure in patients with type 2 diabetes mellitus and chronic kidney disease compared to placebo. It has also recently been shown that finerenone can reduce the rate of hospitalization for heart failure and other heart failure events and improve quality of life in patients with left ventricular ejection fraction ≥40 %.
Keywords: Mineralokortikoidrezeptor-Antagonisten, Herzinsuffizienz, Chronische Nierenerkrankung, Hyperkaliämie
Einleitung
Herzinsuffizienz
Herzinsuffizienz ist ein klinisches Syndrom und die häufigste Ursache für Krankenhauseinweisungen in Europa. Neurohumorale Aktivierung und gesteigerte Sympathikusaktivität spielen eine zentrale Rolle in der Entstehung und Progression einer Herzinsuffizienz (1). Die nachteiligen Konsequenzen dieser neurohumoralen Aktivierung sind zu einem Teil den profibrotischen und vaskulären Effekten erhöhter Aldosteronspiegel und der konsekutiven Aktivierung von Mineralokortikoidrezeptoren (MR) geschuldet (2). Das reduzierte kardiale Auswurfvolumen führt über eine Stimulation von Barorezeptoren in den juxtaglomerulären Zellen der Nieren zu einer Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS). Am Ende des RAAS steht die Bildung von Aldosteron, das über MR-Aktivierung zu Natrium- und Volumenretention führt und dadurch das Fortschreiten der Herzinsuffizienz begünstigt. Als Steroidhormon wirkt Aldosteron vornehmlich über den intranukleären MR mit nachfolgenden translationalen Effekten (3), jedoch sind auch nicht-genomische Mechanismen der Hormonwirkung bekannt (3). Der MR kommt darüber hinaus in vielen anderen Geweben vor, so auch in den Nieren, und seine Überstimulation trägt nachgewiesenermassen zur Entstehung und Progression einer Herz- und Nierenerkrankung bei (4–6). Die MR-Aktivierung in den Nieren kann zur Glomerulosklerose, einem Abfall der geschätzten glomeruläre Filtrationsrate (eGFR) und zur Entstehung einer Proteinurie führen (6–8). Mineralokortikoidrezeptor-Antagonisten (MRA) wie Spironolacton und Eplerenon können durch einen kompetitiven Antagonismus am MR die schädlichen Folgen der Aldosteronüberaktivität verringern (9) und sind Erstlinien-Medikamente zur Behandlung der Herzinsuffizienz mit reduzierter Pumpfunktion (HFrEF, linksventrikuläre Ejektionsfraktion (EF) ≤ 40 %). Die Randomized Aldactone Evaluation Study (RALES) konnte 1999 zeigen, dass Spironolacton im Vergleich zu Placebo die kardiovaskuläre Sterblichkeit bei Patienten mit HFrEF, die bereits mit einem Angiotensin-Converting-Enzym (ACE)-Hemmer und einem Beta-Blocker behandelt wurden, senkt (10) (Hazard Ratio (HR) für kardiovaskulären Tod 0.70; 95 % Konfidenzintervall (KI): 0.60–0.82; p < 0.001). Wenig später zeigte sich in einer Placebo-kontrollierten Studie auch für Eplerenon 25 mg pro Tag (auftitriert auf 50 mg), dass es zu einer Reduktion der Gesamtsterblichkeit (HR 0.85; 95 % KI: 0.75–0.96; p = 0.008) und des kardiovaskulären Todes (HR 0.87; 95 % KI: 0.79–0.95; p = 0.002) bei Patienten mit HFrEF führt (11).
Chronische Nierenerkrankung
Neben der Reduktion von Hospitalisierungsraten und der Verbesserung des Gesamtüberlebens bei Patienten mit HFrEF wurde nachgewiesen, dass MRA zu einer Reduktion der Albuminurie bei Patienten mit chronischer Nierenerkrankung (CKD) beitragen (12). Die Albuminurie gilt bei Patienten mit HFrEF als ein Risikoindikator für kardiale Dekompensationen (13) und für kardiovaskuläre Ereignisse, unabhängig vom Vorliegen eines Diabetes mellitus (14). Des Weiteren ist eine zunehmende Albuminurie ein Indikator für einen beschleunigten Progress der CKD (14, 15). Es wurde gezeigt, dass bei Patienten mit diabetischer Nephropathie, die bereits mit dem ACE-Hemmer Lisinopril in maximal tolerierter Dosis behandelt wurden, eine vorbestehende Proteinurie durch die Einnahme von Spironolacton reduziert werden kann (16). Die Therapie mit 25 mg Spironolacton täglich führte im Vergleich zu Placebo zu einer relativen Reduktion der Albumin-Kreatinin-Ratio im Urin (UACR) von 34.0 % (95 % KI: 11.2–51.0 %; p = 0.007) (16). Eine Hinzunahme von Losartan, einem Angiotensin-Rezeptor-Blocker (AT1-Blocker), zur vorbestehenden ACE-Hemmer-Therapie führte zu keiner signifikanten Reduktion der UACR (Reduktion um 16.8 %; 95 % KI: 10.5–37.3 %; p = 0.20) (16).
Akutes Koronarsyndrom
Präklinische Studien konnten zeigen, dass eine erhöhte MR-Aktivität nach einem Myokardinfarkt mit schlechten Outcomes assoziiert ist, unabhängig davon, ob eine Herzinsuffizienz besteht oder nicht (17). Aus diesem Grund wurden klinische Studien durchgeführt, die steroidale MRA bei Patienten mit akutem Koronarsyndrom (ACS) testeten.
Die REMINDER-Studie (Early eplerenone treatment in patients with acute ST-elevation myocardial infarction without heart failure) testete Eplerenon 25–50 mg einmal täglich im Vergleich mit Placebo in 1012 Patienten mit ST-Streckenhebungsinfarkt (STEMI) ohne Hinweise auf eine Herzinsuffizienz (18). Das mediane Alter betrug 58 Jahre, 18 % der Patienten waren Frauen. Mehr als 80 % der Patienten hatten einen ACE-Hemmer und einen Betablocker zusätzlich zu einer doppelten Plättchenhemmung und einem Statin. Es konnte gezeigt werden, dass Eplerenon in diesem Patientenkollektiv den kombinierten Endpunkt aus kardiovaskulärer Sterblichkeit, Re-Hospitalisierung oder verlängerter Hospitalisierung wegen Herzinsuffizienz (oder einer ventrikulären Tachykardie, linksventrikulärer Ejektionsfraktion (LVEF) < 40 %, BNP > 200 pg/ml oder NTproBNP > 450 pg/ml) signifikant senkte. Die Reduktion des primären Endpunkts war allerdings durch eine Reduktion der natriuretischen Peptide getrieben. Die Einnahme von Eplerenon war sicher und führte nicht zu mehr Hyperkaliämien (18). Die ALBATROSS-Studie (Aldosterone Lethal effects Blocked in Acute MI Treated with or without Reperfusion to improve Outcome and Survival at Six months follow-up) war eine randomisierte, open-label Studie, die den Einsatz von Spironolacton bei Patienten mit ACS testete (19). Eingeschlossen wurden Patienten, die einen STEMI oder einen Nicht-ST-Streckenhebungsinfarkt (NSTEMI) mit hohem Risiko hatten. Patienten erhielten entweder 200 mg Kaliumcanrenoat intravenös, gefolgt von 25 mg Spironolacton für 6 Monate zusätzlich zur Standardtherapie, oder nur die Standardtherapie. Insgesamt wurden 1603 Patienten in die Intention-to-treat-Analyse eingeschlossen. Das mediane Alter war 58 Jahre, 17 % waren Frauen, die mediane LVEF lag bei 50 % und 90 % der Patienten in beiden Gruppen hatten eine vollständige Therapie aus doppelter Plättchenhemmung, Statin, ACE-Hemmer und Betablocker. Spironolacton führte nicht zu einer Reduktion des kombinierten Endpunktes aus Tod, überlebtem Herzstillstand, anhaltender ventrikulärer Tachykardie, der Implantation eines ICD (oder einer entsprechenden IA-Indikation) sowie einer neu auftretenden oder sich verschlechternden Herzinsuffizienz (HR 0.97, 95 % KI: 0.73–1.28; 95 (11.8 %) Ereignisse vs. 98 (12.2 %) Ereignisse) (19). Allerdings war die Studie unterpowert, da die beobachtete Ereignisrate mit 12.2 % in der Kontrollgruppe deutlich niedriger war als erwartet (20 % in der Kontrollgruppe) (20). Die REMINDER- und ALBATROSS-Studien zeigten, dass Patienten, die zusätzlich zu einer Revaskularisation bereits mit einer doppelten Plättchenhemmung, Statin, ACE-Hemmer sowie Betablocker nach einem ACS behandelt wurden und keine Hinweise auf eine HFrEF hatten, nicht von einem MRA profitierten. Kürzlich wurden zudem die Ergebnisse der CLEAR-Synergy-Studie veröffentlicht, in der Spironolacton bei Patienten mit ACS im Vergleich zu Placebo untersucht wurde (21). Die Studie randomisierte 7062 Patienten mit STEMI (95 %) oder NSTEMI (5 %) und zusätzlichen Risikofaktoren (LVEF ≤ 45 %; T2DM, koronare Mehrgefässerkrankung, vorheriger Myokardinfarkt, Alter > 60 Jahre) zu Placebo oder Spironolacton. Analysiert wurde ein kombinierter Endpunkt aus Herzinfarkt, Schlaganfall, neuer oder verschlechterter Herzinsuffizienz, kardiovaskulärem Tod und Gesamtsterblichkeit. Spironolacton senkte das Risiko für das Auftreten des kombinierten Endpunktes nicht (HR 0.89, 95 % KI 0.73–1.08; p = 0.23). Zusammenfassend konnte bisher nicht überzeugend gezeigt werden, dass steroidale MRA nach einem ACS bei Patienten ohne HFrEF die Morbidität und Sterblichkeit positiv beeinflussen.
Unerwünschte Wirkungen etablierter MRA
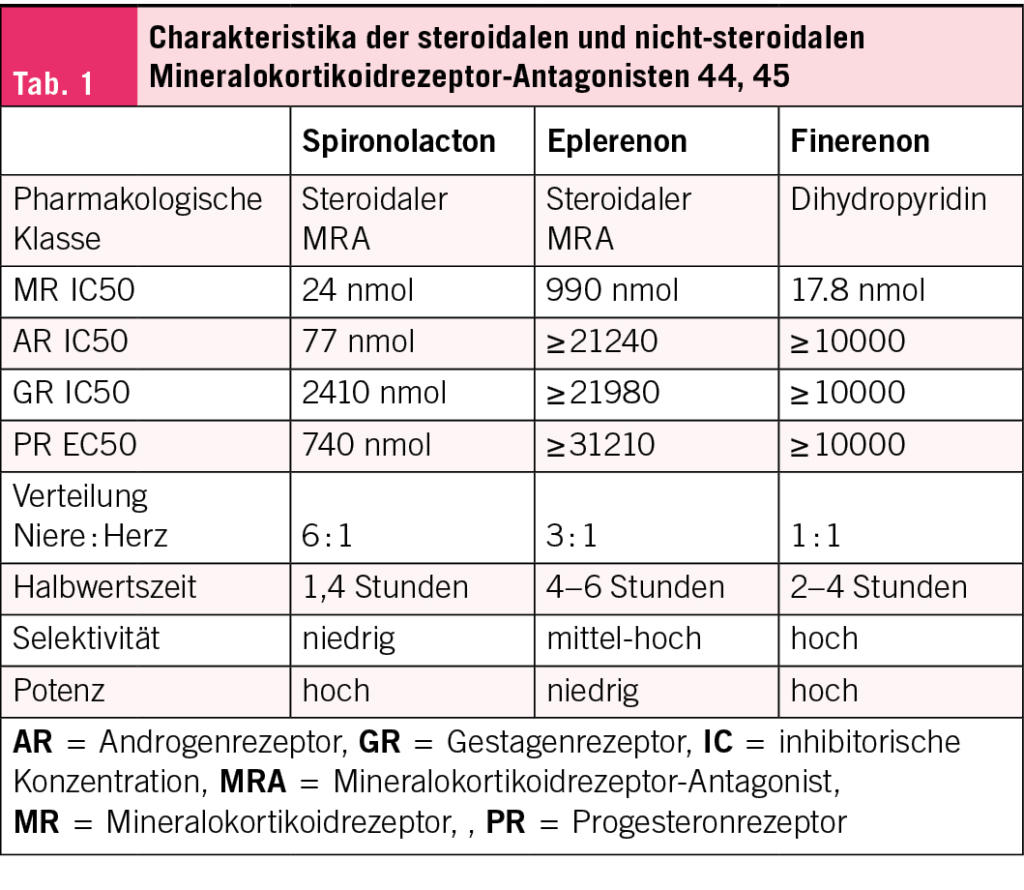
Trotz der Klasse-I-Empfehlung für Spironolacton und Eplerenon zur Behandlung der HFrEF werden MRA bei etwa zwei Drittel der Patienten nicht konsequent eingesetzt, da sie zu unerwünschten Arzneimittelwirkungen führen können (22–24). Neben den anti-androgenen Wirkungen des Spironolactons, wie Gynäkomastie, Impotenz und progesterogenen Effekten wie Amenorrhoe, können ein Abfall der eGFR und Hyperkaliämien den Einsatz limitieren. Im Fall von Spironolacton liegt dies darin begründet, dass es eine mangelnde Affinität für den MR des Herzens aufweist und etwa 10-mal stärker am MR der Niere und den Androgen- und Progesteronrezeptoren wirkt (22, 25). Eplerenon hingegen weist zwar eine höhere Spezifität für kardiale MR auf, ist jedoch insgesamt weniger potent, sodass höhere Dosierungen notwendig sind. Zusätzlich weist Eplerenon ebenso wie Spironolacton eine höhere Anreicherung in den Nieren als im Herzen auf (25) (Tab. 1).
Insbesondere die renalen Nebenwirkungen werden bei gleichzeitig bestehender CKD verstärkt (26). Die CKD ist eine der häufigsten Komorbiditäten der Herzinsuffizienz und bei etwa 50 % der Patienten mit Herzinsuffizienz zu finden (27). Damit stellt die CKD einen bedeutenden limitierenden Faktor zur Etablierung einer MRA-Therapie dar. Spironolacton sollte bei Patienten mit einer eGFR ≤ 30 ml/min/1.73 m2 oder einem Serum-Kreatinin von ≥ 1.8 mg/dl nur vorsichtig verordnet werden. Eplerenon sollte ebenfalls nur bei Patienten mit einer eGFR ≥ 30 ml/min/1.73 m2 zur Anwendung kommen und bei einer eGFR von 30–50 ml/min/1.73 m2 wird zur besonderen Vorsicht und zur Dosisreduktion geraten. Zusätzlich entsteht durch die Blockade der Aldosteron-Rezeptoren eine gesteigerte Natriurese und eine Abnahme des intravasalen Volumens, wodurch es konsekutiv zu einer vermehrten Resorption von Kalium kommt. Dies begünstigt die Entstehung von Hyperkaliämien (3, 28), so verdoppeln steroidale MRA das Risiko für die Entstehung einer Hyperkaliämie bei Patienten mit CKD (29). Daher sollten Eplerenon und Spironolacton bei einem Serum-Kalium ≥ 5.5 mmol/l dosisreduziert und bei einem Serumkalium ≥ 6.0 mmol/l pausiert werden oder mit Medikamenten zur Senkung der Kaliumkonzentration kombiniert werden (zum Beispiel Patiromer (30)).
Finerenon – ein neuer nicht-steroidaler MRA
In den letzten Jahren wurden einige selektive MRA entwickelt. Am weitesten fortgeschritten ist die Entwicklung und Untersuchung des nichtsteroidalen, spezifischen MRA Finerenon. Abgeleitet von einer Dihydropyrimidin-Struktur (gleiche Klasse wie die L-Typ Kalziumkanalblocker Nifedipin, Nimodipin und Amlodipin) weist Finerenon eine höhere Spezifität für kardiale MR auf als Spironolacton und eine höhere Potenz und Rezeptoraffinität als Eplerenon (25, 28, 31). Finerenon hat eine inhibitorische Konzentration, bei der 50 % der Rezeptor-Aktivität herabgesetzt ist (IC50), von 17.8 nMol für den MR. Diese liegt im Vergleich dazu für Spironolacton bei 24 nMol und für Eplerenon bei 990 nMol. Zusätzlich besitzt Finerenon eine besondere Selektivität mit einer mehr als 500-fach höheren Bindungsaffinität an den MR als an die Androgen-, Progesteron- und Glukokortikoid-Rezeptoren (31). Präklinische Experimente konnten zeigen, dass sich die aktiven Metabolite zu nahezu gleichen Anteilen in den Nieren und dem Herzen anreichern (32) (Tab. 1).
Finerenon bei Patienten mit diabetischer CKD
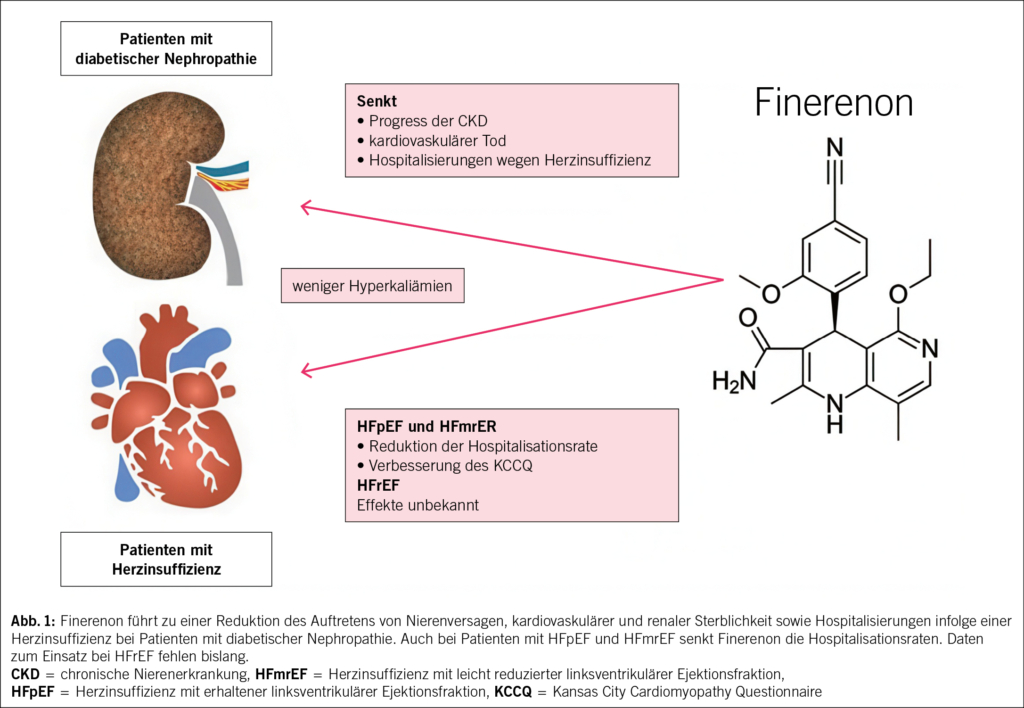
Im Jahr 2020 wurde die FIDELIO-DKD (Finerenone in Reducing Kidney Failure and Disease Progression in Diabetic Kidney Disease) Studie veröffentlicht. In diese randomisierte (1 : 1), placebokontrollierte, doppelblinde, multizentrische Studie wurden 5734 Patienten mit diabetischer Nephropathie eingeschlossen. Patienten mit einer UACR von 30–300 mg/g und einer eGFR von 25–60 ml/min/1.73 m2 mit diabetischer Retinopathie oder einer UACR von 300–5000 mg/g und einer eGFR von 25–75 ml/min/1.73 m2 konnten teilnehmen (33). Alle Patienten wurden bereits mit einem ACE-Hemmer oder AT1-Blocker in maximal tolerierter Dosis behandelt. Der zusammengesetzte primäre Endpunkt war definiert als renaler Tod, Verlust der eGFR von > 40 % (über 4 Wochen) und terminale CKD (Einleitung einer Dialyse, Nierentransplantation oder eGFR < 15 ml/min/1.73 m2). Als sekundäre Endpunkte wurden kardiovaskulärer Tod, nicht-tödlicher Herzinfarkt oder Schlaganfall, sowie Hospitalisierungen infolge einer dekompensierten Herzinsuffizienz definiert. Patienten mit einer eGFR > 60 ml/min/1.73 m2 wurden mit 20 mg/d Finerenon behandelt, Patienten mit einer eGFR < 60 ml/min/1.73 m2 mit 10 mg/d. Die 10 mg/d Dosis wurde nach 30 Tagen gesteigert, wenn das Serum-Kalium bei < 4.8 mmol/l lag. Nach einem medianen Follow-Up von 2.6 Jahren führte Finerenon zu einer signifikanten Senkung des zusammengesetzten primären (HR 0.82; 95 % KI: 0.73–0.93; p = 0.001; number needed to treat (NNT) = 29) und sekundären Endpunkts (HR 0.76; 95 % KI: 0.65–0.90; p = 0.03; NNT = 42), sowie der Einzelkomponenten des primären Endpunkts. Auch die Einzelkomponenten des sekundären Endpunkts konnten signifikant gesenkt werden mit Ausnahme von nicht-tödlichen Schlaganfällen (33). Die FIDELIO-DKD Studie zeigte somit, dass Finerenon eine effektive und sichere Reduktion von klinisch relevanten renalen Endpunkten bei Patienten mit diabetischer Nephropathie bewirken kann. Finerenon reduzierte zusätzlich auch, gemäss einer Subanalyse von FIDELIO-DKD, das Risiko für eine Erstmanifestation von Vorhofflimmern (34).
Die Finerenone in Reducing Cardiovascular Mortality and Morbidity in Diabetic Kidney Disease (FIGARO-DKD) Studie randomisierte 7437 Patienten mit T2DM und einer UACR von 30–300 mg/g sowie einer eGFR von 25–90 ml/min/1.73 m2 bzw. einer eGFR > 60 ml/min/1.73 m2 und einer UACR von 300–5000 mg/g auf eine Therapie mit Finerenon oder Placebo (35). Primärer Endpunkt war eine Kombination aus kardiovaskulärem Tod, nicht-tödlicher Herzinfarkt oder Schlaganfall, sowie Hospitalisierungen infolge einer dekompensierten Herzinsuffizienz. Der sekundäre Endpunkt war definiert als eine Zusammensetzung aus Nierenversagen und anhaltendem Verlust der eGFR > 40 % über 4 Wochen (35). Durch die Finerenon-Therapie wurde der primäre Endpunkt signifikant reduziert im Vergleich zur Placebo-Behandlung (HR 0.87; 95 % KI: 0.76–0.98; p = 0.03). Die Reduktion des primären Endpunktes wurde hauptsächlich durch eine Reduktion der Hospitalisationsraten beeinflusst (HR 0.71; 95 % KI: 0.56–0.90). Der zusammengesetzte sekundäre Endpunkt unterschied sich nicht statistisch signifikant zwischen den beiden Gruppen (HR 0.87; 95 % KI: 0.76–1.01) (35). Die Therapie mit Finerenon war sicher, lediglich Hyperkaliämien traten in der Finerenon-Gruppe häufiger auf als in der Placebo-Gruppe (10.8 % vs. 5.3 %; p < 0.0001). Finerenon führt also zu einer Reduktion des kombinierten kardiovaskulären Endpunktes, hauptsächlich bedingt durch eine Reduktion von HHF. Die kardiovaskuläre Sterblichkeit wurde nicht signifikant beeinflusst. Verglichen mit der FIDELIO-DKD-Studie, untersuchte FIGARO-DKD auch Patienten mit besserer Nierenfunktion. Hierbei ist zu beachten, dass die FIDELIO-DKD-Studie entworfen wurde, um renale Effekte der Finerenon-Therapie zu untersuchen und die FIGARO-DKD-Studie zur Evaluation kardiovaskulärer Effekte. Die FIGARO-DKD Studie zeigte, dass mit Finerenon ein neuer Therapieansatz für Patienten mit diabetischer CKD zur Senkung der kardiovaskulären Morbidität und Sterblichkeit zur Verfügung steht.
Die Patientenkollektive der FIGARO-DKD und FIDELIO-DKD Studien wurden in den FIDELITY-Analysen zusammengefasst (n = 13 026). Das Gesamtkollektiv umfasste damit Patienten in den CKD-Stadien 1–436. Die FIDELITY-Analyse zeigte, dass Finerenon über das gesamte Patientenkollektiv den zusammengesetzten kardiovaskulären Endpunkt, bestehend aus kardiovaskulärer Tod, nicht-tödlicher Schlaganfall oder Herzinfarkt sowie HHF (HR 0.86; 95 % KI: 0.78–0.95; p = 0.0018) und den zusammengesetzten renalen Endpunkt (Nierenversagen, eGFR Verlust von ≥ 57 % über 4 Wochen, Tod infolge einer CKD) signifikant senkte (HR 0.77; 95 % KI: 0.67–0.88; p = 0.0002) (36). Der kardiovaskuläre Endpunkt wurde dabei hauptsächlich durch eine Reduktion von HHF beeinflusst (HR 0.78; 95 % KI: 0.66–0.92; p = 0.003). Die Einzelkomponenten des renalen Endpunkts wurden signifikant reduziert mit Ausnahme des renalen Todes. Insgesamt 573 Fälle von Hyperkaliämien wurden in der Finerenon-Gruppe dokumentiert (vs. 249 in der Placebogruppe). Darüber hinaus wies Finerenon ein sehr gutes Verträglichkeitsprofil auf (36). Die FIDELITY-Studie unterstützte also die Ergebnisse der beiden vorangegangenen Studien und bestätigte die vorteilhaften Effekte von Finerenon auf das kardiovaskuläre und renale Outcome bei Patienten mit leichter bis schwerer diabetischer Nephropathie.
Kürzlich wurde zudem eine Subgruppenanalyse der FIDELITY-Studie hinsichtlich vorbestehender atherosklerotischer kardiovaskulärer Erkrankungen (ASCVD) durchgeführt. Insgesamt 5935 Patienten mit ASCVD wurden identifiziert, die ein erhöhtes Risiko (im Vergleich zu Patienten ohne ASCVD) für das Auftreten des zusammengesetzten kardiovaskulären Endpunktes aufwiesen (37). Finerenon senkte unabhängig von einer vorbestehenden ASCVD den zusammengesetzten primären Endpunkt. Es konnte gezeigt werden, dass Finerenon ausserdem bei Patienten mit CKD, T2DM und einer vorbestehenden ASCVD zu einer signifikanten Reduktion des Auftretens von nichttödlichen Herzinfarkten führte und die Sterblichkeit signifikant senkte.
Finerenon bei Patienten mit HFpEF
Die FINEARTS-HF (Finerenone Trial to Investigate Efficacy and Safety Superior to Placebo in Patients with Heart Failure) Studie randomisierte 6016 Patienten mit einer LVEF ≥ 40 % 1 : 1 zu Finerenon (maximale Dosis 20–40 mg) oder Placebo (38). Als Endpunkt wurde der Komposit aus Herzinsuffizienzevents (ungeplante Hospitalisierung oder ungeplante Vorstellung wegen Herzinsuffizienz) und kardiovaskulärem Tod gewählt. Etwa 85 % der Patienten wurden bereits mit einen Betablocker, etwa 80 % mit einem RAAS-Inhibitor und knapp 14 % mit einen SGLT-2 Inhibitor behandelt. Nach einer medianen Nachbeobachtung von 32 Monaten wurde eine signifikante Reduktion des zusammengesetzten Endpunktes durch Finerenon gezeigt (RR 0.84; 95 % KI 0.74–0.95; p = 0.007). Getrieben wurde diese Endpunktreduktion vor allem durch weniger Herzinsuffizienz-Ereignisse (842 vs. 1024; p = 0.006). Die kardiovaskuläre Sterblichkeit wurde nicht signifikant reduziert (242 vs. 260 Todesfälle). Ferner führte Finerenon zu einer Symptomverbesserung um 1.6 Punkte im Kansas City Cardiomyopathy Questionnaire im Vergleich zu Placebo, jedoch nicht zu einer signifikanten Verbesserung der NYHA-Klasse (38). Hinsichtlich der Sicherheit unterschied sich die Anzahl der unerwünschten Events nicht in den beiden Gruppen, unter Finerenon kam es allerdings häufiger zu einer Hyperkaliämie. Ähnlich wie die SGLT-2-Inhibitoren konnte auch Finerenon die kardiovaskuläre Sterblichkeit nicht signifikant bei Patienten mit einer LVEF ≥ 40 % senken; die FINEARTS Studie bleibt dennoch eine positive Studie, da Finerenon sicher und effektiv Herzinsuffizienzevents reduzierte. Kritisch anzumerken bleibt, dass nur etwa 14 % der Patienten in beiden Gruppen einen SGLT-2-Inhibitor einnahmen, eine Therapie, die während Durchführung der Studie zu einer Leitlinienempfehlung bei HFpEF wurde (38).
Studien, die den Einsatz von Finerenon bei Patienten mit HFrEF (LVEF < 40 %) testen sind aktuell geplant und wären wichtig, um diese Substanzklasse auch in diesem Patientenkollektiv anwenden zu können (FINALITY-HF A Study to Evaluate Finerenone on Clinical Efficacy and Safety in Patients With Heart Failure Who Are Intolerant or Not Eligible for Treatment With Steroidal Mineralocorticoid Receptor Antagonists; NCT06033950). Bislang fehlen klinische Studien, die einen direkten Vergleich von Finerenon gegen Spironolacton bzw. Eplerenon untersuchen.
MRA-Effekt über das gesamte Spektrum an linksventrikulärer Ejektionsfraktion
Zeitgleich mit der FINEARTS-HF Studie wurde eine Metaanalyse veröffentlicht, die auf individuellen Patientendaten der RALES, EMPHASIS-HF, TOPCAT-HF und FINEARTS-HF-Studie basierte (39). Die Metaanalyse zeigte, dass MRA vor allem zur Behandlung der HFrEF wirksam sind und in diesem LVEF-Phänotyp die kardiovaskuläre Sterblichkeit um 28 % (HR 0.72 95 % KI 0.63–0.82) und HHF um 40 % senkt (HR 0.60 95 % KI 0.52–0.69). Bei Patienten mit HFpEF sind die Effekte weniger ausgeprägt: Bei diesen Patienten wird die kardiovaskuläre Sterblichkeit nicht signifikant gesenkt (HR 0.92 95 % KI 0.80–1.05), jedoch die HHF Rate um 18 % (HR 0.82 95 % KI 0.74–0.90). Diese Unterschiede können auf verschiedene Arten erklärt werden. Dass nsMRA die Sterblickeit von Patienten mit HFpEF nicht senken, könnte am konkurrierenden Risiko dieser Patienten an anderen (nicht-kardiovaskulären) Erkrankungen liegen. Ferner muss beachtet werden, dass die Hintergrundtherapie der Patienten in TOPCAT-HF (insbesondere Device-Therapien) und FINEARTS-HF (14 % bereits mit SGLT-2 Inhibitoren behandelt) besser gewesen ist als beispielsweise in RALES und EMPHASIS.
Mögliche Vorteile einer Kombination aus MRA und SGLT-2 Inhibitoren
Die Annahme, dass die Kombination aus MRA und SGLT-2 Inhibitoren additive Vorteile bringen könnte, erscheint plausibel (40). Eine Meta-Analyse mit 21 947 Patienten überprüfte die Effekte einer solchen Kombination bei Patienten mit Herzinusffizienz unabhängig von der LVEF (41). Die Analyse kam zu dem Ergebnis, dass die Kombination effektiver hinsichtlich der Reduktion von kardiovaskulären Ereignissen und kardiovaskulärem Tod war, verglichen mit einer Behandlung mit nur einer der Substanzklassen. Zudem war die Hyperkaliämierate bei Patienten, die mit der Kombination behandelt wurden, niedriger als bei denen, die nur einen MRA erhielten (42). Die synergistischen Effekte einer Therapie mit MRA und SGLT-2 Inhibitoren werden prospektiv in der CONFIRMATION-HF Studie evaluiert.
Finerenon für wen?
Seit Februar 2022 hat Finerenon (Handelsname Kerendia®), eine EU-Zulassung zur Therapie von Patienten mit CKD im Stadium 3–4 mit einhergehender Proteinurie und zugrundeliegendem T2DM. In Abhängigkeit der eGFR und des Serum-Kaliumspiegels können Dosen zwischen 10–20 mg täglich verordnet werden. In der Schweiz kann Finerenon gemäss der Spezialitätenliste bei Patienten mit einem Kalium ≤ 5.0 mmol/l, einer seit ≥3 Monate bestehenden CKD (definiert als eGFR 25–59 ml/min/1.73 m2 und UACR >30 mg/g oder eGFR 25–75 ml/min/1.73 m2 und UACR >300 mg/g) und einer persistierenden UACR >300 mg/g trotz einer Behandlung mit einem RAAS-Inhibitor und SGLT-2 Inhibitor begonnen werden.
Schlussfolgerung
MRA sind effektive Substanzen zur Therapie der HFrEF und CKD mit einhergehender Proteinurie. Eine Therapie mit steroidalen MRA kann mit relevanten, insbesondere renalen aber auch extrarenalen unerwünschten Arzneimittelwirkungen einhergehen, wodurch der klinische Einsatz dieser Substanzen limitiert sein kann. Finerenon, ein neuer, selektiver nsMRA, ist mit weniger renalen und extrarenalen Nebenwirkungen assoziiert und bietet damit potenzielle Vorteile. Bei Patienten mit diabetischer Nephropathie im Stadium 1–4 senkte Finerenon das Auftreten von kardiovaskulärer und renaler Endpunkte (Abb. 1). Zusätzlich kann Finerenon bei Patienten mit Herzinsuffizienz und einer LVEF ≥ 40 % die Hospitalisierungsraten wegen Herzinsuffizienz senken. Weitere Studien, die insbesondere den Einfluss einer kombinierten Therapie aus SGLT-2 Inhibition und nsMRA testen, werden aktuell durchgeführt (43).
Dr. med. Felix Götzinger
Dr. med. Michael Kunz
Dr. med. Lucas Lauder
Prof. Dr. med. Felix Mahfoud
Universitäres Herzzentrum Basel
Universitätsspital Basel
Am Petersgraben 4, 4031 Basel
Copyright
Aerzteverlag medinfo AG
Universitäres Herzzentrum Basel
Universitätsspital Basel
Am Petersgraben 4, 4031 Basel
Universitäres Herzzentrum Basel
Universitätsspital Basel
Am Petersgraben 4, 4031 Basel
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
info@herz+gefäss
- Vol. 15
- Ausgabe 3
- Juli 2025