- Überblick Nuklearkardiologie
Die Nuklearkardiologie, die SPECT und PET einsetzt, bietet wichtige Instrumente für die Diagnose von koronarer Herzerkrankung, Amyloidose und Sarkoidose. Sie ermöglicht eine präzise Beurteilung von Myokarddurchblütungsstörungen, Myokardablagerungen und Entzündungsprozessen. Die Fortschritte in der Bildgebung und Quantifizierung bieten Internisten und Kardiologen wertvolle Erkenntnisse für die Risikostratifizierung, Therapieplanung und Überwachung komplexer kardiovaskulärer Erkrankungen.
Nuclear cardiology, utilizing SPECT and PET, provides essential tools for diagnosing coronary artery disease, amyloidosis, and sarcoidosis. It enables precise assessment of perfusion abnormalities, myocardial deposits, and inflammatory processes. Advances in imaging and quantification offer internists and cardiologists valuable insights for risk stratification, therapy planning, and monitoring in complex cardiovascular conditions.
Keywords: Nuklearkardiologie; PET Perfusion; Skelettszintigraphie; Inflammatorische Kardiomyopathie
Einführung
Die Nuklearkardiologie ist ein zentrales Feld der Herz-Kreislauf-Diagnostik und umfasst hochentwickelte Verfahren wie die Single-Photon-Emissions-Computertomographie (SPECT) und die Positronen-Emissions-Tomographie (PET). Diese ermöglichen die präzise Erkennung von Durchblutungsstörungen bei der koronaren Herzerkrankung (KHK), die nicht-invasive Diagnose der ATTR-Amyloidose und die Diagnose inflammatorischer Kardiomyopathien wie bei der kardialen Sarkoidose. Durch die Kombination funktioneller und anatomischer Informationen leisten diese Techniken einen entscheidenden Beitrag zu präziser Diagnostik, individualisierter Therapieplanung und Risikostratifizierung, was sie zu einem unverzichtbaren Bestandteil der kardiologischen Versorgung machen. Auf den folgenden Seiten finden Sie eine Übersicht über den aktuellen Stand der nuklearkardiologischen Methoden.
Koronare Herzerkrankung
Die KHK wird als pathologischer Prozess definiert, der durch die Ansammlung atherosklerotischer Plaques in den epikardialen Herzkranzarterien, unabhängig von deren obstruktivem oder nicht-obstruktivem Charakter, gekennzeichnet ist (1). Chronische Koronarsyndrome umfassen klinische Präsentationen, die durch strukturelle oder funktionelle Veränderungen der Koronararterien oder Mikrozirkulation eine Diskrepanz zwischen myokardialem Sauerstoffbedarf und Blutversorgung verursachen können. Dies führt zu ischämischen Durchblutungsstörungen, die sich typischerweise, aber nicht ausschliesslich, als Angina pectoris oder Dyspnoe äussern. Zwei etablierte Verfahren zur KHK-Diagnostik sind die Myokardsperfusion-SPECT und -PET. Beide ermöglichen die nicht-invasive Erkennung von Durchblutungsstörungen. SPECT verwendet Gamma-strahlende Radionuklide wie 99mTechnetium mit Tracern wie Sestamibi oder Tetrofosmin. PET nutzt β+-strahlende Radionuklide wie 13N-Ammoniak oder 82Rubidium, die kürzere Halbwertszeiten haben und den Einsatz von Zyklotronen oder Generatoren erfordern.
Ablauf
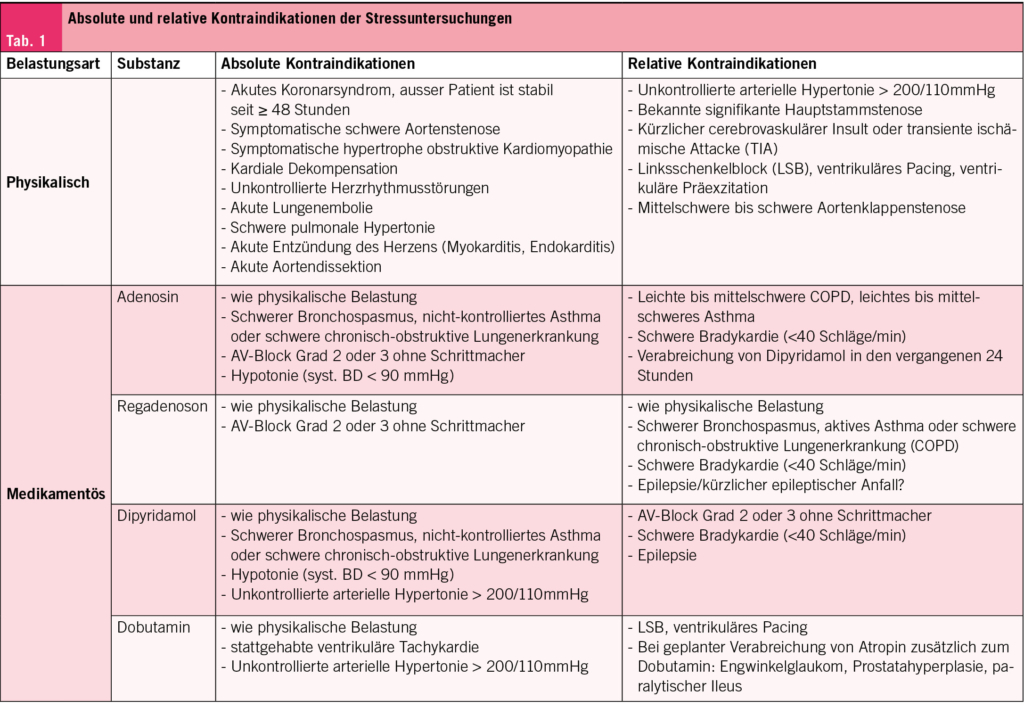
Zur Durchführung nuklearmedizinischer Myokardperfusionsuntersuchungen mittels SPECT oder PET müssen Patienten mindestens sechs Stunden nüchtern bleiben und koffeinhaltige Getränke wie Kaffee oder Tee mindestens zwölf Stunden meiden, da diese die Wirkung von Stressmitteln wie Regadenoson und Adenosin beeinträchtigen können. Myokardperfusionsuntersuchungen bestehen aus einer Ruhe- und einer Stressphase. Bei der PET-Myokardsperfusion wird die Ruheaufnahme typischerweise vor der Stressaufnahme durchgeführt, was durch die kurzen Halbwertszeiten der Radiotracer eine schnelle Testabfolge ermöglicht. Die Stressinduktion erfolgt fast ausschliesslich medikamentös, wobei die Wahl des Stressmittels von individuellen Kontraindikationen abhängt (Tab. 1). SPECT-Untersuchungen nutzen aufgrund der längeren Halbwertszeit von 99mTechnetium oft körperliche Belastung mittels Ergometrie. Hierbei ist ein Zeitabstand von mindestens zwei Stunden zwischen den Phasen erforderlich, wodurch flexible Protokolle (z. B. Ruhe-Stress, Stress-Ruhe oder «Stress-nur») möglich sind. Das «Stress-nur»-Protokoll reduziert die Untersuchungsdauer erheblich und verringert die Strahlenbelastung um über 50 % (2).
Beurteilung
Ziel der Myokardperfusionsuntersuchungen ist es, physiologische und/oder verminderte Myokardperfusion im Sinne von Ischämien oder Narben zu diagnostizieren sowie deren Schweregrad zu bewerten. Narbengewebe, das durch den Verlust funktionsfähiger Myozyten entsteht, zeigt fixierte Perfusionsdefizite in Ruhe und unter Belastung, da keine Radionuklidanreicherung mehr erfolgt. Ischämisches Myokardgewebe, das in Ruhe noch ausreichend durchblutet ist, kann unter Stress (entweder medikamentös oder durch körperliche Belastung) ein relatives Perfusionsdefizit zeigen, wenn eine hämodynamisch relevante Stenose den Blutfluss begrenzt. PET- und SPECT-Untersuchungen erlauben nicht nur eine qualitative Beurteilung der Myokardperfusion, sondern – insbesondere bei der PET – auch eine absolute Quantifizierung des myokardialen Blutflusses (in Millilitern pro Minute pro Gramm Myokard) sowohl unter Stress als auch in Ruhe. Diese erfolgt
mittels dynamischer Akquisition während der Radiotracer-Anflutungsphase und ist bei der PET inzwischen Standard, während sie bei der SPECT nur in spezialisierten Zentren verfügbar ist.
Das Verhältnis des myokardialen Blutflusses unter Belastung und in Ruhe ist die myokardiale Flussreserve (MFR), die eine zentrale diagnostische und prognostische Rolle spielt. Sie spiegelt die Funktion der epikardialen Koronararterien sowie der Mikrozirkulation wider und erlaubt eine umfassende Bewertung der koronaren Gesundheit. Patienten mit einer normalen MFR (> 2) haben eine ausgezeichnete Prognose mit einer Event-Rate von weniger als 1 % pro Jahr. Zusätzlich, dank der Blutfluss-Quantifizierung, ist PET die einzige klinisch genutzte Modalität, die eine nicht-invasive Diagnose der mikrovaskulären Dysfunktion ermöglicht. Prognostisch entscheidend ist zudem die sogenannte Ischämie-Last: Ab einer Ischämie von 10-15 % gilt das kardiovaskuläre Risiko gemäss Leitlinien als erhöht, was therapeutische Konsequenzen nach sich ziehen kann. Ein weiterer Risikomarker ist der Kalzium-Score, der mithilfe einer nicht-kontrastverstärkten Low-Dose-CT zur Attenuierungskorrektur bestimmt wird. Solche CT-Scans werden immer bei PET durchgeführt und sind auch für SPECT-Untersuchungen empfohlen. Sie ermöglichen eine zusätzliche Ermittlung des Agatston-Scores zur Beurteilung der koronaren Kalziumlast und liefern wesentliche Informationen zur Risikostratifizierung, selbst bei fehlenden flusslimitierenden Koronarstenosen.
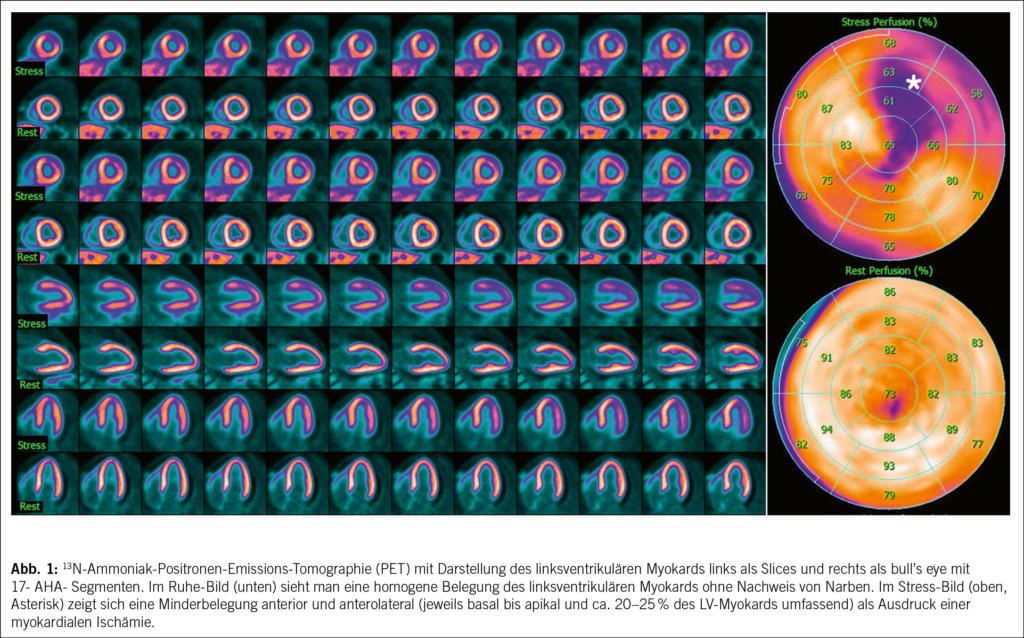
Die Wahl zwischen PET und SPECT richtet sich nach den individuellen Anforderungen der Diagnostik. PET bietet durch höhere räumliche und zeitliche Auflösung sowie die Möglichkeit der quantitativen Blutflussmessung deutliche Vorteile, insbesondere bei diffuser KHK oder mikrovaskulären Störungen. Zudem ist die Strahlenbelastung bei PET geringer (1–2 mSv) im Vergleich zur SPECT (ca. 5 mSv). Die SPECT hingegen punktet mit flexiblen Protokollen, der Möglichkeit einer physischen Belastung und modernen Kameras, die auch Patienten mit Platzangst mehr Komfort bieten. Beide Verfahren ergänzen sich in der nuklearmedizinischen Diagnostik und erlauben eine präzise Beurteilung von Ischämien und Narben sowie eine umfassende Risikobewertung. Ihre Kombination mit innovativen Technologien wie Low-Dose-CT und dynamischer Akquisition eröffnet weitere Möglichkeiten in der personalisierten Diagnostik und Therapieplanung bei Patienten mit koronarer Herzerkrankung (3) (Abb. 1).
Zukunft
Die nuklearkardiologische Bildgebung erlebt derzeit bedeutende Fortschritte, insbesondere in der Diagnostik der koronaren Herzerkrankung. Ein Meilenstein ist die Einführung des neuen PET-Radiotracers 18F-Flurpiridaz, der in zwei grossen klinischen Studien untersucht und kürzlich von der U.S. Food and Drug Administration (FDA) zugelassen wurde. Die Studienergebnisse belegen, dass 18F-Flurpiridaz eine überlegene diagnostische Genauigkeit im Vergleich zu herkömmlichen Radiotracern wie 99mTechnetium aufweist. Insbesondere bei der Detektion von koronaren Stenosen zeigt 18F-Flurpiridaz PET eine deutlich höhere Sensitivität und überlegene Bildqualität im Vergleich zur SPECT-Bildgebung. 18F-Flurpiridaz hat zudem eine längere Halbwertszeit als andere PET-Tracer, was die Verteilung und den Einsatz in mehr Instituten ermöglicht. Dank dieser Eigenschaften könnte der Tracer zukünftig auch bei Belastungstests mit physikalischer Belastung eingesetzt werden, was bisher mit anderen PET-Tracern nicht möglich war. Auch im Bereich der SPECT-Bildgebung gibt es bedeutende Fortschritte. Neue SPECT-Kameras bieten die Möglichkeit, dynamische Akquisitionen durchzuführen, was eine Quantifizierung des myokardialen Blutflusses erlaubt. Dies könnte die diagnostische Genauigkeit der SPECT in den kommenden Jahren erheblich steigern und die Rolle dieser Technologie weiter festigen.
Amyloidose
Die Amyloidose ist eine Erkrankung, bei der gestörter Proteinstoffwechsel zu Ablagerungen von Amyloidfibrillen im extrazellulären Raum führt, was die Funktion betroffener Organe beeinträchtigt. Bei kardialer Beteiligung erhöhen die Ablagerungen zwischen Myofibrillen die Myokardsteifigkeit und verursachen eine diastolische Dysfunktion. Die häufigsten Formen sind die AL-Amyloidose, verursacht durch Plasmazellmyelome, und die Transthyretin (ATTR)-Amyloidose, die durch Ablagerungen von Transthyretin entsteht, einem Protein aus der Leber. Die 99mTc-Skelettszintigraphie hat sich als nicht-invasive Methode mit hoher diagnostischer Genauigkeit zur Diagnose der ATTR-Amyloidose etabliert und kann heutzutage die invasive Endomyokardbiopsie ersetzen. Die Diagnostik erfolgt schrittweise: Bei Verdacht auf Amyloidose werden Serum-Leichtketten und Protein-Immunfixation in Serum und Urin durchgeführt. Ein positiver Befund erfordert hämatologische Abklärung. Bei negativem Ergebnis wird eine Skelettszintigraphie oder SPECT veranlasst, die eine Sensitivität von 92 % und eine Spezifität von 95 % für die ATTR-Amyloidose aufweist (4, 5).
Ablauf
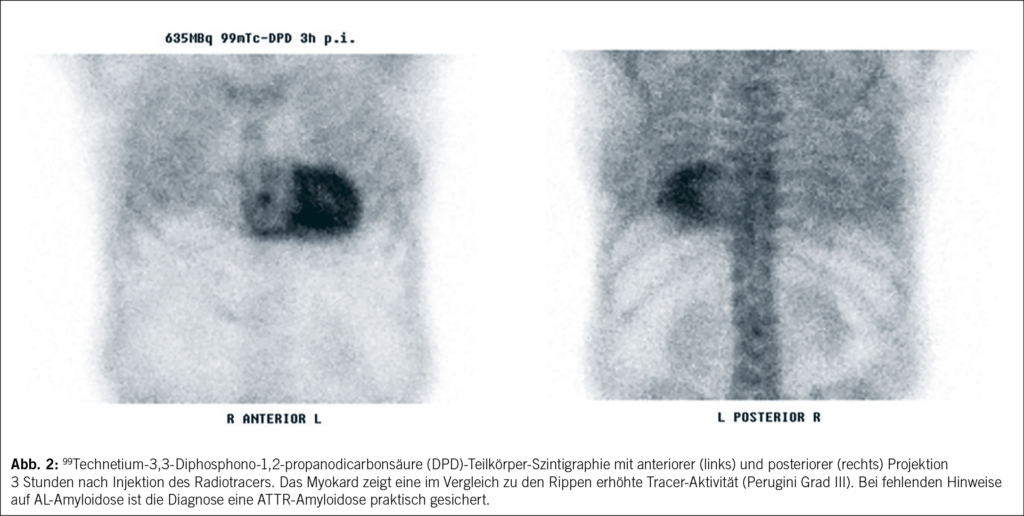
In der Skelettszintigraphie zur ATTR-Diagnostik werden knochenaffine Biphosphonate wie 3,3-Diphosphono-1,2-propanodicarbonsäure (DPD) verwendet. Diese Substanzen binden spezifisch an Amyloidfibrillen, wobei der Bindungsmechanismus nicht vollständig geklärt ist. Nach intravenöser Gabe des Radiotracers erfolgt eine Wartezeit von 3 Stunden, bevor biplanare oder Ganzkörperaufnahmen erstellt werden, um extrakardiale Ablagerungen zu detektieren.
Beurteilung
Bei Nachweis myokardialer Aktivität wird immer eine SPECT-Untersuchung zur dreidimensionalen Darstellung der Tracerverteilung ergänzt. Die semiquantitative Bewertung der Myokardaktivität erfolgt in der Regel anhand eines Gradings (Perugini-Score):
• Grad 0: keine myokardiale Aktivität
• Grad I: Myokard-Uptake < Rippen-Uptake
• Grad II: Myokard-Uptake = Rippen-Uptake
• Grad III: Myokard-Uptake > Rippen-Uptake
Bei Patienten, bei denen eine AL-Amyloidose ausgeschlossen wurde und die in der Skelettszintigraphie Grad-II- oder Grad-III-Scores aufweisen, gilt die Diagnose einer ATTR-Amyloidose als praktisch gesichert (Abb. 2).
Zukunft
Neue PET-Radiotracer wie 18F-Florbetapir, 18F-Florbetaben und 18F-Flutemetamol, ursprünglich für β-Amyloid im Gehirn entwickelt, zeigen grosses Potenzial zur kardialen Amyloidose-Diagnostik. Sie bieten durch längere Halbwertszeit und höhere räumliche Auflösung eine genauere Quantifizierung der Ablagerungen, sind jedoch noch nicht klinisch etabliert (6, 7). Ein weiterer Fortschritt ist 124I-Evuzamitid, ein unspezifisch an Amyloidfibrillen bindender Tracer, der sowohl ATTR- als auch AL-Amyloidose nachweisen kann und ebenfalls grosses Potenzial für die klinische Anwendung bietet (8).
Sarkoidose
Die Sarkoidose ist eine multisystemische entzündliche Erkrankung unbekannter Ursache, gekennzeichnet durch nicht-nekrotisierende Granulome in betroffenen Organen. Kardialer Befall wird oft bei Patienten mit extrakardialer Sarkoidose diagnostiziert, während in 20–25 % der Fälle eine isolierte kardiale Sarkoidose vorliegt (9). Häufige klinische Manifestationen sind höhergradige AV-Blockierungen, Herzinsuffizienz und ventrikuläre Arrhythmien (10). Die Diagnostik basiert auf klinischen Symptomen, histologischen Befunden und dem Ausschluss alternativer Diagnosen. Eine zentrale Rolle spielt die 18F-FDG-PET, besonders bei unklaren oder negativen MRT-Befunden, und ist laut Leitlinien als Zweitliniendiagnostik empfohlen (11).
Ablauf
Die 18F-FDG-PET unterscheidet entzündliches von normalem Myokard durch deren Stoffwechselaktivität: Normales Myokard nutzt bei kohlenhydratfreier Diät Fettsäuren, während entzündliches Gewebe Glukose bevorzugt. Eine kohlenhydratfreie Diät 24–72 Stunden vor der Untersuchung unterdrückt die FDG-Aufnahme im gesunden Myokard, wodurch pathologische FDG-Akkumulation in entzündeten Arealen sichtbar wird. Fettreiche Ernährung unterstützt diesen Effekt. Oft wird Heparin zur Fettsäurenfreisetzung zur Verstärkung der FDG-Aufnahme im entzündlichen Gewebe verabreicht. Nach intravenöser Gabe des Radiotracers 18F-FDG folgt eine 60-minütige Wartezeit, bevor die PET-Aufnahme erfolgt. Diese kann als Thorax/Abdomen- oder Ganzkörper-Scan durchgeführt werden.
Beurteilung
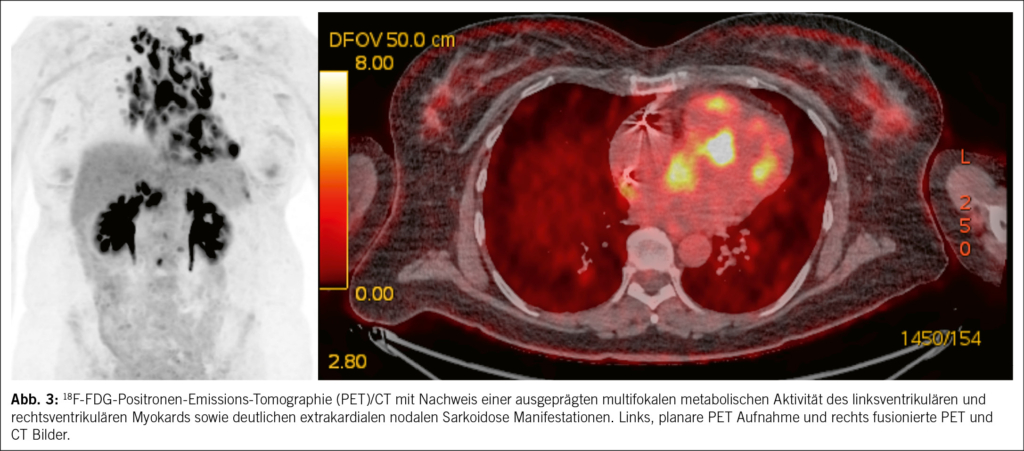
Die Interpretation kardialer Befunde erfordert eine sorgfältige Differenzierung zwischen physiologischer FDG-Aufnahme und pathologischen Entzündungsherden. Pathologische FDG-Akkumulation im Myokard zeigt typischerweise ein fleckförmiges (multifokales) Uptake-Muster, das auf aktive Entzündungen hinweist und weniger häufig ein diffuses Uptake-Muster, welches suspekt auf nicht supprimierte physiologische Glukoseaufnahme ist. Der standardisierte Uptake-Wert (SUV) hilft, die Intensität der FDG-Aufnahme zu quantifizieren und liefert Hinweise auf den Schweregrad der Entzündung. FDG-PET ist zudem nützlich für das Monitoring des Therapieansprechens und zur Planung von Follow-up-Untersuchungen, um die Krankheitsaktivität und das Risiko für Ereignisse zu bewerten. Darüber hinaus dient die 18F-FDG-PET als Basis für die Risikostratifizierung, indem sie hilft, das Ausmass der Myokardentzündung zu quantifizieren und den potenziellen Krankheitsverlauf einzuschätzen. Ein Vorteil der 18F-FDG-PET gegenüber der MRT ist die Möglichkeit, neben der myokardialen auch die extrakardiale Entzündungsaktivität zu erfassen. Extrakardiale FDG-Anreicherungen, beispielsweise in Lymphknoten oder anderen Organen, können eine gezielte Biopsie unterstützen, insbesondere, wenn histologische Nachweise erforderlich sind (Abb. 3).
Zukunft
Fibroblast activation protein Inhibitor (FAPI) ist ein Inhibitor des Proteins alpha, welches von aktiven Fibroblasten produziert wird. Die Entwicklung von FAPIs, die mit Radionukliden wie 68Ga oder 18F markiert sind, eröffnet neue Möglichkeiten für die Sarkoidose Bildgebung welche bereits in verschiedenen Zentren zu Forschungszwecken im Einsatz und dient dem Nachweis von Gewebeaktivität im Rahmen fibrotischer Prozesse, wie sie nach aktiven Entzündungsreaktionen häufig auftreten. Ein potentieller Anwendungsbereich dieses Radiotracers ist die Risikostratifizierung und Verlaufskontrolle von kardialer Sarkoidose-Patienten unter immunsuppressiver Therapie, in welchen oft noch eine chronische Fibroblastenaktivität als Hinweis auf ein Remodeling dargestellt werden kann, während mittels 18F-FDG-PET bereits keine Entzündungsaktivität mehr nachgewiesen werden kann (12, 13).
Copyright
Aerzteverlag medinfo AG
Klinik für Nuklearmedizin
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Klinik für Nuklearmedizin
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Präzise Diagnostik für die KHK: SPECT und PET bieten eine detaillierte Analyse von Durchblutungsstörungen und liefern wichtige prognostische Parameter wie die Ischämie-Last und die myokardiale Flussreserve.
◆ Nicht-invasive Amyloidose Diagnostik durch Skelettszintigraphie:
Die Skelettszintigraphie ermöglicht eine präzise Diagnostik der ATTR-Amyloidose, während neue quantitative Ansätze die diagnostische Genauigkeit weiter verbessern.
◆ Kardiale Sarkoidose Detektion: Mittels 18F-FDG, erlaubt die PET-Bildgebung die genaue Identifikation von Myokardentzündungen und extrakardialen Manifestationen, unterstützt die gezielte Biopsie-Planung und bietet wertvolle Informationen zur Therapieüberwachung.
1. Vrints C, Andreotti F, Koskinas KC, Rossello X, Adamo M, Ainslie J, et al. 2024 ESC Guidelines for the management of chronic coronary syndromes: Developed by the task force for the management of chronic coronary syndromes of the European Society of Cardiology (ESC) Endorsed by the European Association for Cardio-Thoracic Surgery (EACTS). European Heart Journal. 2024;45(36):3415-537.
2. Garefa C, Sager DF, Heiniger PS, Markendorf S, Albertini T, Jurisic S, et al. Duration of adenosine-induced myocardial hyperaemia: insights from quantitative 13N-ammonia positron emission tomography myocardial perfusion imaging. Eur Heart J Cardiovasc Imaging. 2024;25(10):1367-73.
3. Chang SM, Nabi F, Xu J, Peterson LE, Achari A, Pratt CM, Mahmarian JJ. The coronary artery calcium score and stress myocardial perfusion imaging provide independent and complementary prediction of cardiac risk. J Am Coll Cardiol. 2009;54(20):1872-82.
4. Maurer MS, Bokhari S, Damy T, Dorbala S, Drachman BM, Fontana M, et al. Expert Consensus Recommendations for the Suspicion and Diagnosis of Transthyretin Cardiac Amyloidosis. Circ Heart Fail. 2019;12(9):e006075.
5. Treglia G, Glaudemans A, Bertagna F, Hazenberg BPC, Erba PA, Giubbini R, et al. Diagnostic accuracy of bone scintigraphy in the assessment of cardiac transthyretin-related amyloidosis: a bivariate meta-analysis. Eur J Nucl Med Mol Imaging. 2018;45(11):1945-55.
6. Sperry BW, Bock A, DiFilippo FP, Donnelly JP, Hanna M, Jaber WA. Pilot Study of F18-Florbetapir in the Early Evaluation of Cardiac Amyloidosis. Front Cardiovasc Med. 2021;8:693194.
7. Genovesi D, Vergaro G, Giorgetti A, Marzullo P, Scipioni M, Santarelli MF, et al. [18F]-Florbetaben PET/CT for Differential Diagnosis Among Cardiac Immunoglobulin Light Chain, Transthyretin Amyloidosis, and Mimicking Conditions. JACC Cardiovasc Imaging. 2021;14(1):246-55.
8. Wall JS, Martin EB, Lands R, Ramchandren R, Stuckey A, Heidel RE, et al. Cardiac Amyloid Detection by PET/CT Imaging of Iodine ((124)I) Evuzamitide ((124)I-p5+14): A Phase 1/2 Study. JACC Cardiovasc Imaging. 2023;16(11):1433-48.
9. Kawai H, Sarai M, Kato Y, Naruse H, Watanabe A, Matsuyama T, et al. Diagnosis of isolated cardiac sarcoidosis based on new guidelines. ESC Heart Fail. 2020;7(5):2662-71.
10. Ekström K, Lehtonen J, Nordenswan HK, Mäyränpää MI, Räisänen-Sokolowski A, Kandolin R, et al. Sudden death in cardiac sarcoidosis: an analysis of nationwide clinical and cause-of-death registries. Eur Heart J. 2019;40(37):3121-8.
11. Cheng RK, Kittleson MM, Beavers CJ, Birnie DH, Blankstein R, Bravo PE, et al. Diagnosis and Management of Cardiac Sarcoidosis: A Scientific Statement From the American Heart Association. Circulation. 2024;149(21):e1197-e216.
12. Siebermair J, Kessler L, Kupusovic J, Rassaf T, Rischpler C. Cardiac fibroblast activation detected by (68)Gallium-FAPI-46 positron emission tomography-magnetic resonance imaging as a sign of chronic activity in cardiac sarcoidosis. Eur Heart J Case Rep. 2022;6(1):ytac005.
13. Solanki R, Singh H, Mehta V, Panda P, Singhal M, Sood A, Mittal BR. Potential application of (68)Ga-FAPI PET/CT for diagnosing cardiac sarcoidosis. J Nucl Cardiol. 2024;36:101835.
info@herz+gefäss
- Vol. 15
- Ausgabe 2
- Mai 2025