- AACR (American Association of Cancer Research) 2025
ADC-Grundlagen
Dr. Funda Meric-Bernstam (University of Texas, Houston) präsentierte Grundlagen zu Aufbau, Wirkmechanismus, Forschung und klinischer Anwendung von ADCs. Zugelassene ADCs für solide Tumoren sind: Trastuzumab Emtansin und Trastuzumab Deruxtecan (HER2), SacituzumabA Govitecan (TROP2), Tisolumab Vedotin (Tissue Factor), Mirvetuximab Soravtansin (Folat-Rezeptor alpha), Enfortumab Vedotin sowie Enfortumab Vedotin + Pembrolizumab (Nectin-4) und Datopotamab Deruxtecan (TROP2) für unterschiedliche Indikationen.
Der Wirkmechanismus von ADCs umfasst mehrere Prinzipien: Einerseits wird eine Antitumoraktivität durch FC-vermittelte Stimulation von Immunzellen und durch Unterbrechung der Rezeptordimerisierung erzielt. Andererseits werden die meisten ADCs nach Bindung an Tumorzellen internalisiert, die Wirkstofffracht wird aus Endosomen und Lysosomen freigesetzt und führt zum Zelltod. Membrandurchdringende Wirkstoffkomponenten können auch benachbarte Zellen abtöten, was als Bystander-Effekt bezeichnet wird.
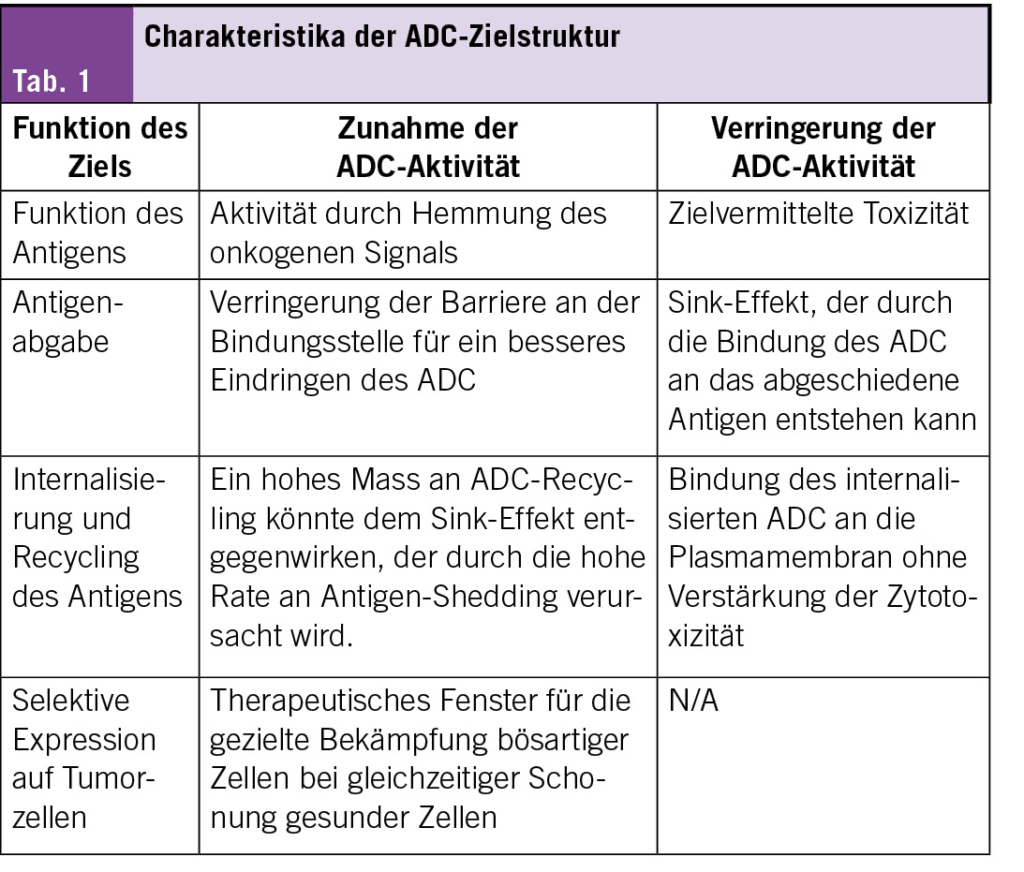
Eine Übersicht zu Charakteristika der ADC-Zielstrukturen zeigt Tab. 1.
Targets für zugelassene Wirkstoffe: HER2, TROP2, Nectin-4, TF und FRalpha
Die Trends in der Entwicklung von ADCs über vier Jahrzehnte hinweg zeigen eine Vielfalt von Ansätzen mit eindeutig herausragenden Nutzlastklassen. In den 1980er Jahren dominierten Vinca-Alkaloide und DNA-schädigende Substanzen. In den 1990er Jahren kamen Calicheamicin-basierte ADCs hinzu. Danach folgten Auristatin- und Maytansinoid-basierte ADCs. Zwischen 2015 und 2020 dominierten PBD-basierte ADCs. Aktuell befinden sich vor allem Camptothecin-ADCs in klinischer Entwicklung. Weitere Payload-Klassen werden ebenfalls untersucht, haben aber noch nicht zur Zulassung geführt.
Herausforderungen bei der Entwicklung von ADCs
Herausforderungen bei der ADC-Entwicklung umfassen:
• Optimierung von klinischem Monitoring, Dosierung und Zeitplan,
• Verständnis der Linkerstabilität,
• Entwicklung von Fernüberwachungs-Tools,
• Pharmakogenomik-Testungen,
• retrospektive und prospektive Studien zu ADC-Sequenzen,
• klinische Studien zu dualen Wirkstoffen, Radionukliden, immunstimulierenden Molekülen und proteinabbauenden Substanzen,
• Kombinationstherapien,
• Erforschung von Resistenzmechanismen,
• genauere Charakterisierung der Tumorbiologie,
• computergestützte Pathologie und Zielquantifizierung.
ADCs gelten als modulare Plattform: Die Antikörper-Komponente kann bispezifisch, trispezifisch oder maskiert sein. Linker können spaltbar oder ortsspezifisch sein, die Payload duale Wirkstoffe, immunstimulierende Substanzen oder Radionuklide enthalten.
Zukünftige Entwicklungen
Innovationen in jeder der ADC-Komponenten können zu weiteren Verbesserungen in der Krebstherapie führen. Dabei spielt die Toxizität eine wichtige Rolle. Entsprechende Strategien sind: Behandlungsdauer, fraktionierte Dosierung, Dosisanpassung nach Therapieansprechen, spaltbare und/oder chemisch labile Linker. Höhere Potenz des Wirkstoffs, Membranpermeabilität. Dosisfindungsstudien
ADCs bei Brustkrebs
Prof. Sara A. Hurvitz, Seattle, Washington, präsentierte aktuelle Erkenntnisse, praktische Möglichkeiten zur klinischen Integration und anschauliche Fallbeispiele. Sie stellte den Fall einer 56-jährigen Frau mit metastasiertem Mammakarzinom vor, die ihr zur Beratung überwiesen wurde. Die Patientin hatte vor acht Jahren einen ER+/PR+/HER2 1+ Brustkrebs Stadium IIA links. Nach einer Chemotherapie, einer modifizierten radikalen Mastektomie, einer Bestrahlung sowie einer antihormonellen Therapie mit Tamoxifen (2 Jahre) und Letrozol (2 Jahre) kam es vor drei Jahren zur Entwicklung von Lungenmetastasen (ER+/PR+/HER2 0). Die Erstlinientherapie mit Ribociclib/Fulvestrant führte nach 18 Monaten zu einem Progress in der Leber. Eine Zweitlinientherapie mit Everolimus/Exemestan scheiterte nach 10 Monaten an weiterem Progress in Knochen und Lunge, begleitet von Kurzatmigkeit und Husten.
Vergangenheit, Gegenwart und Zukunft der HER2-Expression bei Brustkrebs
Während bei nicht amplifiziertem ERBB2 bisher keine Wirksamkeit einer HER2-Blockade nachweisbar war, eröffnet der Einsatz neuer ADCs neue Therapieansätze. In der DESTINY-Breast04-Studie zeigte Trastuzumab Deruxtecan (T-DXd) bei vorbehandelten Patientinnen mit metastasiertem HER2-positivem Brustkrebs eine anhaltende antitumorale Aktivität und einen signifikanten Vorteil beim progressionsfreien Überleben (PFS) gegenüber einer vom Arzt gewählten Chemotherapie. Diese Vorteile wurden sowohl bei HER2-low als auch bei HER2-ultralow Tumoren beobachtet. Die Destiny-Breast06-Studie bestätigte T-DXd als Standardtherapie nach mindestens einer endokrinen Therapie bei Patientinnen mit HER2-low und HER2-ultralow HR+ metastasiertem Brustkrebs (mBC).
In der EMILIA-Studie konnte Trastuzumab Emtansin das PFS und das Gesamtüberleben im Vergleich zu Lapatinib plus Capecitabin verbessern, bei gleichzeitig geringerer Toxizität. Diese Patientinnen hatten zuvor bereits Trastuzumab und Taxane erhalten. In der Destiny-Breast03-Studie wurde das Fortschreiten der Erkrankung bei mit Trastuzumab und Taxanen vorbehandelten Patientinnen, die Trastuzumab Deruxtecan erhielten, deutlich seltener beobachtet als bei Patientinnen, die Trastuzumab Emtansin erhielten. Allerdings war Trastuzumab Deruxtecan mit einem erhöhten Risiko für interstitielle Lungenerkrankungen und Pneumonitis assoziiert.
DESTINY-BREAST12 zeigte, dass T-DXd auch bei Patientinnen mit Hirnmetastasen eine signifikante und anhaltende intrakranielle und systemische Wirksamkeit erzielte. T-DXd wird aktuell als Erstlinientherapie für HER2-Rezeptor-positive Pa-tientinnen eingesetzt. Für die Zukunft erwähnte Prof. Hurvitz drei laufende Studien:
• DESTINY-Breast09, eine randomisierte, offene Phase-III-Studie zur Wirksamkeit und Sicherheit von Palbociclib plus ti-HER2+ endokriner Therapie bei hormonpositivem, HER2-positivem metastasiertem Brustkrebs.
• DEMETHER, eine multizentrische, einarmige Phase-II-Studie zur Erhaltungstherapie mit Trastuzumab und Pertuzumab nach Induktion mit Trastuzumab Deruxtecan bei Patientinnen mit HER2-positivem, lokal rezidivierendem oder metastasiertem Brustkrebs.
• HER2CLIMB-05, eine Phase-III-Studie mit Tucatinib oder Placebo in Kombination mit Trastuzumab und Pertuzumab als Erhaltungstherapie bei HER2+ metastasiertem Mammakarzinom.
Anschliessend ging Prof. Hurvitz auf die Herausforderungen bei HER2-low und HER2-ultralow mBC ein. In DESTINY-Breast06 wurde ein längeres PFS von Trastuzumab Deruxtecan gegenüber Chemotherapie bei Patientinnen mit hormonrezeptorpositivem, HER2-low oder ultralow mBC gezeigt, die zuvor mindestens eine endokrine Therapie erhalten hatten. Daraus ergibt sich T-DXd als neue Erstlinientherapie bei vorbehandeltem HER2-low oder ultralow metastasiertem Brustkrebs.
Fokus auf HER2-low und -ultralow
Der College of American Pathologists aktualisierte das Protokoll zur HER2-Biomarker-Bestimmung beim Mammakarzinom. Dabei wurden Bewertung und Berichterstattung zur HER2-Statusbestimmung überarbeitet und standardisierte Kommentare eingeführt, die insbesondere die klinische Relevanz betonen.
In der DESTINY-Breast04-Studie konnte bei Patientinnen mit HER2-low metastasiertem Brustkrebs mit Trastuzumab Deruxtecan im Vergleich zur Chemotherapie ein signifikant längeres PFS und OS erzielt werden. Auch DESTINY-Breast06 zeigte einen PFS-Vorteil bei Patientinnen mit HR-positivem HER2-low oder ultralow metastasiertem Brustkrebs. Dabei wurden keine neuen Sicherheitssignale identifiziert.
Weitere Studien bestätigten diese Ergebnisse: BEGONIA, eine Phase-Ib/II-Studie mit Datopotamab Deruxtecan (Dato-DXd) plus Durvalumab als Erstlinientherapie bei nicht resezierbarem, lokal fortgeschrittenem oder metastasiertem triple-negativem Brustkrebs (TNBC), zeigte hohe und anhaltende Ansprechraten bei akzeptabler Sicherheit. Destiny-Breast08 untersuchte T-DXd in Kombination mit Capecitabin oder Capivasertib und zeigte erste Hinweise auf antitumorale Aktivität bei Patientinnen mit HER2-low metastasiertem Brustkrebs.
Erkennung und Umgang mit T-DXd-bezogenen ILDs: die fünf «S» Regel
Besonders hervorgehoben wurde der Umgang mit T-DXd-assoziierten interstitiellen Lungenerkrankungen anhand der sogenannten «5-S-Regel»: Screen, Scan, Survey, Suspend treatment, Steroids.
In der Phase-III-Studie ASCENT verbesserte Sacituzumab Govitecan das mediane PFS und Gesamtüberleben in allen Trop-2-Quartilen. Die TROPiCS-02-Phase-II-Studie bei Patientinnen mit vorbehandeltem, endokrin resistentem, Hormonrezeptor-positivem und HER2-negativem metastasiertem Brustkrebs zeigte ebenfalls einen signifikanten PFS-Vorteil gegenüber einer Chemotherapie.
Datopotamab Deruxtecan bestätigte in der TROPION-Breast01-Studie bei vorbehandeltem, operablem, HR-positivem, HER2-negativem Brustkrebs eine signifikante Verbesserung des PFS und zeigte ein günstiges und gut kontrollierbares Sicherheitsprofil im Vergleich zur Chemotherapie. Diese Ergebnisse unterstützen den Einsatz von Dato-DXd als neue Behandlungsoption für Patientinnen mit inoperablem oder metastasiertem Brustkrebs, die eine oder zwei vorangegangene Chemotherapien erhalten haben.
Insgesamt zeichnet sich ein Paradigmenwechsel ab: Die Rolle von ADCs bei Brustkrebs verschiebt sich zunehmend in Richtung einer früheren Therapielinie.
ADCs bei Lungenkrebs
Prof. Dr. Stephen V. Liu, Georgetown University, Washington, Columbia, stellte den aktuellen Stand der Wissenschaft und klinische Implikationen von ADCs bei Lungenkrebs vor. Anhand eines Fallbeispiels präsentierte er einen 52-jährigen Patienten mit einer 10-jährigen Raucheranamnese und diagnostiziertem metastasiertem Lungenadenokarzinom mit Leber- und Knochenmetastasen. Ein NGS-Test ergab keine therapierbaren Mutationen, der PD-L1-Score betrug 10 %. Eine Behandlung mit Carboplatin, Pemetrexed und Pembrolizumab führte zunächst zu einer teilweisen Remission, nach sieben Wochen kam es jedoch zum Progress.
HER2 ADC Therapie bei NSCLC, HER2 Veränderungen und Screening bei NSCLC
Die HER2-gerichtete ADC-Therapie bei NSCLC wurde thematisiert. HER2 ist bei einem relevanten Anteil von Lungenadenokarzinomen überexprimiert, amplifiziert oder mutiert. Die prognostische Bedeutung dieser Veränderungen ist jedoch unklar, da keine klare Korrelation zwischen Überexpression, Amplifikation und Mutation besteht. Es wurde betont, dass Studienkohorten strikt nach der spezifischen HER2-Veränderung definiert werden müssen. Die meisten HER2-aktivierenden Mutationen beim NSCLC sind Exon-20-Insertionen (ca. 90 %), daneben existieren Punktmutationen in der Kinase- oder Non-Kinase-Domäne.
In der Studie DESTINY-Lung01 zeigte Trastuzumab Deruxtecan (T-DXd) bei vorbehandelten Patienten mit nicht resezierbarem oder metastasiertem HER2-mutierten NSCLC eine anhaltende Antitumor-Aktivität.
Zielgerichtet auf TROP2
Auch für TROP2 liegen zunehmend Daten vor. Die EVOKE-01-Studie verglich Sacituzumab Govitecan mit Docetaxel bei vorbehandeltem, fortgeschrittenem oder metastasiertem NSCLC. Trotz nicht erreichter statistischer Signifikanz zeigte sich unter Sacituzumab Govitecan eine klinisch relevante Verbesserung des Gesamtüberlebens (OS), insbesondere bei Patienten, die nicht auf eine vorherige PD-L1-haltige Therapie angesprochen hatten. Das Sicherheitsprofil entsprach dem bekannten Muster ohne neue Signale.
Weitere ADCs für Lungenkrebs in Sicht
Weitere ADCs für Lungenkrebs werden aktuell untersucht. In der LUMINOSITY-Studie zeigte Telisotuzumab Vedotin als Monotherapie bei vorbehandeltem NSCLC mit c-Met-Überexpression und EGFR-Wildtyp ein überzeugendes und anhaltendes Ansprechen, vor allem bei hoher c-Met-Expression. Das Sicherheitsprofil war akzeptabel.
ADCs bei gastrointestinalen, gynäkologischen, urothelialen und anderen soliden Tumoren
Dr. Kathleen N. Moore (Stephenson Cancer Center, Oklahoma) präsentierte neue Daten zur Anwendung von ADCs bei verschiedenen Tumoren. An einem Fallbeispiel stellte sie eine 64-jährige Patientin mit metastasiertem serös-papillärem Uteruskarzinom vor. Die Patientin wies eine intraperitoneale Ausbreitung, Lymphknotenmetastasen und Lungenmetastasen auf. Bei HER2-positivem Tumor (HER2/CEP17-Verhältnis ≥2) wurde sie mit Paclitaxel, Carboplatin und Trastuzumab behandelt, erzielte eine komplette Remission und erhielt anschliessend 18 Monate Erhaltungstherapie mit Trastuzumab. Bei Rezidiv erfolgte eine erneute Therapiebesprechung. Insgesamt befinden sich aktuell fast 190 ADCs in der Entwicklung für gynäkologische Tumoren. In der Phase-III-Studie MIRASOL führte Mirvetuximab gegenüber Chemotherapie zu einer 35 %igen Verbesserung des PFS, einer 33 %igen Verbesserung des OS und einer Verdopplung der Ansprechrate (42 % vs. 16 %, p < 0,0001). Weitere laufende Studien untersuchen ADCs gegen Folatrezeptor alpha, darunter Raludotatug Deruxtecan, welches bei stark vorbehandelten Patientinnen mit Ovarialkarzinom auch ohne Vorselektion für CDH6 eine akzeptable Sicherheit und ermutigende Wirksamkeit zeigte.
Rinatabart Sesutecan, ein weiterer FRα-gerichteter ADC, zeigte in der Phase-1/2-Studie RAINFOL-01 eine objektive Ansprechrate von 55.6 % bei stark vorbehandelten Ovarialkarzinom-Patientinnen, unabhängig vom FRα-Expressionsniveau.
Ausrichtung auf TROP2 bei gynäkologischem Krebs
Die laufende Phase-3-Studie ENGOT-en23/GOG-3095/ MK-2870-005 untersucht Sacituzumab Tirumotecan versus Chemotherapie bei Patientinnen mit Endometriumkarzinom nach vorheriger Chemotherapie oder Immuntherapie.
Weitere Target-Ansätze umfassen B7H4, ein transmembranöses Protein, das bei etwa 90 % der Endometriumkarzinome exprimiert wird, wobei bei 30 % eine starke Färbung in mehr als 50 % der Tumorzellen festgestellt wurde.
In der TOPIC-03-Studie zeigte Sacituzumab Govitecan bei stark vorbehandelten Endometriumkarzinom-Patientinnen eine vielversprechende Wirksamkeit und beherrschbare Toxizität.
In der laufenden REJOICE-Ovarian01-Studie erzielte Raludotatug Deruxtecan bei Patientinnen mit platinresistentem Ovarialkarzinom eine bestätigte objektive Ansprechrate von 48.6 %.
In der geplanten Phase-3-Studie DESTINY-Ovarian01 soll Trastuzumab Deruxtecan (Enhertu) in Kombination mit Bevacizumab gegenüber Bevacizumab allein als Erstlinien-Erhaltungstherapie bei HER2-exprimierenden Tumoren geprüft werden.
ADCs bei Blasenkrebs
In der Phase-III-Studie EV-302 senkte Enfortumab Vedotin plus Pembrolizumab bei zuvor unbehandeltem lokal fortgeschrittenem oder metastasiertem Urothelkarzinom das Mortalitätsrisiko um 53 % und verlängerte das PFS um 55 % im Vergleich zur Chemotherapie. In DESTINY-PanTumor02 zeigte Trastuzumab Deruxtecan klinisch signifikante Vorteile bei HER2-exprimierenden Tumoren, insbesondere bei IHC3+ Tumoren, unabhängig davon, ob die Patienten durch lokale oder zentrale Tests identifiziert wurden. In der Phase-III-Studie TROPICS-04 führte Sacituzumab Govitecan bei vorbehandeltem metastasiertem Urothelkarzinom zwar nicht zu einer signifikanten Verbesserung von OS oder PFS gegenüber Taxanen oder Vinflunin, wies aber eine höhere objektive Ansprechrate auf. Das Sicherheitsprofil war konsistent mit bisherigen Studien, frühe Toxizitäten beeinträchtigten jedoch den klinischen Gesamterfolg.
ADCs bei gastrointestinalen Tumoren
Bei Magenkrebs zeigte Trastuzumab Deruxtecan in der DESTINY-Gastric01-Studie eine statistisch signifikante Verbesserung gegenüber Standardtherapie. Vorläufige Daten legen auch einen möglichen Nutzen bei HER2-low Magenkarzinomen nahe. Die starke räumliche und zeitliche Heterogenität der HER2-Expression erschwert jedoch die Patientenidentifikation. Eine hohe Übereinstimmung (64 %) zwischen HER2-Positivität und ERBB2-Genamplifikation wurde festgestellt. Weitere Genamplifikationen wie MET, EGFR und FGFR2 in zirkulierender Tumor-DNA waren mit einer geringeren ORR assoziiert.
DESTINY-CRC01 belegte eine signifikante Überlebensverlängerung bei HER2-positivem, metastasiertem Kolorektalkarzinom nach Versagen der Standardtherapien. In DESTINY-CRC02 wurde eine Einzeldosis von 5.4 mg/kg als optimal definiert, auch für Patienten mit RAS-Mutationen oder nach Vorbehandlung.
In DESTINY-PanTumor02 profitierten vorbehandelte Patienten mit HER2-exprimierenden Tumoren, insbesondere bei IHC3+, deutlich von T-DXd, das ein bekanntes Sicherheitsprofil (inklusive ILD) aufwies.
Fazit
Die in diesem Symposium präsentierten Ergebnisse zeigen, dass in der Entwicklung von ADCs grosse Fortschritte erzielt wurden. In den kommenden Jahren ist mit weiteren innovativen therapeutischen Verbesserungen bei zahlreichen soliden Tumoren zu rechnen.
Vorhersage und Simulationen des Tumorwachstums
Beim AACR fand ein Symposium statt, bei dem unter anderem Aspekte der Tumorgrössenentwicklung diskutiert wurden. Zwar gab es keine spezifische Session zur Modellierung der Tumorgrösse, jedoch wurden Themen behandelt, die sich mit der Vorhersage und Simulation des Tumorwachstums befassen. In der Plenary Session «Opportunities in Predictive Oncology» präsentierte Prof. Christina Curtis von der Stanford University ihre Arbeit zur Entwicklung von «digitalen Zwillingen» von Tumoren. Digitale Tumorzwillinge sind virtuelle Modelle von Tumoren, die auf Basis realer Patientendaten wie Bildgebungsdaten, molekularen Daten und klinischen Informationen erstellt werden. Sie ermöglichen eine präzisere Vorhersage des Tumorverhaltens und helfen bei der Auswahl optimaler Therapieansätze. Prof. Curtis betonte die Bedeutung gross angelegter Datenanalysen und entsprechender Technologien, um den Verlauf von Tumorerkrankungen besser vorhersagen zu können. Solche Ansätze sind entscheidend für die Entwicklung präziserer und personalisierter Behandlungsstrategien.
Lorlatinib – eine neue Behandlungsoption beim NSCLC
Die im Folgenden beschriebenen Präsentationen befassten sich mit Lorlatinib (Lorviqua®), einem Drittgenerations-ALK-Inhibitor, der sich als wichtige neue Behandlung bei ALK-positivem NSCLC erwiesen hat.
• Abstract 5947: Efficacy and safety of Lorlatinib in first-line and later-line treatment for Chinese patients: a real-world study with retrospective and prospective bidirectional cohorts: Lorlatinib zeigte bei einer chinesischen Population mit ALK-positivem fortgeschrittenem NSCLC eine starke Wirksamkeit, wobei das mediane PFS sowohl in der Erstlinien- als auch in der Zweitlinienbehandlung noch nicht erreicht wurde. Hyperlipidämie, eine bekannte Nebenwirkung von Lorlatinib, trat häufig auf, insbesondere bei Patienten mit Hirnmetastasen. Eine lipidsenkende Therapie normalisierte die Lipidwerte.
• Abstract 4720: Evaluation of Lorlatinib Efficacy Using Plasma DNA: Diese multizentrische prospektive Studie untersuchte die Wirksamkeit von Lorlatinib bei Patienten mit ALK-rearrangiertem NSCLC, die zuvor mit Alectinib behandelt wurden. Durch die Analyse zirkulierender Tumor-DNA (ctDNA) wurden prädiktive Marker und Resistenzmechanismen identifiziert. Die Ergebnisse zeigten, dass TP53-Mutationen mit einer verkürzten progressionsfreien Überlebenszeit (PFS) assoziiert waren. Zudem wurden persistierende ALK-Fusionen und neue Rearrangements beobachtet, die mit einer reduzierten Wirksamkeit von Lorlatinib korrelierten. Diese Erkenntnisse unterstreichen die Bedeutung von ctDNA-Analysen zur Vorhersage des Behandlungserfolgs und zur Identifikation von Resistenzmechanismen.
• Abstract 5947: Efficacy and Safety of Lorlatinib in First-Line and Later-Line Treatment: In dieser retrospektiven und prospektiven Studie wurden 63 Patienten mit ALK-positivem fortgeschrittenem NSCLC untersucht, die Lorlatinib entweder als Erstlinien- oder als spätere Therapie erhielten. Die objektive Ansprechrate (ORR) betrug in der Erstlinienbehandlung 85.7 % und in der späteren Behandlung 26.7 %. Die mediane PFS wurde in beiden Gruppen noch nicht erreicht. Ein häufig beobachteter Nebeneffekt war Hyperlipidämie, insbesondere bei Patienten mit Hirnmetastasen. Die Studie betont die Wirksamkeit von Lorlatinib und die Notwendigkeit eines Managements der Nebenwirkungen.
• Abstract 6794: Elucidating Mechanisms of Cancer Cell Persistence to Lorlatinib: Diese präklinische Studie analysierte die Mechanismen der Persistenz von Krebszellen gegenüber Lorlatinib bei ALK-positivem NSCLC. Durch genomische Analysen von Zelllinien und patientenabgeleiteten Xenograft-Modellen wurden MAPK-Signalwege und stammzellähnliche Zellpopulationen identifiziert, die zur Resistenzentwicklung beitragen könnten. Die Ergebnisse deuten auf potenzielle therapeutische Ziele hin, um die Wirksamkeit von Lorlatinib zu verbessern.
riesen@medinfo-verlag.ch