- Endoradiotherapie des Prostatakarzinoms mittels 177Lu-PSMA-Liganden
Die sogenannte PSMA-Therapie ist die einzige, in der Schweiz von den Behörden offiziell genehmigte Drittlinientherapie des metastasierten, kastrationsrefraktären Prostatakarzinoms. Soweit klinisch sinnvoll, kann sie jedoch nach Tumorboardbeschluss auch früher durchgeführt werden. Weitere Einschlusskriterien sind eine ausreichende PSMA-Expression der Tumorherde (sichtbar in der PSMA-PET/CT) sowie eine ausreichende Knochenmarkreserve und Nierenfunktion. Abgesehen von einer Chemotherapie-Karenz von wenigen Wochen (je nach Knochenmarkreserve) bedarf die PSMA-Therapie keiner besonderen Vorbereitung (keine spezifische Diät oder Medikamentenumstellung). Eine Kostengutsprache durch die Versicherungen ist nicht erforderlich.
La thérapie dite PSMA est la seule thérapie de troisième ligne pour le cancer de la prostate métastatique et résistant à la castration qui a été officiellement approuvée par les autorités en Suisse. Toutefois, si elle est cliniquement significative, elle peut également être effectuée à un stade plus précoce, après une décision du conseil des tumeurs. D’autres critères d’inclusion sont une expression suffisante des foyers de la tumeur (visible dans le PSMA-PET/CT) ainsi qu’une réserve de moelle osseuse et une fonction rénale suffisantes. En dehors d’un congé de chimiothérapie de quelques semaines (en fonction de la réserve de moelle osseuse), la thérapie PSMA ne nécessite aucune préparation particulière (pas de changement de régime alimentaire ou de médicament spécifique). Un crédit de frais par les compagnies d’assurance n’est pas nécessaire.
Der erste Patient in der Schweiz wurde im August 2019 mit PSMA therapiert. Seitdem wird diese palliative Therapie routinemässig durchgeführt und zeigt in ca. 1/3 der Patienten eine hohe anti-tumorale Wirkung mit entsprechendem PSA-Abfall und erheblicher Verbesserung des allgemeinen Zustandes. Bei einem weiteren Drittel der Patienten kann ein stable disease erreicht werden. Negative prädiktive Faktoren sind Lebermetastasen und Cabazitaxel-Vorbehandlung. Die PSMA-Therapie ist während der ersten drei Zyklen in der Regel hervorragend verträglich; Nebenwirkungen treten meist ab dem 4. Zyklus auf und betreffen vor allem die Speicheldrüsen sowie das blutbildende Knochenmark. Andere Nebenwirkungen sind selten und treten in der Regel erst in späteren Stadien der PSMA-Therapie auf. Bei Respondern können im Durchschnitt progressionsfreie Überlebensintervalle von 4-5 Monaten erwartet werden.
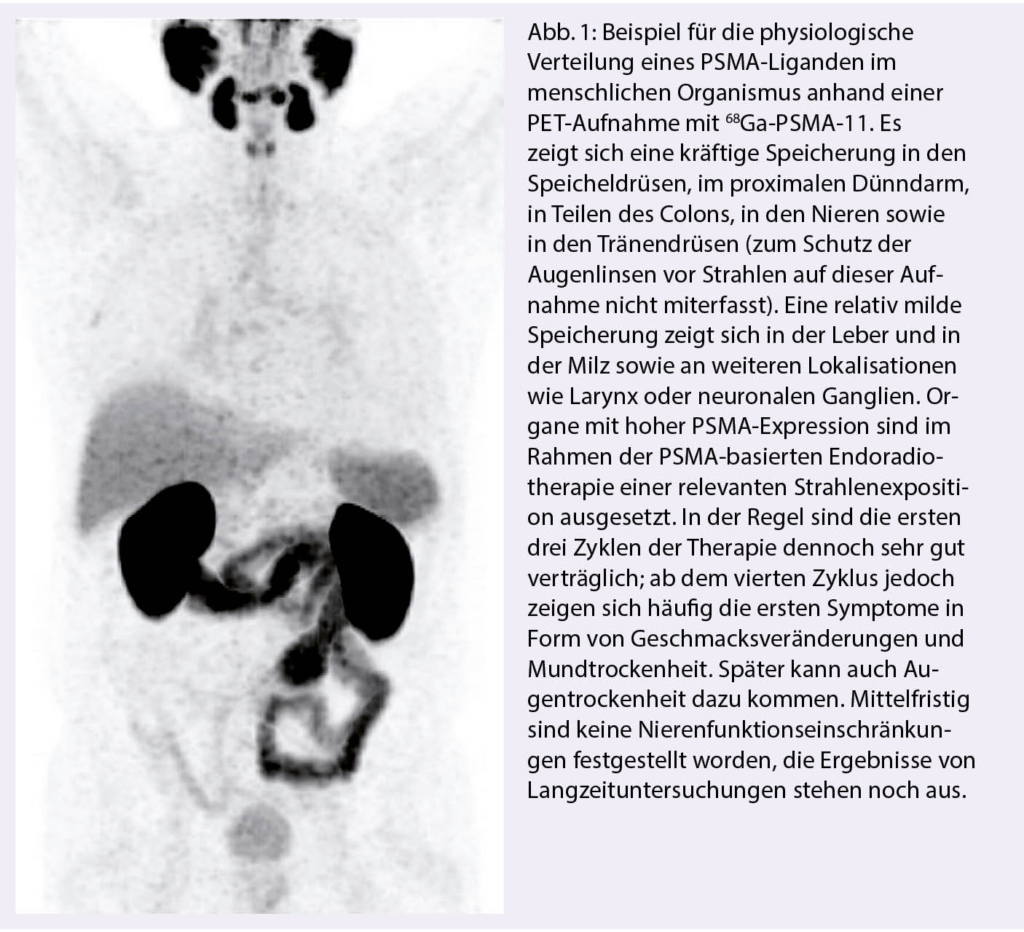
In den letzten Jahren lag der Fokus innovativer theranostischer Möglichkeiten im Rahmen des Prostatakarzinoms (PC) vor allem auf dem Prostata-Spezifischen-Membran-Antigen (PSMA). PSMA ist ein transmembranes Protein, welches in der Mehrzahl der PC-Zellen signifikant stärker exprimiert wird als in normalen Prostatazellen. Entgegen seines Namens wird PSMA jedoch auch in anderen Geweben des Organismus exprimiert (Abb. 1). Die Zielstruktur PSMA eignet sich nicht nur zur Diagnostik - z.B. mittels Positronen-Emissions-Tomographie (PET), sondern in besonderem Masse auch für eine zielgerichtete, endogene Radiotherapie (Radioligandentherapie). Voraussetzung einer solchen Therapie ist eine ausreichend hohe PSMA-Expression der Tumorherde, die mittels PSMA-Liganden PET/CT sichtbar gemacht werden kann.
Die Anfänge der PSMA-basierten Endoradiotherapie
Die ersten «PSMA-Therapien» in Menschen mit radioaktiv markierten Liganden wurden – ebenso wie die PSMA-PET/CT – im Jahre 2011 in der Nuklearmedizin der Uniklinik Heidelberg (D) durchgeführt (1, 2). Dabei wurde der PSMA-Ligand MIP-1095 der US-amerikanischen Firma Molecular Insight Pharmaceuticals (MIP) mit dem radioaktiven Halogen 131Iod gekoppelt und bei konventionell in der Regel austherapierten Patienten intravenös verabreicht. Bereits nach einer einzigen Gabe (Zyklus) konnten damit teils erstaunliche Ergebnisse mit raschem biochemischem und bildmorphologischem Ansprechen und Herddosen bis zu 300 Gy erzielt werden (1, 2). Beispielsweise zeigten >38% der Patienten nach dem ersten Zyklus einen PSA-Abfall von mindestens 75%. Die Nebenwirkungen waren beim ersten Zyklus zumeist mild und klinisch selten relevant, nahmen jedoch ab dem zweiten Zyklus zu (2). Zum relevanten Nebenwirkungsprofil gehörten Leukozytopenie, Thrombopenie und Xerostomie. Letzteres ist der physiologischen Aufnahme von PSMA-Liganden im Speicheldrüsengewebe geschuldet.
Ein Nachteil der Therapie mit 131Iod-MIP-1095 lag in der langen Hospitalisationsdauer von bis zu 10 Tagen. Der Grund dafür war die lange im Organismus verbleibende Radioaktivität, so dass entsprechend die gesetzlich vorgeschriebenen Werte für die Entlassung nach Hause relativ spät erreicht wurden.
177Lutetium-PSMA-Liganden
Seit 2013 wurde 131Iod-MIP-1095 v.a. aufgrund der langen Hospitalisationsdauer von PSMA-Liganden, die das radioaktive Metall 177Lutetium (177Lu) tragen, abgelöst. Auch wenn nach 2013 unseres Wissens nach keine PSMA-Therapien mehr mit 131Iod-MIP-1095 durchgeführt wurden, hat diese Substanz in hohem Masse dazu beigetragen, diese PSMA-Therapie zu verstehen.
Auch bei den 177Lu-markierten PSMA-Liganden zeigten sich teils vielversprechende Therapieresultate bei einem günstigen Nebenwirkungsprofil und einer kurzen stationären Verweildauer von wenigen Tagen (2-4 Tagen). Aus diesen Gründen hat zunächst innerhalb Deutschlands und wenige Jahre später auch weltweit eine rasche Ausbreitung dieser Therapieform stattgefunden. Die zwei führenden 177Lu-Liganden sind 177Lu-PSMA-617 (entwickelt am Deutschen Krebsforschungszentrum in Heidelberg) sowie 177Lu-PSMA-I&T (entwickelt an der Technischen Universität München). Suffiziente Studien zum Vergleich der beiden Substanzen untereinander bezüglich Wirkung und Nebenwirkungen sind aktuell nicht vorhanden.
Die positiven Ergebnisse multipler Publikationen und Erfahrungsberichte führten schliesslich dazu, dass nach einer aufwendigen Antrags-Prozedur die PSMA-Therapie mit 177Lu-PSMA-617 in 12/2018 auch in der Schweiz von den Behörden genehmigt wurde. Allerdings konnte aufgrund von Lieferschwierigkeiten der Substanz die erste Therapie in der Schweiz erst im August 2019 durchgeführt werden (Uniklinik Bern). Seitdem jedoch wird die PSMA-Therapie mit zunehmenden Fallzahlen routinemässig durchgeführt. Seit Mai 2020 liegt zur PSMA-Therapie mittels 177Lu-PSMA-I&T von den Schweizer Behörden ebenfalls eine Genehmigung vor.
Regularien
Die Regularien für die Durchführung einer PSMA-Therapie in der Schweiz sind wie folgt: die Therapie ist vorgesehen für die Drittlinientherapie des metastasierten, kastrations-resistenten PC (mCRPC). Allerdings kann sie nach Tumorboardbeschluss – sofern sinnvoll erachtet – auch früher als in der dritten Linie durchgeführt werden. Tatsächlich zeigen die Ergebnisse einer klinischen Phase-II-Studie aus Australien, dass die PSMA-Therapie gegenüber der Therapie mit Cabazitaxel wirkungsvoller und nebenwirkungsärmer war (3). Insgesamt sind international immer häufiger Überlegungen und Bestrebungen ersichtlich, die PSMA-Therapie früher als in der dritten Linie einzusetzen.
Einschlusskriterien
Weitere Einschlusskriterien neben einem interdisziplinären Tumorboardbeschluss und einer ausreichenden PSMA-Expression der Tumorherde sind eine suffiziente Knochenmarkreserve und Nierenfunktion. Abgesehen von einer Chemotherapie-Karenz von wenigen Wochen (je nach Knochenmarkreserve) bedarf die PSMA-Therapie keiner besonderen Vorbereitung; eine spezielle Diät, das Absetzen von Medikamenten oder eine Kostengutsprache mit den Versicherungen sind somit nicht erforderlich. Es ist sinnvoll, die Basismedikation für das PC (z.B. GnRh-Analoga oder knochen-stabilisierende Substanzen bei entsprechender ossärer Metastasierung) fortzuführen.
Wirkungspotential der PSMA-Therapie
Die allgemeinen Erfahrungen mit 177Lu-PSMA-Therapien zeigen, wie oben angedeutet, bereits nach einem einzigen Zyklus vielversprechende, in der Anfangsphase sogar gelegentlich spektakuläre Ergebnisse, auch wenn grundsätzlich keine Heilung in Aussicht gestellt werden kann: bei >60% der Patienten sinkt der PSA-Wert um mindestens 50% (4). In dosimetrischen Analysen konnten Herddosen von bis zu 162 Gy für eine verabreichte Aktivität von 7.4 GBq 177Lu-PSMA-617 nachgewiesen werden (5).
Aktuell werden 4-6 Zyklen PSMA-Therapie à 6 bis 7.4 Gigabecquerel (GBq) in Abständen von 6-8 Wochen empfohlen (6). Jedoch kann – je nach Ausmass der Nebenwirkungen und dem sonstigen Zustand des Patienten – die Therapie bei Respondern über den
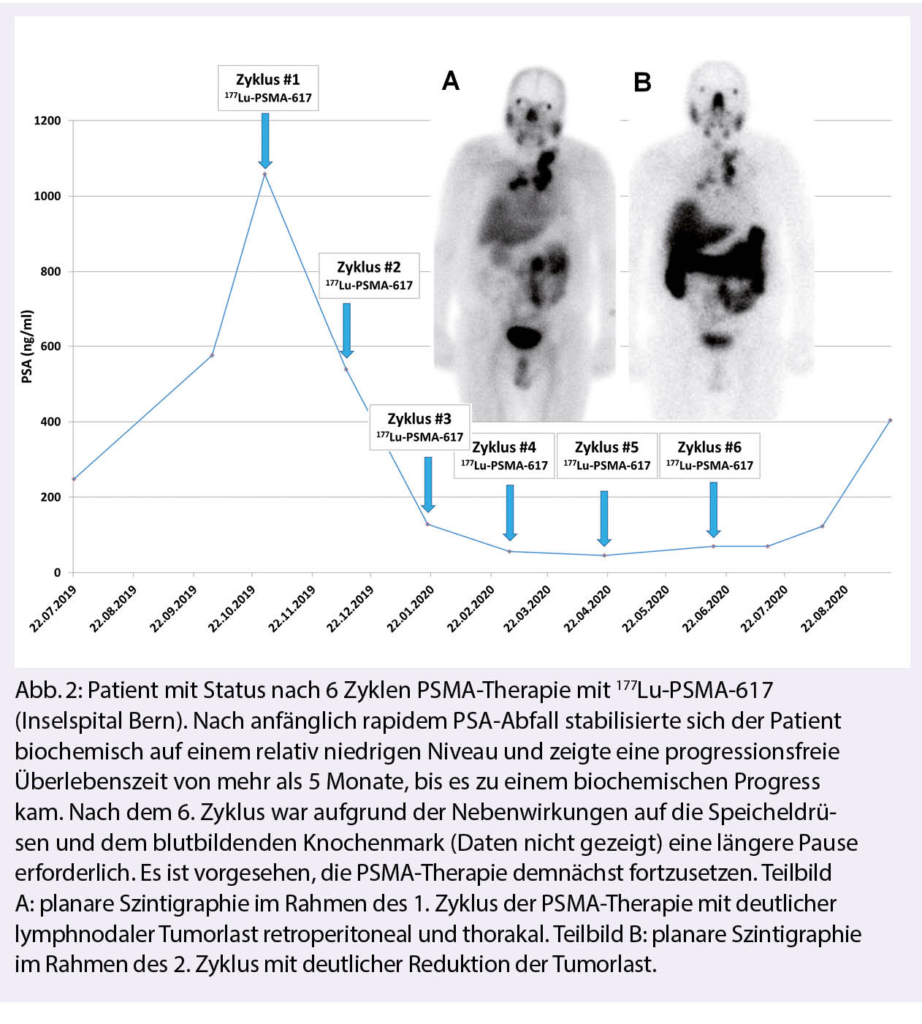
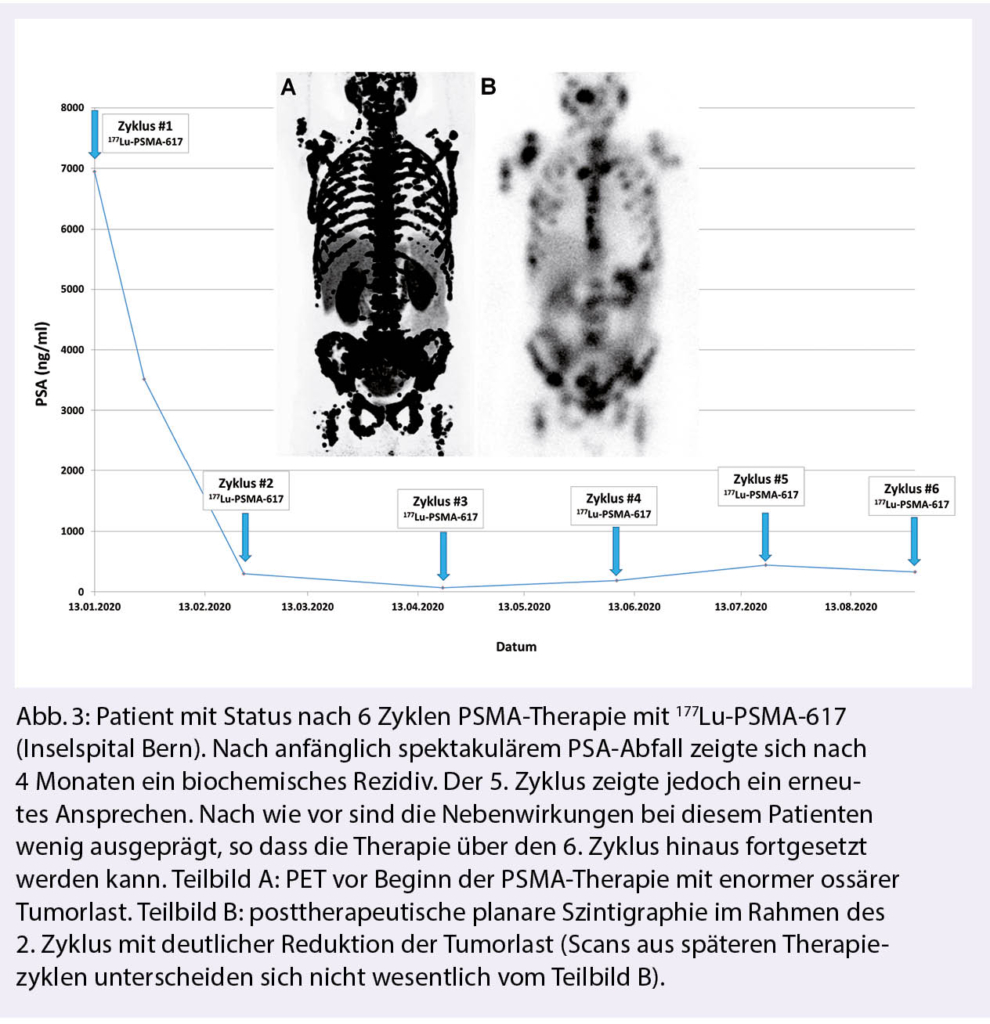
6. Zyklus hinaus fortgeführt werden. Bisherigen Erfahrungen nach können die Ansprechraten wie folgt angegeben werden: 1/3 der Patienten weisen eine sehr gute Response auf die PSMA-Therapie auf (Abb. 2-3). Dies zeigt sich innerhalb weniger Wochen auch in einer signifikanten Besserung des zuvor teils erheblich reduzierten Allgemeinzustandes. Bei 1/3 bleibt die Erkrankung für Wochen bis Monaten stabil und 1/3 der Patienten profitieren nicht von der Therapie (4). Bekannte negative prädiktive Faktoren sind Lebermetastasen und eine stattgehabte Cabazitaxel-Therapie.
Nebenwirkungen
Insgesamt ist die 177Lu-PSMA-Therapie während der ersten drei Zyklen hervorragend verträglich und relevante Nebenwirkungen sind nicht zu erwarten. Sollte die PSMA-Therapie darüber hinaus fortgeführt werden (bei Respondern oder denjenigen mit stable disease), so werden die Nebenwirkungen zumeist ab dem vierten Zyklus symptomatisch. Diese äussern sich in zunächst milden, pro weiteren Zyklus zunehmenden Geschmacksveränderungen und Mundtrockenheit aufgrund von Schäden an den Speicheldrüsen, die auch bei einer längeren Pausierung der PSMA-Therapie kaum ein Erholungspotential zeigen. Bei Respondern gelten die Nebenwirkungen an den Speicheldrüsen als der primär limitierende Faktor der PSMA-Therapie.
Bisher haben mehrere Ansätze zur Reduktion der Schäden an den Speicheldrüsen wie z.B. ein Exkretionsreiz (Zitronensaft etc.) oder Sialoskopie mit Steroidinjektion keinen Erfolg gezeigt. Eine Injektion von Botulinumtoxin in die Speicheldrüsen kann die Aufnahme des PSMA-Liganden zwar reduzieren, ist jedoch aufgrund der langen Wirkung von 3-4 Monaten schwer kontrollierbar und hat sich bisher in der klinischen Routine nicht durchsetzen können. Ein weiterer Ansatz ist die Kühlung der Speicheldrüsen mit dem Ziel, die Perfusion und in der Folge dessen die Aufnahme der PSMA-Liganden zu reduzieren. Obwohl die Effektivität dieser Massnahme bisher nicht bewiesen worden ist, so ist sie dennoch leicht umsetzbar, von den Pateinten gut tolerierbar und auch von den Leitlinien empfohlen (1/2 h vor und 4-6 h nach Beginn der Injektion der PSMA-Liganden) (6).
Die unspezifische Mitbestrahlung des blutbildenden Knochenmarks im Rahmen der PSMA-Therapie äussert sich in einer von Zyklus zu Zyklus häufig abnehmenden Anzahl an entsprechenden Blutzellen wie Leukozyten, Thrombozyten und Erythrozyten. Diese Nebenwirkung stellt häufig einen weiteren limitierenden Faktor der PSMA-Therapie dar und ist vor allem dann eine schwer beherrschbare Herausforderung, wenn Patienten bereits mit einer deutlich reduzierten Knochenmarkreserve infolge multipler Chemotherapien oder infolge einer ausgeprägten Knochenmarkinfiltration der PSMA-Therapie zugeführt werden. In Anbetracht dieser Umstände sind Überlegungen, die Chemotherapie frühzeitig zugunsten einer PSMA-Therapie zu pausieren, berechtigt und sinnvoll. Falls die Patienten von der PSMA-Therapie nicht profitieren sollten, kann auf der anderen Seite zeitnah die Chemotherapie wieder begonnen werden.
Ab dem 5. bis 6. Zyklus kann auch eine zunehmende Trockenheit der Augen infolge einer Tränendrüsenschädigung klinisch in Erscheinung treten (ebenfalls kaum Erholungspotential vorhanden). Regelmässig wird auch ein passagares Fatigue-Syndrom beobachtet, wobei noch unklar ist, ob dies infolge der Tumorerkrankung oder infolge der PSMA-Therapie auftritt. Andere Nebenwirkungen wie eine abnehmende Leistungsfähigkeit der Nieren sind kurzfristig nicht beobachtet worden. Mittel- und langfristig auftretende Niereninsuffizienzen sind noch Gegenstand klinischer Forschung.
Auswirkungen auf das Überleben:
Der aktuellen Datenlage zufolge können progressionsfreie Überlebensintervalle von durchschnittlich 4-5 Monaten bei Respondern erwartet werden (7). Diese Ergebnisse sind in Anbetracht der Tatsache, dass es sich bei den Patienten in der Regel um end-stage Patienten handelt, beachtlich. Neue prospektive randomisierte Studien zur PSMA-Therapie auch in früheren Stadien werden zukünftig sicherlich weiteres Potential dieser Therapieform in Bezug auf das Gesamtüberleben zeigen.
Copyright bei Aerzteverlag medinfo AG
Klinik für Nuklearmedizin
Inselspital Bern
Freiburgstrasse 18
3010 Bern
ali.afshar@insel.ch
Klinik für Nuklearmedizin
Inselspital Bern
Freiburgstrasse 18
3010 Bern
Die Autoren haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Die PSMA-Therapie zeigt bei auf konventionellem Weg austherapierten Patienten im kastrationsrefraktären, metastasierten Stadium beachtliches Potential bei gutem Nebenwirkungsprofil.
- Einschlusskriterien sind eine ausreichend hohe PSMA-Expression, eine suffiziente Knochenmarkreserve sowie Nierenfunktion.
- Eine Kostengutsprache mit den Versicherungen ist nicht erforderlich.
– Bekannte negative prädiktive Faktoren sind Cabazitaxel und
Lebermetastasen.
– Abgesehen von einer Chemotherapie-Karenz von wenigen Wochen (je nach Knochenmarkreserve) bedarf die PSMA-Therapie keiner besonderen Vorbereitung. Die Basismedikation für das PC (z.B. GnRh-Analoga oder kochen-stabilisierende Substanzen) sollten fortgeführt werden. - Nebenwirkungen betreffen vor allem die Speicheldrüsen sowie
das blutbildende Knochenmark. Andere Nebenwirkungen sind
selten und treten in der Regel erst in späteren Stadien der PSMA-Therapie auf. - Bei Respondern zeigen sich durchschnittlich 4-5 Monate progressionsfreies Überleben.
Messages à retenir
- La thérapie de PSMA présente un potentiel considérable avec un bon profil d’effets secondaires chez les patients traités de manière conventionnelle au stade métastatique, réfractaire à la castration.
- Les critères d’inclusion sont une expression PSMA suffisamment élevée, une réserve de moelle osseuse et une fonction rénale.suffisante
- Un crédit de frais auprès des compagnies d’assurance n’est pas nécessaire.
– Les facteurs prédictifs négatifs connus sont le cabazitaxel et les métastases hépatiques.
– En dehors d’un congé de chimiothérapie de quelques semaines (en fonction de la réserve de moelle osseuse), la thérapie PSMA ne nécessite aucune préparation particulière. Les médicaments de base pour le cancer de la prostate (par exemple, les analogues du GnRh ou les substances stabilisant l’ébullition) doivent être poursuivis. - Les effets secondaires touchent principalement les glandes salivaires et la moelle osseuse hématopoïétique. Les autres effets secondaires sont rares et ne surviennent généralement qu’à des stades ultérieurs du traitement de la PSMA.
- Les répondants montrent une moyenne de 4-5 mois de survie sans progression.
1. Zechmann CM, Afshar-Oromieh A, Armor T, Stubbs JB, Mier W, Hadaschik B, et al. Radiation dosimetry and first therapy results with a (124)I/ (131)I-labeled small molecule (MIP-1095) targeting PSMA for prostate cancer therapy. European journal of nuclear medicine and molecular imaging. 2014;41:1280-92. doi:10.1007/s00259-014-2713-y.
2. Afshar-Oromieh A, Haberkorn U, Zechmann C, Armor T, Mier W, Spohn F, et al. Repeated PSMA-targeting radioligand therapy of metastatic prostate cancer with (131)I-MIP-1095. European journal of nuclear medicine and molecular imaging. 2017;44:950-9. doi:10.1007/s00259-017-3665-9.
3. https://www.urotoday.com/conference-highlights/asco-2020/asco-2020-prostate-cancer/121811-asco-2020-therap-a-randomised-phase-ii-trial-of-177lu-psma-617-lupsma-theranostic-versus-cabazitaxel-in-metastatic-castration-resistant-prostate-cancer-mcrpc-progressing-after-docetaxel-initial-results-anzup-protocol-1603.html.
4. Rahbar K, Ahmadzadehfar H, Kratochwil C, Haberkorn U, Schafers M, Essler M, et al. German Multicenter Study Investigating 177Lu-PSMA-617 Radioligand Therapy in Advanced Prostate Cancer Patients. Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 2017;58:85-90. doi:10.2967/jnumed.116.183194.
5. Kratochwil C, Giesel FL, Stefanova M, Benesova M, Bronzel M, Afshar-Oromieh A, et al. PSMA-Targeted Radionuclide Therapy of Metastatic Castration-Resistant Prostate Cancer with 177Lu-Labeled PSMA-617. Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 2016;57:1170-6. doi:10.2967/jnumed.115.171397.
6. Kratochwil C, Fendler WP, Eiber M, Baum R, Bozkurt MF, Czernin J, et al. EANM procedure guidelines for radionuclide therapy with (177)Lu-labelled PSMA-ligands ((177)Lu-PSMA-RLT). European journal of nuclear medicine and molecular imaging. 2019;46:2536-44. doi:10.1007/s00259-019-04485-3.
7. Brauer A, Grubert LS, Roll W, Schrader AJ, Schafers M, Bogemann M, et al. (177)Lu-PSMA-617 radioligand therapy and outcome in patients with metastasized castration-resistant prostate cancer. European journal of nuclear medicine and molecular imaging. 2017;44:1663-70. doi:10.1007/s00259-017-3751-z.
info@onco-suisse
- Vol. 10
- Ausgabe 6
- Oktober 2020