- Gebrauch und Missbrauch von Bone Targeting Agents in der Schweiz bei Patienten mit metastasiertem Prostata Karzinom
Bone targeted agents (BTAs) wie Denosumab oder Zoledronsäure werden in einer höheren Dosisintensität zur Verhinderung sogenannter skeletal-related events (SREs) bei Patienten mit kastrations-resistentem Prostatakarzinom (mCRPC) mit Knochenmetastasen geprüft und eingesetzt. Im Gegensatz dazu sind BTAs in der Behandlung von Patienten mit kastrations-sensitivem Prostatakarzinom (mCSPC) in dieser Dosis und Frequenz nicht indiziert, sondern bei Vorliegen von Risikofaktoren in der Dosis für Osteoporoseprophylaxe gegen «cancer treatment-induced bone loss» unabhängig des Vorhandenseins von Metastasen. In diesem Artikel soll ein Blick auf deren Verwendungssituation und ökonomischen Konsequenzen in der Schweiz geworfen werden.
Whereas bone targeted agents (BTAs) such as denosumab or zoledronic acid in a higher dose and frequency are used to reduce the risk of skeletal-related events in patients with castration-resistant prostate cancer with bone metastases, they are not indicated for patients with metastatic castration-sensitive prostate cancer in this higher dose intensity, but in a much lower dose intensity for the prevention of cancer treatment-induced bone loss, independent from the presence of metastases. This article will take a look at the prevalence and economic consequences of real-world use of BTAs in Switzerland.
Key Words: bone-targeted agents, castration-sensitive prostate cancer, patterns of care, economic consequences, health economic analysis
Der RANK-Ligand Inhibitor Denosumab, sowie das Bisphosphonat Zoledronsäure können die Inzidenz von SREs wie pathologische Frakturen, Radiotherapie und/oder Chirurgie am Knochen, Spinalkanalkompression oder Hyperkalzämie bei Patienten mit mCRPC mit Knochenmetastasen reduzieren, wobei Denosumab diesbezüglich eine etwas höhere Wirksamkeit aufweist (1-4). Basierend auf diesen Studien empfiehlt die Europäische Gesellschaft für Medizinische Onkologie (ESMO) den Einsatz von Denosumab oder Bisphosphonaten für Patienten mit mCRPC und Knochenmetastasen mit einem hohen Risiko für ein klinisch signifikantes SRE, üblicherweise in einem Dosierungsintervall von 3-4 Wochen (5). Unklar ist, wie ein solch erhöhtes Risiko definiert werden soll. Häufig werden Tumorlast (z.B. >3 Knochenmetastasen, erhöhte alkalische Phosphatase), Lokalisation der Knochenmetastasen oder vorausgegangene SREs als Hochrisiko-Situationen beurteilt (6), jedoch handelt es sich hierbei nicht um validierte Faktoren. Im Weiteren sind auch das ideale Behandlungsintervall und die Dauer der Therapie unklar. Fachgesellschaften erachten eine Therapiedeeskalation zumindest für Zoledronsäure bei Patienten mit soliden Tumoren und Knochenmetastasen bei gut kontrollierter Krankheitssituation für sinnvoll (7). In der Zulassungsstudie für Denosumab wurden Patienten mit mCSPC explizit ausgeschlossen. Der klinische Nutzen von Denosumab wurde bisher in keiner Studie im kastrations-sensitiven Setting bei Patienten mit Knochenmetastasen untersucht (8). Zoledronsäure wurde für diese Indikation in zwei randomisierten Studien getestet ohne nachgewiesene Reduktion skelettaler Ereignisse während des publizierten Follow-up (9, 10). Dementsprechend sind gemäss der Amerikanischen Gesellschaft für Klinische Onkologie (ASCO) und der ESMO BTAs in der hohen Dosis/Frequenz für die Reduktion der Inzidenz von SREs nicht Bestandteil einer Behandlung von Patienten mit mCSPC (11, 12). Unbestritten ist der Einsatz von BTAs bei Patienten unter Androgendeprivationstherapie zur Verhinderung von «cancer treatment-induced bone loss» bzw. osteoporotischen Frakturen. Die Dosis in dieser Indikation ist aber 10–13-mal tiefer, Denosumab 60 mg alle 6 Monate oder Zoledronsäure 5 mg einmal jährlich. Trotz der fehlenden Evidenz für BTAs in der hohen Dosisintensität im mCSPC-Setting ist Denosumab in einer Dosierung von 120 mg alle 3-4 Wochen gemäss Spezialitätenliste des Bundesamtes für Gesundheit für die Behandlung von Pa-tienten mit Knochenmetastasen solider Tumoren in Verbindung mit einer antineoplastischen Standardtherapie, ungeachtet des Kastrationsstatus, kassenzulässig (13). Ähnliches gilt auch für das Bisphosphonat Zoledronsäure (14).
Behandlungssituation mit BTAs bei Patienten mit mCSPC in der Schweiz
In einer durch die Swiss Group for Clinical Cancer Research (SAKK) durchgeführten Querschnitts-Studie (SAKK 95/16 prostate study) wurde der Einsatz von BTAs in der Schweiz untersucht (15). Insgesamt haben 86 Onkologen, welche über 400 Patienten mit soliden Tumoren und Knochenmetastasen behandeln, an dieser Untersuchung teilgenommen. 20 dieser Experten gaben an auch Patienten mit mCSPC zu betreuen, wovon mehr als die Hälfte (55%) dieser Patienten eine zusätzliche Behandlung mit einem BTA aufgrund Vorliegens von Knochenmetastasen erhalten hat. Weitaus am häufigsten wurde dabei Denosumab eingesetzt (84%), vorwiegend in einem Dosierungsintervall von 3-4 Wochen (75%). In knapp einem Drittel der Fälle (31%) wurde das Therapie-Intervall von Denosumab auf 12 Wochen nach zwei Behandlungsjahren verlängert. Als häufigste Gründe für die Verabreichung von BTAs bei Patienten mit mCSPC wurden von den Onkologen Knochenschmerzen (37%), hohes Risiko für Knochenkomplikationen (21%) und die Anzahl Knochenmetastasen (16%) genannt. Eine Kostenanalyse dieser nicht-indizierten Behandlung ergab eine jährliche Belastung für das Schweizer Gesundheitssystem von über 8,3 Millionen Schweizer Franken. Bereits im Jahr 2012 wurde die Swissmedic von Schweizer Experten mit einem Schreiben auf den fehlenden Nachweis eines Nutzens von Denosumab zur Verhinderung skelettaler Ereignisse bei Patienten mit mCSPC hingewiesen (16). Immerhin erfolgte Jahre später hierdurch wenigstens in der entsprechenden Fachinformation eine Anpassung (17).
Weiteres Vorgehen in der Betreuung von Patienten mit Knochenmetastasen in der Schweiz
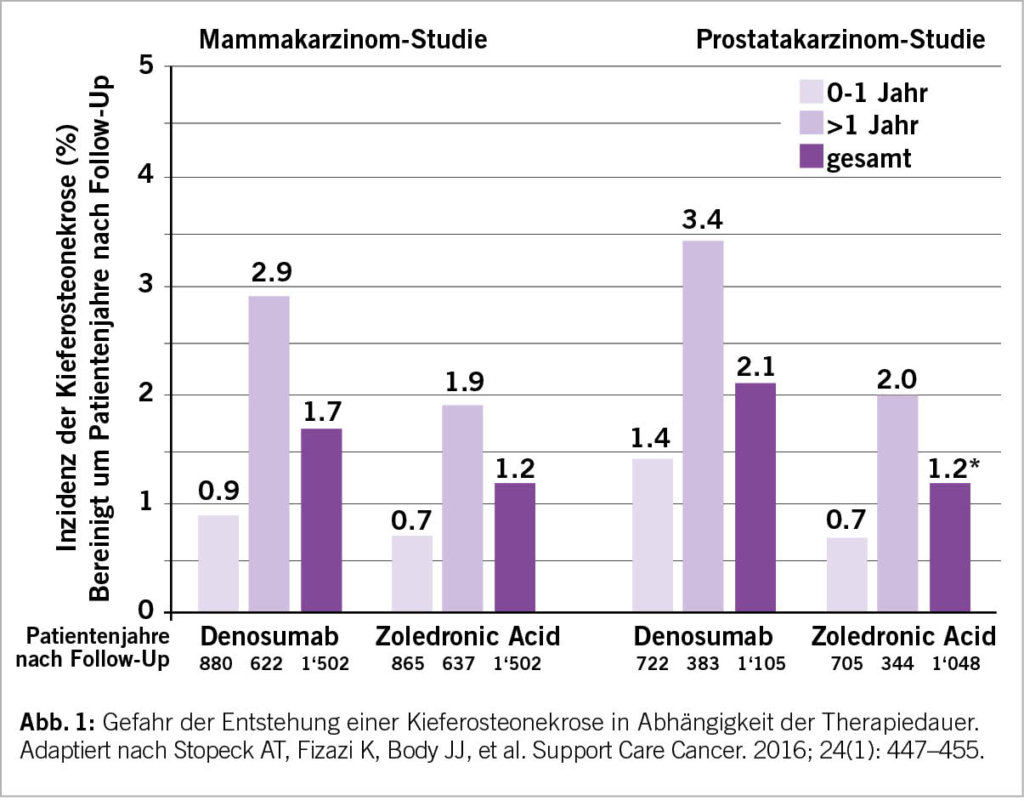
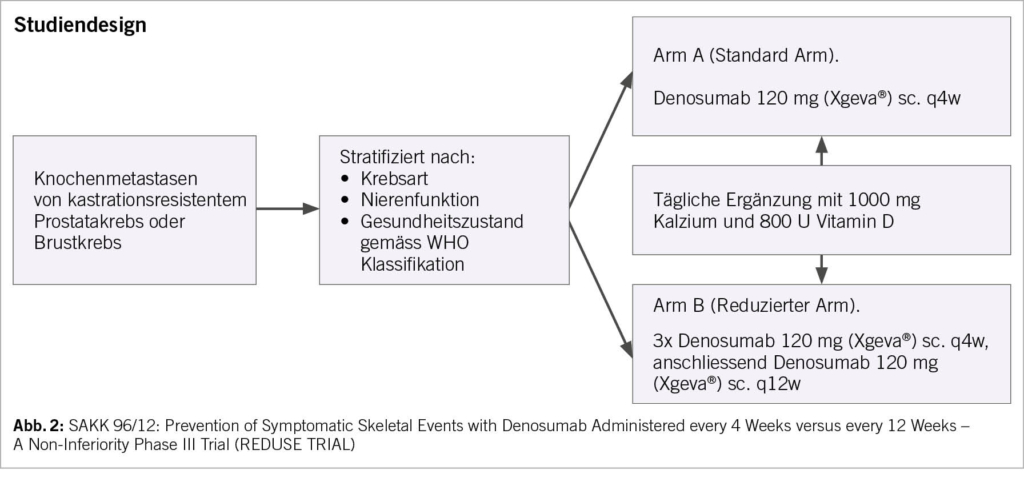
BTAs sind zurzeit ein fester Bestandteil in der Behandlung von Knochenmetastasen bei Patienten mit soliden Tumoren. Wie im Beispiel der Patienten mit mCSPC aufgezeigt, muss deren Einsatz kritisch hinterfragt werden, dies nicht nur aus ökonomischen Gründen, sondern insbesondere auch wegen der Gefahr des Auftretens einer BTA-assoziierten Kieferosteonekrose, deren Inzidenz mit zunehmender Therapiedauer deutlich ansteigt (Abb. 1). In diesem Zusammenhang stellt sich die Frage der Möglichkeit der Verlängerung des Therapie-Intervalls des heutzutage am häufigsten verwendeten BTA Denosumab. Die SAKK 96/12-Studie dürfte diese Frage beantworten, welche Denosumab alle 4 Wochen versus alle 12 Wochen bei Patienten mit Knochenmetastasen von mCRPC oder Brustkrebs vergleicht (Abb. 2). Der Grossteil der geplanten 1380 Patienten konnte zwischenzeitlich für diese Studie rekrutiert werden, sodass wir voraussichtlich im Jahre 2024 auf erste Resultate hoffen dürfen. Im Weiteren ist der Nutzen von BTAs zur Verhinderung skelettaler Ereignisse bei Patienten mit Knochenmetastasen im Zeitalter der Immuntherapien und zielgerichteten Behandlungen ungewiss. Mithilfe des SAKK-Immunregisters (SAKK 80/19 BTA study) werden wir versuchen, einen Beitrag auch zur Beantwortung dieser Frage zu leisten. Erste Daten hierzu sollen demnächst präsentiert werden.
Ausblick
Knochenmetastasen bei soliden Tumoren sind häufig und deren SREs gefürchtet. Ein interdisziplinäres Management dieser Patienten zur Verhinderung solcher skelettaler Ereignisse ist wichtig. Dementsprechend hat das Istituto Oncologico della Svizzera Italiana (IOSI) in Zusammenarbeit mit der Medizinischen Onkologie des Kantonsspital Graubünden ein gemeinsames interkantonales osteo-onkologisches Tumorboard geplant, in welchem Patienten mit Knochenmetastasen interdisziplinär diskutiert werden können. Im Weiteren findet am IOSI auch eine reguläre osteo-onkologische Sprechstunde statt. Wir erhoffen uns, mit diesen Massnahmen den Krankheitsverlauf dieser Patienten günstig beeinflussen zu können. Ob dies gelingt und das Angebot demzufolge weiter ausgebaut werden soll, wird uns die Zukunft weisen.
PD Dr. med. Michael Mark 1,2
Prof. Dr. med. Silke Gillessen 2,3
Dr. med. Benjamin Pedrazzini 3
Prof. Dr. med. Roger von Moos 4
1 Medizinische Onkologie/Hämatologie, Kantonsspital Graubünden, Chur
2 Università della Svizzera Italiana, Lugano
3 Istituto Oncologico della Svizzera Italiana, EOC, Bellinzona
4 Forschungs- und Tumorzentrum, Kantonsspital Graubünden, Chur
– Medizinische Onkologie/Hämatologie, Kantonsspital Graubünden, Chur
– Università della Svizzera Italiana, Lugano
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Saad F, Gleason DM, Murray R et al. Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormonerefractory prostate cancer. J Natl Cancer Inst 2004; 96: 879–882. 201.
2. Fizazi K, Carducci M, Smith M et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011; 377: 813–822.
3. Hernandez RK, Wade SW, Reich A, et al. Incidence of bone metastases in patients with solid tumors: analysis of oncology electronic medical records in the United States. BMC Cancer 2018;18:44.
4. Saad F, et al. Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer
J Natl Cancer Inst 2004;96:879–82.
5. Parker C, Castro E, Fizazi K, Heidenreich A, Ost P, Procopio G, et al.; ESMO Guidelines Committee. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020;31(9):1119–34.
6. Horwich A, Hugosson J, de Reijke T, Wiegel T, Fizazi K, Kataja V, et al.; Panel Members; European Society for Medical Oncology. Prostate cancer: ESMO Consensus Conference Guidelines 2012. Ann Oncol. 2013;24(5):1141–62.
7. Coleman R, et al. Bone health in cancer: ESMO Clinical Practice Guidelines.
8. Hegemann M, Bedke J, Stenzl A, Todenhöfer T. Denosumab treatment in the management of patients with advanced prostate cancer: clinical evidence and experience. Ther Adv Urol. 2017;9(3-4):81–8.
9. James ND, Sydes MR, Clarke NW, Mason MD, Dearnaley DP, Spears MR, et al.; STAMPEDE investigators. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet. 2016;387(10024):1163–77.
10. Smith MR, Halabi S, Ryan CJ, Hussain A, Vogelzang N, Stadler W, et al. Randomized controlled trial of early zoledronic acid in men with castration-sensitive prostate cancer and bone metastases: results of CALGB 90202 (alliance). J Clin Oncol. 2014;32(11):1143–50.
11. Saylor PJ, Rumble RB, Tagawa S, Eastham JA, Finelli A, Reddy PS, et al. Bone Health and Bone-Targeted Therapies for Prostate Cancer: ASCO Endorsement of a Cancer Care Ontario Guideline. J Clin Oncol. 2020;38(15):1736–43.
12. Horwich A, Hugosson J, de Reijke T, Wiegel T, Fizazi K, Kataja V, et al.; Panel Members; European Society for Medical Oncology. Prostate cancer: ESMO Consensus Conference Guidelines 2012. Ann Oncol. 2013;24(5):1141–62.
13. Swissmedic Journal. 12/2011.
14. Swissmedic Journal. 2/2012.
15. Stoffel Sandro T., von Moos Roger, Thürlimann Beat, Cathomas Richard, Gillessen Silke, Zürrer-Härdi Ursina, von Briel Thomas, Anchisi Sandro, Feller Anita, Schär Corinne, Dietrich Daniel, Schwenkglenks Matthias, Lupatsch Judith, Mark Michael. Patterns of care and economic consequences of using bone-targeted agents for castration-sensitive prostate cancer patients with bone metastases to prevent skeletal-related events in Switzerland – the SAKK 95/16 prostate study. Swiss Med Wkly. 2021;151:w20464.
16. Rothermund C, Gillessen S, Cerny T. Zulassung Denosumab (XGEVA). Received by Schnetzer J, 2012 June 17.
17. Documed.ch
info@onco-suisse
- Vol. 13
- Ausgabe 3
- Mai 2023