- Medikamentöse Therapie des metastasierten GIST’s
Die Mehrheit der GIST-Erkrankungen weist eine c-KIT/PDGFR Driver-Mutation auf. Durch Einsatz von Tyrosinkinaseinhibitoren (TKI’s) kommt es zu Entwicklung von sogenannten Sekundärmutationen, die gegenüber den verschiedenen TKI’s ein unterschiedliches Empfindlichkeitsmuster aufweisen. In den letzten Jahren wurden darum Substanzen entwickelt, die ein möglichst breiteres Hemmspektrum aufweisen, in der Hoffnung, so effizienter zu sein. Ob und in welcher Situation diese Annahme korrekt war, erfahren Sie im folgenden Beitrag.
Most of GIST-Tumor harbor a c-KIT /PDGFR-mutation. The development of so-called secondary mutations is the consequence of constant inhibition by Tyrosin-kinase-inhibitors (TKI’s). Their sensitivity to the different TKI’s is well known in the meantime. New TKI’s with a broader sensitivity spectrum were developed during the last few years in the hope that they are more efficient. In the following article you can read If this is true or not.
Keywords: GIST, Tyrosinkinase-Inhibitors, secondary mutations, liquid biopsy
Einleitung
Beim gastrointestinalen Stromatumor (GIST) handelt es sich um eine mesenchymale Neoplasie des Magendarmtraktes. Immunhistochemisch weist sie typischerweise eine Positivität für CD117 (c-KIT) und/oder DOG-1 auf. Die jährliche Inzidenz ist mit ungefähr 10 neuen Fällen pro 1 Million Einwohnern tief. Patient/-innen berichten bei Diagnosestellung klassischerweise über gastrointestinale Blutungen oder über Abdominalbeschwerden. In Anbetracht des zunehmenden Einsatzes von Schnittbildern im Rahmen anderer medizinischer Fragestellungen wird GIST vermehrt aber auch bei asymptomatischen Patient/-innen diagnostiziert. Die pathogenetischen Mechanismen dieser Tumorerkrankung sind heutzutage sehr gut bekannt; 80-95% der Tumore weisen als Driver-Mutation entweder eine c-KIT- oder eine PDGFRA-Veränderung auf. Selten findet man eine SDH-Defizienz (typischerweise bei jungen GIST-Patient/-innen) oder eine BRAF-, RAS- oder NTRAK-Alteration. Diese seltenen GIST-Subtypen unterscheiden sich fundamental bezüglich der medikamentösen Therapie; auf sie wird in diesem Artikel bewusst nicht eingegangen.
Chronologie der medikamentösen GIST-Therapie
In Analogie zu anderen Sarkomerkrankungen wurden bis anfangs 2000 GIST-Patient/-innen mit einer Doxorubicin-haltigen Therapie behandelt; leider aber absolut frustran, weshalb GIST-Tumore heutzutage als primär chemorefraktär gelten. Im Jahre 2001 beschrieb Heikki Joensu erstmalig ein unglaublich gutes Ansprechen einer bis dahin intensiv vorbehandelten Patientin auf die Substanz STI571, welche heutzutage als Imatinib bekannt ist. Damit wurde der Grundstein für die medikamentöse Therapie von GIST gelegt. Imatinib als Tyorosinkinase-Inhibitor (TKI) konnte in zwei grossen Phase III Studien gegenüber Placebo einen klinisch relevanten PFS- und OS-Benefit zeigen und stellt auch heutzutage die Substanz der Wahl in der ersten Linie dar. Im Gegensatz zu den ursprünglichen Studien wird heutzutage aber vor Therapieeinleitung eine c-KIT und PDGFR-Mutationsanalyse empfohlen, da nicht ganz alle c-KIT/PDGFR-Mutationen Imatinib-sensitiv sind. In den folgenden Jahren etablierten sich die TKI’s Sunitinib und Regorafenib als Zweitlinien- bzw. als Drittlinientherapie. Am ESMO 2019 wurde erstmal die Invictus-Studie präsentiert (1). Bei mit Imatinib, Sunitinib und Regorafenib vorbehandelten Patient/-innen konnte Repretinib gegenüber Placebo das PFS wie auch das OS (um 7,5 Monate) nochmals signifikant und klinisch relevant verlängern. Der OS-Gewinn ist umso beeindruckender, wenn man bedenkt, dass 66% der mit Placebo behandelten Patient/-innen anschliessend Repretinib erhielten. Erfreulicherweise ist die Verträglichkeit von Repretinib im Allgemeinen gut; in Analogie zu den anderen bei GIST verwendeten Tyrosinkinase-Inhibitoren berichten die Patient/-innen über gastrointestinale Nebenwirkungen wie Nausea und Diarrhoe und Entwicklung eines Hand-Fuss-Syndroms; wenn auch nur selten höheren Grades. Die am häufigsten beschriebene Nebenwirkung stellt interessanterweise die Alopezie dar. Darauf muss man die Patient/-innen explizit hinweisen, sind sie doch mit dieser Nebenwirkung bis dahin nicht in Kontakt gekommen.
Spezialfälle
Basierend auf den Daten der Meta-GIST Studie sollten GIST-Patient/-innen mit einer Exon 9 Mutation in der ersten Linie nicht mit 400mg/d, sondern mit 800mg Imatinib/d behandelt werden. Liegt eine PDGFRA D842V-Mutation vor, welche in der Vergangenheit mit einer TKI-Resistenz verbunden war, bietet sich heutzutage der Einsatz von Avapritinib an. Diese Substanz zeigte im Navigator-Trial bei 49 von 56 (88%) Patient/-innen mit einer PDGFRA D842V-Mutation ein Ansprechen; das PFS betrug ganze 34 Monate (2). Am häufigsten berichteten die Patienten unter Avapritinib über Nausea, Müdigkeit, periorbitalen Oedemen und Anämie, wie wir es von Imatinib her kennen. Als spezielle Nebenwirkung sind die sogenannten «cognitive effects» zu erwähnen, welche Gedächnisabnahme bis hin zur Entwicklung einer Encephalitis beinhalten. Auf diese Nebenwirkung gilt es im klinischen Alltag gut zu achten und mit einer raschen Dosisreduktion bzw. einer zeitweiligen Medikationspause zu reagieren. Basierend auf diesen überzeugenden Daten wurde Avapritinib unterdessen von der FDA und EMA zur Therapie von GIST-Patient/-innen mit einer PDGFRA D842V-Mutation zugelassen; eine Swissmedic-Zulassung liegt zurzeit noch nicht vor.
Entwicklung einer Imatinibresistenz
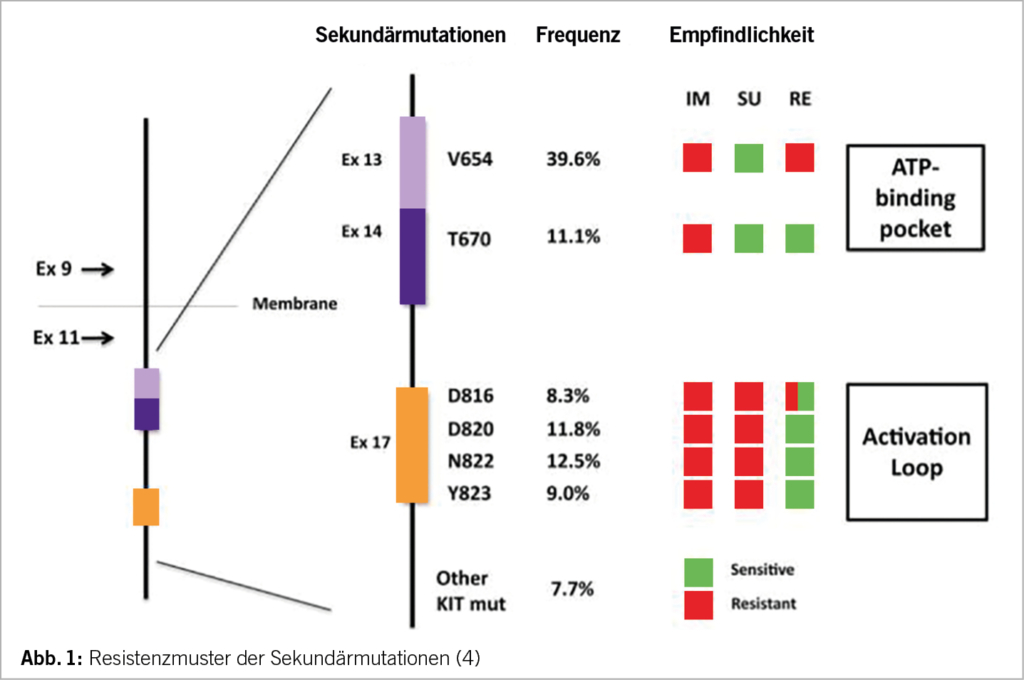
Die Zeit, in der die GIST-Erkrankung unter Imatinib gut kontrolliert ist, ist bemerkenswert lang; bei Patienten mit einer Exon 11 Mutation sind es an die 2 Jahre. Das PFS der darauffolgenden Substanzen wie Sunitinib, Regorafenib und Repretinib ist mit 4-7 Monaten dagegen relativ kurz. Daher kommt der Entwicklung der Imatinib-Resistenz eine klinisch entscheidende Bedeutung zu. Den Mechanismus der Imatinibresistenz verstehen wir heutzutage gut; die im Rahmen der Imatinib-Resistenz entstandenen Mutationen befinden sich nicht einfach irgendwo im c-KIT- oder PDGFRA-Gen, sondern an ganz spezifischen Stellen. Was das c-KIT Gen anbelangt, treten diese sogenannten Sekundärmutationen typischerweise im Exon 13, 14 oder 17, 18 auf (3). Die nach Imatinibversagen verwendeten Substanzen Sunitinb, Regorafenib und Repretinib weisen unterschiedliche Empfindlichkeiten/Resistenzen gegenüber den jeweiligen Sekundärmutationen auf (4) (Tab. 1).
Überwinden der Imatinibresistenz
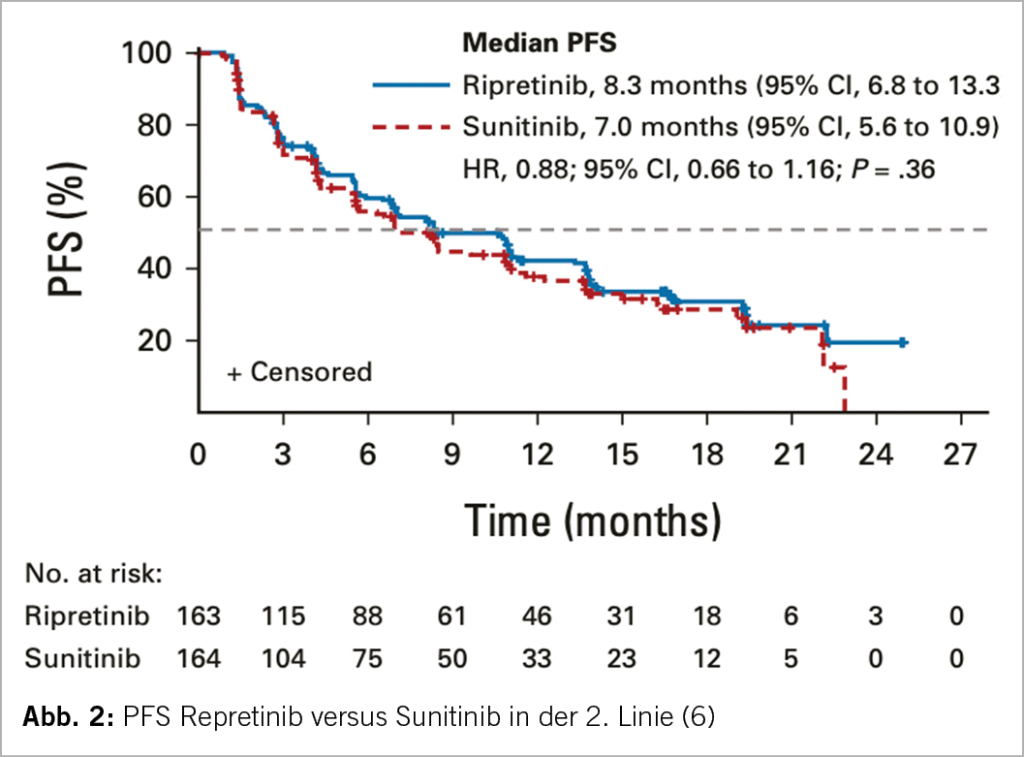
Kommt es unter Imatinib zu einer Progression, so sollte eine Substanz gewählt werden, welche möglichst alle beim Patienten vorliegenden Sekundärmutationen überwindet. Eine Substanz, welche alle bekannten Sekundärmutationen abdeckt, existiert zurzeit aber nicht (Tab. 1). Eine Rebiopsie gefolgt von einer Mutationsanalyse und dem individuellen Einsatz eines TKI’s macht in Anbetracht der Tumorheterogenität wenig Sinn. Naheliegenderweise wurden neuere Substanzen wie Ripretinib und Avapritinib, welche ein breiteres Wirkungsspektrum aufweisen als Sunitinib und Regorafenib, früher eingesetzt. Dieser Ansatz wurde in der Voyage-Studie (Avapritinib versus Regorafenib in der dritten Linie) (5) und in der Intrigue-Studie (Repretinib versus Sunitinib in der zweiten Linie) (6) untersucht. Der primäre Endpunkt, das PFS, fiel aber in beiden Studien überraschenderweise absolut identisch aus. Anhand von Liquid-Biopsy-Resultaten konnte zwar gezeigt werden, dass Repretinib beim Vorliegen einer Exon 11 plus 17/18 Mutation Sunitinib betreffend Ansprechsrate, PFS und OS überlegen ist; Sunitinib hingegen im Falle einer Exon 11 plus 13/14-Mutation (7). Der Prozentsatz der Proben, bei denen sich überhaupt ctDNA mit einer c-KIT-Mutation in der Liquid-Biopsy nachweisen liess, war mit 59% relativ tief, so dass die Durchführung einer Liquid-Biopsy zur Therapiesteuerung im klinischen Alltag im Moment meiner Meinung nach keine Option darstellt.
Möglicher neuer Therapieansatz
Der in den letzten Jahren praktizierte Ansatz, mit einer Substanz möglichst alle Primär- und Sekundärmutationen abdecken zu wollen, ist wahrscheinlich nicht zielführend. Neu wird der gleichzeitige Einsatz von mehreren TKI’s geprüft. Basierend auf einer erfolgreichen Phase I /II Studie scheint die Kombination Sunitinib plus PLX9486 / CGT9486 / Bezuclastinib sehr vielversprechend zu sein (8). Bei Bezuclastinib handelt es sich – im Gegensatz zu den früher verwendeten KIT-Inhibitoren –, um einen sogenannten Typ I KIT-Inhibitor mit einem hervorragenden Verträglichkeitsprofil. In den USA werden zurzeit Patient/-innen für eine Phase III Studie (Peak-Study) rekrutiert, welche die Kombination Bezuclastinib zusammen mit Sunitinib versus Sunitinib mono vergleicht.
Optimale Therapiesequenz heutzutage
Bis die Resultate dieser Peak-Studie vorliegen, sollten die Patienten weiterhin anhand der historisch gewachsenen Therapiesequenz Imatinib gefolgt von Sunitinib, Regorafenib und Repretinib behandelt werden. Im Hinblick auf einen optimalen Therapieerfolg sollte jede Therapielinie möglichst lange ausgereizt werden. Dies beinhaltet, dass in den frühen Linien bei einer singulären Progression lokale Massnahmen wie Chirurgie oder Radiofrequenzablation an einem interdisziplinären Tumorboard als Therapieoption ausgelotet werden. Im Weiteren ist ein optimales Toxizitätsmanagment absolut essentiell. Dafür müssen gegebenenfalls auch Dosis-Reduktionen durchgeführt werden. Zu guter Letzt kann – sofern keine klinische Studie zur Verfügung steht – auch ein Re-Challenge einer sehr effektiven Therapielinie nochmals erwogen werden (9), wobei diese Option sich meiner Meinung nach nicht nur auf Imatinib bezieht, sondern auf den TKI’, welche bei der individuellen Patientin/dem individuellen Patienten am besten gewirkt hat.
Copyright bei Aerzteverlag medinfo AG
Co-Leiter Onko-Zentrum
Zuger Kantonsspital
Landhausstrasse 11
6340 Baar
donat.duerr@zgks.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. J.Y Blay et al, Lancet Oncology 2020: 21; 923-34
2. M. Heinrich et al, Lancet Oncology 2020: 21; 935-46
3. M. Heinrich et al, JCO 2006: 24; 4764-4774
4. C. Serrano et al, BJC 2019: 120; 612-620
5. Y. Kang et al, JCO 2021: 39; 3128-39
6. S. Bauer et al JCO 2022: 40; 3918-28
7. S. Bauer et al, JCO 23: 41; Abstract 397784
8. A. Wagner et al, JAMA Oncol 2021: 7; 1343-1350
9. Y. Kang et al, Lancet Oncol 2013 :14 ; 1175-1182
info@onco-suisse
- Vol. 13
- Ausgabe 6
- September 2023