- Micro-RNA als Tumormarker beim Hodenkrebs: Ready for prime time?
Keimzelltumoren des Hodens sind die häufigsten malignen Tumoren junger Männer. Klassische Tumormarker wie AFP, β-HCG und LDH sind nur bei etwa 50 % der Patienten erhöht. Zirkulierende MicroRNAs, insbesondere miR-371a-3p, haben sich in den letzten Jahren als vielversprechende neue Biomarker etabliert. Sie eignen sich für Primärdiagnostik, Therapiemonitoring, Beurteilung postchemotherapeutischer Residualtumoren und die frühzeitige Rezidiverkennung. Erste prospektive Studien bestätigen einen klinischen Nutzen von miR-371a-3p. Die Integration in Leitlinien erfordert jedoch weitere Standardisierung und Validierung.
Testicular germ cell tumors are the most common malignancies in young men. Conventional tumor markers such as AFP, β-HCG, and LDH are elevated in only about 50% of patients. Circulating microRNAs, particularly miR-371a-3p, have recently emerged as promising new biomarkers. They show strong potential in primary diagnosis, therapy monitoring, evaluation of post-chemotherapy residual tumors, and early relapse detection. First prospective studies confirm the clinical utility of miR-371a-3p. Broader guideline integration, however, requires further standardization and validation.
Keywords: MicroRNA-371a-3p, Testicular germ cell tumor, Biomarker, RPLND, Active surveillance
Einleitung
Keimzelltumoren des Hodens sind die häufigsten malignen Tumoren junger Männer. Die bisherigen Standard-Tumormarker (α-Fetoprotein (AFP), humanes Choriongonadotropin (β-HCG), Laktatdehydrogenase (LDH)) sind bei Diagnosestellung nur bei etwa 50 % der Patienten erhöht (1). Zirkulierende Mikro-RNAs, insbesondere miR-371a-3p, haben sich in den letzten Jahren als vielversprechende neue Biomarker etabliert, da sie mit Ausnahme von reinen Teratomen eine hohe Sensitivität und Spezifität bei der Detektion makroskopischer Keimzelltumoren aufweisen (2).
Was sind microRNAs?
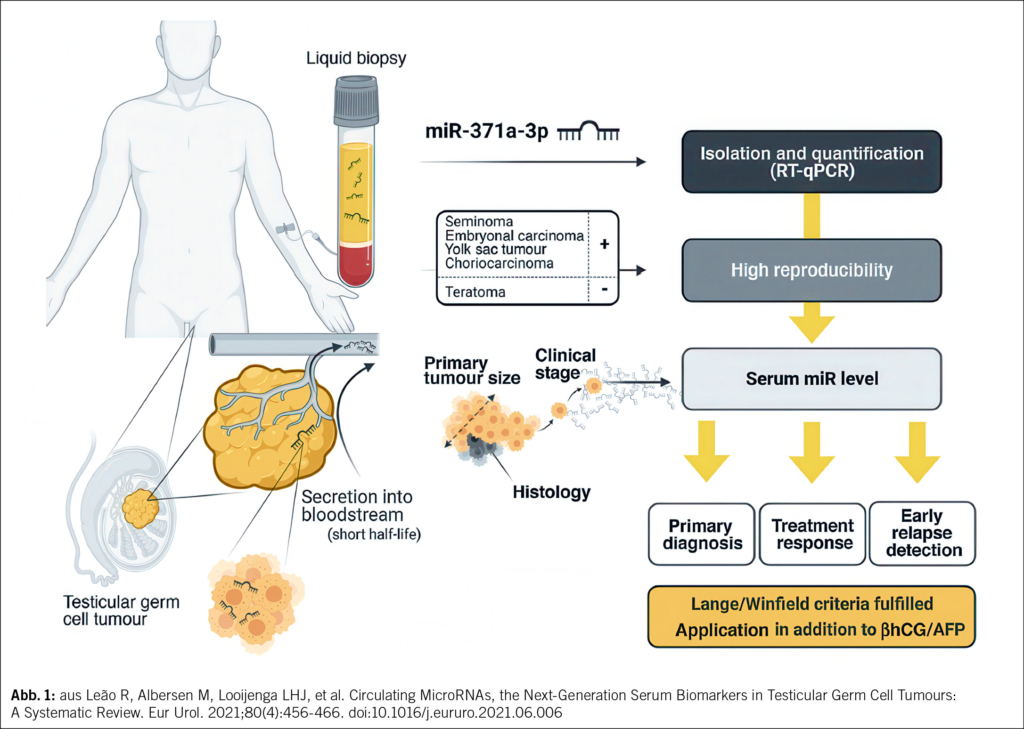
Die Entdeckung der embryonalen MicroRNAs des 371–373-Clusters stellt einen bedeutenden Fortschritt in der Entwicklung neuer Biomarker für Keimzelltumoren dar. Seit der ersten Beschreibung im Jahr 2006 konnte in zahlreichen klinischen Studien gezeigt werden, dass insbesondere miR-371a-3p derzeit der vielversprechendste Biomarker für Hodentumoren ist, sowohl in Gewebeproben als auch in Blutproben (3) (Abb. 1).
MicroRNAs sind kurze, nicht-kodierende RNA-Moleküle, welche die Genexpression auf epigenetischer Ebene regulieren, ohne die DNA-Sequenz zu verändern. Gerade bei Keimzelltumoren, die nur wenige genetische Veränderungen aufweisen und bei denen epigenetische Mechanismen in der Keimzellentwicklung und Embryogenese eine zentrale Rolle spielen, gewinnen epigenetische Biomarker zunehmend an Bedeutung (4).
Besonders attraktiv sind MicroRNAs als Tumormarker aufgrund ihrer hohen Stabilität im Blut, ihrer kurzen Halbwertszeit (31/2 bis 7 Stunden) und der Möglichkeit, sie mit weit verbreiteten, kostengünstigen und schnellen Methoden wie PCR-basierten Techniken nachzuweisen. Dies erlaubt eine zeitnahe Diagnostik und Verlaufskontrolle, ohne dass aufwendige oder teure Spezialanalysen erforderlich werden (5).
Potenzielle Einsatzgebiete
Die potenziellen Einsatzgebiete von zirkulierendem miR-371a-3p bei Keimzelltumoren sind vielfältig und umfassen sowohl diagnostische als auch therapeutische Entscheidungssituationen. In der Primärdiagnostik könnte der Marker einen entscheidenden Vorteil bringen. In Situationen, in denen sonographisch ein kleiner intratestikulärer Tumor entdeckt wird und die klassischen Tumormarker negativ sind, ist es oft unklar, ob es sich um eine maligne oder benigne Veränderung handelt. MiR-371a-3p kann hier mit einer hohen Sensitivität und Spezifität von > 90 % zur Differenzierung beitragen und so die Indikationsstellung zur Orchiektomie präzisieren (6, 7).
Ein weiteres wichtiges Einsatzfeld ist das Therapiemonitoring. Während der systemischen Chemotherapie spiegeln die miR-371a-3p-Konzentrationen die Tumorlast oft genauer und schneller wider als klassische Marker. Rasche Veränderungen im Spiegel können ein Ansprechen oder ein Ausbleiben des Therapieerfolgs anzeigen und somit eine frühzeitige Anpassung der Behandlung ermöglichen (6).
Auch bei der Beurteilung postchemotherapeutischer Residualtumoren bietet miR-371a-3p relevante Informationen. Nach abgeschlossener Chemotherapie bleibt häufig ein Resttumor im Retroperitoneum oder in anderen Lokalisationen zurück. Die Differenzierung zwischen vitalem Tumor, Teratom und Nekrose ist für das weitere Vorgehen entscheidend. Da miR-371a-3p vor allem vitale Keimzelltumorkomponenten anzeigt, könnte der Marker helfen, unnötige Resektionen zu vermeiden oder Operationen gezielter zu planen (8). Der Nachweis von Teratomen bleibt jedoch eine Limitation, da dieser Subtyp miR-371a-3p-negativ ist.
In der Nachsorgephase schliesslich eröffnet miR-371a-3p die Möglichkeit, Rezidive früher als mit herkömmlichen Verfahren zu erkennen. Aktuelle Daten deuten darauf hin, dass der Marker oft Wochen bis Monate vor bildgebenden Befunden oder klinischen Symptomen ansteigt (9). Dies könnte zu einer deutlichen Reduktion der Strahlenbelastung durch CT-Untersuchungen führen, da Intervalle der Bildgebung verlängert oder Untersuchungen gezielter eingesetzt werden können. Gleichzeitig besteht das Potenzial, die psychologische Belastung der Patienten zu reduzieren, indem unnötige diagnostische Massnahmen vermieden werden.
Wo stehen wir in der Schweiz?
In der Schweiz wird der Einsatz von microRNA-371 während der Nachsorge im Rahmen einer prospektiven, multizentrischen Studie (NCT02229916 (microRNA-TARGET)) untersucht. Beteiligt sind aktuell 11 Schweizer Zentren, die gemeinsam Patienten mit lokalisiertem Hodenkrebs im Stadium I nach Orchiektomie unter aktiver Überwachung rekrutieren. Neben den etablierten Tumormarkern AFP, β-HCG und LDH wird bei jedem Nachsorgetermin ein CE-zertifizierter qRT-PCR-Test auf microRNA-371 durchgeführt. Bei zwei konsekutiv erhöhten und steigenden Werten erfolgt eine gezielte bildgebende Abklärung. Erste Zwischenergebnisse bestätigen eine frühere Rezidiverkennung und eine höhere Sensitivität, Spezifität sowie positiven und negativen Vorhersagewert gegenüber den klassischen Markern. Anfang 2026 ist die Publikation der ersten Studienergebnisse geplant. Zudem kann microRNA-371 auch für die anderen oben genannten Einsatzgebiete verwendet werden. Ausserhalb von Studien müssen die Kosten aktuell jedoch vom Patienten getragen werden, da die Krankenkassen diesen Test bisher noch nicht übernehmen.
Was verspricht die Zukunft
Die Entwicklung und klinische Validierung von miR-371a-3p stehen aktuell an einem entscheidenden Punkt. Mehrere grosse, prospektive Multicenter-Studien (NCT02229916, NCT04435756, NCT04914026) untersuchen derzeit die optimale Einbindung des Markers in bestehende diagnostische und therapeutische Abläufe. Ziel ist es, robuste Daten zu generieren, die den Weg in die internationalen Leitlinien ebnen und eine flächendeckende Implementierung ermöglichen. Eine zentrale Herausforderung bleibt die Standardisierung der Testmethoden. Unterschiedliche Präanalytik- und Analyseschritte können die Vergleichbarkeit der Ergebnisse einschränken, weshalb harmonisierte Protokolle unabdingbar sind.
Ein weiterer Schwerpunkt liegt auf der Definition klinisch relevanter Cut-offs und Testintervalle. Um den Marker zuverlässig einsetzen zu können, muss klar definiert sein, bei welchen Werten Handlungsbedarf besteht und in welchem zeitlichen Abstand Messungen sinnvoll sind. Dies betrifft nicht nur die Nachsorge, sondern auch die Primärdiagnostik und das Therapiemonitoring.
Langfristig könnte miR-371a-3p zu einem Schlüsselelement einer stärker personalisierten Medizin werden. Denkbar ist beispielsweise eine risikoadaptierte Nachsorge, bei der Patienten mit persistierend negativen miR-371a-3p-Werten seltener bildgebend untersucht werden, während bei positiven Befunden eine intensivere Diagnostik und Therapieeinleitung erfolgen. Im Falle der Chemotherapie nach Orchiektomie wäre ebenfalls ein personalisierter Ansatz möglich, bei welchem die Anzahl der Chemotherapie-Zyklen bei gutem Ansprechen mit raschem Abfall der miR-371a-3p-Werte reduziert werden könnte.
Nach abgeschlossener Chemotherapie könnte miR-371a-3p ebenfalls helfen, optimale Kandidaten für eine retroperitoneale Lymphadenektomie (RPLND) zu definieren. Da miR-371a-3p vor allem vitale Keimzelltumorkomponenten anzeigt und das Rezidivrisiko bei vitalem Tumor (> 10%) signifikant erhöht ist, könnten Patienten mit positivem miR-371a-3p gezielt für eine radikale RPLND mit bilateralem Full-Template ohne Nerven- und Lumbalgefässschonung selektioniert werden, um die häufigen Rezidive zu minimieren. miR-371a-3p-negativen Patienten könnte hingegen eine nervenschonende Resektion mit oder ohne unilaterale Resektion angeboten werden (10).
Auch die primäre RPLND etabliert sich zunehmend als Alternative bei Keimzelltumoren im Stadium II. Ein wesentlicher Vorteil liegt im Verzicht auf die potenziellen Langzeitnebenwirkungen einer Chemotherapie oder Strahlentherapie. Mit Hilfe von miR-371a-3p eröffnet sich zudem die Möglichkeit, selbst kleinvolumige retroperitoneale Tumormanifestationen zuverlässig zu identifizieren, was die Indikationsstellung stützt, um die pN0-Rate und somit eine Übertherapie zu minimieren (11, 12).
Dadurch liessen sich nicht nur Chemotherapien, Strahlenexposition und Kosten reduzieren, sondern auch die Patientenselektion für chirurgische Eingriffe präziser gestalten.
Insgesamt verspricht die Zukunft der microRNA-basierten Diagnostik beim Hodenkrebs eine deutliche Verbesserung der Patientenversorgung. Die Schweiz nimmt hierbei durch die eigene microRNA-TARGET-Studie eine zentrale Rolle ein. Wenn es gelingt, die verbleibenden methodischen und klinischen Fragen zu beantworten, könnte miR-371a-3p in naher Zukunft vom Forschungsinstrument zu einem festen Bestandteil der Routineversorgung werden und damit die Diagnostik und Nachsorge von Keimzelltumoren nachhaltig verändern.
Copyright
Aerzteverlag medinfo AG
Klinik für Urologie
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
Klinik für Onkologie/Hämatologie
Kantonsspital Graubünden
Loëstrasse 170
7000 Chur
richard.cathomas@ksgr.ch
Kantonsspital Luzern
Klinik für Urologie
Spitalstrasse
6000 Luzern
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Fischer S, Rothermundt C, Stalder O, Terbuch A, Hermanns T, Zihler D, et al. (2023) The Value of Tumour Markers in the Detection of Relapse-Lessons Learned from the Swiss Austrian German Testicular Cancer Cohort Study. Eur Urol Open Sci; 50:57-60.
2. Piao J, Lafin JT, Scarpini CG, Nuño MM, Syring I, Dieckmann KP, et al. (2021) A Multi-institutional Pooled Analysis Demonstrates That Circulating miR-371a-3p Alone is Sufficient for Testicular Malignant Germ Cell Tumor Diagnosis. Clinical genitourinary cancer; 19:469-79.
3. Leão R, Albersen M, Looijenga LHJ, Tandstad T, Kollmannsberger C, Murray MJ, et al. (2021) Circulating MicroRNAs, the Next-Generation Serum Biomarkers in Testicular Germ Cell Tumours: A Systematic Review. European urology; 80:456-66.
4. Costa AL, Lobo J, Jerónimo C, Henrique R (2017) The epigenetics of testicular germ cell tumors: looking for novel disease biomarkers. Epigenomics; 9:155-69.
5. Almstrup K, Lobo J, Mørup N, Belge G, Rajpert-De Meyts E, Looijenga LHJ, et al. (2020) Application of miRNAs in the diagnosis and monitoring of testicular germ cell tumours. Nat Rev Urol; 17:201-13.
6. Dieckmann KP, Radtke A, Geczi L, Matthies C, Anheuser P, Eckardt U, et al. (2019) Serum Levels of MicroRNA-371a-3p (M371 Test) as a New Biomarker of Testicular Germ Cell Tumors: Results of a Prospective Multicentric Study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology; 37:1412-23.
7. Nazzani S, Busico A, Bernasconi V, Bruniera M, Gianninò M, Rusconi D, et al. (2025) Clinical evaluation of the role of miRNA 371 in small testicular masses. Results of the „S1STeM 371“ Trial. European journal of cancer (Oxford, England : 1990); 223:115494.
8. Leão R, van Agthoven T, Figueiredo A, Jewett MAS, Fadaak K, Sweet J, et al. (2018) Serum miRNA Predicts Viable Disease after Chemotherapy in Patients with Testicular Nonseminoma Germ Cell Tumor. The Journal of urology; 200:126-35.
9. Fankhauser CD, Christiansen AJ, Rothermundt C, Cathomas R, Wettstein MS, Grossmann NC, et al. (2021) Detection of recurrences using serum miR-371a-3p during active surveillance in men with stage I testicular germ cell tumours. British journal of cancer;
10. Antonelli L, Ardizzone D, Tachibana I, Adra N, Cary C, Hugar L, et al. (2023) Risk Factors for Relapse in Nonseminomatous Testicular Cancer After Postchemotherapy Retroperitoneal Lymph Node Dissection With Viable Residual Cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology; 41:5296-305.
11. Antonelli L, Heidenreich A, Bagrodia A, Amini A, Baky F, Branger N, et al. (2025) Primary retroperitoneal lymph node dissection in clinical stage 2a/b non-seminomatous germ cell tumour. BJU international; 135:621-8.
12. Sigg S, Rothermundt C, Fankhauser CD (2025) Surgical management of testicular cancer with limited retroperitoneal disease. Current opinion in urology; 35:178-88.
info@onco-suisse
- Vol. 15
- Ausgabe 6
- Dezember 2025