- Neue Erkenntnisse zum metastasierten, nicht-hellzelligen Nierenzellkarzinom
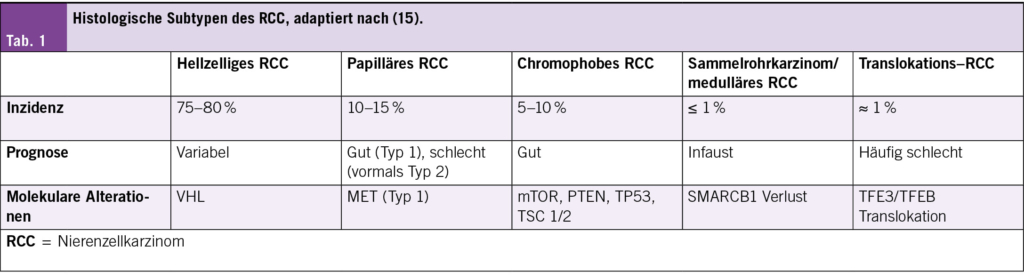
Die nicht-hellzelligen Nierenzellkarzinome (nccRCC) machen ca. 20 % der Nierenzellkarzinome aus, der häufigste Subtyp der nccRCC ist das papilläre Nierenzellkarzinom. Aufgrund der Seltenheit der einzelnen Entitäten werden die nccRCC häufig in Basket-Studien zusammengefasst mit jeweils kleinen Patientenzahlen für die jeweiligen histologischen Subtypen. Die Systemtherapie beim metastasierten nccRCC umfasst die TKI-Monotherapie, die Immuntherapie und die Kombination TKI/Immuntherapie sowie beim Sammelrohrkarzinom auch die Platin-basierte Chemotherapie.
Non-clear-cell renal cell carcinomas (nccRCC) account for approx. 20 % of renal cell carcinomas, the most prevalent subtype of nccRCC is the papillary RCC. Given the rarity of the individual entities, nccRCCs are often pooled together in basket trials with small numbers of patients with each histological subtype. Systemic therapy options for metastatic nccRCC include TKI monotherapy, immunotherapy and the combination of TKI/immunotherapy as well as platinum-based chemotherapy for metastatic collecting duct RCC.
Keywords: nicht-hellzelliges RCC, papilläres RCC, chromophobes RCC, Systemtherapie
Einleitung
80 % der malignen Nierentumore werden histologisch dem hellzelligen Nierenzellkarzinom (ccRCC) zugeordnet, die übrigen 20 % den sogenannten nicht-hellzelligen Nierenzellkarzinomen (nccRCC). Der Begriff des nicht-hellzelligen Nierenzellkarzinoms umschreibt eine heterogene Tumorentität und umfasst verschiedene Subtypen mit spezifischen molekularen oder histologischen Charakteristika. Die häufigsten Subtypen des nccRCC sind das papilläre Nierenzellkarzinom (ca 10–15 % aller RCC), das chromophobe Nierenzellkarzinom (ca 5–10 % aller RCC), das Sammelrohr-Karzinom inkl. dem medullären Nierenzellkarzinom sowie das Translokationskarzinom (1). Aufgrund der relativen Seltenheit der einzelnen Entitäten sind prospektive, randomisierte Studien schwierig durchzuführen und häufig werden die nccRCC in Basket-Studien zusammengefasst. In diesem Artikel konzentrieren wir uns auf die neueren Studienresultate der Tyrosinkinase-Inhibitoren sowie den Immuntherapie-basierten Kombinationen beim metastasierten nccRCC.
Papilläres Nierenzellkarzinom
Lange wurde das papilläre Nierenzellkarzinom (pRCC) in das papilläre Nierenzellkarzinom Typ 1 und Typ 2 unterteilt. Molekularpathologisch scheinen Typ 1 und Typ 2 pRCC verschiedene Entitäten mit spezifischen genetischen Alterationen (und prognostischen Implikationen) zu sein: Typ 1 pRCC ist assoziiert mit MET-Alterationen, während das Typ 2 pRCC durch CDKN2A Silencing, SETD2 Mutationen, TFE3 Fusionen und Mutationen im Fumarat-Hydratase-Gen charakterisiert ist und somit in der aktuellen WHO-Klassifikation 2022 teilweise eigene, molekular definierte Nierenzellkarzinomtypen darstellen (1) (Tab. 1).
Tyrosinkinase-Inhibitoren als Monotherapie
Die zwei Phase 2 Studien ESPN und ASPEN untersuchten den Tyrosinkinase-Inhibitor (TKI) Sunitinib vs. den mTOR-Hemmer Everolimus im nccRCC, in beiden Studien waren mehrheitlich papilläre Nierenzellkarzinome eingeschlossen. Sunitinib konnte einen Benefit im Progressionsfreien-Überleben (PFS) und in den Ansprechsraten (ORR), jedoch keinen Überlebensbenefit (OS) zeigen (2, 3).
Mit der Entdeckung der Aktivierung des cMET-Signalwegs im papillären Nierenzellkarzinom wurde die biologische Rationale für den Einsatz der MET-Inhibition als effektive Behandlungsoption gelegt:
Savolitinib und Cabozantinib, beides TKIs mit Inhibition des cMET-Signalwegs, wurden in der vorzeitig geschlossenen Phase 3 Studie SAVOIR respektive in der vollständig rekrutierten und publizierten Phase 2 Studie PAPMET gegen Sunitinib beim papillären Nierenzellkarzinom verglichen: In der vierarmigen PAPMET Studie mit Patienten mit 0–1 Vortherapien wurden die Arme mit Crizotinib und Savolitinib wegen Unwirksamkeit vorzeitig geschlossen. Cabozantinib konnte gegen Sunitinib eine signifikante Verbesserung des medianen PFS (9.0 Monate, 95 % CI 6–12 vs. 5.6 Monate, 95 % CI 3–7; Hazard Ratio für Progression oder Tod 0.60, 95 % CI 0.37–0.97, one-sided p = 0.019) sowie der ORR (23 % vs. 4 %, two-sided p = 0.010) erreichen. Es konnte jedoch keine statistisch signifikante Verbesserung des Overall Survival von Cabozantinib gegenüber Sunitinib dargestellt werden. Anders als in der SAVOIR-Studie waren die Patienten in der PAPMET-Studie nicht molekular selektioniert, es war kein Nachweis einer MET-Alteration (u.a. Chromosom 7 Gewinn, MET-Amplifikation oder MET-Kinase Mutation) für den Studieneinschluss notwendig (4).
Immuntherapie-basierte Optionen
Immuntherapie mono
Die Kohorte B der einarmigen Phase 2 Studie KEYNOTE-427 untersuchte in nccRCC die palliative Erstlinientherapie mit Pembrolizumab. Der primäre Endpunkt ORR betrug in den 118 Patienten mit pRCC 28.8 %. Das mediane PFS war 5.5 Monate (95 % CI, 3.9–6.9) und das mediane OS 31.5 Monate (95 % CI, 25.5– nicht erreicht) (5).
Kombinierte Immuntherapie
2022 wurde die Kohorte 2 der Checkmate-920, eine nicht randomisierte Phase 3b/4 Studie, publiziert, der Anteil der pRCC betrug 34.6 %. Mit der palliativen Erstlinientherapie mit Ipilimumab/Nivolumab wurde in den nccRCC ein Ansprechen in 9 von 46 Patienten (ORR 19.6 % (95 % CI 9.4–33.9)) erreicht, darunter in 5 von 18 Patienten mit papillärem RCC. Das mediane PFS für alle behandelten Patienten war nur 3.7 Monate (95 % CI 2.7–4.6), das mediane OS betrug 21.2 Monate (95 % CI 16.6–NE) (6).
Am ESMO 2024 wurden die Resultate der SUNNIFORECAST Studie präsentiert, eine prospektive, randomisierte Phase 2 Studie, die den Einsatz der kombinierten Immuntherapie mit Ipilimumab/Nivolumab vs. Standard of Care (SOC) beim nccRCC verglich. Die Randomisierung war nach Histologie (pRCC vs. non-papilläres nccRCC) stratifiziert. Der Standard of Care umfasste mehrheitlich eine TKI-Monotherapie (78 % Sunitinib, 7 % Cabozantinib), 11 % erhielten eine TKI/Immuntherapie-Kombination. Der primäre Endpunkt der Studie war das Gesamtüberleben nach 12 Monaten, sekundäre Endpunkte umfassten unter anderem PFS und ORR. 62 % der eingeschlossenen Patienten hatten ein pRCC.
Ipilimumab/Nivolumab zeigte einen signifikanten Benefit gegenüber SOC beim 12-Monats-OS: 78 % in der Ipilimumab/Nivolumab Kohorte (95 % CI 71–84 %) vs. 68 % in der SOC (95 % CI 60–75 %, p = 0.026). In der Subgruppenanalyse schienen vor allem Patienten mit einem CPS ≥ 1 von der kombinierten Immuntherapie zu profitieren.
In der Subgruppenanalyse der pRCC zeigte sich ein medianes OS von 28.4 (18.4–40.9) Monate im Ipilimumab/Nivolumab Arm versus 18.9 (14.4.–32.8) Monate im SOC Arm (HR 0.84 (0.59–1.21)) und eine 12-Monats-OS Rate von 74.6 % (64.7 %–82.0 %) vs. 64.1 % (53.0 %–73.3 %). Die ORR bei den auswertbaren Patienten mit pRCC betrug 29 % im Immuntherapie Arm vs. 21 % im SOC Arm (7).
Immuntherapie/TKI-Kombinationen
Die Kombination eines PD-1 Inhibitors mit einem TKI ist eine Standardtherapieoption im metastasierten hellzelligen Nierenzellkarzinom und der Benefit gegenüber der Sunitinib Monotherapie ist in mehreren grossen, randomisierten Phase 3 Studien belegt. Im Gegensatz dazu ist die Kombination Immuntherapie/TKI beim nccRCC erst in kleineren Phase 1b/2 Studien untersucht.
In der COSMIC-021 (Atezolizumab/Cabozantinib, n = 32 in der nccRCC Kohorte), in der CA209-9KU (Nivolumab/Cabozantinib, n = 40) sowie in der Keynote-B61 (Pembrolizumab/Lenvatinib, n = 158) Studie wurden verschiedene histologische Subtypen des nccRCC eingeschlossen, das pRCC war in allen genannten Studien die häufigste Histologie. Der primäre Endpunkt aller Studien war die ORR. Für das papilläre Nierenzellkarzinom zeigt sich mit den verschiedenen Kombinationen Immuntherapie/TKI eine ORR von ca. 50 % (8–10).
In der einarmigen Phase 2 Studie CALYPSO wurden 41 Patienten mit ausschliesslich pRCC eingeschlossen, 34 % der Patienten hatten eine MET-Alteration. Die Kombination Savolitinib/Durvalumab erreichte ihren primären Endpunkt nicht, die ORR Rate lag bei 29 %. In der Subgruppe der MET-alterierten pRCC zeigte sich jedoch eine ORR von 53 %. Auch das mPFS und das mOS waren in der MET-alterierten Subgruppe fast verdoppelt im Vergleich zu den molekular unselektionierten pRCC (11).
Chromophobes Nierenzellkarzinom (ChrRCC)
Das chromophobe Nierenzellkarzinom geht prinzipiell mit einer guten Prognose einher. Beim chromophoben Nierenzellkarzinom können genetische Alterationen auftreten, die unter anderem zu einer Aktivierung des mTOR Signalweges führen. Der Einsatz von mTOR-Inhibitoren kann somit eine wirksame Therapieoption sein (Tab. 1).
TKI/mTOR-Inhibitor Monotherapie und Kombination mit VEGF-TKI
In den ASPEN Studie waren ebenfalls Patienten mit chrRCC (15 % der Patienten) eingeschlossen. Bei den Patienten mit chrRCC zeigte sich eine verbesserte ORR für Everolimus vs. Sunitinib (33 % vs. 10 %), ebenfalls war das mPFS mit Everolimus deutlich verlängert im Vergleich zu Sunitinib (2).
Auch die Kombination des VEGF-TKIs Lenvatinib mit dem mTOR-Inhibitor Everolimus wurde in einer einarmigen Phase 2 Studie bei unbehandelten nccRCC getestet, 9 Patienten hatten ein chrRCC. Die ORR betrug bei den chrRCC 44 % (12).
Immuntherapie-basierte Optionen
Die Pembrolizumab Monotherapie zeigte in der Keynote-427 bei den 21 Patienten mit einem chrRCC nur eine ORR von 9.5 % (5).
Kombinierte Immuntherapie
In der SUNNIFORECAST waren 59 Patienten ( = 20 %) mit einem chrRCC eingeschlossen, die ORR betrug für Ipilimumab/Nivolumab 27 % vs. 10 % für den SOC Arm. Im Gegensatz dazu konnte in der Checkmate-920 bei keinem der 7 Patienten mit chrRCC ein Ansprechen auf die kombinierte Immuntherapie nachgewiesen werden (6, 7).
Immuntherapie/TKI-Kombinationen
Auch für die Kombination Immuntherapie/TKI existieren widersprüchliche Daten für das chrRCC. Während in der Keynote-B61 bei den 29 Patienten mit chrRCC eine ORR von 28 % mit Lenvatinib/Pembrolizumab nachgewiesen werden konnte, zeigte sich bei den 7 Patienten mit chrRCC mit der Kombination Cabozantinib/Nivolumab kein Ansprechen. 11 % (1 von 9) der Patienten mit chrRCC zeigten ein Ansprechen in der COSMIC 021 (8–10).
Die nicht-papillären, nicht-chromophoben nccRCC
Das Sammelrohr-Karzinom inkl. dem medullären Nierenzellkarzinom sind sehr seltene und aggressive Karzinome, die klassischerweise mit platin-basierter Chemotherapie behandelt werden. Für das unbehandelte Sammelrohrkarzinom konnte in einer Phase 2 Studie mit 23 Patienten eine Ansprechsrate von 35 % mit Cabozantinib und ein medianes PFS von 4 Monaten (95 % CI, 3–13 Monate) sowie ein medianes OS von 7 Monaten (95 % CI, 3–31 Monate) erreicht werden. Cabozantinib ist somit eine Therapieoption bei diesem sehr seltenen Karzinom (13).
Das Krankheitsbild der hereditären Leiomyomatose mit Nierenzellkarzinom (HLRCC) ist durch eine Keimbahnmutation im Fumarat-Hydratase-Gen charakterisiert. Die Nierenzellkarzinome mit Fumarat-Hydratase-Mutation zeigen eine erhöhte ORR (72 %), ein verlängertes mPFS sowie verlängertes mOS auf eine Behandlung mit Erlotinib/Bevacizumab im Vergleich zum sporadischen pRCC und stellt somit eine wichtige Therapieoption bei dieser seltenen Entität ohne Standardtherapie dar (14).
Die Translokationskarzinome sind gekennzeichnet durch Fusionen im TFE3 Gen, was zu einer Aktivierung des Microphthalmia-assoziierten Transkriptionsfaktors (MITF) führt. In den drei TKI/Immuntherapie-Kombinationsstudien COSMIC-021, CA209-9KU und Keynote-B61 waren auch Translokationskarzinome eingeschlossen, die meisten Patienten (n = 6) waren in der Keynote-B61 inkludiert. Die ORR für Pembrolizumab/Lenvatinib betrug 67 % (8–10).
Copyright
Aerzteverlag medinfo AG
Oberärztin meV Medizinische Onkologie und Hämatologie
Kantonsspital Winterthur
Brauerstrasse 15
8401 Winterthur
Die Autorin hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Die exakte histologische Diagnose (ccRCC vs. verschiedene Entitäten des nccRCC) hat eine grosse prognostische und therapeutische Implikation, die histopathologische Sicherung einer Nierenläsion oder Metastase ist dringend empfohlen zur Therapiefestlegung.
- Das häufigste nccRCC ist das papilläre Nierenzellkarzinom, die Unterscheidung zwischen Typ 1 und Typ 2 wurde in der aktuellen WHO-Klassifikation aufgegeben. Ein Teil der pRCC zeichnet sich durch MET-Alterationen und Ansprechen auf eine Savolitinib-basierte Therapie aus.
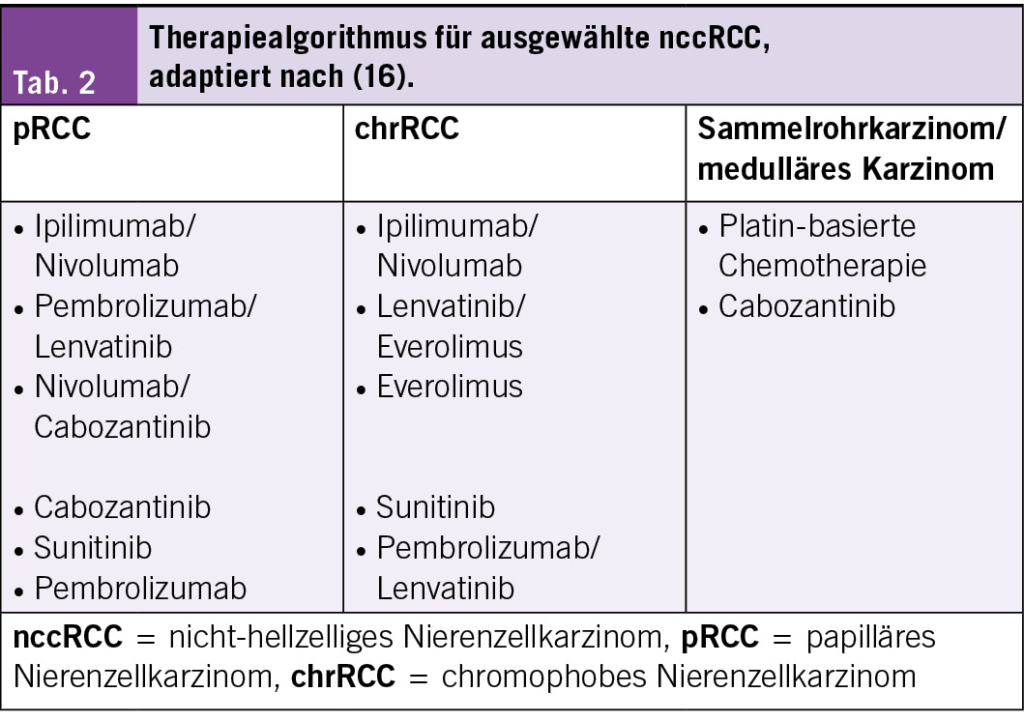
- Mit dem verbesserten Verständnis der molekularen Alterationen der nccRCC zeichnen sich vermehrt zielgerichtete Therapie-Optionen ab. Die aktuelle Behandlung der nccRCC stützt sich mehrheitlich auf die Therapiekonzepte für das hellzellige Nierenzellkarzinom (Tab. 2). Der Einschluss der Patienten in laufende Studien für das nccRCC ist empfohlen.
- «One size does not fit all» – für das Sammelrohrkarzinom und medulläre Nierenzellkarzinom wird die platin-basierte Chemotherapie empfohlen.
1. Moch H, et al. The 2022 World Health Organization classification of tumours of the urinary system and male genital organs-part A: renal, penile, and testicular tumours. Eur Urol. 2022;82(5):458-468.
2. Armstrong AJ, et al. Everolimus versus sunitinib for patients with metastatic non-clear cell renal cell carcinoma (ASPEN): a multicentre, open-label, randomised phase 2 trial. Lancet Oncol. 2016;17(3):378-388.
3. Tannir NM, et al. Everolimus versus sunitinib prospective evaluation in metastatic non-clear cell renal cell carcinoma (ESPN): a randomized multicenter phase 2 trial. Eur Urol. 2016;69(5): 866-874.
4. Barata P, et al. Final Overall Survival Analysis of S1500: A Randomized, Phase II Study Comparing Sunitinib With Cabozantinib, Crizotinib, and Savolitinib in Advanced Papillary Renal Cell Carcinoma. J Clin Oncol.2024;42(33):3911-3916
5. McDermott DF, et al. Open-Label, Single-Arm Phase II Study of Pembrolizumab Monotherapy as First-Line Therapy in Patients With Advanced Clear Cell Renal Cell Carcinoma. J Clin Oncol. 2021;39(9):1020-1028.
6. Tykodi SS, et al. Safety and efficacy of nivolumab plus ipilimumab in patients with advanced non-clear cell renal cell carcinoma: results from the phase 3b/4 CheckMate 920 trial. J Immunother Cancer. 2022;10(2):e003844.
7. Bergmann L, et al. Prospective randomized phase-II trial of ipilimumab/nivolumab versus standard of care in non-clear cell renal cell cancer – results of the SUNNIFORECAST trial. Ann Oncol. 2025;36(7): 796-806
8. Pa SK, et al. Cabozantinib in Combination With Atezolizumab for Advanced Renal Cell Carcinoma: Results From the COSMIC-021 Study. J Clin Oncol 2021:39(33): 3725-3736
9. Fitzgerald KN, et al. Cabozantinib Plus Nivolumab in Patients with Non–Clear Cell Renal Cell Carcinoma: Updated Results from a Phase 2 Trial. Eur Urol. 2024:86(2): 90-94.
10. Albiges L, et al. Pembrolizumab plus lenvatinib as first-line therapy for advanced non-clear-cell renal cell carcinoma (KEYNOTE-B61): a single-arm, multicentre, phase 2 trial. Lancet Oncol. 2023:24(8): 881-891.
11. Suárez C, et al. Phase II Study Investigating the Safety and Efficacy of Savolitinib and Durvalumab in Metastatic Papillary Renal Cancer (CALYPSO). J Clin Oncol. 2023:41(14): 2493-2502
12. Hutson TE, et al. A Single-arm, Multicenter, Phase 2 Study of Lenvatinib Plus Everolimus in Patients with Advanced Non-Clear Cell Renal Cell Carcinoma. Eur Urol. 2021:80(2): 162-170
13. Procopio G, et al. Cabozantinib as First-line Treatment in Patients With Metastatic Collecting Duct Renal Cell Carcinoma: Results of the BONSAI Trial for the Italian Network for Research in Urologic-Oncology. JAMA Oncol. 2022;8(6):910–913
14. Srinivasan R, et al. Bevacizumab and Erlotinib in Hereditary and Sporadic Papillary Kidney Cancer. N Engl J Med. 2025:392(23): 2346-2356.
15. Zoumpourlis P, et al. Systemic Therapies for the Management of Non–Clear Cell Renal Cell Carcinoma: What Works, What Doesn’t, and What the Future Holds. Clin Genitourin Cancer. 2021:19(2):103-116
16. Powles T, et al. Renal cell carcinoma: ESMO Clinical Practice Guideline for diagnosis, treatment and follow up. Ann Oncol. 2024:35(8):692-706; ESMO Renal Cell Carcinoma Living Guidelines, v1.1 June 2025
info@onco-suisse
- Vol. 15
- Ausgabe 5
- Oktober 2025