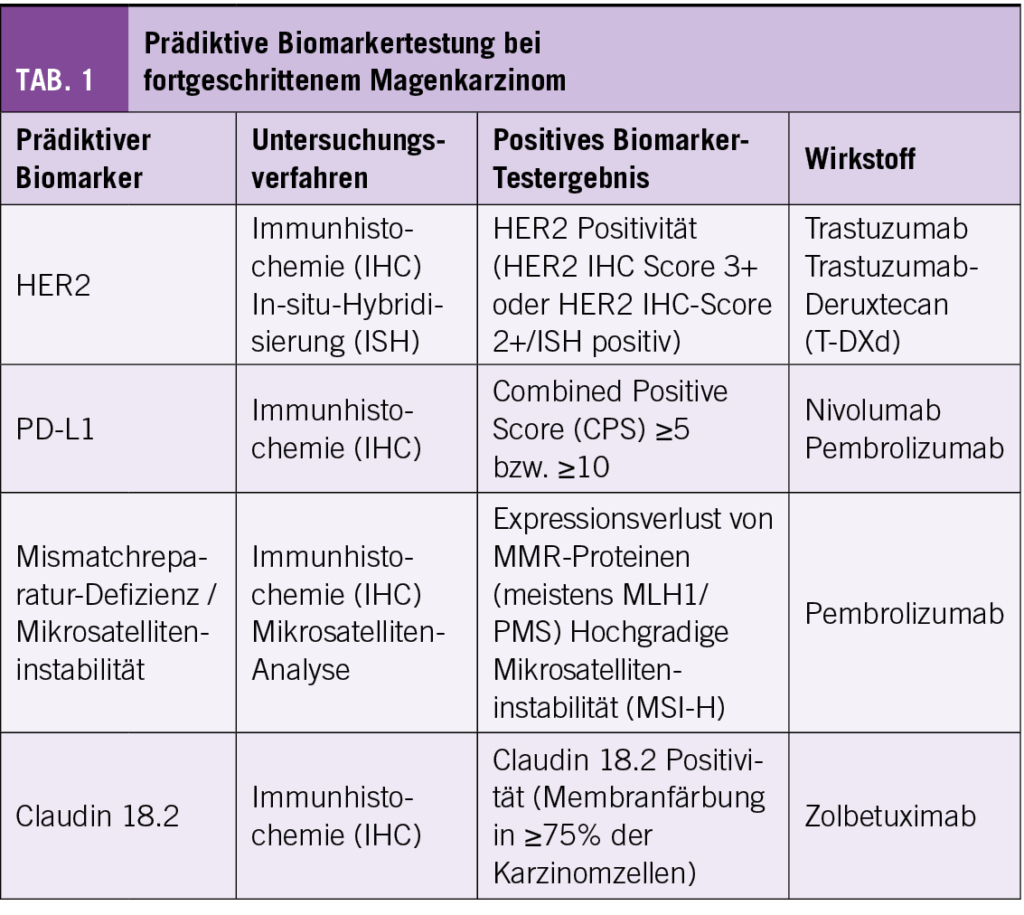
- Prädiktive Biomarker-Testung bei fortgeschrittenem Magenkarzinom
Zielgerichtete und Immuntherapien werden zur Behandlung des lokal fortgeschrittenen, nicht resezierbaren oder metastasierten Magenkarzinoms eingesetzt. Der Einsatz dieser Therapiekonzepte erfordert die Analyse von prädiktiven Biomarkern an Tumorzellen. Im folgenden Beitrag werden aktuelle Entwicklungen bei klinisch relevanten prädiktiven Biomarkern des Magenkarzinoms dargestellt.
Targeted and immune therapies are used for the treatment of locally advanced unresectable or metastatic gastric cancer. These treatment concepts require the analysis of tumor-based predictive biomarkers. This report describes recent developments regarding clinically relevant predictive biomarkers in gastric cancer.
Key Words: Gastric cancer; targeted therapy; immune checkpoint inhibitor; biomarker
Einleitung
Magenkarzinome werden häufig erst in einem fortgeschrittenen Erkrankungsstadium diagnostiziert. Im Gegensatz zu Frühkarzinomen ist die Prognose schlecht (1). Die histologische Typisierung des Magenkarzinoms erfolgt gemäss der WHO-Klassifikation (2019) oder der Laurén-Klassifikation. Mehrheitlich handelt es sich um Adenokarzinome. Eine molekulare Klassifikation des Magenkarzinoms unterscheidet vier Subtypen des Magenkarzinoms mit unterschiedlichen genetischen, pathologischen und klinischen Merkmalen: Epstein-Barr-Virus (EBV)-positive Karzinome, Mikrosatelliten-instabile (MSI) Karzinome, genomisch stabile (GS) Karzinome, und Karzinome mit chromosomaler Instabilität (CIN) (2). EBV-positive Karzinome sind mit der günstigsten, GS-Karzinome mit der schlechtesten Prognose verbunden (3).
Bei Magenkarzinomen im lokal fortgeschrittenen, nicht resezierbaren oder metastasierten Stadium ist eine medikamentöse Systemtherapie mit palliativer Zielsetzung indiziert (4). Als Erstlinienbehandlung wird eine Platin-/Fluoropyrimidin-haltige Kombinationstherapie eingesetzt. Diese kann durch zielgerichtete und/oder immunonkologische Therapien ergänzt werden, falls prädiktive Biomarkertestungen positiv ausfallen. Aktuelle Guidelines von Fachgesellschaften (ESMO, NCCN, ASCO) empfehlen bei Magenkarzinom die Testung der Biomarker HER2, PD-L1 und Mismatchreparatur-Defizienz (4-6) (Tabelle 1). Aktuelle Studienergebnisse lassen erwarten, dass diese Liste zukünftig durch Claudin 18.2 (CLDN18.2) ergänzt wird.
HER2
Ungefähr 15-20% der metastasierten Magenkarzinome sind positiv für den Wachstumsfaktorrezeptor HER2 (ERBB2) (5). In der ToGA-Studie verlängerte der HER2-gerichtete Antikörper Trastuzumab (in Kombination mit Standardchemotherapie) das progressionsfreie und das Gesamtüberleben bei Patienten mit HER2-positivem Magenkarzinom (7). Daher empfehlen aktuelle Guidelines, die Erstlinienchemotherapie des HER2-positiven Magenkarzinoms mit Trastuzumab zu ergänzen (4-6).
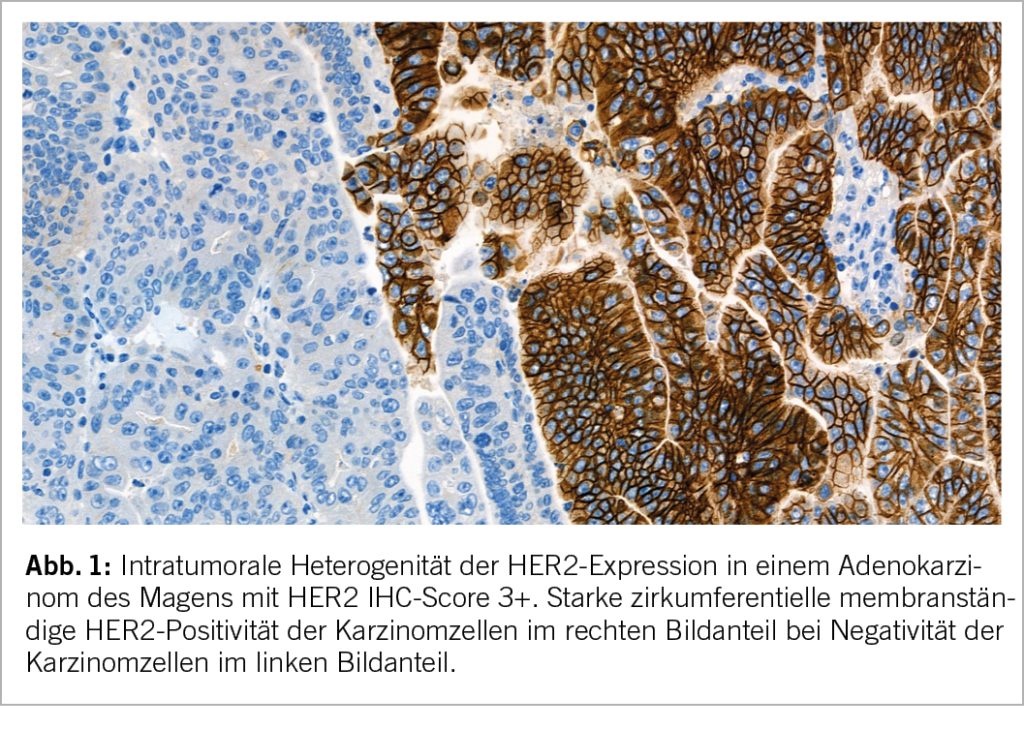
Eine ASCO/CAP Guideline beschreibt einen Algorithmus und Beurteilungskriterien für die HER2-Testung bei Magenkarzinom (8). HER2-positive Karzinome sind charakterisiert durch eine Überexpression des HER2-Proteins oder eine HER2-Genamplifikation. Die HER2-Proteinexpression wird mittels Immunhistochemie (IHC) untersucht und das Färbeergebnis einer von vier semiquantitativen Kategorien zugeordnet (HER2 IHC-Score 0, 1+, 2+, oder 3+). Der HER2 IHC-Score wird anhand der Intensität der membranständigen HER2-Immunreaktivität und der Anzahl der positiven Karzinomzellen ermittelt. Ein HER2 IHC-Score 3+ in ≥ 10% der Tumorzellen gilt als positiv für eine HER2-Überexpression (Abb.1). Zum Nachweis einer HER2-Genamplifikation wird die In-situ-Hybridisierung (ISH) eingesetzt, bei der die Anzahl der HER2-Genkopien in den Tumorzellen bestimmt und in Beziehung zur Chromosom 17-Zahl (CEP17) gesetzt wird. Eine HER2/CEP17 Ratio ≥2 wird als positiv für eine HER2-Genamplifikation bewertet. Häufig findet sich eine intratumorale Heterogenität des HER2-Status der Magenkarzinomzellen, so dass der endoskopischen Entnahme von repräsentativem Probenmaterial für die histopathologische Diagnostik grosse Bedeutung zukommt. Es wird die Entnahme bzw. Analyse von mindestens fünf, besser sechs bis acht Biopsieproben mit Karzinomzellen empfohlen (8).
Zur Zweitlinienbehandlung des HER2-postiven Magenkarzinoms steht in der Europäischen Union (EU) seit Anfang 2023 Trastuzumab-Deruxtecan (T-DXd) als Monotherapie zur Verfügung. T-DXd ist ein Antikörper-Wirkstoff-Konjugat (ADC), das aus dem HER2-gerichteten Antikörper Trastuzumab, einem spaltbaren Linker, und dem zytotoxischen Topoisomerase-I-Inhibitor Deruxtecan (DXd) besteht. T-DXd bindet über seine Antikörper-Komponente selektiv an den HER2-Rezeptor auf der Oberfläche einer Tumorzelle. Nach Aufnahme in die Zelle wird Deruxtecan abgespalten und induziert den Zelltod. In der randomisierten DESTINY-Gastric01 Studie verlängerte T-DXd bei Patienten aus Ostasien das Gesamtüberleben im Vergleich zu Chemotherapie bei HER2-positivem Magenkarzinom (9). Die Wirksamkeit von T-DXd wurde kürzlich in der einarmigen DESTINY-Gastric02 Studie mit Patienten aus den USA und Europa bestätigt (10).
In DESTINY-Gastric01 wurde auch ein objektives Ansprechen in einer kleinen exploratorischen Kohorte von Magenkarzinomen mit einem sogenannten «HER2 Low» Status (IHC-Score 1+ oder HER2 IHC-Score 2+/ISH negativ) beobachtet (11). Aktuell werden Karzinome mit einem HER2 IHC-Score 1+ bzw. Karzinome mit einem HER2 IHC-Score 2+ und negativer HER2-Genamplifikation (ISH negativ) als HER2-negativ beurteilt. Aufgrund der Ergebnisse der DESTINY-Gastric01 Studie zeichnet sich ab, dass in Zukunft eine dichotome Kategorisierung des HER2-Status als positiv und negativ nicht mehr ausreicht, sondern «HER2 Low» als zusätzliche Kategorie eingeführt werden sollte.
PD-L1
PD-L1 bildet zusammen mit seinem Rezeptor PD-1 einen Immuncheckpoint, dessen hemmende Wirkung durch gegen PD-1 oder PD-L1 gerichtete therapeutische Antikörper aufgehoben werden kann. Als Erstlinientherapie bei fortgeschrittenem Magenkarzinom wurden bisher vor allem die PD-1 Inhibitoren Nivolumab und Pembrolizumab untersucht: bei HER2-negativem Magenkarzinom in Kombination mit Chemotherapie (CheckMate-649, ATTRACTION-4, KEYNOTE-062, KEYNOTE-859), bei HER2-positivem Magenkarzinom in Kombination mit einer HER2-gerichteten Therapie (Trastuzumab) und Chemotherapie (KEYNOTE-811) (12-15). Die Studienergebnisse deuten darauf hin, dass die Wirksamkeit von PD-1 Inhibitoren mit dem PD-L1 Status des Tumors assoziiert ist.
Bei Magenkarzinom empfehlen aktuelle Guidelines den Combined Positive Score (CPS) für die Beurteilung des PD-L1 Status (4-6). Der CPS berücksichtigt die PD-L1 Expression von Tumorzellen und tumorassoziierten Immunzellen (Makrophagen, Lymphozyten, dendritische Zellen). Bei Tumorzellen gilt eine membranständige Anfärbung unabhängig von der Intensität als positiv, bei Immunzellen nur eine zytoplasmatische Anfärbung. Zur Bestimmung des CPS wird die Summe der PD-L1 positiven Zellen durch die Anzahl der Tumorzellen in mehreren Gesichtsfeldern dividiert und der Quotient mit 100 multipliziert. Es entsteht ein dimensionsloser Wert, der dem CPS entspricht. Der CPS wurde initial für den PD-L1 IHC 22C3 pharmDx (22C3) Assay entwickelt und validiert, danach auch für den PD-L1 IHC 28-8 pharmDx (28-8) Assay eingesetzt (u.a. in der CheckMate-649 Studie). Bei beiden Tests handelt es sich um geschlossene Reagenzien-Systeme, die nur auf der Geräteplattform (Dako Autostainer Link48) des Kitherstellers eingesetzt werden können. In zwei Vergleichsstudien wurde eine hohe Konkordanz der 22C3 und 28-8 Testergebnisse für verschiedene CPS-Schwellenwerte (1, 5, 10, 50) beobachtet (16, 17).
Die Ergebnisse der Studien Checkmate-649 und KEYNOTE-859 deuten darauf hin, dass PD-L1 CPS ≥5 und CPS ≥10 klinisch relevante Schwellenwerte bei Magenkarzinom sind (12). CheckMate-649 untersuchte Nivolumab in Kombination mit Chemotherapie (CAPOX oder FOLFOX) als Erstlinienbehandlung bei HER2-negativem Magenkarzinom (12). Im Vergleich zu alleiniger Chemotherapie verlängerte die Nivolumab/Chemotherapie Kombination das progressionsfreie und das Gesamtüberleben vor allem in der Subgruppe der Patienten mit einem PD-L1 CPS ≥5. In KEYNOTE-859 verbesserte Pembrolizumab in Kombination mit Chemotherapie das Gesamtüberleben bei allen Studienpatienten, vor allem aber in der Subgruppe mit einem PD-L1 CPS ≥10 (18). Dies ist in Übereinstimmung mit Ergebnissen einer retrospektiven Analyse zur prädiktiven Signifikanz des CPS in den Patientenkohorten der KEYNOTE-59, -61 und -62 Studien (19).
In der Routinediagnostik der meisten Pathologie-Institute werden aus praktischen Gründen auch andere Testverfahren als die 22C3 und 28-8 Assays zu Bestimmung des PD-L1 Status eingesetzt, auch wenn keine formale Vergleichsstudien verfügbar sind. Dieses Vorgehen erfordert eine Methodenvalidierung vor Ort und eine regelmässige externe Qualitätssicherung durch Ringversuchteilnahmen.
Mismatchreparatur-Defizienz
Als Mismatchreparatur-Defizienz (MMRd) wird der Ausfall eines zellulären Reparaturmechanismus bezeichnet, der fehlerhaft eingebaute Basen im Genom beseitigt, die bei der Replikation und Schädigung von Zell-DNA entstehen können. Das Vorliegen einer MMRd definiert einen molekularen Subtyp des Magenkarzinoms mit charakteristischen pathologischen und klinischen Merkmalen (2). Eine MMRd liegt bei 7-23% der Magenkarzinome vor und ist meistens (>90%) auf einen Expressionsverlust des MMR-Proteins MLH1 in den Karzinomzellen zurückzuführen (20). Der MLH1-Verlust wird in der Regel durch eine Promoterhypermethylierung des MLH1-Gens verursacht und führt zu einer hochgradigen Mikrosatelliteninstabilität (MSI-H) im Tumorzellgenom.
KEYNOTE-158 untersuchte die Wirksamkeit einer Pembrolizumab-Monotherapie als Zweitlinientherapie bei 27 Tumortypen mit MMRd oder MSI-H (21, 22). Bei den wenigen Magenkarzinompatienten in der Studienkohorte wurde eine hohe objektive Ansprechrate von rund 46% beobachtet. Auch post hoc Analysen von Studien, in denen Immuncheckpoint-Inhibitoren (Pembrolizumab, Nivolumab, Avelumab) allein oder in Kombination mit Chemotherapie bei Magenkarzinom untersucht wurden, deuten auf eine prädiktive Signifikanz des MMRd/MSI-H Status (23, 24).
Aktuelle Guidelines (ESMO, CAP) empfehlen Immunfärbungen für MMR-Proteine und/oder die Mikrosatellitenanalyse mittels Polymerase-Kettenreaktion (PCR) in Hinblick auf eine Immuncheckpoint-Inhibitortherapie (25, 26). Eine aktuelle Studie zeigte an einer grossen Magenkarzinom-Kohorte eine hohe Konkordanz der mittels Mikrosatellitenanalyse oder Immunfärbung für MMR-Proteine erhaltenen Testergebnisse (27).
Die immunhistochemische Analyse auf MMRd sollte die vier MMR-Proteine MLH1, MSH2, MSH6 und PMS2 umfassen. Die meisten Magenkarzinome mit MMRd zeigen einen nukleären Expressionsverlust von MLH1 und/oder PMS2, selten einen Ausfall von MSH2 und/oder MSH6. Bei MLH1-Expressionsverlust kann ergänzend der Methylierungsstatus des MLH1-Genpromotors untersucht werden.
Bei MMRd verändert sich die Länge der Mikrosatelliten im Tumorzellgenom. Mikrosatelliten mit Längenveränderungen werden als instabil bezeichnet. Meistens liegt eine Verkürzung (Deletion) um 4-12 Basen vor. Die Länge eines Mikrosatelliten kann durch selektive Amplifikation mittels Polymerase-Kettenreaktion (PCR) und nachfolgender Längenanalyse des PCR-Produkts (meistens mittels Kapillarelektrophorese) ermittelt werden. In der klinischen Diagnostik werden zur MMRd-Testung mindestens fünf Mikrosatelliten analysiert. Das NCI-Referenzpanel (Bethesda Panel) umfasst zwei Mononukleotid-Mikrosatelliten (BAT-25, BAT-26) und drei Dinukleotid-Mikrosatelliten (D2S123, D5S346, D7S250). Andere Panel zur MSI-Analyse verwenden ausschliesslich (quasi-)monomorphe Mononukleotid-Marker (BAT-25, BAT-26, NR-21, NR-24, MONO-27; OncoMate™ MSI Dx Analysis System; Promega) und/oder eine grössere Anzahl von Markern (7 Loci, IdyllaTM MSI Assay; 8 Loci, EasyPGX ready MSI Kit). Mononukleotid-Marker zeigen eine grössere Spezifität und Sensitivität als Dinukleotid-Marker für Längenveränderungen bei Vorliegen einer MMRd. Eine MSI-H liegt vor, wenn mehr als 30% der untersuchten Mikrosatelliten eine Instabilität aufweisen.
Claudin 18.2
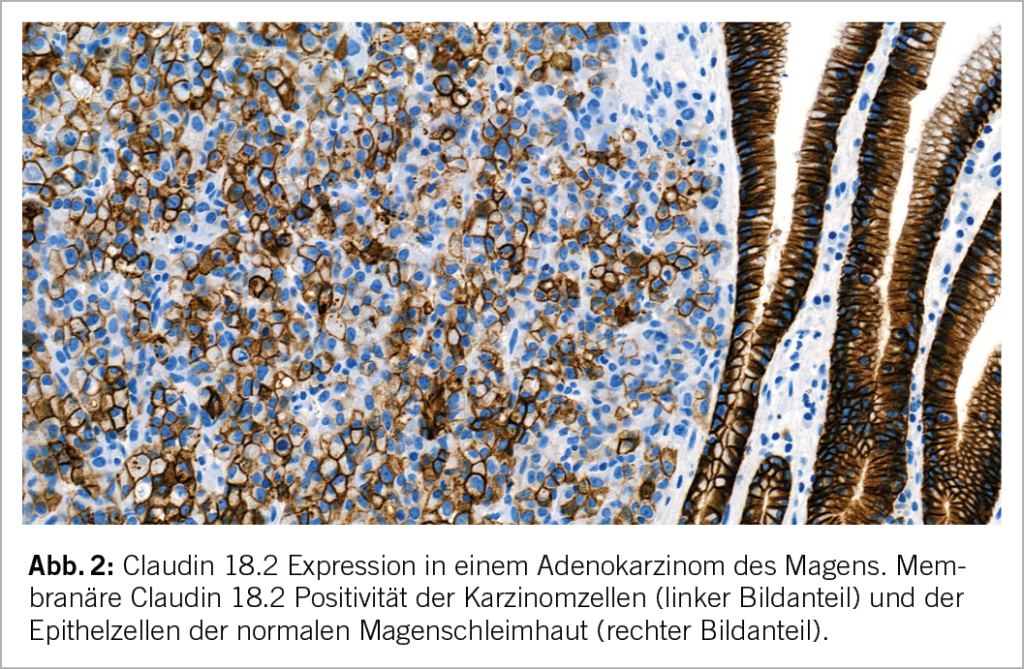
Claudin 18.2 (CLDN18.2) wird in den Schlussleisten der normalen Magenschleimhaut exprimiert und ist dort an der Regulation von Epithelzellpolarität und Schleimhautpermeabilität beteiligt. Bei einem Teil der Magenkarzinome findet sich CLDN18.2 auf der Oberfläche der Karzinomzellen (Abb. 2).
Zolbetuximab ist ein therapeutischer Antikörper, der an CLDN18.2 bindet und eine antikörperabhängige zell- und komplementvermittelte Zytotoxizität auslöst. In der SPOTLIGHT Studie führte Zolbetuximab in Kombination mit Chemotherapie (mFOLFOX6) zu einer signifikanten Verlängerung von progressionsfreiem und Gesamtüberleben bei Patienten mit CLDN18.2-positivem, HER2-negativem Magenkarzinom (28). Die Wirksamkeit von Zolbetuximab wurde in der GLOW-Studie auch in Kombination mit einer Capecitabin/Oxaliplatin Chemotherapie (CAPOX) bestätigt (29).
Der CLDN18.2 Status eines Magenkarzinoms wird mittels Immunhistochemie analysiert. In den Studien SPOTLIGHT und GLOW wurde der Ventana CLDN18 IVD (43-14A) Assay verwendet. Der Antikörper-Klon 43-14A erkennt mehrere CLDN18.2 Isoformen. Da Magenkarzinome nur die CLDN18.2 Isoform exprimieren, kann ein positives 43-14A Färbeergebnis mit einer CLDN18.2 Expression gleichgesetzt werden. CLDN18.2 Positivität wurde in SPOTLIGHT und GLOW als mässige bis starke CLDN18.2 Membranfärbung (komplett, basolateral, oder lateral) in ≥75% der Karzinomzellen definiert. Eine solche CLDN18.2 Positivität liegt bei 24-43% der Magenkarzinome vor (28-30). Aufgrund der positiven Studienergebnisse ist damit zu rechnen, dass sich CLDN18.2 als neuer prädiktiver Biomarker bei Magenkarzinom etablieren wird.
Ausblick
Neue zielgerichtete Wirkstoffe und Therapieformen zur Behandlung des Magenkarzinoms sind in klinischer Erprobung (unter anderem Antikörper-Wirkstoff-Konjugate, bispezifische Antikörper, CAR-T-Zellen). So zeigte der FGFR2b-gerichtete therapeutische Antikörper Bemarituzumab Wirksamkeit bei Patienten mit FGFR2b-positivem Magenkarzinom (FIGHT Studie) (31). Es ist daher damit zu rechnen, dass sich die Anzahl der bei Magenkarzinom klinisch relevanten Biomarker in Zukunft vergrössern wird.
Biomarkertestungen an zirkulierender Tumor-DNA (ctDNA) könnten zukünftig Analysen an Tumorgewebe ergänzen oder teilweise ersetzen. ctDNA wird von Tumorzellen in das Blut abgegeben. In der GOZILA Studie konnte an ctDNA von Magenkarzinompatienten eine Testung auf Mikrosatelliteninstabilität und HER2-Amplifikation unter anderem mit hoher Konkordanz zu gepaarten Tumorgewebsproben durchgeführt werden (32). Allerdings ist der klinische Nutzen von ctDNA Testungen begrenzt, da HER2, PD-L1 und CLDN18.2 Proteinexpressionsanalyen an dieser Art von Probenmaterial nicht durgeführt werden können.
Copyright bei Aerzteverlag medinfo AG
Institut für Pathologie
Kantonsspital St. Gallen
9007 St. Gallen
wolfram.jochum@kssg.ch
Der Autor und die Autorin haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Prädiktive Biomarker-Testungen bei Magenkarzinom dienen vor allem der Vorhersage eines Ansprechens auf HER2-gerichtete Therapien und Immuncheckpoint-Inhibitoren.
◆ HER2, PD-L1 und Mismatchreparatur-Defizienz/Mikrosatelliten-Instabilität sind Biomarker, die bei jedem Patienten mit fortgeschrittenem Magenkarzinom bestimmt werden sollten.
◆ Zur Biomarker-Testung werden vor allem Immunhistochemie (HER2, PD-L1, Mismatchreparatur-Proteine), In situ-Hybridisierung (HER2) und Polymerase-Kettenreaktion (Mikrosatelliten-Analyse) eingesetzt.
◆ Claudin 18.2 ist ein neuer Biomarker, der vermutlich in naher Zukunft die klinische Routinediagnostik bei fortgeschrittenem Magenkarzinom erweitern wird.
1. Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F. Gastric cancer. Lancet. 2020;396(10251):635-48.
2. Cancer Genome Atlas Research N. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014;513(7517):202-9.
3. Sohn BH, Hwang JE, Jang HJ, Lee HS, Oh SC, Shim JJ, et al. Clinical Significance of Four Molecular Subtypes of Gastric Cancer Identified by The Cancer Genome Atlas Project. Clin Cancer Res. 2017;23(15):4441-9.
4. Lordick F, Carneiro F, Cascinu S, Fleitas T, Haustermans K, Piessen G, et al. Gastric cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022;33(10):1005-20.
5. Ajani JA, D’Amico TA, Bentrem DJ, Chao J, Cooke D, Corvera C, et al. Gastric Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022;20(2):167-92.
6. Shah MA, Kennedy EB, Alarcon-Rozas AE, Alcindor T, Bartley AN, Malowany AB, et al. Immunotherapy and Targeted Therapy for Advanced Gastroesophageal Cancer: ASCO Guideline. J Clin Oncol. 2023;41(7):1470-91.
7. Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376(9742):687-97.
8. Bartley AN, Washington MK, Colasacco C, Ventura CB, Ismaila N, Benson AB, 3rd, et al. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. J Clin Oncol. 2017;35(4):446-64.
9. Shitara K, Bang YJ, Iwasa S, Sugimoto N, Ryu MH, Sakai D, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med. 2020;382(25):2419-30.
10. Van Cutsem E, di Bartolomeo M, Smyth E, Chau I, Park H, Siena S, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol. 2023.
11. Yamaguchi K, Bang YJ, Iwasa S, Sugimoto N, Ryu MH, Sakai D, et al. Trastuzumab Deruxtecan in Anti-Human Epidermal Growth Factor Receptor 2 Treatment-Naive Patients With Human Epidermal Growth Factor Receptor 2-Low Gastric or Gastroesophageal Junction Adenocarcinoma: Exploratory Cohort Results in a Phase II Trial. J Clin Oncol. 2023;41(4):816-25.
12. Janjigian YY, Shitara K, Moehler M, Garrido M, Salman P, Shen L, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021;398(10294):27-40.
13. Kang YK, Chen LT, Ryu MH, Oh DY, Oh SC, Chung HC, et al. Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022;23(2):234-47.
14. Shitara K, Van Cutsem E, Bang YJ, Fuchs C, Wyrwicz L, Lee KW, et al. Efficacy and Safety of Pembrolizumab or Pembrolizumab Plus Chemotherapy vs Chemotherapy Alone for Patients With First-line, Advanced Gastric Cancer: The KEYNOTE-062 Phase 3 Randomized Clinical Trial. JAMA Oncol. 2020;6(10):1571-80.
15. Janjigian YY, Kawazoe A, Yanez P, Li N, Lonardi S, Kolesnik O, et al. The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer. Nature. 2021;600(7890):727-30.
16. Ahn S, Kim KM. PD-L1 expression in gastric cancer: interchangeability of 22C3 and 28-8 pharmDx assays for responses to immunotherapy. Mod Pathol. 2021;34(9):1719-27.
17. Narita Y, Sasaki E, Masuishi T, Taniguchi H, Kadowaki S, Ito S, et al. PD-L1 immunohistochemistry comparison of 22C3 and 28-8 assays for gastric cancer. J Gastrointest Oncol. 2021;12(6):2696-705.
18. Rha SY, Wyrwicz L, Weber PEY, Bai Y, Ryu M-H, Lee J, et al. KEYNOTE-859 study of pembrolizumab plus chemotherapy for advanced HER2-negative gastric or gastroesophageal junction (G/GEJ) cancer: Outcomes in the protocol-specified PD-L1–selected populations. Journal of Clinical Oncology. 2023;41(16_suppl):4014.
19. Wainberg ZA, Fuchs CS, Tabernero J, Shitara K, Muro K, Van Cutsem E, et al. Efficacy of Pembrolizumab Monotherapy for Advanced Gastric/Gastroesophageal Junction Cancer with Programmed Death Ligand 1 Combined Positive Score >/=10. Clin Cancer Res. 2021;27(7):1923-31.
20. Bevilacqua RA, Simpson AJ. Methylation of the hMLH1 promoter but no hMLH1 mutations in sporadic gastric carcinomas with high-level microsatellite instability. Int J Cancer. 2000;87(2):200-3.
21. Marabelle A, Le DT, Ascierto PA, Di Giacomo AM, De Jesus-Acosta A, Delord JP, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol. 2020;38(1):1-10.
22. Maio M, Ascierto PA, Manzyuk L, Motola-Kuba D, Penel N, Cassier PA, et al. Pembrolizumab in microsatellite instability high or mismatch repair deficient cancers: updated analysis from the phase II KEYNOTE-158 study. Ann Oncol. 2022;33(9):929-38.
23. Chao J, Fuchs CS, Shitara K, Tabernero J, Muro K, Van Cutsem E, et al. Assessment of Pembrolizumab Therapy for the Treatment of Microsatellite Instability-High Gastric or Gastroesophageal Junction Cancer Among Patients in the KEYNOTE-059, KEYNOTE-061, and KEYNOTE-062 Clinical Trials. JAMA Oncol. 2021;7(6):895-902.
24. Pietrantonio F, Randon G, Di Bartolomeo M, Luciani A, Chao J, Smyth EC, et al. Predictive role of microsatellite instability for PD-1 blockade in patients with advanced gastric cancer: a meta-analysis of randomized clinical trials. ESMO Open. 2021;6(1):100036.
25. Bartley AN, Mills AM, Konnick E, Overman M, Ventura CB, Souter L, et al. Mismatch Repair and Microsatellite Instability Testing for Immune Checkpoint Inhibitor Therapy: Guideline From the College of American Pathologists in Collaboration With the Association for Molecular Pathology and Fight Colorectal Cancer. Arch Pathol Lab Med. 2022;146(10):1194-210.
26. Luchini C, Bibeau F, Ligtenberg MJL, Singh N, Nottegar A, Bosse T, et al. ESMO recommendations on microsatellite instability testing for immunotherapy in cancer, and its relationship with PD-1/PD-L1 expression and tumour mutational burden: a systematic review-based approach. Ann Oncol. 2019;30(8):1232-43.
27. Park Y, Nam SK, Seo SH, Park KU, Oh HJ, Park YS, et al. Comprehensive Study of Microsatellite Instability Testing and Its Comparison With Immunohistochemistry in Gastric Cancers. J Gastric Cancer. 2023;23(2):264-74.
28. Shitara K, Lordick F, Bang YJ, Enzinger P, Ilson D, Shah MA, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2023.
29. Shah MA, Shitara K, Ajani JA, Bang YJ, Enzinger P, Ilson D, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023;29(8):2133-41.
30. Kubota Y, Kawazoe A, Mishima S, Nakamura Y, Kotani D, Kuboki Y, et al. Comprehensive clinical and molecular characterization of claudin 18.2 expression in advanced gastric or gastroesophageal junction cancer. ESMO Open. 2023;8(1):100762.
31. Wainberg ZA, Enzinger PC, Kang YK, Qin S, Yamaguchi K, Kim IH, et al. Bemarituzumab in patients with FGFR2b-selected gastric or gastro-oesophageal junction adenocarcinoma (FIGHT): a randomised, double-blind, placebo-controlled, phase 2 study. Lancet Oncol. 2022.
32. Nakamura Y, Taniguchi H, Ikeda M, Bando H, Kato K, Morizane C, et al. Clinical utility of circulating tumor DNA sequencing in advanced gastrointestinal cancer: SCRUM-Japan GI-SCREEN and GOZILA studies. Nat Med. 2020;26(12):1859-64.
info@onco-suisse
- Vol. 13
- Ausgabe 6
- September 2023