- Résultats de l’étude RATIONALE 306
Le carcinome épidermoïde avancé ou métastatique de l’œsophage est associé à un pronostic défavorable. L’immunothérapie prend une importance croissante dans le traitement de première ligne de ce groupe de patients (1, 2).
L’étude RATIONALE-306 a examiné le bénéfice du tislelizumab, un inhibiteur de PD-1, en combinaison avec une chimiothérapie à base de sels de platine. Un avantage significatif en termes de survie a été observé pour le traitement de première ligne avec tislelizumab plus chimiothérapie par rapport au placebo plus chimiothérapie chez les patients atteints d’ESCC avancé, à la fois lors de l’analyse primaire (2) et après un suivi minimal de trois ans (3). Lors du suivi à trois ans, les résultats de la survie globale (OS) ont montré un HR stratifié de 0,70 pour l’ensemble des patients de la population ITT. Chez les patients ayant un score TAP PD-L1 tumoral ≥ 10 % ou ≥ 5 %, les HR étaient respectivement de 0,70 et 0,62 (3).
À l’occasion du congrès ESMO-GI 2025, le Prof. David Tougeron, de Poitiers (France), et ses collègues issus de 18 institutions internationales ont présenté les données de RATIONALE-306 dans le sous-groupe des patients avec un score TAP PD-L1 tumoral ≥ 5 %, comme retenu par l’Agence européenne des médicaments (EMA) pour l’autorisation (4).
RATIONALE-306 (NCT03783442) est une étude internationale de phase 3, randomisée et en double aveugle, portant sur l’évaluation de l’efficacité et de la sécurité du tislelizumab plus chimiothérapie par rapport au placebo plus chimiothérapie en tant que traitement de première ligne du carcinome épidermoïde œsophagien (ESCC) métastatique ou inopérable. Des patients atteints d’un ESCC localement avancé non résécable ou métastatique, sans traitement systémique préalable pour une maladie avancée, avec un score de performance ECOG 0 ou 1 et une maladie mesurable ou évaluable selon RECIST v1.1, ont été traités par tislelizumab 200 mg i.v. toutes les 3 semaines (Q3W) plus chimiothérapie (platine + fluoropyrimidine ou platine + paclitaxel dans un rapport 1:1) contre placebo i.v. Q3W plus chimiothérapie (platine + fluoropyrimidine ou platine + paclitaxel), en traitement d’entretien jusqu’à toxicité inacceptable ou progression de la maladie.
Le critère principal était la survie globale (OS) dans la population ITT. Les critères secondaires comprenaient l’OS dans le sous-groupe avec un score TAP PD-L1 ≥ 10 %, la survie sans progression (PFS), le taux de réponse objective (ORR), la durée de réponse (DoR), la qualité de vie liée à la santé (HRQoL) ainsi que la sécurité. L’analyse post hoc incluait l’analyse en sous-groupes des patients avec un score TAP PD-L1 tumoral ≥ 5 %.
Facteurs de stratification :
• Région géographique (Asie [hors Japon] vs Japon vs reste du monde)
• Traitement curatif antérieur (oui vs non)
• Chimiothérapie choisie par l’investigateur (platine + fluoropyrimidine)
Les patients ont été inclus dans l’étude indépendamment de leur expression du PD-L1 au moment du screening. Les échantillons ont été colorés avec le test VENTANA PD-L1 (SP263) (Roche) et l’expression a été évaluée selon le score TAP. À des fins exploratoires, les mêmes échantillons colorés ont été évalués par des pathologistes au laboratoire central selon le score CPS.
Disposition des patients et caractéristiques initiales
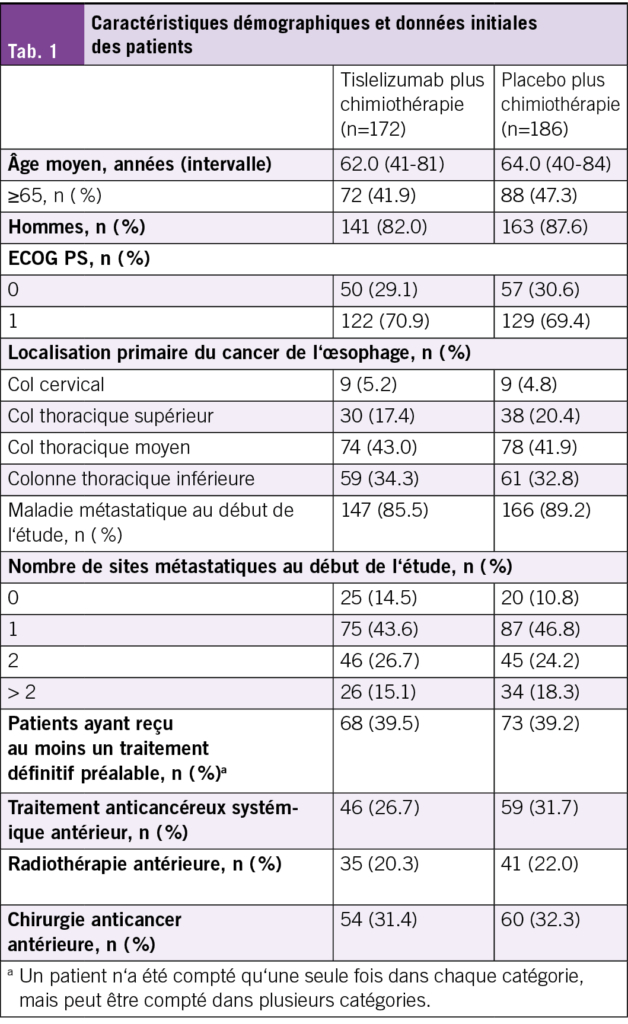
Parmi les 649 patients randomisés (tislelizumab plus chimiothérapie n = 326 ; placebo plus chimiothérapie n = 323), 358 (55,2 %) présentaient un score TAP PD-L1 tumoral ≥ 5 % (tislelizumab plus chimiothérapie n = 172 ; placebo plus chimiothérapie n = 186) (Tab. 1). Les caractéristiques de base des patients ayant un score TAP ≥ 5 % correspondaient à celles de la population ITT. À la date de coupure des données (22 août 2024), la durée minimale de suivi de l’étude était de 45,2 mois (plage : 0,4–63,6). Dans le bras tislelizumab plus chimiothérapie, 106 patients (61,6 %) ont reçu une thérapie systémique post-traitement, contre 126 (67,7 %) dans le bras placebo plus chimiothérapie. Parmi eux, 27 (25,5 %) contre 44 (34,9 %) ont reçu une immunothérapie systémique.
Efficacité
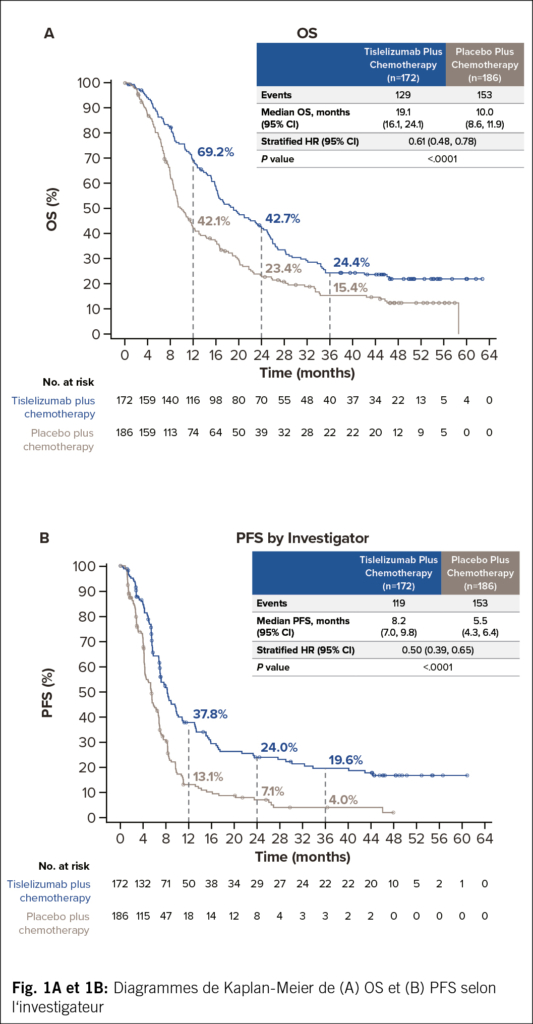
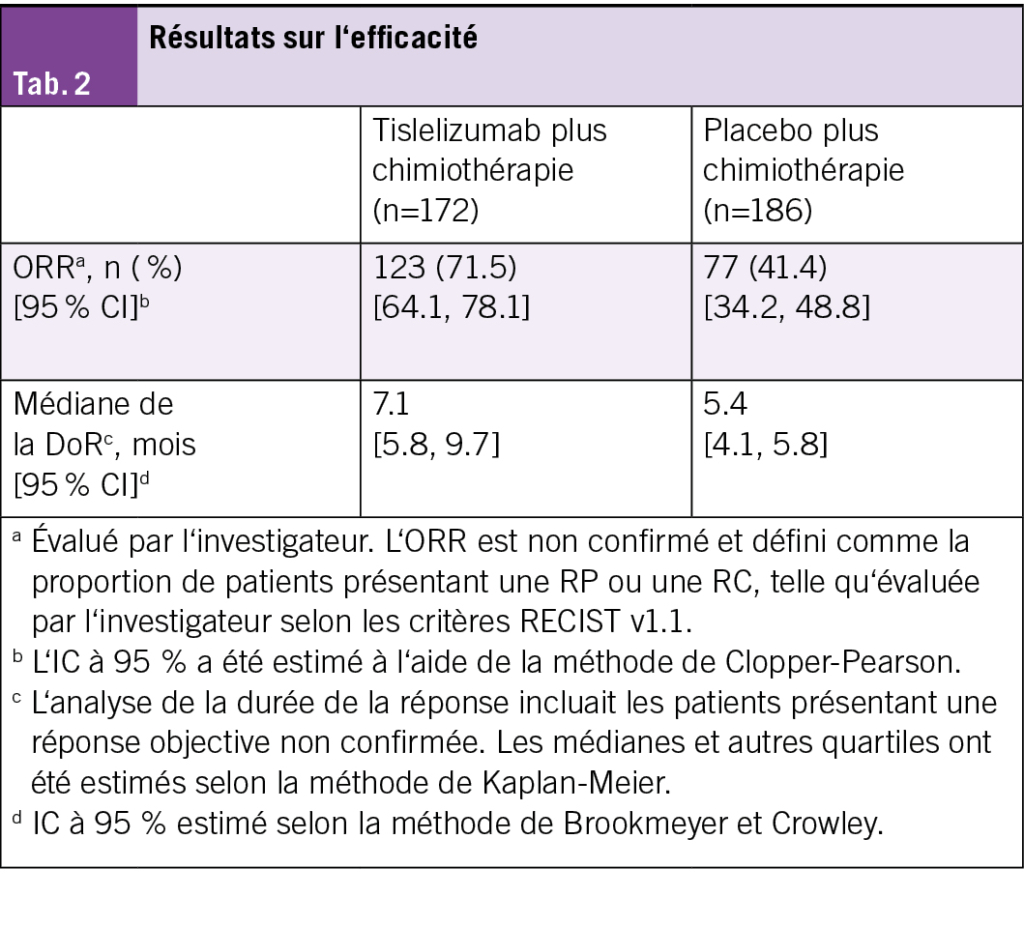
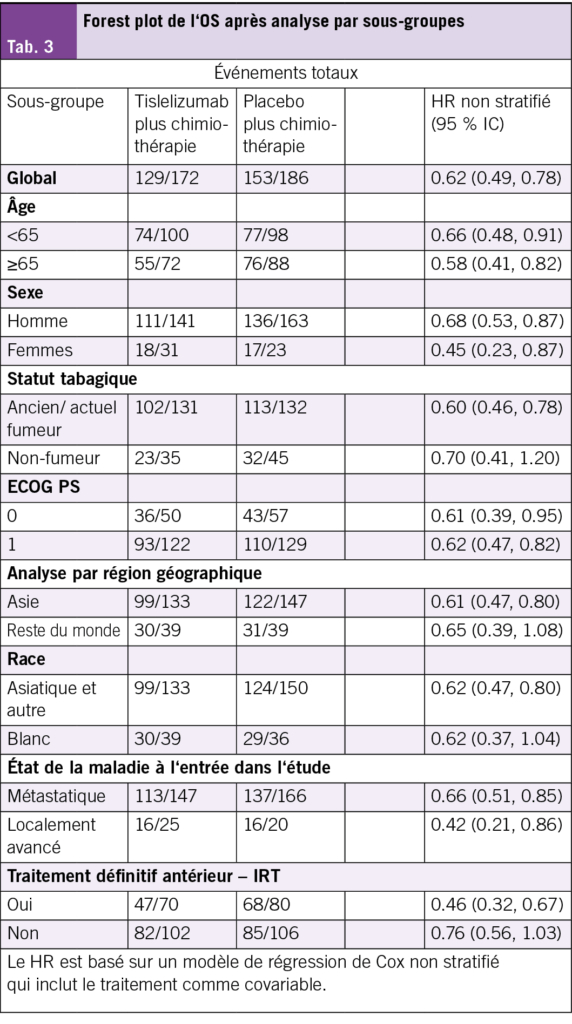
Des améliorations cliniquement significatives de l’OS (Fig. 1A) et de la PFS évaluée par l’investigateur (Fig. 1B) ont été observées avec tislelizumab plus chimiothérapie par rapport au placebo plus chimiothérapie. Un taux de réponse objective (ORR) plus élevé ainsi qu’une durée de réponse (DoR) prolongée ont également été constatés dans le groupe tislelizumab plus chimiothérapie (Tab. 2). Le bénéfice en termes d’OS a été observé dans tous les sous-groupes prédéfinis (Tab. 3).
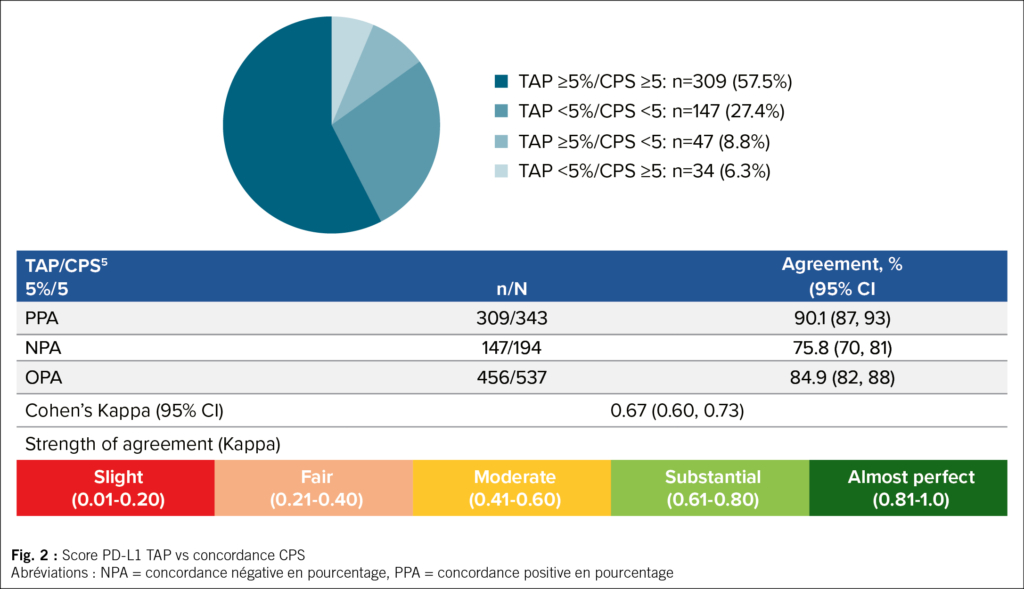
Score TAP PD-L1 vs score CPS – Concordance
Les seuils TAP ≥ 5 % et CPS ≥ 5 ont montré une concordance globale de 84 %, ce qui représente un accord substantiel (Fig. 2).
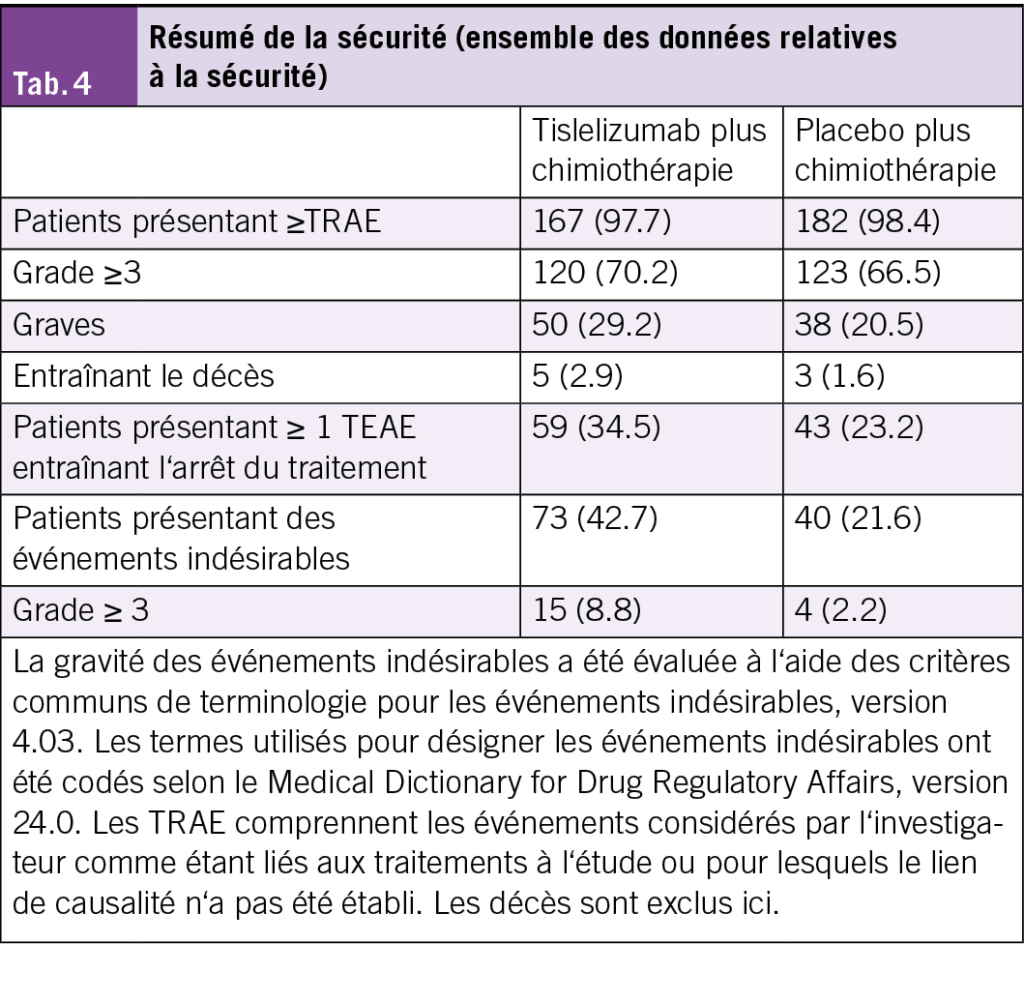
Sécurité et tolérance
Des effets indésirables liés au traitement (TRAEs) ont été observés chez la majorité des patients dans les deux groupes, avec des taux similaires tous grades confondus. Une incidence plus élevée d’effets indésirables TRAEs de grade ≥ 3 ainsi que d’effets indésirables graves a été constatée dans le groupe tislelizumab plus chimiothérapie (Tab. 4).
Les TRAEs de grade ≥ 3 survenant chez ≥ 10 % des patients dans le groupe tislelizumab plus chimiothérapie comparé au groupe placebo plus chimiothérapie comprenaient :
• neutropénie (35,1 % vs 31,9 %)
• leucopénie (12,3 % vs 17,8 %)
• anémie (13,5 % vs 11,4 %)
Les TRAEs ayant conduit au décès (2,9 % vs 1,6 %) et les événements indésirables liés au traitement (TEAEs) ayant conduit à un arrêt de traitement (34,5 % vs 23,2 %) ont été plus fréquents dans le groupe tislelizumab plus chimiothérapie que dans le groupe placebo plus chimiothérapie.
Des effets indésirables immunomédiés (imAEs) ont été rapportés dans les deux groupes. L’incidence des imAEs de grade ≥ 3 était plus élevée dans le groupe tislelizumab plus chimiothérapie (8,8 % vs 2,2 %) (Tab. 4).
Conclusions
La survie globale médiane de 19,1 mois sous tislelizumab plus chimiothérapie chez les patients présentant un score TAP PD-L1 tumoral ≥ 5 % établit une nouvelle référence d’efficacité dans ce groupe de patients atteints d’un carcinome épidermoïde avancé/métastatique de l’œsophage, avec un profil de sécurité acceptable. Les bénéfices en matière d’efficacité et de tolérance sont restés cohérents avec les résultats de l’analyse primaire et du suivi à 3 ans, sans nouveau signal de sécurité.
Ces données soutiennent l’intégration de cette association thérapeutique dans la prise de décision clinique – y compris dans le cadre de l’approche thérapeutique en Suisse.
riesen@medinfo-verlag.ch
1. Kato K, et al. Nivolumab plus chemotherapy or ipilimumab versus chemotherapy in patients with advanced esophageal squamous cell carcinoma (CheckMate 648): 29-month follow-up from a randomized, open-label, phase III tria. l Cancer Med. 2024;13:e7235.
2. Xu J, et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first-line treatment for advanced or metastatic oesophageal squamous cell carcinoma (RATIONALE-306): a global, randomised, placebo-controlled, phase 3 study. Lancet Oncol. 2023;24:483-495.
3. Yoon HH, et al. First-Line Tislelizumab Plus Chemotherapy Shows OS Benefit in PD-L1+ ESCC Subgroups. J Clin Oncol. 2024;42(Suppl 16):4032.
4. European Medicine Agency. Tevimbra 100mg concentrate for solution for infusion. Summary of product characteristics. https//www.ema.europa.eu/en/documents/product .information/Levimbra-epar-product-information_en.pdf. Assessed December 19,2 024.
info@onco-suisse
- Vol. 15
- Ausgabe 5
- Juli 2025